21 жовтня, 2017
Підходи до впровадження популяційного скринінгу раку молочної залози

 Боротьба медичної спільноти з раком має драматичні сторінки, що помережані як великими відкриттями, так і глибокими розчаруваннями. Чимало наукових відкриттів в онкології призвели до революційних успіхів у лікуванні хворих на рак, однак саме впровадження скринінгу на популяційному рівні дозволило залучити до протиракової боротьби не лише вузьких фахівців, але й широку громадськість, економістів, соціологів та представників політичної влади.
Боротьба медичної спільноти з раком має драматичні сторінки, що помережані як великими відкриттями, так і глибокими розчаруваннями. Чимало наукових відкриттів в онкології призвели до революційних успіхів у лікуванні хворих на рак, однак саме впровадження скринінгу на популяційному рівні дозволило залучити до протиракової боротьби не лише вузьких фахівців, але й широку громадськість, економістів, соціологів та представників політичної влади.
Перші рентгенівські дослідження молочної залози (МЗ) проводилися ще у 1913 р. німецьким хірургом Альбертом Саломоном, котрий провів колосальну роботу з рентгенологічного вивчення 3000 мастектомій. Перші мамограми отримані італійцем М. Romagnoli у 1931 р. Однак потрібні були ще публікації уругвайця Raul Leborgne у 1949 р., який завдяки описам мікрокальцинатів «воскресив» інтерес до мамографії, та американця Robert Egan у 1962 р., котрий вдосконалив техніку мамографії так, що вона вперше стала діагностично значущим широко вживаним і донині відомим 2-проекційним дослідженням кожної з МЗ. Ще 20 років пішло на те, щоб американські товариства (радіологічне та онкологічне) включили мамографічне дослідження у свої рекомендації з виявлення раку молочної залози (РМЗ).
Справжньою революцією в популяційному охопленні жіночого населення мамографічним скринінгом стали результати популяційних досліджень у США та Швеції, що продемонстрували зниження смертності від РМЗ у тих жінок, які пройшли 2-4 раунди мамографічного скринінгу [1, 2, 3]. Подібні дослідження в Канаді та країнах Європи, на деяке розчарування, не показали вагомого зниження смертності від РМЗ із впровадженням скринінгу [4, 5, 6].
Окремі публікації в науковій літературі досі підтримують дискусії щодо переконливості доказів ефективності мамографії. Чимало доказів категорії «проти» як причини зниження смертності розглядають застосування кращого лікування РМЗ (впровадження тамоксифену, більш ефективних хіміотерапевтичних, таргетних препаратів та ін.). Деякі аргументи з іншого боку доводять, що відсутність ефективності мамографій спостерігалася в країнах з досить розвиненою медичною інфраструктурою, доступним мамографічним сервісом для рутинної діагностики РМЗ, тому найбільшого ефекту від впровадження популяційного мамографічного скринінгу слід очікувати саме в країнах, що розвиваються.
Коливання між виявленням РМЗ у І стадії в Індії (5%) та Європі (50,9%) колосальні, а між виявленням на стадії Са in situ – дуже суттєві: від 0,1% в Африці і 1% в Індії до 11,4% у Європі та 16% у Північній Америці [7, 8, 9].
Оскільки 65% випадків смерті від РМЗ припадають на країни, що розвиваються, до проблем боротьби з ним у таких країнах прикута увага не лише онкологічної спільноти, але й фінансових організацій. Прикладом може бути Світовий банк, який виділив низку типових проблем з РМЗ у країнах, що розвиваються, та у малорозвинених країнах [10].
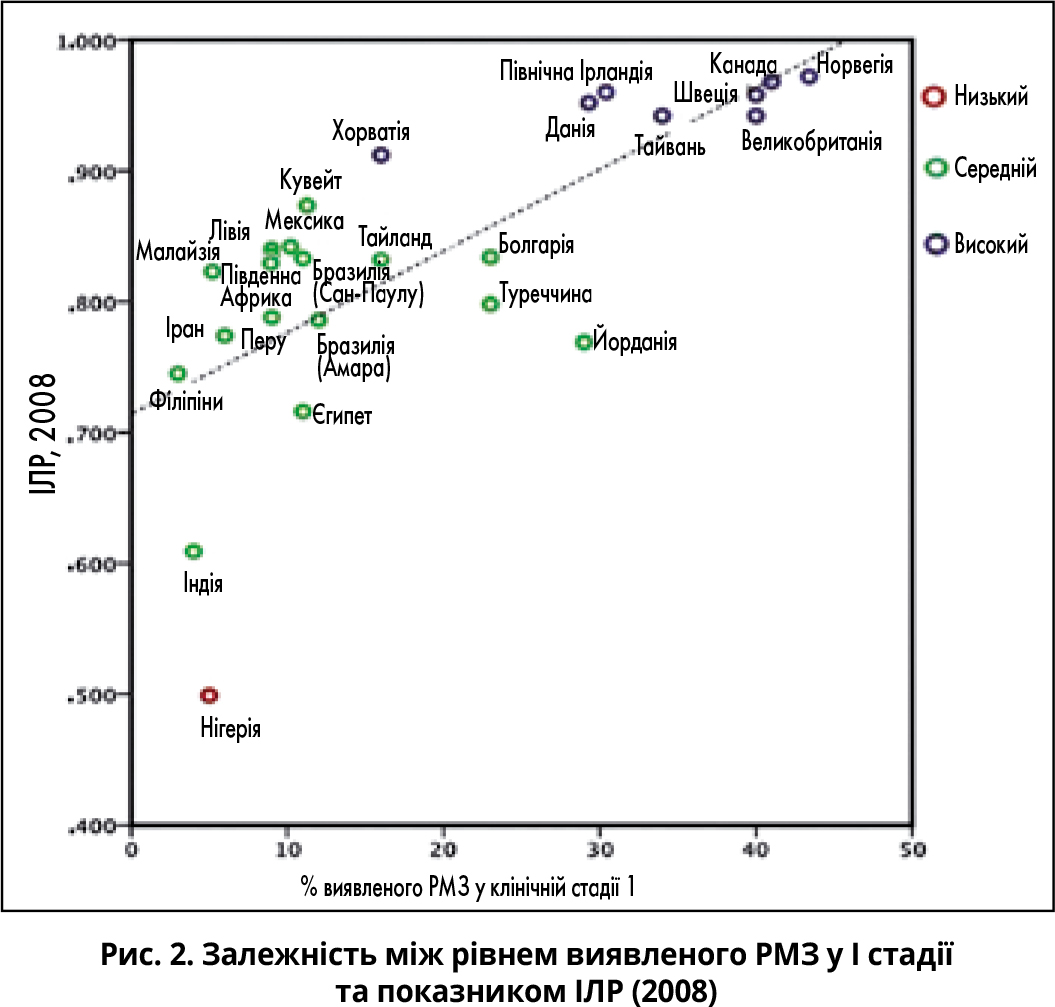
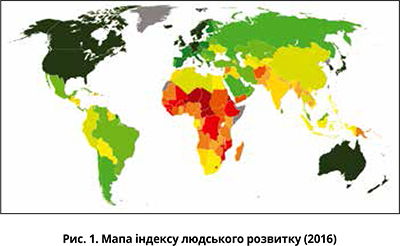 Щоб об’єктивно проаналізувати зв’язок ранньої діагностики РМЗ із соціально-економічним станом, створили діаграму залежності між І стадією РМЗ при первинній діагностиці та Індексом людського розвитку – ІЛР (до 2013 р. – Індекс розвитку людського потенціалу, англ. Human Development Index, HDI), що розраховується щорічно для міждержавного порівняння й вимірювання рівня життя, освіченості та довголіття населення.
Щоб об’єктивно проаналізувати зв’язок ранньої діагностики РМЗ із соціально-економічним станом, створили діаграму залежності між І стадією РМЗ при первинній діагностиці та Індексом людського розвитку – ІЛР (до 2013 р. – Індекс розвитку людського потенціалу, англ. Human Development Index, HDI), що розраховується щорічно для міждержавного порівняння й вимірювання рівня життя, освіченості та довголіття населення.
Він є стандартним інструментом при загальному порівнянні рівня життя різних країн і регіонів. Індекс був розроблений у 1990 р. і публікується у звітах у рамках програми розвитку ООН (рис. 1).
Простежується чітка кореляція між показником ІЛР та виявленням РМЗ у І стадії, оскільки для ранньої діагностики необхідні матеріальні ресурси та належний соціально-освітній рівень населення (рис. 2).
Місце України на діаграмі можна спроектувати, внісши дані про ІЛР (0,733-0,740) [13] та рівень виявлення І стадії РМЗ (близько 20%): отриманий результат наближатиметься до результату Туреччини.
Можливість діагностувати РМЗ у 0-І стадіях дає лише мамографія. На відміну від інших методів, при проведенні мамографії більшість виявлених пухлин мають розмір <2 см [14].
У розвинених країнах рівень охопленості мамографічним скринінгом досить високий. Зокрема, у США скринінгом охоплено 76 і 52% жінок віком 50-69 і 40-49 років відповідно, що на 6-17% нижче, ніж прогнозувалося, однак достатньо для досягнення високого рівня 5-річної виживаності.
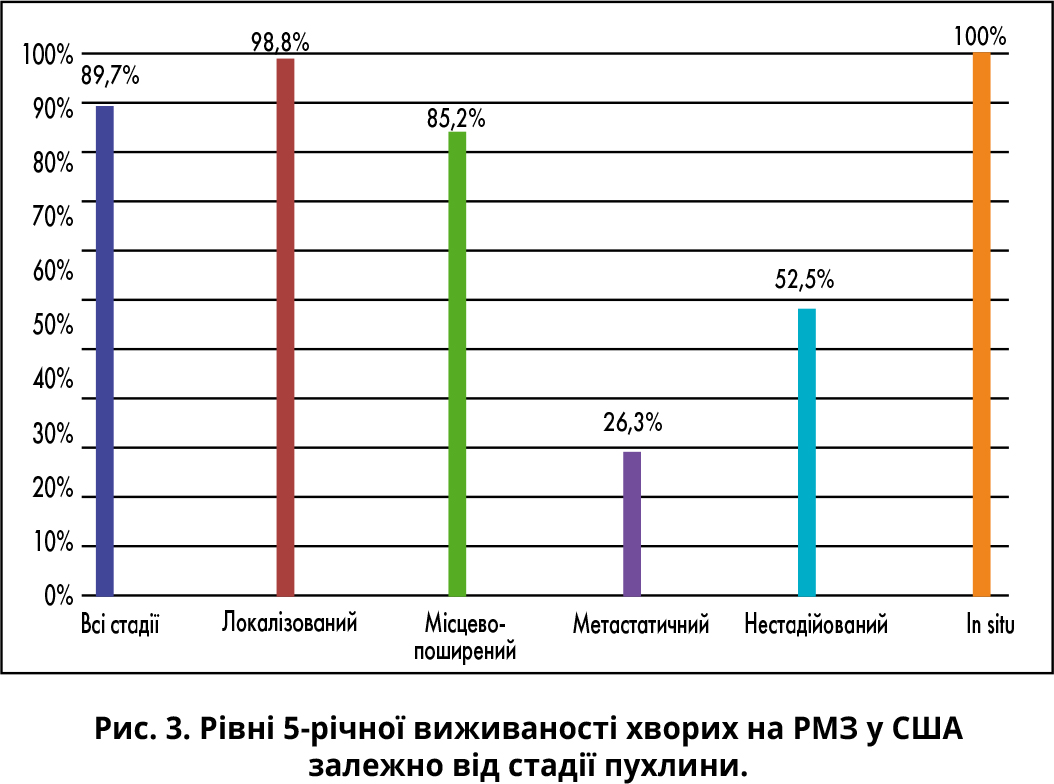
Рівень 5-річної виживаності хворих на РМЗ, за даними бази SEER, у США перевищує 89% (рис. 3). І така ситуація склалася саме завдяки виявленню великої кількості випадків раку ранніх стадій, оскільки рівень 5-річної виживаності достовірно підвищується за цієї умови.
Дослідження CONCORD‑2, в якому аналізувалися дані національних канцер-реєстрів за 2005-2009 рр., виявило досить високі показники 5-річної виживаності в деяких країнах, що розвиваються. Так, за відсутності організованого мамографічного скринінгу національними реєстрами повідомляється про суттєві цифри 5-річної виживаності у Південній Африці (53%), Монголії (57%), Індії (60%). За даними Національного канцер-реєстру України, рівень 5-річної виживаності при РМЗ у нашій країні складає 60,6% [16, 17].
Можливо, у цих країнах спрацьовують інші типи ранньої діагностики РМЗ, що мають високу ефективність?
Справді, певний час поширеною практикою було самообстеження жінками МЗ, що чергувалося з клінічним обстеженням у лікаря при виявленні змін. На жаль, самообстеження МЗ та клінічне обстеження лікарем не показало доказової ефективності щодо зниження смертності. Рандомізовані дослідження, проведені в Китаї та Росії, призвели до втрати ролі самообстежень як методу раннього виявлення РМЗ [18, 19].
Чутливість методу самообстеження досить низька – 20-30%. Мамографія має значно вищу чутливість – 63-95% [20]. Наразі вважається, що мамографія може виявляти найменші пухлини, а відповідно, покращувати виживаність та знижувати смертність.
Відповідь на запитання, чим обумовлений вплив на смертність – скринінгом та більш ранньою діагностикою чи більш якісним лікуванням, – дає порівняльне дослідження 10-річної виживаності між даними бази SEER (США) та Бразильського канцер-реєстру. Практично рівні результати нівелюють значення якості лікування й виводять на домінуючі позиції стадію при первинній діагностиці, а отже – роль скринінгової мамографії [21].
Ще донедавна Бразильське мамологічне товариство, як і Американське онкологічне товариство, дотримувало рекомендацій розпочинати мамографічний скринінг жінкам у віці 40 років, однак аналіз показав, що зниження смертності у віці 40-49 років внаслідок скринінгу менш виражене. Тому у 2016 р. онкологічне товариство США зсунуло вік початку скринінгу з 40 до 45 років. Інші організації (EUSOMA, US Preventive Services Task Force, Міністерство охорони здоров’я Бразилії) дотримують ще більш консервативного рубежу – з 50 років. Чимало національних рекомендацій європейських країн містять вік початку скринінгу 46-48 років.
Причинами невдач при мамографії в молодому віці у 10-30% є щільна паренхіма залози, неправильне позиціонування, скриті вогнища, помилки оцінювання радіологом, повільно прогресуючі пухлини [22]. Зважаючи на це, необхідно також застосовувати методи додаткового скринінгу у вигляді УЗД, МРТ.
Через щільність МЗ знижується інформативність мамографії, хоча цифрова мамографія допомагає отримати більш точні дані в скринінгу, а цифровий 3D-томосинтез дає відповідь тоді, коли 2D-мамографія зазнає невдачі через підвищену щільність [23-26].
Висока щільність МЗ пов’язана з суттєвим підвищенням ризику розвитку РМЗ (у 2,1 раза проти МЗ з нормальною щільністю). Якщо оцінити 10% найбільш щільних та 10% МЗ з найбільшими інволютивними змінами, то ризик раку між ними відрізняється у 4-6 разів [27]. Сьогодні радіологи суб’єктивно оцінюють щільність тканини МЗ за градацією BI-RADS [28], хоча вже доступними є комп’ютерні програми з автоматизованої оцінки щільності. На щільність впливають рівень статевих гормонів та маса тіла жінок, до того ж щільність може змінюватися з віком.
Даних про УЗД при високій щільності МЗ небагато. Додатковий скринінг за допомогою УЗД не доказаний рандомізованими дослідженнями. Вважається, що якщо скринінгова мамографія може запобігти 6 смертям від РМЗ на 1000 жінок, то додаткове застосування УЗД при щільних МЗ запобігає ще лише 0,36 випадку смерті на 1000 [29].
Дуже обмежені дані про автоматизовану УЗД МЗ [30], однак раціональною є закладена в цей метод ідея стандартизованого оцінювання всієї тканини залози у фіксованих положеннях з можливістю цифрової обробки та збереження зображень.
Низка товариств (ACS, NCCN) для жінок з високим ризиком РМЗ при негативних даних мамографії додатково рекомендують МРТ. Те саме стосується жінок з мутаціями генів BRCA1/2, або анамнезом опромінення грудної клітки у віці до 30 років, або ризиком РМЗ більше 20-25% відповідно до сімейного анамнезу.
Для когорти жінок з підвищеним ризиком додаткова МРТ має переваги над УЗД, адже припускає менше псевдопозитивних похибок, ніж остання [31, 32, 33].
З метою розробки науково-доказових показань до саплементного скринінгу була створена група MA-BREAST, котра врахувала критерії застосування МРТ-скринінгу для жінок з ризиком РМЗ >20-25% за моделями, рекомендованими ACS та NCCN [34, 35]. Нині вважається, що слід ширше використовувати оцінку ризику раку з метою призначення додаткового МРТ [36].
Для оцінки ризику РМЗ застосовуються різні моделі: Gail, Claus, Tyrer-Cuzick, BRCAPRO, BOADICEA, Rosner-Colditz. Кожна з них враховує специфічні фактори, які дозволяють визначити ризик розвитку РМЗ. Якщо ризик розвитку раку оцінено як низький (<15% протягом життя), достатньо застосовувати звичайний мамографічний скринінг, однак за високої щільності МЗ перевагу мають цифрова мамографія та томосинтез.
За високого життєвого ризику (>20-25%) рекомендовано додаткове МРТ-дослідження, а при клаустрофобії та неможливості застосування гадолінієвого контрасту – додаткове УЗД.
Відповідно до сучасних рекомендацій, жінкам проміжного ризику не рекомендують застосування додаткової модальності при обстеженні, отже, їм також показаний традиційний мамографічний скринінг.
Наразі навіть за наявності жирової прозорості МЗ мамографія пропускає близько 12-22% випадків РМЗ [37].
У найближчому майбутньому при значній щільності МЗ чільне місце, мабуть, посідатиме 3D-томосинтез [38, 39]. Перевага цього типу обстеження – пошарові рентгенівські дослідження тканини МЗ, що дає можливість прицільно оцінити саме тривожний локус, знявши ефекти накладання інших частин паренхіми залози.
Популяційний скринінг РМЗ серед жіночого населення Львівської області
Впровадження популяційного скринінгу раку серед жіночого населення Львівської області стало можливим завдяки підтримці Світовим банком проекту «Онкопревенція та впровадження високоефективних протипухлинних технологій». У рамках проекту передбачалося використати серед таргетних груп жіночого населення переваги комплексного скринінгу, що поєднував би цитологічний та мамографічний елементи. Цільова когорта жінок для цитологічного скринінгу затверджена в Україні чинним протоколом діагностики раку шийки матки і обмежена 18-65-річним проміжком. Враховуючи моніторинг обстежуваності та зберігання результатів цитологічних досліджень у Електронному реєстрі жіночого населення, при попередній цитологічній нормі адекватним вважається скринінг через кожні 3 роки.
Для мамографічного скринінгу цільова когорта на Україну перенесена з ранніх рекомендацій IARC з впровадження скринінгу в Європейській спілці – це жінки 50-69 років. Для актуального на той час обладнання (плівкової мамографії) обмеженням були висока щільність тканини МЗ, а отже низька чутливість у пременопаузальному віці. Однак РМЗ після 4-ї декади життя жінки має більш агресивний перебіг, і затягування з діагностикою значно погіршує результати лікування. Виявлення РМЗ у більш молодому віці призводить до більшої кількості врятованих років життя, тому скринінг у пременопаузальному віці є дуже актуальним. Чимало сучасних переглядів національних мамографічних програм зсунули вікове вікно у 40-ві роки життя жінки.
У проекті «Онкопревенція» враховано кілька факторів, котрі б дозволили з поліпшеною інформативністю розпочинати скринінг з 45 років. Усе мамографічне обладнання використовує повну цифрову технологію (без плівки та оцифровувачів) з опцією CAD-діагностики, збереження зображень у базі Електронного реєстру жіночого населення, а в експертному обстеженні – використання 3D-томосинтезу. Як додатковий скринінг у пацієнток з високою щільністю МЗ та високим ризиком використовується автоматизоване УЗД та МРТ.
Оскільки цитологічна когорта жінок обмежена верхнім віком 65 років відповідно до рекомендацій протоколу, ми вирішили дотримуватися цього ж вікового обмеження й для мамографічного скринінгу. Мабуть, цікавим обґрунтуванням стоп-дати скринінгу для області є той факт, що середня тривалість життя жінок Львівської області становить 75-77 років, а для прояву ефективності мамографічного скринінгу, за світовими даними, необхідний часовий проміжок у 10 років, отже логічним є обмеження застосування мамографічного скринінгу у 65 років.
Складним для вирішення було прийняття величини скринінгового кроку при мамографії. У відповідні українські рекомендації перенесено давні рекомендації з часу впровадження мамографічного скринінгу в Європі. Однак сучасні дослідження займаються стратифікацією цільової групи жінок і щорічний скринінг рекомендують лише при найвищому ризику, а для решти жінок – один раз на 2, або навіть 3 роки.
Кратність скринінгу також залежить від якості обладнання та забезпеченості мамографічними апаратами по відношенню до величини цільової когорти жінок. У Львівській області коштом Світового банку придбано 8 мамографів – така кількість є оптимальною для близько 350 000 жінок віком 45-65 років з кратністю мамографії 1 раз на 3 роки для груп середнього та низького ризику РМЗ.
Проведення популяційного мамографічного скринінгу передбачає відповідальне ставлення до якості проведення як самих діагностичних процедур, так і організаційних заходів. Необхідне вчасне охоплення лікуванням виявлених хворих, належний моніторинг хворих після спеціального лікування, чітке відстежування груп скринованих жінок, лінкідж даних між Електронним реєстром жінок цільової групи та Національним канцер-реєстром. Акуратне ведення бази даних жіночого населення, точність у популяційних дослідженнях впливу скринінгу на захворюваність та смертність від раку, контроль якості діагностики та лікувальних технік (акцент на органозбереженні, малоінвазивних втручаннях, зменшенні інвалідизації), а також певні інновації, зокрема впровадження 3D-томосинтезу, ABVS- автоматизованого УЗД МЗ, МРТ-мамографії, ОФЕКТ, рідинної цитології, стереотаксичної біопсії непальпабельних утворів МЗ, техніки визначення «сторожового» лімфатичного вузла, ширше застосування онкопластичних підходів у хірургії МЗ, використання лінійного прискорювача при ад’ювантній променевій терапії – сподіваємося, усе це призведе до досягнення цілей проекту – змін на краще в динаміці раннього виявлення, зниження смертності від РМЗ, зменшення інвалідизації хворих жінок та збільшення тривалості їх життя.
Список літератури знаходиться в редакції.
Стаття друкується у скороченні.
Повна версія розміщена в тематичному номері «Онкологія, гематологія, хіміотерапія», №4, 2017 р., Медичної газети «Здоров’я України»
Спеціальний випуск тематичного номеру газети «Здоров’я України» «Онкологія, гематологія, хіміотерапія» 2017 р.