20 березня, 2018
ІX науково-практична конференція «Дні аритмології в Києві»: огляд матеріалів
16-17 листопада 2017 року на базі ДУ «Інститут серця МОЗ України» відбулася щорічна ІX Науково-практична конференція Асоціації аритмологів України та Всеукраїнської асоціації фахівців з аритмології та електрофізіології серця «Дні аритмології в Києві». Протягом двох днів представники провідних наукових шкіл і центрів кардіологічної допомоги обговорювали сучасні тенденції в діагностиці та лікуванні порушень ритму серця, здобутки та проблеми української аритмології. Фокус уваги був зосереджений на таких соціально значущих питаннях, як скринінг факторів ризику раптової серцевої смерті (РСС) і встановлення імплантованих кардіовертерів-дефібриляторів (ІКД), розширення показань до інтервенційного лікування фібриляції передсердь (ФП), і багатьох інших.
 Завідувач кафедри внутрішньої медицини № 3 Вінницького національного медичного університету ім. М.І. Пирогова, доктор медичних наук, професор Валерій Павлович Іванов звернув увагу на проблему неврологічних наслідків ФП і прогностичне значення симптомів аритмії. Виявивши ФП, лікар насамперед має оцінити виразність симптомів, яка визначатиме подальшу тактику, зокрема доцільність призначення антиаритмічних препаратів (ААП). Виразність і частота симптомів відображає те, як серцево-судинна система пристосовується до аритмії. Згідно із сучасною концепцією, відображеною в європейських настановах із ФП, за асимптомного перебігу чи незначної виразності симптомів, яка не впливає на життєдіяльність пацієнта (І-ІІ за класифікацією EHRA), можлива відмова від ААП на користь стратегії контролю частоти шлуночкових скорочень.
Завідувач кафедри внутрішньої медицини № 3 Вінницького національного медичного університету ім. М.І. Пирогова, доктор медичних наук, професор Валерій Павлович Іванов звернув увагу на проблему неврологічних наслідків ФП і прогностичне значення симптомів аритмії. Виявивши ФП, лікар насамперед має оцінити виразність симптомів, яка визначатиме подальшу тактику, зокрема доцільність призначення антиаритмічних препаратів (ААП). Виразність і частота симптомів відображає те, як серцево-судинна система пристосовується до аритмії. Згідно із сучасною концепцією, відображеною в європейських настановах із ФП, за асимптомного перебігу чи незначної виразності симптомів, яка не впливає на життєдіяльність пацієнта (І-ІІ за класифікацією EHRA), можлива відмова від ААП на користь стратегії контролю частоти шлуночкових скорочень.
Оцінюючи симптоми ФП, слід мати на увазі, що за наявності епізодів запаморочення прогноз пацієнта радикально змінюється на гірше.
Синкопальні стани – це реакція центральної нервової системи, що вказує на значні порушення ауторегуляції мозкового кровотоку на тлі порушень системної гемодинаміки під час або після епізоду ФП. Синкопе можуть виникати на тлі як тахікардії, так і брадикардії чи паузи на виході з пароксизму. Такі пацієнти потребують ретельнішого контролю частоти серцевих скорочень (ЧСС) або імплантації штучного водія ритму.
З іншого боку, ризик кардіоемболічного інсульту чи системної емболії іншої локалізації не корелює із симптоматикою ФП або її формою. Асимптомна пароксизмальна ФП, яку лікарі здебільшого вважають доброякісним станом, підвищує ризик розвитку інсульту такою самою мірою, як і персистуюча чи постійна форми цієї аритмії. На останньому конгресі Європейського товариства кардіологів – ESC (серпень 2017 року, м. Барселона, Іспанія) були озвучені дані стосовно збільшення частоти не лише ішемічних інсультів, а й внутрішньочерепних крововиливів у пацієнтів із ФП.
 Також доповідач звернув увагу на приховану проблему когнітивних порушень і деменції, асоційованих із ФП. У 10-38% осіб із ФП за даними комп’ютерної томографії та у 8-28% за даними магнітно-резонансної томографії визначають «німі» інфаркти мозку без задокументованого епізоду гострого неврологічного дефіциту в анамнезі (C. Marini et al., 2005).
Також доповідач звернув увагу на приховану проблему когнітивних порушень і деменції, асоційованих із ФП. У 10-38% осіб із ФП за даними комп’ютерної томографії та у 8-28% за даними магнітно-резонансної томографії визначають «німі» інфаркти мозку без задокументованого епізоду гострого неврологічного дефіциту в анамнезі (C. Marini et al., 2005).
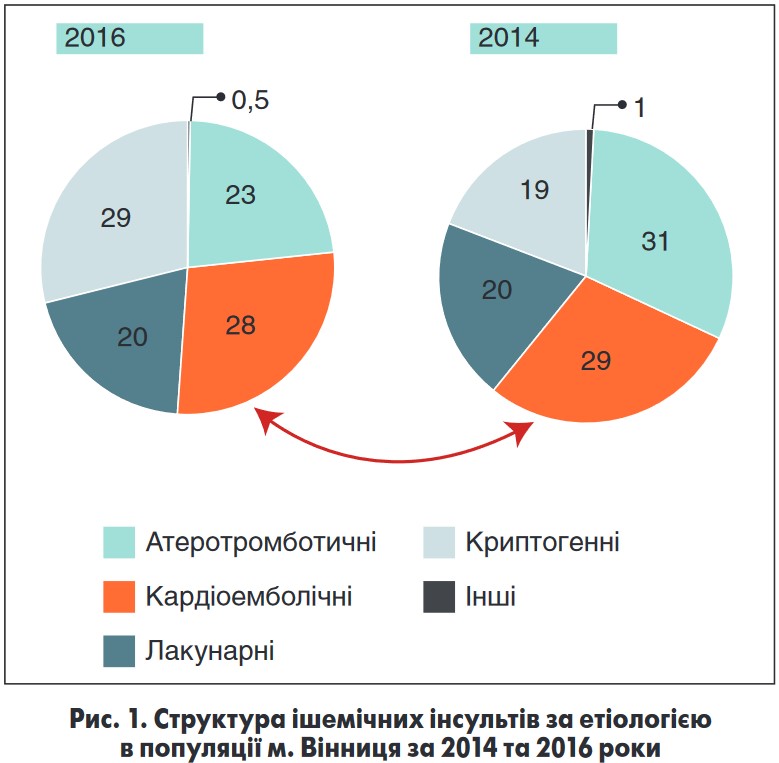
Утім, основним ризиком для пацієнтів із ФП залишається інсульт. Першим проявом асимптомної ФП можуть бути ішемічний інсульт або транзиторна ішемічна атака, котрі досить часто трактують як криптогенні. Ось чому у хворих, які перенесли інсульт нез’ясованої етіології, рекомендують проводити тривале (3-7 днів) моніторування електрокардіограми (ЕКГ), що дає змогу підвищити частоту діагностики ФП. У доповіді були наведені дані дослідження структури ішемічних інсультів у популяції м. Вінниця за 2014 та 2016 роки (рис. 1).
Звертає на себе увагу те, що частка кардіоемболічних інсультів майже не змінилася, тоді як зросла частка криптогенних. Можливо, що в цій категорії приховується багато кардіоемболічних інсультів у пацієнтів із недіагностованою ФП. За даними іноземних авторів, кожен п’ятий інсульт є кардіоемболічним, проте ця цифра може бути занижена. Тому визначення ризику інсульту (за шкалою CHA2DS2-VASc) та призначення перорального антикоагулянту для його профілактики мають бути обов’язковими діями лікаря. Епізоди ФП тривалістю від 5 хв і більше, виявлені при моніторуванні ЕКГ, є підставою для оцінювання ризику розвитку інсульту.
 Завідувач відділу хірургії складних порушень серцевого ритму Національного інституту серцево-судинної хірургії ім. М.М. Амосова (м. Київ), доктор медичних наук Валерій Павлович Залевський представив доповідь під красномовною назвою «Чому українці не використовують ІКД-терапію?».
Завідувач відділу хірургії складних порушень серцевого ритму Національного інституту серцево-судинної хірургії ім. М.М. Амосова (м. Київ), доктор медичних наук Валерій Павлович Залевський представив доповідь під красномовною назвою «Чому українці не використовують ІКД-терапію?».
Проблема РСС завжди актуальна для охорони здоров’я. За даними статистики США, щорічна кількість жертв РСС (450 тис.) більша, ніж смертність від інсультів, раку легень, СНІДу та раку молочної залози разом узятих. І це без урахування додаткових смертей, зумовлених випадками РСС за кермом автотранспорту, коли одномоментно можуть постраждати ще десятки осіб. 88% РСС мають аритмічну причину, й на сьогодні всім цим смертям можна запобігти. У структурі аритмічної РСС 17% становлять брадіаритмії, що успішно профілактуються встановленням штучного водія ритму. Решта 83% припадає на шлуночкові тахіаритмії (ШТ), оптимальною профілактикою яких є імплантація постійного кардіовертера-дефібрилятора.
Рекомендації ESC із ведення хворих на шлуночкові аритмії та профілактики РСС (2015) виділяють дві категорії пацієнтів: для первинної профілактики РСС у хворих зі структурною патологією серця, в анамнезі у яких не було зупинки серцевої діяльності, а також для вторинної профілактики в пацієнтів, яких було успішно реанімовано після епізоду фібриляції шлуночків. Доповідач нагадав, що встановлення ІКД має найвищий рівень доказовості як ефективний засіб відновлення синусового ритму при епізодах ШТ і запобігання РСС.
Основною причиною виникнення загрозливих ШТ є порушення провідності внаслідок перенесеного інфаркту міокарда (ІМ). Якщо після 48 год після ІМ пацієнт мав епізод ШТ із гемодинамічною нестабільністю й фракція викиду лівого шлуночка (ФВ ЛШ) зберігається на рівні ≤35%, то він має бути направлений на встановлення ІКД (клас рекомендації I, рівень доказів A). За відсутності профілактики 90% цих пацієнтів помирає протягом 5 років, і марно розраховувати, що можна буде врятувати їх у разі зупинки серця. За статистикою, 80% випадків РСС настає вдома, 40% – без свідків або уві сні. При позагоспітальних випадках раптової зупинки кровообігу виживає лише 5% пацієнтів, і це в США. Встановлення автоматичних дефібриляторів у громадських місцях, як виявилося, не достатньо, щоб вплинути на статистику РСС.
Вихід полягає в первинній профілактиці РСС у пацієнтів із факторами ризику РСС, такими як діагностовані каналопатії (наприклад, синдром Бругада) та низька ФВ ЛШ у результаті тяжкої структурної патології серця. Якщо пацієнт протягом 6 тиж після перенесеного ІМ має ФВ ЛШ ≤35%, йому показано встановлення ІКД (клас рекомендації I, рівень доказів A). ІКД-терапія також показана хворим на неішемічну кардіоміопатію, у яких протягом 3 міс не покращується ФВ ЛШ (≤35%) під впливом оптимальної терапії (клас рекомендації І, рівень доказів В).
За даними міжнародного реєстру Європейської асоціації ритму серця White Book, в Україні імплантують у десятки разів менше ІКД порівняно з європейськими країнами не першого ряду за рівнем життя, такими як Білорусь, Болгарія, Вірменія, Латвія. Доповідач представив результати опитування 214 українських кардіологів, яким ставили запитання «У чому причина непопулярності ІКД-терапії в Україні?». Переважна більшість (79%) відзначили високу вартість пристроїв, 12% – відсутність спеціалістів, 6% – відсутність пацієнтів, 3% – неефективність лікування. За розрахунками, проведеними в Національному інституті серцево-судинної хірургії ім. М.М. Амосова, вартість ІКД зіставна чи навіть менша за вартість операції аортокоронарного шунтування при ішемічній хворобі серця. На думку доповідача, причина полягає не лише у високій вартості ІКД, а й у тому, що їх імплантацією в Україні займаються переважно кардіохірурги, тоді як у сусідній Польщі хірурги встановлюють лише 1% пристроїв, а решту – кардіологи. Саме кардіологи найкраще обізнані з проблемою й можуть проводити скринінг ризику РСС серед своїх пацієнтів.
Іще одна доповідь В.П. Залевського була присвячена катетерному лікуванню суправентрикулярних тахікардій (СВТ). До СВТ належать три групи порушень ритму:
1. Передсердні тахікардії (ектопічна передсердна тахікардія, тріпотіння передсердь – ТП, ФП).
2. Вузлові тахікардії (атріовентрикулярна (АВ) вузлова реентрі-тахікардія, вузлова ектопічна тахікардія).
3. АВ-реентрі-тахікардії з додатковим шляхом проведення – ДШП (синдром Вольфа-Паркінсона-Уайта (WPW), тракт Махейма).
Доповідач нагадав основні принципи ведення цієї групи пацієнтів згідно з останнім на сьогодні керівним документом – рекомендаціями Американської колегії кардіологів, Американської асоціації серця та Товариства серцевого ритму з діагностики та лікування СВТ (2015). Алгоритми відновлення синусового ритму при симптомному нападі тахікардії практично однакові для всіх типів СВТ. На першому кроці рекомендовано застосування вагусних маневрів і внутрішньовенне введення аденозину (найвищий клас рекомендації І).
За неефективності й наявності порушень гемодинаміки методом вибору є синхронізована електрична кардіоверсія (клас І). У гемодинамічно стабільних хворих як гостру антиаритмічну терапію можуть застосовувати внутрішньовенні інфузії β-блокаторів, дилтіазему чи верапамілу (клас ІІа).
Аденозин (або його похідне – аденозинтрифосфат, доступний в Україні) викликає короткочасну блокаду АВ-вузла за умови швидкого внутрішньовенного введення протягом 3 с, а через 8 с повністю руйнується, тому є досить безпечним. Але після тривалого епізоду СВТ різка зупинка серця може спричинити екстрасистолію, подовження QT і шлуночкову пірует-тахікардію, тому, хоча це ускладнення є рідкісним, уводити аденозин бажано в умовах доступності реанімаційної допомоги та дефібрилятора.
В алгоритмі тривалого лікування СВТ катетерна процедура (радіочастотна абляція – РЧА) має найвищий клас рекомендації як досить ефективний і безпечний радикальний метод усунення аритмії. При вирішенні питання щодо інвазивного лікування пацієнт має бути поінформований лікарем про альтернативні стратегії медикаментозної терапії. Вибір ААП доволі широкий: найвищий клас рекомендації І мають β-блокатори, дилтіазем і верапаміл (за відсутності преекзитації шлуночків), клас ІІа – флекаїнід і пропафенон (у хворих без структурної патології серця), препаратами резерву з класом ІІb залишаються аміодарон, дофетилід (не зареєстрований в Україні) та соталол.
Пацієнтам із синдромом WPW слід наполегливо рекомендувати електрофізіологічне дослідження й у разі виявлення високого ризику аритмогенних подій – катетерну абляцію ДШП. 15% ДШП мають здатність до проведення імпульсів збудження високої частоти з передсердь, і в разі виникнення ФП вона може викликати фібриляцію шлуночків. Цей ризик значно зростає у віці понад 30 років. Із цієї самої причини таким пацієнтам протипоказані змагальні види спорту. Отже, абляція за наявності СВТ із ДШП – це метод профілактики РСС. Процедура проста й ефективна, аритмія радикально усувається в перші секунди після нанесення радіочастотного пошкодження.
Частота рецидивів протягом життя не перевищує 5%. Щодо дітей із синдромом WPW, то їм абляція рекомендована з 12 років при будь-якій виразності симптоматики (клас рекомендації І), а у віці до 4 років – лише при тяжких проявах (тахікардитична міопатія).
Алгоритм гострого лікування передсердної макро-реентрі-тахікардії (ТП) у гемодинамічно стабільних пацієнтів передбачає вибір із двох стратегій:
1) контроль ритму (синхронізована кардіоверсія, пероральний дофетилід і внутрішньовенний ібутилід та/або часта передсердна стимуляція – клас І);
2) контроль частоти (β-блокатори, дилтіазем або верапаміл внутрішньовенно – клас І, аміодарон – клас ІІа).
У разі порушення гемодинаміки показана кардіоверсія чи контроль ЧСС аміодароном.
В алгоритмі тривалого лікування пацієнтів із ТП на перший план виходить катетерна абляція для відновлення синусового ритму (клас І).
Контроль ритму ААП має нижчий клас рекомендацій. Абляція є досить простою у виконанні й ефективною при типовому ТП, коли правопередсердне реентрі залежить від проведення через кавотрикуспідальний перешийок (між тристулковим клапаном і нижньою порожнистою веною), і його ізоляція забезпечує радикальну ліквідацію аритмії.
Отже, на сьогодні практично всі СВТ підлягають катетерному лікуванню (РЧА) за І класом показань, якщо вони загрожують життю (при синдромі WPW) або спричиняють непереносимі симптоми. Завдяки вдосконаленню методики абляції вдалося підвищити ефективність і знизити частоту ускладнень до 1 на 3000 пацієнтів. Проте в Україні катетерні методи використовують недостатньо порівняно з іншими країнами Європи.
 Завідувач кафедри внутрішньої медицини № 1 із курсом серцево-судинної патології Одеського національного медичного університету, доктор медичних наук, професор Юрій Іванович Карпенко поділився досвідом радіочастотної редукції міжшлуночкової перетинки (МШП) у пацієнтів із гіпертрофічною кардіоміопатією (ГКМП). ГКМП – тяжке, зазвичай генетично детерміноване захворювання, що характеризується виразною гіпертрофією міокарда ЛШ, зокрема МШП, їх фіброзом, що призводить до підвищення систолічного градієнта тиску у вихідному тракті (ВТ) ЛШ і його обструкції, та проявляється відповідною симптоматикою грубих порушень гемодинаміки (синкопе), ішемії міокарда та порушень ритму серця.
Завідувач кафедри внутрішньої медицини № 1 із курсом серцево-судинної патології Одеського національного медичного університету, доктор медичних наук, професор Юрій Іванович Карпенко поділився досвідом радіочастотної редукції міжшлуночкової перетинки (МШП) у пацієнтів із гіпертрофічною кардіоміопатією (ГКМП). ГКМП – тяжке, зазвичай генетично детерміноване захворювання, що характеризується виразною гіпертрофією міокарда ЛШ, зокрема МШП, їх фіброзом, що призводить до підвищення систолічного градієнта тиску у вихідному тракті (ВТ) ЛШ і його обструкції, та проявляється відповідною симптоматикою грубих порушень гемодинаміки (синкопе), ішемії міокарда та порушень ритму серця.
Світовий досвід ведення таких пацієнтів узагальнено в рекомендаціях ESC із діагностики та лікування ГКМП (2014). За даними реєстрів США, близько 35% випадків РСС у молодих людей зумовлені ГКМП, у Великій Британії – близько 12%. Недіагностована ГКМП часто стає причиною раптової смерті під час фізичних навантажень або занять спортом. Субстратом розвитку небезпечних шлуночкових аритмій є інтерстиціальний фіброз міокарда. За даними аутопсій кількість фіброзу у хворих на ГКМП у 8 разів більше, ніж при інших захворюваннях серця (V.B. Almaas et al., 2013). Для розрахунку ризику РСС запропонована шкала HCM Risk-SCD, яка докладно описана в рекомендаціях ESC.
Можливості медикаментозного лікування ГКМП обмежені. Для зменшення обструкції ВТ ЛШ призначають β-блокатори, недигідропіридинові блокатори кальцієвих каналів. За обструктивної форми ГКМП здебільшого застосовують хірургічні методи лікування: класична міоектомія, септальна алкогольна абляція, двокамерна стимуляція, встановлення ІКД для профілактики РСС, а також відносно новий метод – РЧА МШП.
Порогом для інвазивного лікування є градієнт тиску у ВТ ЛШ >50 мм рт. ст. за даними ехокардіографії в стані спокою або при виконанні проби Вальсальви чи фізичного навантаження. Редукція МШП для зменшення симптомів рекомендована пацієнтам з обструкцією ВТ ЛШ (>50 мм рт. ст.), які мають ІІІ-ІV функціональний клас за NYHA, незважаючи на максимально переносиму терапію (клас рекомендації І, рівень доказів В).
Хірургічна септальна міоектомія є пріоритетним методом у пацієнтів із показанням до редукції МШП у поєднанні з іншими показаннями до оперативного лікування, наприклад протезування чи пластика мітрального клапана. Недоліки полягають у тому, що це відкрита операція зі штучним кровообігом, є ризик виникнення АВ-блокади при пошкодженні АВ-вузла.
Алкогольна абляція – золотий стандарт малоінвазивного лікування обструктивної ГКМП, але в 10-15% пацієнтів після її виконання виникає блокада пучка Гіса через те, що септальна гілка лівої коронарної артерії, яка підлягає закриттю, постачає кров також до цієї структури провідної системи серця. Також ризик втручання пов’язаний з індивідуальними анатомічними особливостями кровопостачання МШП. Тому роками тривав пошук безпечнішої та точнішої технології.
Перші серії випадків успішної радіочастотної редукції МШП у дітей і дорослих з обструктивною ГКМП були опубліковані 2011 року (N. Sreeram et al.; T. Lawrenz et al.). Радіочастотне пошкодження міокарда МШП завдається після 3D-реконструкції камер серця за даними ультразвукових методів дослідження, а також електрофізіологічного картування, тому виключається пошкодження провідної системи серця. В Україні перше таке втручання було виконане в грудні 2015 року на базі Інституту загальної та невідкладної хірургії НАМН України (м. Харків) пацієнту з тяжкою ГКМП. Вихідний градієнт тиску на ВТ ЛШ 90 мм рт. ст. у спокої знизився після процедури до 45 мм рт. ст. і залишався в межах 50 мм рт. ст. протягом двох років на тлі прийому β-блокатора. Наразі у двох центрах (Харкові й Одесі) виконано дев’ять РЧА МШП, у тому числі у двох пацієнтів після невдалої алкогольної абляції. Середня тривалість процедури – 31±5 хв. Градієнт тиску у ВТ ЛШ знизився із 74±30 до 32±12 мм рт. ст. У семи пацієнтів зменшився функціональний клас за NYHA з ІІІ до ІІ, зросла толерантність до фізичних навантажень.
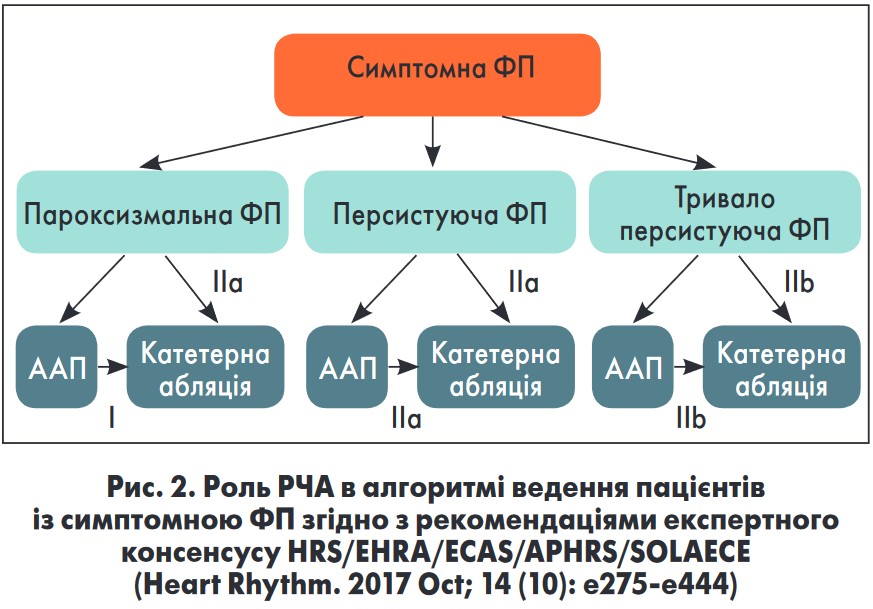
 Завідувач відділення ультразвукової та клінічно-інструментальної діагностики й міні-інвазивних втручань ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» (м. Харків), кандидат медичних наук Дмитро Євгенович Волков розповів про перспективи РЧА при ФП у пацієнтів із систолічною серцевою недостатністю (СН). Ставлення експертних товариств до контролю ритму, й зокрема до РЧА, в пацієнтів із ФП на сучасному етапі можна охарактеризувати як досить стримане та консервативне. Стратегії контролю ритму й контролю частоти в європейських рекомендаціях 2016 року визначають як рівнозначні на підставі результатів дослідження AFFIRM. Експертний консенсус 2017 року щодо катетерних і хірургічних методів лікування ФП на перше місце при пароксизмальній ФП ставить спробу медикаментозної терапії, й лише при її неефективності слід розглядати абляцію (рис. 2).
Завідувач відділення ультразвукової та клінічно-інструментальної діагностики й міні-інвазивних втручань ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» (м. Харків), кандидат медичних наук Дмитро Євгенович Волков розповів про перспективи РЧА при ФП у пацієнтів із систолічною серцевою недостатністю (СН). Ставлення експертних товариств до контролю ритму, й зокрема до РЧА, в пацієнтів із ФП на сучасному етапі можна охарактеризувати як досить стримане та консервативне. Стратегії контролю ритму й контролю частоти в європейських рекомендаціях 2016 року визначають як рівнозначні на підставі результатів дослідження AFFIRM. Експертний консенсус 2017 року щодо катетерних і хірургічних методів лікування ФП на перше місце при пароксизмальній ФП ставить спробу медикаментозної терапії, й лише при її неефективності слід розглядати абляцію (рис. 2).
На практиці антиаритмічна терапія домінує, особливо в країнах Східної Європи. За даними багатьох досліджень, РЧА перевершує ААП за ефективністю відновлення та утримання синусового ритму, однак основним критерієм для її виконання є наявність у пацієнта симптомів.
 Доповідач порушив важливе практичне питання: що ми можемо сьогодні обіцяти пацієнту, котрому пропонуємо абляцію з приводу ФП? На підставі аналізу 96 випадків первинної РЧА з власного досвіду Д.Є. Волков зазначив, що в кожного пацієнта можна принаймні зменшити тягар епізодів ФП (зробити їх рідшими, коротшими, легшими) й радикально покращити якість життя, більшою мірою в когорті пароксизмальної ФП, особливо якщо зробити абляцію своєчасно. 70% пацієнтів абляція зовсім позбавляє аритмії, 60% – без необхідності приймати ААП. Головною умовою є рання діагностика та направлення від кардіолога.
Доповідач порушив важливе практичне питання: що ми можемо сьогодні обіцяти пацієнту, котрому пропонуємо абляцію з приводу ФП? На підставі аналізу 96 випадків первинної РЧА з власного досвіду Д.Є. Волков зазначив, що в кожного пацієнта можна принаймні зменшити тягар епізодів ФП (зробити їх рідшими, коротшими, легшими) й радикально покращити якість життя, більшою мірою в когорті пароксизмальної ФП, особливо якщо зробити абляцію своєчасно. 70% пацієнтів абляція зовсім позбавляє аритмії, 60% – без необхідності приймати ААП. Головною умовою є рання діагностика та направлення від кардіолога.
Проте наявні рекомендації орієнтують здебільшого на застосування РЧА як методу лікування так званої lone-AF (ізольованої ФП), хоча в реальному житті таких пацієнтів стає дедалі менше, оскільки вдосконалення діагностичних методів дає змогу встановити причину аритмії та коморбідні стани в переважній більшості випадків. У результаті консервативного підходу спостерігається тенденція відмови від активного утримання синусового ритму в більш тяжких пацієнтів, зокрема із СН. Утім, на підставі результатів низки досліджень можна очікувати розширення перспективи РЧА як первинного методу відновлення ритму при ФП, і особливо в найважчій групі хворих – із систолічною СН.
СН і ФП – поширена коморбідність зі складними патогенетичними взаємозв’язками, яка драматично погіршує життєвий прогноз хворих. При поєднанні цих станів буває важко зрозуміти, що є первинним і з чого починати допомогу. В цьому аспекті досить цікавими є результати 10-річного спостереження за двома групами: пацієнтів із СН, у яких реєстрували перший епізод ФП, і, навпаки, пацієнтів із ФП, у яких реєстрували перший епізод декомпенсації серцевої діяльності (R. Santhanakrishnan et al., 2016). Якщо ФП виникала в пацієнта із СН, прогноз драматично погіршувався – збільшувалася загальна смертність, чого не відбувалося, коли в пацієнтів із ФП розвивалася СН. Цікаво, що ФП частіше виникала в пацієнтів із діастолічною СН, однак смертність була вищою в групі пацієнтів із систолічною СН. Отже, пацієнти з низькою ФВ ЛШ, у яких виникає ФП, становлять групу найвищого ризику. Можливості антиаритмічної терапії в них дуже обмежені, фактично це лише аміодарон (клас рекомендації І, рівень доказів А). Альтернативою є абляція (клас рекомендації ІІа, рівень доказів В).
Окрему групу становлять пацієнти з низькою ФВ ЛШ та імплантованими пристроями ресинхронізаційної терапії (CRT). CRT у хворих на хронічну СН (ХСН) знижує ризик симптомної ФП, однак остання має тенденцію до персистування й зазвичай потребує проведення електричної кардіоверсії для відновлення синусового ритму. Для таких хворих пароксизмальна тахісистолічна форма ФП навіть більш небезпечна, ніж постійна, оскільки зумовлює різке підвищення ЧСС, нерегулярність ритму, часткову чи повну втрату синхронності скорочень шлуночків у пацієнта, який уже звик до контролю ритму. Вищевикладене обґрунтовує необхідність жорсткого контролю ритму та/або контролю ЧСС. Наявність ФП до запланованої імплантації CRT потребує обговорення тактики лікування з урахуванням ризику рецидиву та шансів контролю аритмії.
У низці попередніх досліджень продемонстровано, що первинна РЧА ФП може бути ефективнішою стосовно утримання синусового ритму, збільшення ФВ і покращення якості життя, ніж РЧА АВ-вузла з наступним встановленням CRT у пацієнтів із ХСН (P.J. Gentlesk et al., 2007; M.N. Khan et al., 2008).
2017 року опубліковано дослідження CAMERA-MRI, в якому продемонстровано кращі результати абляції ФП порівняно з медикаментозним контролем ЧСС у пацієнтів із систолічною дисфункцією. Приріст ФВ ЛШ у групі абляції становив 18,3 проти 4,4% у групі контролю ЧСС (р<0,0001).
Нарешті, дослідження CASTLE-AF, результати котрого доповідалися на конгресі ESC‑2017, стало першим ретельно спланованим рандомізованим дослідженням, у якому доведено позитивний вплив катетерної абляції на прогноз пацієнтів із СН і ФП. 397 пацієнтів із середньою ФВ ЛШ 32%, майже всі з ІКД або CRT із функцією дефібрилятора, рандомізували на групи звичайної терапії або РЧА ФП (ізоляція легеневих вен). За період спостереження до 60 міс відзначено значно меншу персистенцію ФП у групі абляції за даними автоматичного моніторування імплантованими пристроями. Отже, від зменшення тягаря ФП ці пацієнти вже виграли. Але найголовніше – це достовірне покращення виживання в цієї тяжкої групи пацієнтів: зменшення загальної смертності на 47%, серцево-судинної – на 51% порівняно з групою консервативного лікування.
Після результатів CASTLE-AF у наявні рекомендації, ймовірно, будуть внесені доповнення, принаймні щодо пацієнтів із систолічною ХСН, що може привести до суттєвої зміни парадигми їх лікування. Проте в українських реаліях імплементація результатів CASTLE-AF утруднена через украй рідкісні імплантації ІКД, CRT-D, а отже, неможливість апаратного моніторування аритмій, профілактики РСС і ресинхронізаційної терапії в більшості пацієнтів. До того ж залишається низькою частота направлень від кардіологів на РЧА чи апаратне лікування.
Підготував Дмитро Молчанов
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 1 (56) лютий 2018 р.


