29 листопада, 2018
Небезпека внутрішньоутробних герпесвірусних інфекцій та їх профілактика на етапі планування вагітності

Згідно зі статистикою Міністерства охорони здоров’я (МОЗ) України, смертність дітей, зумовлена генералізованими внутрішньоутробними інфекціями, становить 18-20% усієї смертності (близько 70 із 350 випадків на рік) [1]. Так, доведено, що в структурі смертності новонароджених інфекційна патологія сягає 65-70%, тобто є однією з основних причин смерті дітей першого місяця життя.
Високий відсоток летальності новонароджених підтверджує виняткову важливість своєчасної діагностики й адекватного лікування перинатальних інфекцій. Серед дітей, які залишилися живими, майже в 50% випадків розвивається інвалідність [2].
У понад 50% дітей із вродженими вадами розвитку виявляють реактивацію цитомегаловірусної, герпетичної 1 та 2 типу, парвовірусної інфекції В19 і токсоплазмозу за їх морфологічними маркерами [3].
У половини новонароджених дітей України, прооперованих із приводу вроджених вад серця, у тканинних біоптатах серцевих м’язів виявляли ДНК герпесвірусів. Це підтверджує їх значимість у розвитку внутрішньоутробних порушень органогенезу. Таке зростання поширеності зазначеної патології зумовлене зниженням імунітету жінок внаслідок негативних змін екологічного стану, стресогенних факторів у побуті та на роботі, неповноцінного харчування, зниження якості організації медичної допомоги цьому контингенту [4].
Перинатальне інфікування відбувається по-різному: трансплацентарно, висхідним шляхом (трансцервікально), під час проходження дитини через інфіковані пологові шляхи та з материнським молоком.
До головних критеріїв ризику розвитку внутрішньоутробної інфекції, що асоціюється з герпесвірусами, належать: перенесений інфекційний мононуклеоз, гепатит, гепатоспленомегалія, загроза переривання вагітності, затримка розвитку плода, хронічна плацентарна недостатність, багатоводдя, кальцинати плаценти, наявність ДНК вірусу простого герпесу (HSV) у крові, специфічних IgМ, IgА, носійство мутантних алелей генів імунної відповіді. Вірус Епштейна – Барр (EBV) підтверджений у 39,3% дітей із прогресуючою гідроцефалією.
У кожного другого з них встановлені вірусно-вірусні, вірусно-паразитарні асоціації (цитомегаловірус (СMV) + HSV, СMV + Toxoplasma gondii, EBV + парвовірус тощо). При цьому ризик народження дітей у тяжкому стані збільшується в 5 разів при обтяженому акушерсько-гінекологічному анамнезі та інфікуванні в III триместрі вагітності [5].
Цитомегаловірусна інфекція (ЦМВІ) найчастіше має латентний перебіг, тому вірус може тривалий час виділятися від хворої людини в довкілля. Так, скупченість і тісні контакти між дітьми (у дитячих садках, яслах) спричиняють швидке поширення збудника у дитячому колективі.
При розвитку імунодепресивних станів (унаслідок інтеркурентних захворювань, ВІЛ-інфекції, вживання кортикостероїдів, цитостатиків) ЦМВІ може переходити з латентної в клінічно маніфестну форму. Існування кількох генетично варіабельних штамів вірусу зумовлює суперінфекції новими штамами протягом життя, що створює постійний ризик для вагітної.
Частота ЦМВІ варіює залежно від регіону, віку, соціально-культурного рівня населення. Інфікованість дітей віком до 5 років становить 40-50%, дошкільного віку – 25-80%. У країнах, що розвиваються, інфікованість населення віком до 18 років сягає 99%; у розвинених країнах – 50%. Пік первинного інфікування припадає на третій рік життя та період статевого дозрівання.
Ризик первинного інфікування в жінок репродуктивного віку становить 15-45% залежно від соціально-економічного статусу країни. Щорічно від 2 до 6% жінок інфікуються CMV, тож інфікованість вагітних у середньому сягає 70% [6].
Перинатальна ЦМВІ є наслідком контакту дитини з контамінованими цервікальними виділеннями під час пологів, грудним молоком, препаратами крові. На відміну від вродженої ЦМВІ ознаки перинатальної інфекції у 85% випадків розвиваються через ≥2 тижнів після пологів.
Немовлята, які мають материнські специфічні імуноглобуліни проти CMV, не інфікуються або хвороба в них має латентний перебіг. У недоношених дітей з відсутністю антитіл до CMV контакт з вірусом майже завжди призводить до розвитку тяжких форм хвороби. При набутій ЦМВІ в дітей старшого віку енцефаліт зазвичай не розвивається [6].
Від інших внутрішньоутробних інфекцій ЦМВІ відрізняється тим, що вона може передаватися від матері до плода, навіть якщо мати була інфікована багато місяців і років тому.
За даними Всесвітньої організації охорони здоров’я, поширеність інфекції, зумовленої HSV, майже тотальна. Так, 98-99% дорослих інфіковані HSV 1 типу (HSV1), а 73-75% – 2 типу (HSV2). У структурі вірусної патології HSV-індуковані хвороби посідають друге місце після грипу за показниками захворюваності та як причина смертності [4].
Найбільш відомими в клінічній практиці різновидами герпесвірусної інфекції є орофаціальний (частіше спричинений HSV1) та генітальний герпес (як правило, зумовлений HSV2). У США, наприклад, щороку реєструють щонайменше 720 тис. хворих лише на генітальну форму (встановлено серопозитивність у 30 млн жителів та 20-30% вагітних).
У Європі серед захворювань, що передаються статевим шляхом, ця форма інфекції посідає друге місце після трихомоніазу. Загалом не менше 10% жінок та 15% чоловіків мають герпетичні ураження статевої системи [7].
Неонатальна герпесвірусна інфекція (1 випадок на 5 тис. пологів, або 0,02%) проявляється такими клінічними формами: ураження шкіри та слизових оболонок (45%); енцефаліт (35%); дисемінована форма (25%) – одночасно в процес залучаються печінка, легені, шкіра, надниркові залози (смертність при цій формі перевищує 90% випадків) [7].
Частота перинатальної герпесвірусної інфекції варіює, за різними даними, від 2,5 до 5% [4]. Найнебезпечнішим є інфікування плода в І триместрі вагітності, у період ембріоно- та плацентогенезу, коли відбувається диференціювання та починається формування органів і систем плода.
Труднощі в діагностиці ймовірного інфікування плода пов’язані зі складністю та різноманітністю методів лабораторної діагностики неуточненої цитомегаловірусної (аnti-CMV IgM + аnti-CMV IgG + авідність аnti-CMV IgG + полімеразно-ланцюгова реакція (ПЛР) і герпетичної інфекції (аnti-НSV IgM + аnti-НSV IgG + авідність аnti-НSV IgG + ПЛР) [7].
До того ж невідомо, як правильно оцінювати високий антитілогенез IgG у крові вагітних до CMV і HSV1/HSV2 в жінок з різною авідністю антитіл класу IgG до CMV і HSV. І якщо в протоколах Російської Федерації з діагностики і профілактики внутрішньоутробних інфекцій у дітей зазначено 50% ризик інфікування новонароджених за наявності в матері антитіл класу M у поєднанні з низькою авідністю антитіл класу G до цитомегаловірусу, то в протоколах з акушерства і гінекології з тематики «Перинатальні інфекції» МОЗ України така група пацієнток взагалі не вказується.
Мета цієї роботи – оцінити серологічні та молекулярно-генетичні маркери реактивації хронічних CMV-, HSV1- і HSV2-інфекцій, які можуть спричинити внутрішньоутробне ураження плода, а також запропонувати ефективну медикаментозну профілактику цих вроджених герпесвірусних інфекцій на етапі планування вагітності.
Пацієнти і методи
Під спостереженням перебувало 42 жінки з високим ризиком внутрішньоутробного ураження плода через наявність серологічних і/або молекулярно-генетичних маркерів реактивації хронічних герпесвірусних інфекцій. Пацієнток (середній вік 22,3±4,5 року) обстежували на етапі планування повторної вагітності.
Остаточний діагноз «ЦМВІ», «HSV1-інфекція», «HSV2-інфекція» та їх поєднання встановлювали на підставі даних епідеміологічного анамнезу, клінічних симптомів, результатів загальноклінічних досліджень, спеціальних інструментальних методів (ультразвукового дослідження) і розгорнутої серологічної діагностики (виявлення антитіл класу M, G до CMV і НSV2, антитіл класу А, M, G до НSV1 методом імуноферментного аналізу, визначення індексу авідності антитіл класу IgG до досліджуваних герпесвірусів), а також ПЛР-діагностики слини, слизу шийки матки (при HSV2-інфекції) та крові.
Так, за даними акушерсько-гінекологічного анамнезу, встановлено: синдром втрати плода при попередніх вагітностях спостерігався в 6 жінок (14,3%), передчасні пологи – у 4 (9,5%), аномалії розвитку дітей та їх загибель до 1 року – у 5 пацієнток (11,9%). В усіх випадках гістологічне дослідження плода чи мертвої дитини дало можливість діагностувати вроджену ЦМВІ (2 випадки – 13,3%), HSV-інфекцію (3 випадки – 20,0%) та їх поєднання (10 випадків – 66,7%).
Для профілактики реактивації герпесвірусних інфекцій перед планованою наступною вагітністю 20 жінкам (основна група) рекомендували відтермінувати зачаття на 2-3 міс і на фоні базисної терапії (прийом валацикловіру по 0,5 г 2 р/добу протягом 7-10 днів) додатково призначили 6 підшкірних ін’єкцій алоферону в дозі 1 мг через день.
Решта жінок (n=22), які увійшли до контрольної групи, отримували лише зазначене базисне лікування. Групи були зіставні за віком і діагностичними показниками TORCH-комплексу.
Для статистичної достовірності всі дослідження виконували за допомогою однотипних тест-систем мережі лабораторій «Сінево». Для математичної обробки результатів використовували програму Statistica 6.0 (Statsoft, USA).
Результати досліджень та їх обговорення
Клініко-лабораторні ознаки ймовірної маніфестної форми ЦМВІ було виявлено в 4 жінок. У них відзначалося підвищення температури тіла, збільшення печінки, що супроводжувалося лейко- та моноцитозом, збільшенням кількості лімфобластів, наростанням активності аланін-, аспартатамінотрансферази та γ-глутамілтранспептидази. Такі прояви нагадували інфекційний мононуклеоз, однак характерних для нього лімфаденопатії та тонзиліту не спостерігалося.
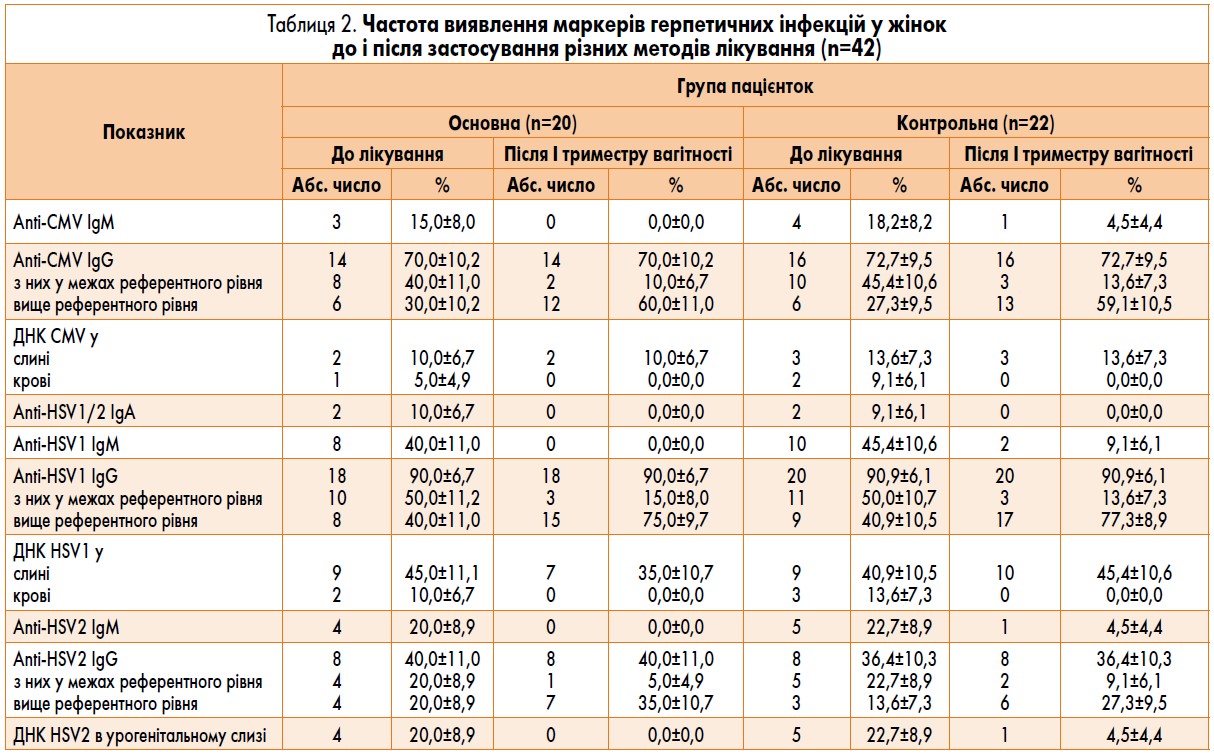
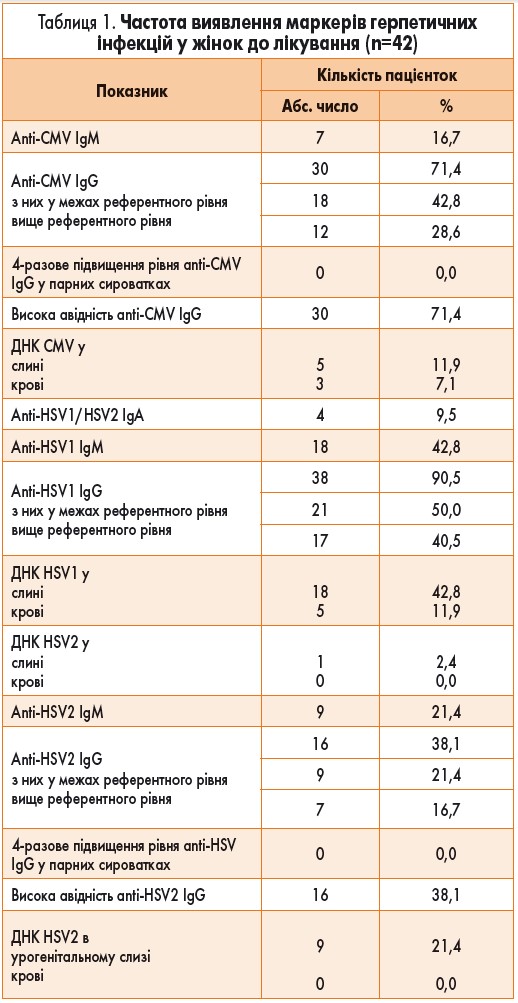 Водночас відносні серологічні ознаки реактивації хронічної ЦМВІ (наявність гострофазових імуноглобулінів) зафіксовано в 7 (16,7%) із 42 обстежених жінок (табл. 1). Антицитомегаловірусні IgG виявляли в 30 (71,4%) пацієнток, у 12 (28,6%) з яких їх титр був істотно вищим за референтне значення. Очевидно, що ізольовано високий титр аnti-CMV IgG не можна трактувати як ознаку реактивації хронічної ЦМВІ, оскільки їх рівень не відображає активності процесу, а свідчить лише про наявність імунної пам’яті організму щодо вірусу.
Водночас відносні серологічні ознаки реактивації хронічної ЦМВІ (наявність гострофазових імуноглобулінів) зафіксовано в 7 (16,7%) із 42 обстежених жінок (табл. 1). Антицитомегаловірусні IgG виявляли в 30 (71,4%) пацієнток, у 12 (28,6%) з яких їх титр був істотно вищим за референтне значення. Очевидно, що ізольовано високий титр аnti-CMV IgG не можна трактувати як ознаку реактивації хронічної ЦМВІ, оскільки їх рівень не відображає активності процесу, а свідчить лише про наявність імунної пам’яті організму щодо вірусу.
У зв’язку із цим можна було б очікувати значного (щонайменше чотириразового) збільшення рівня антитіл при дослідженні в парних сироватках, взятих з інтервалом 7-10 діб. Цей симптом зазвичай свідчить про нещодавнє інфікування або реактивацію хронічної інфекції. Однак жодного випадку прояву цієї ознаки встановлено не було.
Виявлення генетичного матеріалу СMV у крові (метод ПЛР) можна вважати абсолютною ознакою активації ЦМВІ, адже це вказує на вірусемію. Проте його виявляли рідко – у 3 (7,1%) осіб. Наявність ДНК СMV у слині (5 випадків, 11,9%) необов’язково асоціюється з реактивацією ЦМВІ, оскільки свідчить радше про хронічну персистенцію вірусу в слинних залозах.
Відомо, що майже 90% інфікованих ЦМВІ дорослих мають латентну локалізовану форму перебігу з персистенцією вірусу в слинних залозах. У решті випадків відзначається гострий перебіг з підвищенням температури тіла, збільшенням і болючістю печінки, підвищенням кількості мононуклеарів, що нагадує інфекційний мононуклеоз, проте без наявності лімфаденопатії та тонзиліту.
Генералізована інфекція в дорослих з ураженням легень, печінки трапляється рідко і спостерігається при імунодефіциті як опортуністична інфекція, наприклад, на пізніх стадіях ВІЛ-інфекції. Із ЦМВІ пов’язують до 30% гепатитів нез’ясованої етіології.
У відповідь на інфікування вірусом імунна система реагує продукуванням специфічних антитіл. При первинному інфікуванні спочатку синтезується велика кількість IgM, які з’являються в крові через 1-2 тижні після потрапляння вірусу в організм, їх рівень сягає максимуму на 4-6-й тиждень, після чого їх титр зменшується протягом кількох тижнів до 6 міс і надалі не визначається. IgG з’являються в крові через 2-3 тижні після інфікування з наростанням титрів протягом кількох тижнів, і за відсутності рецидивів їхня кількість зменшується, проте вони залишаються в крові у позитивних титрах протягом усього життя при латентному перебігу.
Реактивація інфекції зумовлює збільшення титру IgG, при цьому також може підвищуватися титр IgM. Останній підвищується меншою мірою, ніж при первинному інфікуванні, проте підвищення спостерігається вже через 7-14 діб після початку загострення хвороби.
Вторинне інфікування іншим серотипом вірусу відзначається значним зниженням вірулентності патогену в 15-250 разів, унаслідок чого клінічні прояви стерті, а рівень антитіл у сироватці крові може достовірно не змінюватись.
Ризик внутрішньоутробного інфікування та особливості ураження плода залежать від наявності антитіл у матері та терміну вагітності. При первинному інфікуванні серонегативної вагітної ризик передачі вірусу до плода високий та становить 30-50%; він мало залежить від терміну вагітності, проте знижується з віком матері. У вагітних старше 20 років ризик передачі вірусу втричі менший, ніж у молодших жінок.
Материнські IgG до CMV не забезпечують повного захисту плода, проте навіть при реактивації хронічної інфекції ризик трансплацентарного проникнення вірусу зазвичай не перевищує 1% (за даними різних літературних джерел, до 8%). Навіть якщо інфікування плода усе ж таки відбулося, дитина в більшості випадків народжується без проявів специфічної патології (латентна інфекція).
Однак 5-17% інфікованих дітей можуть мати віддалені наслідки ЦМВІ (порушення слуху, неврологічні розлади). Загалом інфікованість новонароджених становить 0,5-2,5%, а частота клінічних проявів у них не перевищує 0,1-0,5%.
Активна форма рецидивної герпесвірусної інфекції проявлялася типовими везикулярними висипаннями на облямівці губ чи шкірі навколо них, афтами на слизовій оболонці ротової порожнини тощо (орофаціальний герпес – 15 жінок) чи на слизовій оболонці вульви, піхви, цервікального каналу (генітальний герпес – 6 пацієнток), що супроводжувалися відповідним локальним свербінням, болючістю і відчуттям печіння, а нерідко ще й ознаками загальної інтоксикації.
Непрямі методи діагностики інфекцій, спричинених вірусами простого герпесу, також наведені в таблиці 1. Так, лише в 4 (9,5%) жінок виявили IgA до НSV1/НSV2. Інші гострофазові IgM до НSV1 і НSV2 були наявні у 18 (42,8%) і 9 (21,4%) пацієнток відповідно. Як і при ЦМВІ, зазначені серологічні ознаки ймовірної реактивації герпетичної інфекції виявляли частіше, ніж клінічні симптоми. Вважаємо, що цей вид антитіл може бути надійним маркером гострої стадії інфекційного процесу, особливо в разі збільшення рівня IgM при дослідженні парних сироваток.
Однак такі імуноглобуліни не можуть вказувати на реактивацію хронічного процесу. За даними літератури, лише в 56% пацієнтів з активною формою рецидивної герпесвірусної інфекції підвищується вміст IgM; у них часто фіксують зниження, а не підвищення концентрації IgG; продукція ж IgA у 54% різко зменшена (можливо, HSV гальмує послідовне переключення продукції антитіл з IgM на IgG) [7]. Тому особливу увагу слід звертати на типові клінічні симптоми, що завжди свідчать про загострення хронічної герпетичної інфекції.
Аnti-НSV1 IgG виявляли найчастіше – у 38 (90,5%) жінок, а IgG до НSV2 – у 9 (21,4%) пацієнток, що не суперечить даним літератури, адже абсолютна більшість дорослих людей інфікована герпесвірусами. Тому одноразове визначення цих антитіл не має клінічного значення. Проте й кількаразового збільшення рівня аnti-НSV IgG у парних сироватках пацієнток не встановили.
Варто зазначити, що авідність відповідних протигерпетичних IgG в усіх випадках була високою. Як і слід було очікувати, попри те що низький індекс авідності є досить надійним показником нещодавнього інфікування, він не відображає загострення хронічної інфекції.
Молекулярний метод діагностики герпесвірусної інфекції дозволив виявити ДНК НSV1 у слині 18 (42,8%) жінок, що, так само як і при ЦМВІ, необов’язково вказує на реактивацію процесу. У слині 1 (2,4%) пацієнтки був НSV2, що також не є рідкістю, оскільки як лабіальний, так і генітальний герпес можуть зумовлювати обидва типи НSV. Натомість генетичний матеріал НSV1 у крові 5 (11,9%) осіб треба інтерпретувати як ознаку активної інфекції. Потенційну небезпеку висхідного поширення збудника може становити НSV2, наявність якого в урогенітальному слизі була підтверджена в 9 (21,4%) осіб.
Наступним кроком був пошук ефективної медикаментозної профілактики вроджених герпесвірусних інфекцій на етапі планування вагітності. Усіх учасниць дослідження розподілили на дві групи. Пацієнтки основної групи (n=20) на фоні базисної терапії (прийом валацикловіру по 0,5 г 2 р/добу протягом 7-10 днів) додатково отримували 6 підшкірних ін’єкцій алоферону в дозі 1 мг через день; у контрольній групі жінки (n=22) отримували лише зазначене базисне лікування.
У зв’язку з можливою реактивацією герпесвірусних інфекцій усім пацієнткам рекомендували відтермінувати зачаття на 2-3 міс. Групи були зіставні за віком та діагностичними показниками TORCH-комплексу. Автори відстежували перебіг наступної вагітності в кожної жінки, а також стан дитини під час народження.
Встановили, що в жодної пацієнтки основної групи під час наступної вагітності не спостерігалося ознак клінічного рецидиву досліджуваних герпесвірусних інфекцій. Пізніше кожна така жінка народила здорову доношену дитину.
У таблиці 2 наведено показники герпетичних інфекцій у пацієнток порівнюваних груп до і після лікування. Встановили, що гострофазових антитіл до СMV, НSV1 і НSV2 у жінок основної групи після апробованої хіміопрофілактики не було.
Натомість, попри відсутність статистичної відмінності між порівнюваними групами (що може бути наслідком недостатньої кількості досліджень), в однієї жінки контрольної групи (традиційна терапія без імунотропних препаратів) після I триместру наступної планованої вагітності виявили IgM до СMV, у двох – IgM до НSV1, ще в однієї – IgM до НSV2. Очевидно, що зазначений маркер вказує на небезпеку передусім через можливу реактивацію герпетичної інфекції, яка може зумовити ураження плода.
Частота виявлення IgG до всіх досліджуваних вірусів залишалася стабільною в кожній групі, хоча після I триместру вагітності їхній титр закономірно перевищував референтний рівень у більшості осіб. Це явище можна пояснити фізіологічною реакцією, спрямованою на посилення імунореактивності матері проти потенційних патогенів для плода.
Метод ПЛР дозволив підтвердити наявність генетичного матеріалу СMV і НSV1 у слині тих самих жінок до і після лікування, що вказує на хронічну персистенцію вірусу в слинних залозах, яка не становить особливої небезпеки, адже вірусемії СMV і НSV1 не було в жодному випадку.
Лише в однієї пацієнтки контрольної групи, незважаючи на попередню противірусну терапію, під час вагітності було виявлено ДНК НSV2 в урогенітальному слизі, що загрожувало трансцервікальним поширенням цього вірусу з подальшим його проникненням крізь плодові оболонки.
Загалом усі 20 жінок основної групи, які на етапі планування вагітності на фоні загальноприйнятої базисної терапії (хіміопрофілактики) герпесвірусних інфекцій додатково отримували алоферон, народили здорових доношених дітей.
У 2 пацієнток контрольної групи, лікування яких не включало апробованого препарату, перебіг вагітності супроводжувався ускладненнями. До того ж в однієї жінки вагітність закінчилася передчасними пологами на 26-27-му тижні та антенатальною загибеллю плода, а в другої – народженням недоношеної дитини (32 тижні), яка через 1 міс 28 діб померла від нетравматичного крововиливу в шлуночок головного мозку. В обох випадках патанатомічно як фоновий стан було діагностовано внутрішньоутробну герпесвірусну і цитомегаловірусну інфекцію. Проілюструємо це прикладом із власної практики.
Клінічний випадок
Пацієнтка Г. С., 28 років. Два роки тому в терміні 15-16 тижнів першої вагітності стався самовільний викидень.
При взятті на облік у терміні 6-8 тижнів вагітності на підставі наявності згрупованих везикул на малих і великих статевих губах, а також на шкірі перианальної ділянки, що супроводжувалися свербінням, почервонінням і набряком тканин, клінічно діагностовано рецидивний генітальний герпес.
За результатами імуноферментного аналізу відразу після I триместру вагітності встановлено:
IgM до CMV 0,51 АІ (референтне значення <0,8 АІ – негативний результат);
IgG до CMV 19,6 AІ (референтне значення >1,1 АІ – позитивний результат);
авідність IgG до CMV 84% (референтне значення >60% – висока);
IgM до HSV 1 типу 0,46 R (референтне значення <0,8 R – негативний результат);
IgG до HSV 1 типу 4,24 R (референтне значення >1,1 R – позитивний результат);
IgM до HSV 2 типу 2,33 R (референтне значення >1,1 R – позитивний результат);
IgG до HSV 2 типу 16,8 R (референтне значення <0,9 R – негативний результат);
IgА до HSV1/2 типу 2,25 R (референтне значення <0,8 R – негативний результат);
авідність IgG до HSV 2 типу 82% (референтне значення ≥50% – висока);
виявлено ДНК НSV2 в урогенітальному слизі;
IgM до Toxoplasma gondii 0,64 AI (референтне значення <0,8 AI – негативний результат);
IgG до Toxoplasma gondii 78,8 IU/ml (референтне значення >12,0 IU/ml – позитивний результат);
IgM до вірусу краснухи 0,34 AI (референтне значення <0,8 AI – негативний результат);
IgG до вірусу краснухи 45,68 ІЕ/мл (референтне значення >10 ІЕ/мл – позитивний результат);
IgA до Chlamydia trachomatis не виявлено;
IgM до Chlamydia trachomatis не виявлено;
IgG до Chlamydia trachomatis не виявлено;
IgA до Ureaplasma urealyticum не виявлено;
IgG до Ureaplasma urealyticum не виявлено;
IgA до Mycoplasma hominis не виявлено;
IgG до Mycoplasma hominis не виявлено.
Таким чином, клінічна діагностика рецидивного генітального герпесу підкріплена лабораторно – виявленням IgM та IgG до HSV 2 типу (за високої авідності відповідних IgG), а також наявністю ДНК НSV2 в урогенітальному слизі. Цілком ймовірно, що саме це захворювання матері зумовило ураження плода і викидень.
Після зазначеного інциденту пацієнтка двічі лікувалася у зв’язку з черговими рецидивами генітального герпесу. Отримувала валацикловір по 0,5 г 2 р/добу протягом 7-10 днів.
Згодом жінка звернулася до гінеколога з метою підготовки до наступної запланованої вагітності й була обстежена на предмет TORCH-комплексу:
IgM до CMV 0,62 АІ (референтне значення <0,8 АІ – негативний результат);
IgG до CMV 24,3 AІ (референтне значення >1,1 АІ – позитивний результат);
авідність IgG до CMV 90% (референтне значення >60% – висока);
IgM до HSV 1 типу 0,58 R (референтне значення <0,8 R – негативний результат);
IgG до HSV 1 типу 6,30 R (референтне значення <0,9 R – негативний результат);
IgM до HSV 2 типу 0,26 R (референтне значення <0,8 R – негативний результат);
IgG до HSV 2 типу 4,24 R (референтне значення >1,1 R – позитивний результат);
IgА до HSV1/2 типу 0,39 R (референтне значення <0,8 R – негативний результат);
авідність IgG до HSV 2 типу 87% (референтне значення ≥50% – висока);
IgM до Toxoplasma gondii 0,72 AI (референтне значення <0,8 AI – негативний результат);
IgG до Toxoplasma gondii 43,5 IU/ml (референтне значення >12,0 IU/ml – позитивний результат);
IgM до вірусу краснухи 0,34 AI (референтне значення <0,8 AI – негативний результат);
IgG до вірусу краснухи 39,93 ІЕ/мл (референтне значення >10 ІЕ/мл – позитивний результат);
IgA до Chlamydia trachomatis не виявлено;
IgM до Chlamydia trachomatis не виявлено;
IgG до Chlamydia trachomatis не виявлено;
IgA до Ureaplasma urealyticum не виявлено;
IgG до Ureaplasma urealyticum не виявлено;
IgA до Mycoplasma hominis не виявлено;
IgG до Mycoplasma hominis не виявлено.
Попри те що клінічних проявів генітального герпесу на момент огляду не було, на підставі анамнестичних даних пацієнтку зарахували до групи ризику стосовно герпетичних інфекцій, у зв’язку із чим вона профілактично отримала черговий курс лікування валацикловіром.
Незважаючи на лікування, у I триместрі наступної вагітності спостерігався епізод генітального герпесу з характерними клінічними проявами. У терміні 26-27 тижнів розпочалася пологова діяльність.
Діагноз клінічний
Пологи II передчасні, на 26-27 тижні вагітності. Сідничне передлежання плода. Неспроможність післяопераційного рубця на матці. Антенатальна загибель плода.
Патологоанатомічний діагноз
Основне захворювання. Антенатальна асфіксія плода: численні точкові крововиливи в слизові та серозні оболонки, рідка кров у камерах серця та просвіті великих судин, виражене загальне венозне повнокров’я внутрішніх органів.
Ускладнення основного захворювання. Виражені розлади мікроциркуляції у внутрішніх органах. Геморагічна інфільтрація мозкового шару обох надниркових залоз. Крововиливи в паренхіму легень, нирок. Перивазальний, перицелюлярний набряк головного мозку. Численні екстравазальні крововиливи в головному мозку.
Супутні захворювання. Внутрішньоутробна інфекція – герпесвірусна і цитомегаловірусна: двобічна вогнищева десквамаційна пневмонія, вогнищевий паренхіматозно-інтерстиціальний міокардит, вогнищевий енцефаліт, наявність клітин з гіперхромними внутрішньоядерними включеннями та цитомегалія у внутрішніх органах. Акцидентальна інволюція тимуса II стадії. Недоношеність.
Клініко-патологоанатомічний епікриз
На підставі зіставлення клінічних і патологоанатомічних даних було зроблено висновок, що в мертвонародженого породіллі Г. С., народженого при других передчасних пологах у 26-27 тижні вагітності, відбулася внутрішньоутробна асфіксія, зумовлена недостатністю плаценти.
Морфологічними проявами дисфункції плаценти були поширені дистрофічні та дегенеративні зміни, розлади гемодинаміки, явища запалення в посліді. Смерть плода настала антенатально. Певну роль у танатогенезі відіграли супутні захворювання – внутрішньоутробна мікст-інфекція (герпесвірусна і цитомегаловірусна), акцидентальна інволюція тимуса.
Таким чином, додаткове застосування препаратів алоферону в комплексній профілактиці вроджених герпесвірусних інфекцій у кожної жінки відповідної групи ризику забезпечувало відсутність реактивації герпесвірусів під час вагітності, що сприяло набагато кращому клініко-лабораторному ефекту порівняно з валацикловіром, який використовувався в контрольній групі.
Раніше вважалося, що імунна система не здатна впливати на вірус, що перебуває всередині нейрона, проте останнім часом пропонується теорія потрійної взаємодії «вірус – нейрон – імунна система». Доведено збільшення кількості CD8+ Т-лімфоцитів навколо тіл нейронів і посилення продукції цитокінів CCL5 (наприклад, інтерлейкіну (ІЛ)-8), інтерферону-γ та фактора некрозу пухлини. Інтерферон-γ – найважливіший фактор, що гальмує реплікацію герпесвірусів на рівні нейрона через пригнічення надранніх вірусних протеїнів [8].
Як відомо, антивірусна дія індукторів інтерферону реалізується через механізми активації ними цитокінів, що пригнічуються при вірусному інфікуванні. Вважають, що здатність «забороняти відключення» цитокінів при вірусних інфекціях може стати методом відбору нових антивірусних препаратів.
Першим представником цієї унікальної групи противірусних засобів є препарат алоферон, в основу створення якого лягла відшліфована тисячоліттями здатність алоферонів комах (олігопептиди імунної системи комах) «забороняти відключення» цитокінів [9].
Отже, реакції цитокінового ряду безпосередньо пов’язані з противірусними ефектами цитокінів. Вони можуть реалізовуватися на рівні інфікованих клітин і/або активувати неспецифічний клітинний імунітет, при цьому кінцевим етапом реакції цитокінового ряду є участь у специфічній імунній відповіді [9, 10].
Дія алоферону спрямована на посилення розпізнавання вірусних антигенів та інфікованих клітин натуральними (природними) кілерами (NK), нейтрофілами й іншими ефекторними системами природного імунітету, відповідальними за елімінацію вірусу.
Саме такий механізм дії особливо актуальний при лікуванні рецидивних герпесвірусних інфекцій. Як показали дослідження останніх років, різні представники родини Herpesviridae захищають інфіковану клітину організму-хазяїна від знищення цитотоксичними лімфоцитами, блокуючи активність Т- і NK-клітин.
Цим і пояснюється розвиток хронічного процесу при герпесвірусних інфекціях. Алоферон поліпшує розпізнавання уражених клітин і дозволяє пригнічувати вогнища реплікації вірусу. Крім того, препарат посилює продукцію інтерферону-γ природними кілерами (NK-клітинами) у відповідь на стимуляцію ІЛ‑12 [10].
Таким чином, головна ефекторна функція NK-клітин – продукція цитокіну. Вони допомагають обмежувати і контролювати розповсюдження вірусу в перші години і дні після зараження. Зважаючи на цю важливу роль NK-клітин у регуляції вірусних інфекцій, не дивно, що багато вірусів виробили механізми для модуляції активності NK-клітин. Отже, без медикаментозної активації NK-клітин препаратами, що «забороняють відключення» цитокінів (алоферон), обійтися складно.
Найбільш вивченими ці механізми були у вірусів родини Herpesviridae. Оскільки вірус герпесу кодує дуже велика кількість генів, частина вірусного геному може кодувати імуносупресорні білки. Ці імуносупресанти дозволяють вірусу «ховатися» від основних компонентів імунної системи і, таким чином, дозволяють вірусу герпесу персистувати [10].
Герпесвіруси не лише персистують, але й репродукуються в клітинах імунної системи. Тим самим вони, зумовлюючи загибель або зниження функціональної активності цих клітин, спричиняють розвиток вторинних імунодефіцитних станів і підтримують тривалу персистенцію вірусу. Таким чином, виникає своєрідне хибне коло.
На відміну від відомих індукторів інтерферону алоферон є кофактором, який дозволяє лейкоцитам, що продукують інтерферон-α, ефективно реагувати на вірусний антиген. Це дає можливість сфокусувати дію препарату в місці розмноження вірусу й запобігти надлишковій реакції лейкоцитів за межами вогнища інфекції [11].
Отримані дані свідчать про значну імунокорегувальну дію апробованого імунотропного препарату. Позитивні зміни стосуються системи цитокінів: спостерігається активація клітинних механізмів вродженого імунітету, що сприяє пригніченню системної і місцевої реплікації герпесвірусів. Загалом застосування препарату забезпечує дієву профілактику вроджених герпесвірусних інфекцій на етапі планування вагітності в жінок з високим ризиком внутрішньоутробного ураження плода через наявність серологічних і/або молекулярно-генетичних маркерів реактивації зазначених хронічних інфекцій.
Висновки
1. Повторну появу у крові IgM до СMV можна розцінювати як ознаку загострення хронічної ЦМВІ. Однак абсолютне значення має виявлення генетичного матеріалу СMV у крові (метод ПЛР), але не в слині. Таку вірусемію вдається виявити рідко. Тому для встановлення реактивації СMV варто орієнтуватися передусім на клінічні та інші лабораторні ознаки ЦМВІ: підвищення температури тіла, збільшення печінки, лейко- та моноцитоз, збільшення кількості лімфобластів, наростання активності аланін-, аспартатамінотрансферази та γ-глутамілтранспептидази. На відміну від інфекційного мононуклеозу такі прояви не супроводжуються лімфаденопатією та тонзилітом.
2. Подібним чином можна трактувати і повторну сероконверсію гострофазових білків (IgA та IgM) до HSV1/HSV2, а також виявлення ДНК НSV1 у крові чи ДНК НSV2 в урогенітальному слизі. Та визначальне значення для діагностики реактивації хронічної НSV-інфекції мають клінічні прояви: типові везикулярні висипання на облямівці губ чи шкірі навколо них, афти на слизовій оболонці ротової порожнини тощо (орофаціальний герпес), везикули на слизовій оболонці вульви, піхви, цервікального каналу (генітальний герпес) з локальним свербінням, болючістю, відчуттям печіння та ознаками загальної інтоксикації.
3. Високий рівень IgG до СMV, HSV1 і HSV2 не можна трактувати як показник реактивації відповідної хронічної герпесвірусної інфекції. Авідність аnti-CMV IgG, аnti-НSV2 IgG при хронічних герпесвірусних інфекціях також завжди залишається високою.
4. У разі реактивації герпесвірусів збільшення рівня відповідних IgG у ≥4 рази при дослідженні в парних сироватках не відбувається.
5. Жінкам із групи ризику рекомендована комплексна профілактика вроджених герпесвірусних інфекцій: прийом валацикловіру по 0,5 г 2 р/добу протягом 7-10 днів та 6 підшкірних ін’єкцій цитокіноподібного препарату алоферону в дозі 1 мг через день на етапі планування вагітності. На відміну від базисного лікування ця комбінація дозволяє запобігти реактивації герпесвірусів (СMV, HSV1 і HSV2) під час вагітності.
Список літератури знаходиться в редакції.
Тематичний номер «Акушерство, Гінекологія, Репродуктологія» № 3 (31), жовтень 2018 р.