10 січня, 2019
Міждисциплінарні проблеми кардіології: думка провідних європейських експертів у рамках Кардіофоруму 2018
За матеріалами науково-практичної конференції, 7-8 вересня, м. Львів
На початку вересня у Львові відбулася масштабна спеціалізована конференція CardioForum, у рамках якої лікарі різних спеціальностей обговорювали оптимальні підходи до лікування серцево-судинних (СС) захворювань і супутньої патології. Лейтмотивом заходу очікувано став аналіз положень рекомендацій Європейського товариства кардіології (ESC) та Європейського товариства гіпертензії (ESH) з лікування артеріальної гіпертензії (АГ), оновлених у поточному році.
Високий науковий рівень доповідей привернув увагу вітчизняних кардіологів, терапевтів і лікарів загальної практики: у лекційних залах кардіофоруму українською, російською, англійською лунали доповіді провідних європейських і вітчизняних фахівців.
 Наукову програму конференції CardioForum відкрив професор Peter Nilsson (Швеція), який присвятив свою доповідь роз’ясненню оновлених положень настанов ESC/ESH з лікування АГ й актуальним тенденціям у кардіології. Науковець особливо відзначив високу поширеність АГ у Європейському регіоні, зокрема в Україні. Так, розповсюдженість АГ у нашій державі протягом останніх 25 років зросла з 30,6 до 35,3%, що супроводжувалося також підвищенням середніх значень систолічного артеріального тиску (САТ) в українській популяції. Представляючи положення оновлених рекомендацій ESC/ESH з лікування АГ (2018), професор P. Nilsson підкреслив, що дефініція і класифікація АГ залишилися незмінними (табл. 1).
Наукову програму конференції CardioForum відкрив професор Peter Nilsson (Швеція), який присвятив свою доповідь роз’ясненню оновлених положень настанов ESC/ESH з лікування АГ й актуальним тенденціям у кардіології. Науковець особливо відзначив високу поширеність АГ у Європейському регіоні, зокрема в Україні. Так, розповсюдженість АГ у нашій державі протягом останніх 25 років зросла з 30,6 до 35,3%, що супроводжувалося також підвищенням середніх значень систолічного артеріального тиску (САТ) в українській популяції. Представляючи положення оновлених рекомендацій ESC/ESH з лікування АГ (2018), професор P. Nilsson підкреслив, що дефініція і класифікація АГ залишилися незмінними (табл. 1).
До факторів ризику АГ належать чоловіча стать, похилий вік, куріння (у минулому або нині), високий рівень загального холестерину (ХС), ХС ліпопротеїнів низької щільності (ЛПНЩ), сечової кислоти (СК), наявність супутнього цукрового діабету (ЦД), надлишкової маси тіла, ожиріння, обтяженого сімейного анамнезу щодо передчасної СС-смерті (чоловіки <55 років, жінки <65 років) і раннього початку АГ, рання менопауза, гіподинамія, висока частота серцевих скорочень (у спокої >80 уд./хв). Важливою є наявність підтверджених СС-захворювань (ішемічна хвороба серця (ІХС), інфаркт міокарда (ІМ), стенокардія, перенесена реваскуляризація, серцева недостатність (СН), фібриляція передсердь, цереброваскулярна патологія (ішемічний інсульт, внутрішньочерепна кровотеча, транзиторна ішемічна атака), захворювання нирок або периферичних артерій, виявлення атероматозної бляшки в сонних артеріях при проведенні візуалізаційних досліджень.
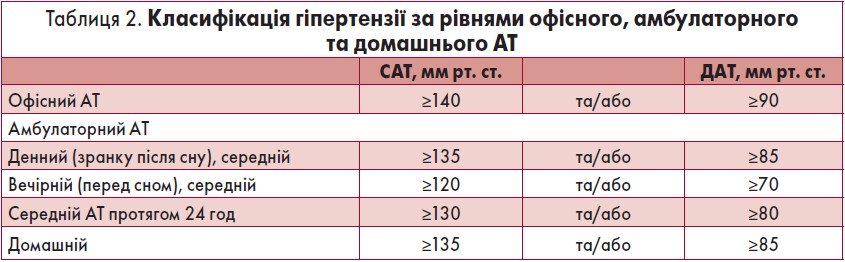
Професор P. Nilsson привернув увагу присутніх до класифікації гіпертензії залежно від рівня офісного, амбулаторного і домашнього АТ (табл. 2). 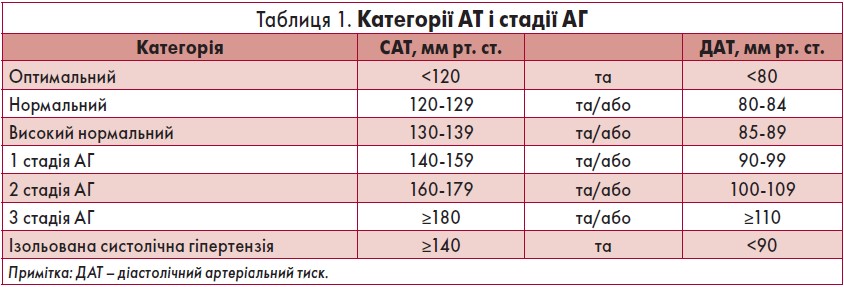
 Далі доповідач акцентував на необхідності проведення ретельного інструментального обстеження хворих на АГ для виключення ураження органів-мішеней. Згідно з положеннями оновлених настанов ESC/ESH, усі пацієнти з АГ потребують проведення 12-канальної ЕКГ (клас рекомендації I, рівень доказів B)1;
Далі доповідач акцентував на необхідності проведення ретельного інструментального обстеження хворих на АГ для виключення ураження органів-мішеней. Згідно з положеннями оновлених настанов ESC/ESH, усі пацієнти з АГ потребують проведення 12-канальної ЕКГ (клас рекомендації I, рівень доказів B)1;
1 Класи рекомендацій: І – докази та/або загальна згода, що лікування або процедура є корисною та ефективною; ІІ – суперечливі докази та/або розбіжність експертної думки про користь/ефективність лікування або процедури: ІІа – більш переконливі докази/експертна думка на користь того, що лікування є ефективним, ІІb – менш переконливі докази про ефективність.
Рівні доказів: А – дані отримані в численних рандомізованих клінічних дослідженнях або метааналізах; B – дані отримані в єдиному рандомізованому клінічному дослідженні або великих нерандомізованих дослідженнях; С – консенсус експертної думки та/або невеликі дослідження, ретроспективні дослідження або реєстри.
натомість ехокардіографію (ЕхоКГ) необхідно рекомендувати особам з АГ, у яких на ЕКГ виявлено патологічні зміни, а також хворим зі специфічними симптомами/ознаками дисфункції лівого шлуночка (ЛШ; I, B). Ультразвукове дослідження каротидних артерій показане хворим, які перенесли інсульт або транзиторну ішемічну атаку (I, B), безсимптомним пацієнтам з атеросклеротичними бляшками чи стенозом каротидних артерій (IIb, B). Усім хворим на АГ слід провести визначення сироваткової концентрації креатиніну, швидкості клубочкової фільтрації (ШКФ; I, B), а також розрахунок співвідношення альбумін–креатинін (I, B).
Учасників кардіофоруму неабияк зацікавила наступна частина доповіді професора P. Nilsson, присвячена лікуванню АГ. Експерти ESC/ESH рекомендують знижувати офісний АТ <140/90 мм рт. ст. в усіх хворих на АГ, при добрій переносимості терапії необхідно прагнути досягти цільового рівня АТ 130/80 мм рт. ст. або нижчих значень (I, A). Оновлені рекомендації передбачають різні діапазони зниження САТ залежно від віку хворих. Так, пацієнтам віком до 65 років, які отримують гіпотензивні препарати, рекомендується підтримувати рівень САТ від 120 до <130 мм рт. ст. (I, A), тоді як у хворих віком понад 65 років він має інші межі – 130-140 мм рт. ст. (I, A).
У пацієнтів з діабетом первинною метою є зниження АТ <140/80 мм рт. ст. (цільовий САТ – 130 мм рт. ст.; І, А). Якщо лікування добре переноситься, САТ можна знижувати <130 мм рт. ст. (проте в жодному разі не <120 мм рт. ст.) з огляду на переваги щодо профілактики інсульту (І, А). У пацієнтів віком ≥65 років із ЦД цільовий діапазон САТ становить 130-139 мм рт. ст. (І, А). Рівень ДАТ у хворих на діабет має бути <80, але не <70 мм рт. ст. (І, С).
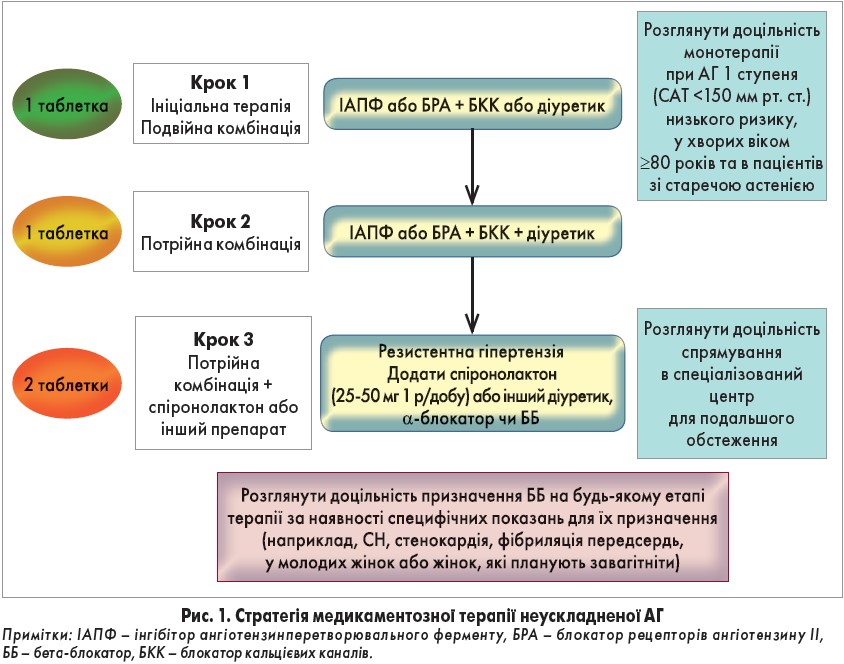
Продовжуючи свій виступ, професор P. Nilsson приділив велику увагу стратегії медикаментозного лікування неускладненої АГ (рис. 1), відповідно до якої сучасна фармакотерапія АГ ґрунтується на застосуванні всіх 5 основних класів антигіпертензивних препаратів з переважним призначенням фіксованих комбінацій.
Стратегія медикаментозного лікування неускладненої АГ (може використовуватися в більшості пацієнтів із цереброваскулярною патологією, ЦД, захворюваннями периферичних артерій).
Зазвичай стартова терапія має включати блокатор ренін-ангіотензин-альдостеронової системи (РААС; ІАПФ або БРА) в комбінації з БКК чи діуретиком; також можуть використовуватися інші комбінації (I, A). Виключенням є пацієнти з коморбідними ІХС, ХСН, фібриляцією передсердь, в яких початкова схема лікування має включати ББ. Особливу увагу було приділено ББ із судинорозширювальними властивостями як препаратам, які краще знижують центральний АТ порівняно з більш застарілими кардіоселективними ББ.
У доповіді були представлені нові дані двох нещодавно опублікованих досліджень, проведених у США, із застосування ББ у лікуванні АГ. Аналіз терапії 130 тис. пацієнтів продемонстрував статистично значиме зниження частоти госпіталізацій з приводу кардіоваскулярних ускладнень у 1,5-2 раза на тлі лікування небівололом (як у монотерапії, так і в комбінації з іншими антигіпертензивними засобами) порівняно з використанням ББ без судинорозширювальних властивостей.
Рекомендується розпочинати гіпотензивну терапію з двокомпонентної комбінації, бажано у вигляді фіксованої комбінації. Монотерапія може бути доцільною лише в пацієнтів з АГ 1 ступеня, в ослаблених пацієнтів і хворих у віці старше 80 років.
Розглядаючи найоптимальніші комбінації гіпотензивних препаратів, доповідач приділив велику увагу результатам рандомізованих контрольованих досліджень (РКД), у яких було показано, що порівняно з валсартаном та амлодипіном комбінація олмесартану й амлодипіну більш значимо знижує центральний САТ при м’якій і помірній АГ. За даними метааналізу, поєднання олмесартану й амлодипіну дає змогу знизити САТ на 23,7 мм рт. ст., натомість застосування інших комбінацій препаратів супроводжується зменшенням цього показника в середньому на 20,2 мм рт. ст.
Завершуючи свій виступ, професор P. Nilsson окреслив найбільш перспективні, на його думку, напрями кардіології майбутнього, як-от публічне здоров’я (спрощення підходу за допомогою використання фіксованих комбінацій, підтримання відмови від паління), спеціалізована кардіологія (персоніфікована терапія, заснована на генетичному профілюванні), регенеративна кардіологія (відновлення втрачених функцій серця, терапія стовбуровими клітинами тощо).
 Доповідь «Найбільш ефективні комбінації лікарських засобів для лікування резистентної гіпертензії» представила доктор медичних наук, професор Олена Геннадіївна Несукай (ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України», м. Київ). Починаючи свій виступ, Олена Геннадіївна підкреслила, що про резистентну АГ йдеться у випадку, коли на тлі застосування оптимальних (або таких, що найкраще переносяться) доз трьох або більше препаратів (зазвичай ІАПФ або БРА з БКК і тіазидним/тіазидоподібним діуретиком) неможливо домогтися зниження САД і ДАТ до <140 та/або <90 мм рт. ст. відповідно. Крім цього, слід підтвердити неадекватний контроль АТ за даними добового моніторування, виключити псевдорезистентну (у тому числі внаслідок низької прихильності до терапії) і вторинну АГ. Доповідач наголосила, що в оновленій версії рекомендацій ESC/ESH велику увагу приділено інертності лікарів, як діагностичній, так і терапевтичній. За словами професора О.Г. Несукай, приклади лікарської інерції можна спостерігати в дослідженнях, де через недостатню титрацію дози, відсутність підвищення дози ліків або непризначення комбінованих медикаментів не вдається досягти цільових цифр АТ.
Доповідь «Найбільш ефективні комбінації лікарських засобів для лікування резистентної гіпертензії» представила доктор медичних наук, професор Олена Геннадіївна Несукай (ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України», м. Київ). Починаючи свій виступ, Олена Геннадіївна підкреслила, що про резистентну АГ йдеться у випадку, коли на тлі застосування оптимальних (або таких, що найкраще переносяться) доз трьох або більше препаратів (зазвичай ІАПФ або БРА з БКК і тіазидним/тіазидоподібним діуретиком) неможливо домогтися зниження САД і ДАТ до <140 та/або <90 мм рт. ст. відповідно. Крім цього, слід підтвердити неадекватний контроль АТ за даними добового моніторування, виключити псевдорезистентну (у тому числі внаслідок низької прихильності до терапії) і вторинну АГ. Доповідач наголосила, що в оновленій версії рекомендацій ESC/ESH велику увагу приділено інертності лікарів, як діагностичній, так і терапевтичній. За словами професора О.Г. Несукай, приклади лікарської інерції можна спостерігати в дослідженнях, де через недостатню титрацію дози, відсутність підвищення дози ліків або непризначення комбінованих медикаментів не вдається досягти цільових цифр АТ.
Не менше значення має прихильність пацієнтів до терапії, що проводиться. За даними одного РКД, у якому прихильність до лікування оцінювалася за допомогою суворого моніторування концентрації досліджуваного препарату в крові, лише 34,5% пацієнтів приймали ліки згідно з призначеною схемою, 65,5% хворих відповідали критеріям неприхильності до терапії, а в 34,5% учасників досліджувані засоби в крові взагалі не виявлялися.
Роз’яснюючи положення оновлених рекомендацій, що регламентують стартову терапію АГ, професор О.Г. Несукай приділила велику увагу вибору оптимального блокатора РААС. Доповідач навела результати метааналізу, який показав, що ІАПФ і БРА є зіставними за ефективністю зниження АТ, і довів перевагу БРА над ІАПФ щодо безпеки лікування: сартани рідше спричиняють небажані реакції, їх рідше відміняють. Відмічено, найсильнішим серед усіх БРА є олмесартан, оскільки клінічний ефект при його застосуванні починає проявлятися вже через 1-2 тиж. На відміну від інших сартанів олмесартан активує ангіотензинперетворювальний фермент другого типу, що зумовлює підвищення концентрації ангіотензину 1-7. Ангіотензин 1-7 має здатність знижувати периферійний опір судин, а також чинить інші нефро- і кардіопротекторні ефекти.
Професор О.Г. Несукай назвала такі переваги фіксованих комбінацій: швидке зниження АТ, велика ймовірність досягнення цільового АТ, нейтралізація побічних ефектів монотерапії, покращення переносимості, висока прихильність до терапії, зменшення ризику СС-подій у порівнянні з монотерапією, економічна доступність. Серед безлічі зареєстрованих фіксованих комбінацій Олена Геннадіївна відокремила комбінацію олмесартану/амлодипіну, тому що це поєднання має багато переваг. Доведено, що фіксована комбінація олмесартану/амлодипіну перевершує периндоприл/амлодипін у зниженні центрального артеріального тиску у пацієнтів з АГ і ЦД. Зміна центрального аортального тиску на тлі прийому комбінації сартану/БКК мала більш виражений характер, ніж у разі застосування поєднання ІАПФ/БКК. Терапія олмесартаном/амлодипіном, сприяла значимому зниженню САТ і ДАТ. У порівнянні з периндоприлом/амлодипіном ще однією перевагою фіксованої комбінації олмесартану/амлодипіну є кращий контроль АТ при випадковому пропуску прийому препарату. Олмесартан/амлодипін перевершує периндоприл/амлодипін також за профілем переносимості лікування.
На закінчення свого виступу доповідач розглянула питання доцільності включення ББ у схему лікування хворих на резистентну АГ, які приймають ІАПФ або БРА разом із сечогінним препаратом та/або БКК. Подібну практику часто піддають критиці через незначну додаткову гіпотензивну дію ББ. Утім, це не стосується ББ з вазодилатуючими властивостями, наприклад небівололу, здатного в комбінації з блокаторами РААС забезпечувати ефективне зниження АТ.
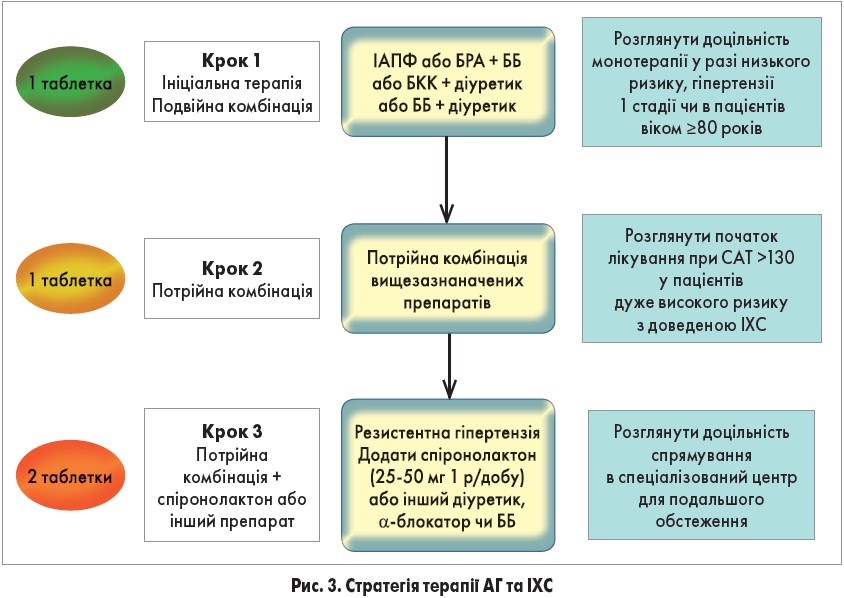
Професор О.Г. Несукай представила доповідь про стратегії медикаментозної терапії АГ та ІХС, підготовлену доктором медичних наук, професором Юрієм Миколайовичем Сіренком (ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України»). Розпочинаючи свій виступ, доповідачка зробила акцент на високій поширеності перебігу АГ на фоні супутньої ІХС як в усьому світі, так і в Україні. Одночасна наявність АГ та ІХС характеризується важким перебігом і значним зростанням смертності в порівнянні з ізольованою АГ або ІХС.
У хворих на АГ фактор наявності ІХС вносить певні зміни в рекомендований рівень цільового АТ. Так, у пацієнтів 18-65 років, які страждають на АГ та ІХС, цільовий САТ має становити 130 мм рт. ст. і нижче, якщо добре переноситься, і при цьому не повинен знижуватися <120 мм рт. ст. У когорті хворих 65-79 років цільовий АТ зростає до 130-139 мм рт. ст., якщо переноситься. Примітно, що цільовий ДАТ не залежить від віку і становить 70-79 мм рт. ст.
Доповідачка звернула увагу слухачів на стратегію терапії АГ та ІХС, викладену в нових рекомендаціях ESC/ESH (рис. 3).
Коментуючи положення оновлених настанов, професор О.Г. Несукай підкреслила гетерогенність групи ББ щодо їхніх властивостей. Протягом останніх років зросла частота застосування ББ з вазодилатуючими ефектами, таких як небіволол і карведилол. РКД, у яких проводилося вивчення небівололу, продемонстрували його здатність нормалізувати центральний аортальний тиск, зменшувати жорсткість аорти та вираженість ендотеліальної дисфункції. На відміну від класичних ББ, небіволол не чинить несприятливого впливу на метаболічний профіль, не збільшує ризик розвитку ЦД і не провокує виникнення ЕД. На завершення професор О.Г. Несукай відзначила ефективність полікомпонентної терапії АГ та ІХС і доцільність використання ББ та ІАПФ, оскільки ці препарати покращують результати лікування після перенесеного інфаркту міокарда.
 Продовжила наукову програму доповідь «Еректильна дисфункція як ранній предиктор кардіоваскулярних подій», яку представив професор Yacov Reisman (Нідерланди). Відомо, що сексуальна активність є предиктором гарного стану здоров’я і високої тривалості життя. За даними статистики, понад 50% осіб віком 57-75 років і третина представників вікової групи 75-85 років є сексуально активними. Висока сексуальна активність асоціюється з низьким ризиком смерті: у чоловіків, які часто досягають оргазму, летальність удвічі нижча, ніж у чоловіків, які рідко його відчувають. Протягом останніх років спостерігається зростання поширеності еректильної дисфункції (ЕД) в усьому світі. ЕД асоціюється з низкою негативних наслідків: зниженням упевненості в собі, зменшенням працездатності, розвитком депресії, погіршенням стосунків у родині, якості життя тощо.
Продовжила наукову програму доповідь «Еректильна дисфункція як ранній предиктор кардіоваскулярних подій», яку представив професор Yacov Reisman (Нідерланди). Відомо, що сексуальна активність є предиктором гарного стану здоров’я і високої тривалості життя. За даними статистики, понад 50% осіб віком 57-75 років і третина представників вікової групи 75-85 років є сексуально активними. Висока сексуальна активність асоціюється з низьким ризиком смерті: у чоловіків, які часто досягають оргазму, летальність удвічі нижча, ніж у чоловіків, які рідко його відчувають. Протягом останніх років спостерігається зростання поширеності еректильної дисфункції (ЕД) в усьому світі. ЕД асоціюється з низкою негативних наслідків: зниженням упевненості в собі, зменшенням працездатності, розвитком депресії, погіршенням стосунків у родині, якості життя тощо.
Розвиток ЕД пов’язують із недостатньою продукцією оксиду азоту й ендотеліальною дисфункцією, що, так само, є чинником ризику розвитку АГ, ЦД, дисліпідемії. Ризик ЕД зростає при будь-якій СС-патології: АГ, інсульті, захворюваннях периферичних артерій, а також у разі ЦД. Доведено, що поява ЕД у молодих чоловіків передує розвитку СС-захворювань; натомість нівелювання явищ ЕД у хворих, які перенесли інфаркт міокарда, асоційоване зі зниженням смертності і частоти госпіталізації, зумовленої СН.
Лікування ЕД полягає в модифікації способу життя (зниження маси тіла, підвищення фізичної активності, збільшення частки овочів і фруктів у раціоні та ін.) і прийомі специфічних медикаментів – інгібіторів фосфодіестерази 5 типу (ФДЕ‑5). Встановлено, що прийом інгібіторів ФДЕ‑5 зменшує ризик виникнення СС-подій. Порівнявши наявні на фармацевтичному ринку інгібітори ФДЕ‑5 (аванафіл, силденафіл, варденафіл, тадалафіл), доповідач відзначив переваги аванафілу: короткий проміжок часу до появи клінічного ефекту, тривалий період напіввиведення, відсутність накопичення в плазмі, високий профіль безпеки.
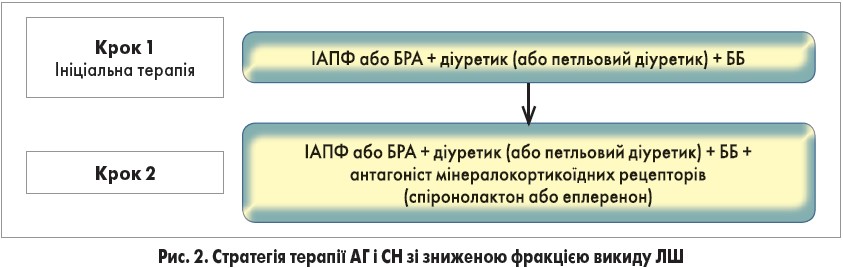
 Естафету розгляду оновлених положень настанов ESC/ESH прийняв професор Athanasios Manolis (Греція) з повідомленням «СН: терапія, рекомендована посібниками, і реальність. Що необхідно реалізувати?» Нагадавши учасникам кардіофоруму дефініцію і класифікацію СН, професор A. Manolis наголосив, що мета лікування АГ полягає в попередженні/уповільненні розвитку СН і продовженні життя хворих (IA). З цією метою всім пацієнтам з високим ризиком СС-захворювань, незалежно від наявності/відсутності систолічної дисфункції ЛШ, рекомендується терапія статинами (IA). Аналогічні завдання має рекомендація щодо відмови від тютюнових виробів / припинення куріння і зменшення вживання алкоголю, її отримують хворі-курці та особи, які зловживають алкогольними напоями (IA). Передбачається також корекція інших факторів ризику СН. Експерти ESC/ESH рекомендують призначати ІАПФ пацієнтам із безсимптомною систолічною дисфункцією ЛШ, які перенесли інфаркт міокарда, для попередження/уповільнення розвитку СН і збільшення тривалості життя (IA).
Естафету розгляду оновлених положень настанов ESC/ESH прийняв професор Athanasios Manolis (Греція) з повідомленням «СН: терапія, рекомендована посібниками, і реальність. Що необхідно реалізувати?» Нагадавши учасникам кардіофоруму дефініцію і класифікацію СН, професор A. Manolis наголосив, що мета лікування АГ полягає в попередженні/уповільненні розвитку СН і продовженні життя хворих (IA). З цією метою всім пацієнтам з високим ризиком СС-захворювань, незалежно від наявності/відсутності систолічної дисфункції ЛШ, рекомендується терапія статинами (IA). Аналогічні завдання має рекомендація щодо відмови від тютюнових виробів / припинення куріння і зменшення вживання алкоголю, її отримують хворі-курці та особи, які зловживають алкогольними напоями (IA). Передбачається також корекція інших факторів ризику СН. Експерти ESC/ESH рекомендують призначати ІАПФ пацієнтам із безсимптомною систолічною дисфункцією ЛШ, які перенесли інфаркт міокарда, для попередження/уповільнення розвитку СН і збільшення тривалості життя (IA).
На сьогодні автори настанов ESC/ESH рекомендують відмовитися від монотерапії в лікуванні АГ у хворих на СН (рис. 2).
Доповідач розглянув переваги призначення ББ при СН, підкресливши при цьому, що літніх пацієнтів часто виключають з досліджень щодо СН навіть без проведення об’єктивного огляду через віковий ценз. Тому професор А. Manolis приділив велику увагу результатам дослідження SENIORS, у якому взяли участь хворі похилого віку. Згідно з дизайном цього РКД, призначення небівололу сприяло зниженню смертності у сформованій когорті пацієнтів на 14%. Серед інших переваг дослідження SENIORS доповідач відзначив високу (68%) частку хворих, які досягли цільової дози ББ (10 мг небівололу). В інших РКД, у яких вивчалася ефективність карведилолу, метопрололу, бісопрололу, цей показник був значно меншим. Досягнення цільової дози небівололу асоціювалося зі зниженням показника загальної смертності або госпіталізації із СС-причин на 25%, а також зі зменшенням загальної смертності на 16%. Крім того, у хворих літнього віку зі зниженою/збереженою фракцією викиду ЛШ небіволол зменшував імовірність досягнення комбінованої кінцевої точки – летального наслідку або госпіталізації з кардіоваскулярних причин.
На закінчення професор А. Manolis надав перелік препаратів, які не слід призначати пацієнтам зі зниженою фракцією викиду ЛШ, оскільки ці засоби погіршують перебіг СН або збільшують ризик госпіталізації, зумовленої декомпенсацією СН. До цього списку увійшли тіазолідиндіони (глітазони), нестероїдні протизапальні препарати або інгібітори циклооксигенази‑2, дилтіазем або верапаміл, комбінація ІАПФ і БРА (підвищують ризик розвитку ниркової дисфункції та гіперкаліємії).
 Великий інтерес учасників форуму викликала доповідь професора Ralf Dechend (Німеччина) «Оптимальний вибір діуретика для хворих на СН». Стисло висвітливши патофізіологічні механізми виникнення венозного застою при СН, доповідач зосередився на лікуванні СН. Згідно із чинними рекомендаціями, терапія СН передбачає обмеження вживання солі, підтримку цільових гемодинамічних показників, збільшення екскреції натрію із сечею. Домогтися останнього можна за допомогою різних засобів: діуретиків, добутаміну, допаміну, нітрогліцерину, мілринону, несиритіду. Найефективнішими препаратами у хворих на СН є діуретики, зокрема торасемід. У порівнянні з фуросемідом торасемід має більшу біодоступність при пероральному прийомі, тривалий період дії і більш передбачуваний натрійуретичний вплив. Доведено, що торасемід негайної форми вивільнення зменшує міокардіальний фіброз і знижує загальну смертність у порівнянні з фуросемідом. Призначення торасеміду хворим на СН асоціюється зі зниженням ризику раптової смерті і некардіоваскулярної летальності. У порівнянні з фуросемідом прийом торасеміду дозволяє швидше зменшити клінічні прояви декомпенсації СН, підвищити якість життя хворих.
Великий інтерес учасників форуму викликала доповідь професора Ralf Dechend (Німеччина) «Оптимальний вибір діуретика для хворих на СН». Стисло висвітливши патофізіологічні механізми виникнення венозного застою при СН, доповідач зосередився на лікуванні СН. Згідно із чинними рекомендаціями, терапія СН передбачає обмеження вживання солі, підтримку цільових гемодинамічних показників, збільшення екскреції натрію із сечею. Домогтися останнього можна за допомогою різних засобів: діуретиків, добутаміну, допаміну, нітрогліцерину, мілринону, несиритіду. Найефективнішими препаратами у хворих на СН є діуретики, зокрема торасемід. У порівнянні з фуросемідом торасемід має більшу біодоступність при пероральному прийомі, тривалий період дії і більш передбачуваний натрійуретичний вплив. Доведено, що торасемід негайної форми вивільнення зменшує міокардіальний фіброз і знижує загальну смертність у порівнянні з фуросемідом. Призначення торасеміду хворим на СН асоціюється зі зниженням ризику раптової смерті і некардіоваскулярної летальності. У порівнянні з фуросемідом прийом торасеміду дозволяє швидше зменшити клінічні прояви декомпенсації СН, підвищити якість життя хворих.
Професор R. Dechend розповів про дослідження TRANSFORM-HF, що наразі триває. У ньому беруть участь хворі на СН. Відповідно до дизайну цього РКД пацієнти були рандомізовані в співвідношенні 1:1 для прийому фуросеміду або торасеміду. У цьому порівняльному РКД буде проаналізовано вплив зазначених діуретиків на рівень смертності від усіх причин після закінчення 12 міс терапії.
Дослідник розглянув деякі нюанси лікування діуретиками у хворих на СН. У певних випадках призначення сечогінних препаратів асоціюється з підвищенням рівня креатиніну, а іноді не супроводжується розвитком достатнього діурезу або адекватного зниження маси тіла. У подібних ситуаціях слід запідозрити відносну резистентність до діуретичної терапії, що часто має місце при СН. Справжня резистентність до діуретиків (яка передбачає погіршення функції нирок, розвиток кардіоренального синдрому) розвивається набагато рідше.
Одним із способів вирішення проблеми відносної резистентності може бути більш часте введення діуретиків. Нині тривають дискусії щодо оптимального способу введення сечогінних препаратів (болюсне або інфузійне).
Коментуючи різні способи розв’язання проблеми відносної резистентності до діуретиків, доповідач навів таку схему введення сечогінних препаратів. Хворим зі збереженою функцією нирок доцільно спочатку болюсно ввести 40 мг фуросеміду, потім провести інфузію цього препарату з розрахунку 5 мг/год (120 мг/добу). При неефективності цих заходів слід болюсно ввести 80 мг фуросеміду і продовжувати повільне введення сечогінного препарату з розрахунку 10 мг/год (240 мг/добу). Пацієнтам зі зниженою ШКФ (<30 мл/хв/1,73 м2) рекомендується збільшити стартову болюсну дозу фуросеміду до 80 мг, як і дозування препарату при проведенні інфузії до 20 мг/год (480 мг/добу). У разі неефективності описаних заходів вводять 120-160 мг фуросеміду болюсно, а потім переходять на інфузійне введення з розрахунку 40 мг/год (960 мг/добу).
Підбиваючи підсумки, професор R. Dechend підкреслив, що при гострій декомпенсації СН пероральна біодоступність сечогінних препаратів ускладнена, тому необхідно віддавати перевагу їх парентеральному введенню. Дозування, форма, схема введення, можливі комбінації петльових діуретиків з тіазидними передбачають наявність глибоких знань в області фармакології і патофізіології СН. Ефективність діуретичної терапії залежить від адекватного вибору терапії, часу і способу введення (перорально або парентерально) діуретиків, використання доцільних комбінацій різних сечогінних препаратів.
 Роль гіперурикемії в розвитку кардіоренальної патології висвітлив професор Jan Kielstein (Німеччина). Відзначивши високу поширеність гіперурикемії (25,8% чоловіків і 15,0% жінок мають високий рівень СК у крові) і подагри у світі, доповідач підкреслив, що збільшення сироваткової концентрації СК на 1 мг/дл асоційоване зі збільшенням ризику СС-смерті (відносний ризик (ВР) 1,77; 95% довірчий інтервал (ДІ) 1,12-2,81) і раптової серцевої смерті (ВР 2,41; 95% ДІ 1,16-5,00). Доведено, що рівень СК у сироватці крові є предиктором несприятливих наслідків у хворих на хронічну хворобу нирок (ХХН).
Роль гіперурикемії в розвитку кардіоренальної патології висвітлив професор Jan Kielstein (Німеччина). Відзначивши високу поширеність гіперурикемії (25,8% чоловіків і 15,0% жінок мають високий рівень СК у крові) і подагри у світі, доповідач підкреслив, що збільшення сироваткової концентрації СК на 1 мг/дл асоційоване зі збільшенням ризику СС-смерті (відносний ризик (ВР) 1,77; 95% довірчий інтервал (ДІ) 1,12-2,81) і раптової серцевої смерті (ВР 2,41; 95% ДІ 1,16-5,00). Доведено, що рівень СК у сироватці крові є предиктором несприятливих наслідків у хворих на хронічну хворобу нирок (ХХН).
Наразі для корекції гіперурикемії використовуються різні препарати, найбільш оптимальним серед них є фебуксостат. Останній перевершує алопуринол за багатьма параметрами. Так, фебуксостат є селективним інгібітором ксантиноксидази, він пригнічує окислені і відновлені форми ксантиноксидази, має два шляхи екскреції (печінковий і нирковий), характеризується високою клінічною ефективністю і добре переноситься. На підтвердження своїх слів доповідач навів дані систематичних оглядів і метааналізу, які доводять перевагу фебуксостату (80 мг) над алопуринолом (300 мг).
Є переконлива доказова база високої кардіоваскулярної безпеки фебуксостату: цей препарат не провокує розвиток інфаркту міокарда або інсульту, його прийом не асоціюється зі зростанням смертності від усіх причин у порівнянні з алопуринолом. Тривала терапія фебуксостатом не чинить негативного впливу на ШКФ, що свідчить про наявність у препарату ренопротекторних властивостей.
Коментуючи особливості лікування гіперурикемії, професор J. Kielstein спирався на рекомендації EULAR щодо лікування подагри. Згідно із цим документом, при проведенні гіпоурикемічної терапії слід ретельно контролювати рівень СК у сироватці крові, підтримуючи його в межах <6 мг/дл. Більш низький цільовий показник СК (<5 мг/дл) рекомендується при важкому перебігу подагри (за наявності тофусів, хронічної артропатії, частих атак) з метою полегшення розчинення кристалів; такої концентрації СК слід дотримуватися аж до повного розчинення кристалів. Згідно з положеннями рекомендацій EULAR, рівень СК <3 мг/дл не слід підтримувати протягом тривалого часу.
 Завдяки доповіді доктора медичних наук, професора Василя Антоновича Скибчика (Львівський національний медичний університет ім. Данила Галицького) «Стабільна стенокардія в пацієнтів зі шлуночковими аритміями. Як покращити якість життя й уникнути поліпрагмазії?» учасники заходу ознайомилися із сучасною тактикою ведення таких хворих.
Завдяки доповіді доктора медичних наук, професора Василя Антоновича Скибчика (Львівський національний медичний університет ім. Данила Галицького) «Стабільна стенокардія в пацієнтів зі шлуночковими аритміями. Як покращити якість життя й уникнути поліпрагмазії?» учасники заходу ознайомилися із сучасною тактикою ведення таких хворих.
Згадавши провідні фактори ризику розвитку мікросудинної стенокардії, доповідач підкреслив значимість дефіциту естрогенів, гістеректомії й інсулінорезистентності в розвитку ІХС і шлуночкових аритмій. Відомі випадки, коли стенокардія прогресувала після проведення реваскуляризації, що, ймовірно, було зумовлено низкою структурних (рестенози, тромбоз стента, неповна реваскуляризація, прогресування атеросклерозу) і функціональних (мікросудинна дисфункція, спазм епікардіальних коронарних артерій) порушень. Дотепер діагностика стенокардії залишається незмінною: необхідно провести ЕКГ, ЕхоКГ, стрес-тести, ангіографію.
Сучасне лікування стенокардії передбачає кілька напрямів: модифікація способу життя, нівелювання факторів ризику, призначення фармакотерапії, навчання пацієнтів. Препаратами першої лінії є ББ та АК. На додачу до ББ (або в разі їх непереносимості) призначаються БКК, при супутній серцевій недостатності, АГ показані ІАПФ (або БРА); при непереносимості АКК та ББ можуть призначатися антиангінальні препарати другої лінії: нітрати пролонгованої дії, триметазидин, нікорандил, ранолазин. Для проведення вторинної профілактики використовуються аспірин і статини. Ранолазин (антиангінальний препарат) виявляє значущі антиаритмічні властивості. Він рекомендований АНА/АСС/HRS (2017) для лікування шлуночкових аритмій і профілактики раптової серцевої смерті, тому що його призначення дозволяє знизити ймовірність шлуночкової тахікардії/аритмії. У дослідженні J. Murray (2016) ранолазин зменшує шлуночкову бігемінію на 80%, ризик появи парних екстрасистол – на 78%, виникнення шлуночкової тахікардії – на 91%. Ранолазин достовірно знижував ризик шлуночкової аритмії при гострій ішемії міокарда, стабільної стенокардії, систолічної дисфункції ішемічного генезу. Ранолазин не рекомендується поєднувати з антиаритмічними препаратами класу IA та III, за винятком аміо дарону.
 Професор Eberhard Standl (Германия) присвятив свою доповідь СС-подіям у пацієнтів із ЦД, запропонувавши аудиторії критичну оцінку результатів профільних РКД. Він уточнив, що хворим на ЦД властивий високий СС-ризик, знизити який можна за допомогою застосування певних гіпоглікемічних препаратів. Доведено, що метформін збільшує виживаність хворих на ЦД після інфаркту міокарда, зменшує смертність від усіх причин. У багатьох РКД продемонстровані висока ефективність і безпека метформіну.
Професор Eberhard Standl (Германия) присвятив свою доповідь СС-подіям у пацієнтів із ЦД, запропонувавши аудиторії критичну оцінку результатів профільних РКД. Він уточнив, що хворим на ЦД властивий високий СС-ризик, знизити який можна за допомогою застосування певних гіпоглікемічних препаратів. Доведено, що метформін збільшує виживаність хворих на ЦД після інфаркту міокарда, зменшує смертність від усіх причин. У багатьох РКД продемонстровані висока ефективність і безпека метформіну.
У 2013 р. розпочалася нова епоха в лікуванні ЦД, що ознаменувалася активним клінічним застосуванням SGLT2 (інгібіторів натрійзалежного переносника глюкози 2 типу), інгібіторів дипептидилпептидази‑4, інгібіторів рецепторів GLP‑1. На сьогодні доведено високий профіль кардіоваскулярної безпеки всіх представників цих класів препаратів. Найбезпечнішими з-поміж них визнані ліраглутид, семаглутид, емпагліфлозин, канагліфлозин.
Лікування хворих на ЦД спрямоване на модифікацію способу життя, контроль глікемії і рівня АТ, концентрації ліпідів у сироватці крові. Схема терапії хворих на ЦД обов’язково має передбачати прийом антитромбоцитарних препаратів. Найдоцільнішими діями в аспекті досягнення контролю глікемії, за словами доповідача, є модифікація способу життя, суворе дотримання дієти і збільшення дози метформіну. При неефективності цих заходів (глікозильований гемоглобін >6,5%) терапію метформіном слід посилити похідними сульфонілсечовини і направити хворого на консультацію до ендокринолога.
Підготувала Лада Матвєєва
Медична газета «Здоров’я України 21 сторіччя» № 22 (443), листопад 2018 р.