19 березня, 2019
Школа ендокринолога: акцент на щитоподібну залозу
Науково-освітній проект «Школа ендокринолога» завітав 1-2 листопада 2018 року до м. Одеси. Під час заходу учасники мали можливість прослухати лекції провідних вітчизняних спеціалістів із питань різноманітних розладів ендокринної системи. В огляді представлено доповіді, що висвітлювали проблеми хвороб щитоподібної залози (ЩЗ).
 Старший науковий співробітник кафедри ендокринології Національної медичної академії післядипломної освіти ім. П. Л. Шупика (м. Київ), кандидат медичних наук Юлія Валеріївна Булдигіна присвятила доповідь синдрому тиреотоксикозу за матеріалами клінічних рекомендацій Американської тиреоїдної асоціації (АТА) з діагностики та ведення пацієнтів із гіпертиреозом та іншими причинами тиреотоксикозу (Ross D. S. et al., 2016).
Старший науковий співробітник кафедри ендокринології Національної медичної академії післядипломної освіти ім. П. Л. Шупика (м. Київ), кандидат медичних наук Юлія Валеріївна Булдигіна присвятила доповідь синдрому тиреотоксикозу за матеріалами клінічних рекомендацій Американської тиреоїдної асоціації (АТА) з діагностики та ведення пацієнтів із гіпертиреозом та іншими причинами тиреотоксикозу (Ross D. S. et al., 2016).
На думку експертів, надзвичайно важливим є з’ясування етіології тиреотоксикозу. Якщо діагноз був підтверджений даними клінічної картини та гормонального дослідження, з метою етіологічної діагностики залежно від ситуації можуть бути призначені такі дослідження, як визначення антитіл до рецептора тиреотропного гормона – ТТГ (АТрТТГ), сцинтиграфія ЩЗ із радіоактивним йодом, визначення швидкості кровотоку за допомогою ультразвукового дослідження (УЗД), у разі підозри на токсичну аденому чи багатовузловий токсичний зоб (БВТЗ) – сцинтиграфія ЩЗ із йодом‑123 чи технецієм‑99m. На жаль, остання діагностична процедура в Україні наразі не доступна. Визначення етіології має велике значення, адже встановлення точного діагнозу дає змогу прогнозувати перебіг захворювання.
Гіпертиреоз характеризується надмірною гормональною активністю ЩЗ і є, ймовірніше, синдромом, аніж захворюванням. Причинами гіпертиреозу можуть бути хвороба Грейвса, тиреоїдити, пухлини (автономна аденома, аденома гіпофіза, ТТГ‑тропінома, пухлини трофобласта), надмірне захоплення йоду та надлишкове вживання тироксину. Експерти АТА рекомендують призначення β-адреноблокаторів (БАБ) усім пацієнтам із доведеним тиреотоксикозом за наявності симптомів, особливо хворим похилого віку й особам із частотою серцевих скорочень >90 уд./хв або супутніми хворобами серця. Інше лікування залежить від етіології процесу.
Тиреотоксикоз може супроводжувати тиреоїдит де Кервена, гострий тиреоїдит (зазвичай має настільки гострий перебіг, що гіперфункція ЩЗ не має клінічного значення), тиреоїдит Хашимото та післяпологовий тиреоїдит. Класифікація тиреоїдитів представлена в таблиці.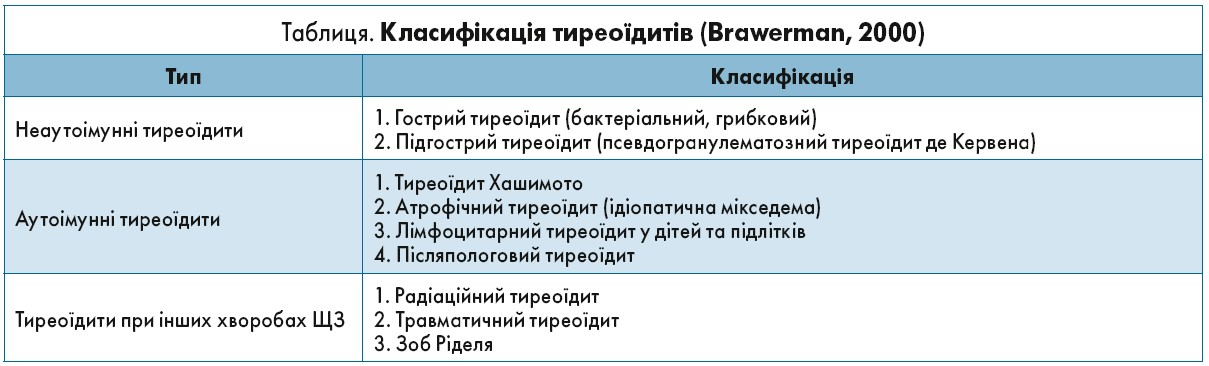
Гострий тиреоїдит є гнійним захворюванням, яке трапляється дуже рідко. При цьому ураженні ЩЗ визначаються лейкоцитоз зі зсувом лейкоцитарної формули вліво, підвищення швидкості осідання еритроцитів до 30-40 мм/год, на УЗД – зона зниженої ехогенності в ділянці ураження. Змін концентрації ТТГ і гормонів ЩЗ, як правило, не виявляють. Лікування гострого тиреоїдиту залежно від клінічної ситуації передбачає призначення антибіотиків або хірургічне дренування. У разі розвитку деструктивного тиреотоксикозу можуть бути призначені БАБ.
При підгострому тиреоїдиті, якому властива вірусна етіологія, виявляють лейкоцитоз зі зсувом вправо, підвищення швидкості осідання еритроцитів до ≥30 мм/год, зниження ТТГ і зростання вільного Т4. Тонкоголкова аспіраційна біопсія дає змогу виявити гігантські багатоядерні клітини та гранульоми. Для стартової терапії пацієнтам із легкими симптомами підгострого тиреоїдиту показано призначення БАБ і нестероїдних протизапальних препаратів (НПЗП). Глюкокортикоїди (ГК) рекомендовані в разі недостатньої ефективності та збереження виражених больових відчуттів і симптомів тиреотоксикозу на тлі прийому НПЗП. На думку доповідача, легкого підгострого тиреоїдиту практично не існує, тому не варто витрачати час на застосування неспецифічних НПЗП.
Післяпологовий тиреоїдит виникає приблизно в 5% жінок через 2-6 міс після пологів. Як правило, ця хвороба розвивається в носійок антитіл до тиреопероксидази (АТПО), а також у пацієнток із цукровим діабетом 1 типу. Цей тиреоїдит розпочинається як раптовий тиреотоксикоз тривалістю 2-6 тиж, після чого формується гіпотиреоз тривалістю кілька тижнів або місяців. Спонтанне розрішення післяпологового тиреоїдиту трапляється в 9 з 10 випадків. Лабораторна діагностика залежить від фази процесу: під час тиреотоксичної фази – ТТГ знижений, вільні Т4 та Т3 підвищені, АТПО підвищені, АТрТТГ не визначаються; під час фази гіпотиреозу – ТТГ підвищений, вільні Т4 та Т3 знижені, АТПО підвищені. Як основна причина післяпологового тиреоїдиту розглядається надлишкова реактивація імунної системи після природної гестаційної імуносупресії (феномен рикошету), що в схильних осіб (носійки АТПО) призводить до деструктивного аутоімунного тиреоїдиту. Якщо тиреотоксикоз уперше виявляють у жінки в післяпологовому періоді, необхідне обстеження з метою диференційної діагностики післяпологового тиреоїдиту та післяпологової маніфестації хвороби Грейвса. Після виключення останньої жінкам із тиреотоксичною фазою хвороби за наявності симптомів можуть бути призначені БАБ.
Ще одна причина тиреотоксикозу – автономна (токсична) аденома, що може бути одиночним вузлом або розвиватися на тлі БВТЗ. Частка вузлового/багатовузлового токсичного зоба становить 5-25% усіх випадків гіпертиреозу. БВТЗ характеризується наявністю кількох вузлів, які виявляються при УЗД і мають властивість вибірково накопичувати радіоактивний йод, і супроводжується клінічною картиною гіпертиреозу. Найпоширенішими причинами токсичної аденоми ЩЗ є йододефіцит або, навпаки, надлишок йоду (наприклад, у разі прийому йодовмісних медикаментозних препаратів (аміодарон, рентгеноконтрастні речовини) або при надмірному вживанні йоду з продуктами харчування). Існує також спадкова аутосомно-домінантна форма БВТЗ. У хворих із токсичною аденомою визначаються мутації рецептора ТТГ або гена білка Gsα, які на початкових стадіях відбуваються в окремому тиреоциті, а далі шляхом моноклонального росту утворюють одну чи кілька аденом, що функціонують автономно. Клінічна картина при токсичній аденомі / БВТЗ ідентична такій при дифузному токсичному зобі (ДТЗ). Часто захворювання супроводжується субклінічним гіпертиреозом, який із часом маніфестує в явний. Автономна функціональна активність токсичної аденоми розвивається протягом 3-8 років. При гістологічному дослідженні видаленої аденоми можна побачити вистелені епітелієм фолікули; ця пухлина практично ніколи не малігнізується. Основними характеристиками лабораторної діагностики токсичної аденоми є зниження ТТГ, підвищення вільних Т4 та Т3, негативні АТПО й АТрТТГ. Якщо як радикальний метод обрано хірургічне лікування БВТЗ або токсичної аденоми, у пацієнтів із маніфестним тиреотоксикозом перед операцією необхідно досягти еутиреоїдного стану за допомогою тиреостатичної терапії тіамазолом, можливо, у комбінації з БАБ. Передопераційне призначення препаратів йоду в таких випадках не показано. Методом вибору при БВТЗ є гранично-субтотальна резекція залози чи тотальна тиреоїдектомія. Оперативне лікування має проводити спеціалізований ендокринний хірург. Терапія тіамазолом відміняється після проведення хірургічного втручання, БАБ також слід поступово відмінити. Знижений ТТГ і підвищений вільний Т3 в пацієнтів із тривалим анамнезом БВТЗ можуть свідчити про формування токсичної аденоми на тлі йододефіциту. Тому за відсутності АТрТТГ доцільно призначити препарати калію йодиду (Йодомарин®, «Берлін-Хемі АГ», Німеччина) в дозі 200 мкг/добу з подальшим контролем рівнів ТТГ і вільного Т3 через 4 тиж. Тривала постійна терапія тіамазолом як метод лікування БВТЗ і токсичної аденоми може розглядатися в деяких літніх пацієнтів з обмеженою фізичною активністю та невеликою очікуваною тривалістю життя, у разі, коли проведення терапії йодом‑131 або тиреоїдектомії ускладнене чи неможливе, а також коли ці пацієнти віддають перевагу прийому тиреостатиків.
В Україні зниження ТТГ і підвищення Т3 зазвичай є наслідками йододефіциту, тому вчасне призначення калію йодиду (Йодомарин® 200) дає змогу запобігти формуванню токсичної аденоми.
Провідними характеристиками ДТЗ (хвороби Грейвса) є гіпертиреоїдизм і наявність АТрТТГ. Окрім того, визначаються знижений ТТГ, підвищені вільні T4 та T3, позитивні АТПО. Ю. В. Булдигіна зазначила, що термін «ДТЗ» є досить неточним, оскільки при цьому захворюванні зоба може не бути взагалі, а дифузність може бути замінена на наявність вузла, тож краще вживати термін «хвороба Грейвса». Цікаво, що рівень АТПО на тлі лікування тиреостатиками практично не змінюється, тоді як рівень АТрТТГ у процесі медикаментозної терапії знижується, досягаючи мінімуму через 6 міс після початку лікування. Якщо ж зниження не спостерігається, ймовірні постійні рецидиви хвороби. Згідно з рекомендаціями АТА, пацієнтам із маніфестним тиреотоксикозом унаслідок хвороби Грейвса слід призначати лікування радіоактивним йодом‑131, тиреостатичними препаратами чи тиреоїдектомію. Препаратами вибору для тиреостатичної терапії є тіамазол/карбімазол; у пацієнток у I триместрі вагітності, при тиреотоксичному кризі та розвитку легких побічних ефектів переваги має пропілтіоурацил. Перед початком тиреостатичної терапії рекомендовано зробити розгорнутий клінічний аналіз крові з визначенням лейкоцитарної формули, а також рівнів білірубіну та трансаміназ. Загальний аналіз крові з лейкоцитарною формулою необхідно проводити також на тлі тиреостатичної терапії при фебрильних станах і появі фарингіту. Перед відміною тиреостатичної терапії з приводу хвороби Грейвса рекомендовано визначити рівень АТрТТГ із метою оцінювання ймовірності ремісії та рецидиву тиреотоксикозу. Якщо для первинного лікування була обрана консервативна терапія тіамазолом, вона має тривати 12-18 міс, після чого відміняється за умови, що рівні ТТГ та АТрТТГ у нормі.
Якщо для радикального лікування обрана тиреоїдектомія, перед скеруванням на оперативне втручання необхідно досягти еутиреоїдного стану на тлі прийому тиреостатиків із БАБ або без них. Безпосередньо перед операцією (за 2 тиж) можуть призначатися препарати йодиду калію. Оскільки необхідні високі дози йоду, використовується розчин Люголя за схемою Пламмера від 5 до 15 крапель 3 р/добу. Максимальна доза розчину – 45 крапель – містить 81 мг йодиду. Така йодна підготовка значно полегшує роботу хірургів, однак має певні недоліки: через 2-3 тиж ЩЗ «вислизає» з-під інгібувального впливу йодидів, а тривале застосування розчину Люголя може призводити до посилення тиреотоксикозу. Останнє більш виражено у хворих із БВТЗ, тому терапія йодидами таким пацієнтам протипоказана.
Діагностичними ознаками ТТГ‑продукувальних аденом гіпофіза є підвищений рівень гормонів ЩЗ і відсутність пригнічення ТТГ (як правило, концентрація останнього нормальна чи підвищена), що зазвичай поєднується з аденомою гіпофіза, виявленою при проведенні комп’ютерної чи магнітно-резонансної томографії. При цьому в пацієнта відсутній анамнез синдрому резистентності до тиреоїдних гормонів (ТГ). Методом вибору в лікуванні ТТГ‑продукувальних аденом гіпофіза є хірургічна аденомектомія, що має виконуватися досвідченим спеціалістом.
Тиреотоксичний криз є специфічним небезпечним станом, діагностика якого ґрунтується на клінічних даних. Криз слід очікувати в пацієнтів із тяжким тиреотоксикозом і декомпенсацією його системних ускладнень. У разі тиреотоксичного кризу пацієнту показане інтенсивне багатокомпонентне лікування, що включає призначення БАБ, тиреостатиків, іон-органічних йодидів, ГК, охолодження (парацетамол, холодні обгортання), відновлення об’єму циркулюючої крові, нутритивну підтримку. Терапія має проводитися в умовах реанімаційного відділення.
Що стосується субклінічного гіпертиреозу, у практичних лікарів часто виникає питання стосовно доцільності його лікування. Згідно з рекомендаціями АТА, активне лікування показано при стійкому субклінічному тиреотоксикозі та рівні ТТГ <0,1 мОд/л у таких ситуаціях: особам віком >65 років, за наявності факторів серцево-судинного ризику, при супутніх хворобах серця й остеопорозі, жінкам у постменопаузі, які не отримують замісну гормональну терапію чи бісфосфонати, за наявності симптомів тиреотоксикозу.
У разі стійкого зниження рівня ТТГ <0,1 мОд/л активне лікування субклінічного тиреотоксикозу може бути рекомендовано й особам віком <65 років, навіть за відсутності вищезгаданих факторів ризику. При стійкому зниженні ТТГ (але >0,1 мОд/л) активне лікування слід проводити в осіб віком >65 років та/або за наявності серцево-судинної патології, остеопорозу чи симптомів тиреотоксикозу.
Окремо виділяють таку патогенетичну форму, як тиреотоксикоз при пухлинах трофобласта. Плацента синтезує хоріонічний гормон людини (ХГЛ), який чинить слабку стимулювальну дію на ЩЗ на ранньому терміні вагітності, досягаючи максимуму до 9-10-го тижня, внаслідок чого зростає вільний Т4 та знижується ТТГ. α-ланцюг ХГЛ ідентичний гіпофізарним гормонам (лютеїнізувальний і фолікулостимулювальний гормони, ТТГ), тому діє на ЩЗ як слабкий аналог ТТГ. При міхурцевому занеску та хоріокарциномі рівень ХГЛ значно зростає, що в деяких випадках може зумовити тиреотоксикоз. Лікування тиреотоксикозу у вагітних передбачає хірургічне втручання (у II триместрі – 24-26-й тиждень) або медикаментозну протитиреоїдну терапію з використанням найменших ефективних доз (у I триместрі – пропілтіоурацил, у II-III триместрі – карбімазол або тіамазол). Еквіваленти середньої дози для вагітних такі: тіамазол – 10-20 мг/добу, карбімазол – 10-40 мг/добу, пропілтіоурацил – 200-400 мг/добу.
 Виступ головного наукового співробітника відділу вікової ендокринології та клінічної фармакології ДУ «Інститут ендокринології та обміну речовин ім. В. П. Комісаренка НАМН України» (м. Київ), доктора медичних наук Олесі Вадимівни Зінич стосувався аміодарон-індукованих патологічних станів ЩЗ. Ключова роль у регуляції різноманітних фізіологічних функцій, включаючи ріст і диференціювання тканин, належить ТГ. Варто зазначити, що серцево-судинна система є однією з найбільш чутливих до зміни рівня останніх, тому існує вираз «коли ЩЗ говорить, серце слухає».
Виступ головного наукового співробітника відділу вікової ендокринології та клінічної фармакології ДУ «Інститут ендокринології та обміну речовин ім. В. П. Комісаренка НАМН України» (м. Київ), доктора медичних наук Олесі Вадимівни Зінич стосувався аміодарон-індукованих патологічних станів ЩЗ. Ключова роль у регуляції різноманітних фізіологічних функцій, включаючи ріст і диференціювання тканин, належить ТГ. Варто зазначити, що серцево-судинна система є однією з найбільш чутливих до зміни рівня останніх, тому існує вираз «коли ЩЗ говорить, серце слухає».
Встановлено, що ТГ реалізують свої ефекти завдяки двом ключовим механізмам: геномному (взаємодія зі специфічними рецепторами) та негеномному (активація сигнальних шляхів). Окрім того, вони чинять опосередкований вплив на регуляцію роботи симпатоадреналової системи. Серед ефектів ТГ у серцево-судинній системі визначають: збільшення амплітуди та частоти серцевих скорочень, підвищення збудливості та швидкості його проведення в серцевому м’язі. Такі тісні взаємозв’язки між роботою ЩЗ і серцем зумовлюють те, що в клінічній практиці ендокринолог часто потребує консультації кардіолога, і навпаки, особливо за наявності в пацієнта фібриляції передсердь (ФП).
ФП є найпоширенішою стійкою серцевою аритмією, частота якої становить 1-2% у загальній популяції. За прогнозами експертів, її поширеність продовжуватиме зростати, передусім у зв’язку зі старінням населення світу. Дисфункція ЩЗ може бути єдиною причиною виникнення ФП. Основним препаратом для контролю останньої є аміодарон, який найефективніше сповільнює та вирівнює ритм серця, проте може спричинити тяжкі екстракардіальні ефекти, зокрема несприятливий вплив на функцію ЩЗ, через що хворі з ФП обов’язково потребують моніторингу рівня ТТГ.
На клітинному рівні аміодарон діє як антагоніст ТГ через структурну подібність. Слід пам’ятати, що вміст йоду становить близько 37% його молекулярної маси, тобто в 1 таблетці (200 мг) – 75 мг йоду, 7,5 мг з яких є неорганічним йодом. Деякі пацієнти щоденно приймають більш як 1 таблетку, тобто добова потреба в йоді, що для дорослих осіб становить 150-200 мкг, істотно перевищується. Встановлено, що «йодне перевантаження» іноді зумовлює розвиток аутоімунних змін у ЩЗ, які підтверджуються підвищенням протитиреоїдних антитіл у сироватці крові.
Аміодарон метаболізується шляхом деалкілування в печінці з утворенням його активного метаболіту – дезетиламіодарону, що діє як конкурентний інгібітор приєднання трийодтироніну до α1-Т3-рецептора та як неконкурентний інгібітор β1-Т3-рецептора й чинить виразний цитотоксичний вплив на ЩЗ.
У більшості хворих, які приймають аміодарон, зберігається еутиреоз, і лише в 30% пацієнтів може розвинутися гіпертироксинемія, що зумовлено пригніченням активності 5-дейодинази 1 типу – ферменту, який дейодує та конвертує Т4 в Т3 у периферичних тканинах, переважно в печінці. Підвищення рівня гормонів не супроводжується клінічними проявами тиреотоксикозу й не потребує медикаментозної корекції. Частота виникнення клінічно значущих відхилень рівня ТГ залежить як від дози, так і від тривалості прийому препарату.
Період напіввиведення аміодарону є досить тривалим і становить у середньому 52 дні, іноді – близько 100 днів, а метаболіт дезетиламіодарон виводиться ще довше. Цей феномен пояснює накопичення аміодарону в організмі з поступовим формуванням дисфункції ЩЗ. Наприклад, аміодарон-індукований тиреотоксикоз (АмІТ) може виникнути через кілька місяців або навіть років від початку призначеної антиаритмічної терапії.
Відповідно до сучасних уявлень, в основі патогенезу АмІТ лежать два ключові механізми, що спричинило виокремлення двох його типів:
- 1 тип, який характеризується підвищенням синтезу ТГ;
- 2 тип, зумовлений розвитком деструктивних процесів у ЩЗ під впливом самого аміодарону та його метаболіту.
Для визначення типу АмІТ слід виконати низку лабораторно-діагностичних процедур. Для 1 типу характерна наявність фонової патології – багатовузловий або дифузний зоб, тоді як 2 тип може розвиватися за відсутності останньої чи на тлі незначно збільшеної ЩЗ. Відмінності виявляються також під час проведення кольорової доплерівської сонографії: при 1 типі може виявлятися гіперваскуляризація тканини ЩЗ, що для 2 типу не характерно. Виникнення стійкого гіпотиреозу після лікування більш імовірне для 2 типу.
Якщо під час лабораторного обстеження виявляють рівень ТТГ <0,1 мОд/л, то встановлюють рівні вільних Т3 та Т4 й далі визначаються між типами АмІТ. За умови ТТГ 0,1-0,4 мОд/л слід провести аналіз на вільні Т3 та Т4 й у разі нормальних їх значень виконати повторні тести через 6 тиж.
Загалом для АмІТ характерна нестандартна клінічна картина, що включає серед іншого рефрактерну до терапії аміодароном тахіаритмію та згладжені чи відсутні класичні клінічні симптоми тиреотоксикозу. Офтальмопатія при АмІТ трапляється рідко, зазвичай у разі супутньої хвороби Грейвса.
Визначаючи тактику лікування АмІТ, передусім необхідно вирішити, чи продовжувати прийом аміодарону. При 2 типі терапію зазвичай можна продовжити, а при 1 типі – бажано відмінити. Не слід забувати, що у 20% пацієнтів з АмІТ відбувається спонтанна ремісія. Проте чи варто чекати? Напіввиведення аміодарону та його метаболітів досить тривале, тому тактика негайного реагування має більше прибічників. Згідно з рекомендаціями Європейської тиреоїдної асоціації, пацієнти з АмІТ належать до групи ризику виникнення невідкладних станів, особливо особи похилого віку та/або з наявністю дисфункції лівого шлуночка серця.
Однак рішення про відміну прийому препарату слід приймати індивідуально, адже:
- нерідко аміодарон є єдиним лікарським засобом, здатним контролювати серцеву аритмію;
- вплив аміодарону може зберігатися протягом багатьох місяців;
- існують дані про підвищення смертності внаслідок виникнення фібриляції шлуночків після відміни препарату;
- при діагностуванні АмІТ 2 типу пацієнти продовжують реагувати на лікування, навіть якщо терапія аміодароном триває, проте відзначаються триваліший час відновлення й вищий ризик рецидивів.
У разі АмІТ 1 типу для пригнічення синтезу ТГ застосовують великі дози протитиреоїдних препаратів (карбімазол, тіамазол, перхлорат натрію).
За умови АмІТ 2 типу призначають ГК (преднізолон 30-60 мг/добу). Доречно зауважити, що швидка відповідь на терапію ГК є додатковим діагностичним критерієм АмІТ 2 типу.
При змішаному типі АмІТ рекомендовано проведення комбінованої терапії – тиреостатики з подальшим призначенням ГК.
Оперативному втручанню (контрольованій тиреоїдектомії) підлягають хворі, резистентні до медикаментозної терапії, чи такі, в яких спостерігаються побічні ефекти від неї, а також пацієнти, котрі тривало приймають аміодарон (відповідно, мають високий ризик рецидиву тиреотоксикозу). Якщо ж тиреоїдектомія є плановою, то перед втручанням слід досягти еутиреоїдного стану.
У регіонах із помірним йодним дефіцитом пацієнтам із дифузним або вузловим зобом, які мають нормальний або підвищений рівень поглинання радіоізотопу, за відсутності ефекту від консервативної терапії чи відмови від хірургічного втручання показано лікування радіоактивним йодом.
Діагностика аміодарон-індукованого гіпотиреозу (АмІГ) ґрунтується на виявленні рівня ТТГ >10 мОд/л та Т4 нижче встановлених референтних значень. У клінічній картині спостерігаються класичні ознаки гіпотиреозу. Питання про відміну аміодарону необхідно вирішувати сумісно з кардіологами, але в більшості випадків АмІГ терапію можна продовжити, оскільки цей стан не супроводжується втратою антиаритмічної ефективності препарату. Лікування з використанням левотироксину натрію (L-Т4) рекомендовано в усіх випадках маніфестного АмІГ. Утім, слід пам’ятати, що деякі пацієнти, особливо похилого віку, можуть зазнавати труднощів із переносимістю препаратів левотироксину, які містять як допоміжну речовину лактозу. За різними оцінками, у 7-20% осіб у загальній популяції виявляють непереносимість лактози, що зумовлено зниженням активності ферменту, який розщеплює її в тонкому кишечнику, – лактази (галактозидази). Темпи зниження активності останнього з віком генетично зумовлені й залежать від етнічної приналежності людини.
Диспепсичні розлади, що супроводжують гіполактазію, можуть сприяти порушенню резорбції L‑тироксину, негативно позначаючись на контролі гіпотиреозу. Тому в тих пацієнтів, яким для досягнення еутиреозу потрібні дуже високі дози L‑тироксину, слід запідозрити порушення його всмоктування, у тому числі внаслідок лактазної недостатності. Нівелювати ризик непереносимості левотироксину можливо при використанні його безлактозної форми – L-Тироксин 50 Берлін-Хемі (Німеччина). Перевагою є також триваліше збереження активності діючої речовини, оскільки її стабільність знижується в присутності лактози.
У деяких випадках субклінічного АмІГ (ТТГ – 4-10 мОд/л, Т4 – у межах норми) лікування можна не призначати, переважно в осіб похилого та старечого віку, за умови частого оцінювання функціонального статусу ЩЗ для моніторингу можливого явного гіпотиреозу, що прогресує.
Отже, належний підхід до оцінювання стану ЩЗ перед початком лікування аміодароном, а також подальший моніторинг її функції дають змогу виявити пацієнтів підвищеного ризику та вчасно провести коригувальну терапію, нівелюючи негативні наслідки застосування препарату.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 3 (448), лютий 2019 р.



