7 травня, 2019
Cучасний погляд на патогенетичне лікування діабетичної полінейропатії
 Цукровий діабет (ЦД) належить до найбільш розповсюджених хронічних захворювань нашого часу, оскільки збільшення числа таких хворих в усьому світі набуло характеру неінфекційної епідемії. За даними International Diabetes Federation (IDF), нині кількість пацієнтів із ЦД у світі перевищує 420 млн, а у 2040 р., за прогнозами, цей показник становитиме понад 642 млн (IDF Diabetes Atlas, 2017). Таким чином, поширеність ЦД у світі найближчими роками досягне 10%. При цьому обсяг витрат на боротьбу із ЦД постійно зростає. Так, у 2017 р. у США видатки на ведення хворих на ЦД дорівнювали 327 млрд доларів, що на 26% більше, ніж у 2012 р. Витрати на лікування ускладнень ЦД, до яких належить діабетична полінейропатія (ДПН), зросли на 36% (ADA, 2019).
Цукровий діабет (ЦД) належить до найбільш розповсюджених хронічних захворювань нашого часу, оскільки збільшення числа таких хворих в усьому світі набуло характеру неінфекційної епідемії. За даними International Diabetes Federation (IDF), нині кількість пацієнтів із ЦД у світі перевищує 420 млн, а у 2040 р., за прогнозами, цей показник становитиме понад 642 млн (IDF Diabetes Atlas, 2017). Таким чином, поширеність ЦД у світі найближчими роками досягне 10%. При цьому обсяг витрат на боротьбу із ЦД постійно зростає. Так, у 2017 р. у США видатки на ведення хворих на ЦД дорівнювали 327 млрд доларів, що на 26% більше, ніж у 2012 р. Витрати на лікування ускладнень ЦД, до яких належить діабетична полінейропатія (ДПН), зросли на 36% (ADA, 2019).
Можливості контролю ЦД (інсулінотерапія з використанням нових форм інсуліну, помп, сучасні протиглікемічні таблетовані препарати) дозволяють досягнути в більшості хворих цільових показників глікемії натще і постпрандіальної глікемії. Тому при наданні допомоги хворим на ЦД вагомого значення набуває контроль діабетичних ускладнень, у тому числі ДПН (Строков И. А. и соавт., 2019).
При ДПН розвивається прогресуюча загибель волокон периферичних нервів (соматичних та автономних), що проявляється больовим синдромом, порушенням чутливості, зниженням сили дистальних м’язів ніг, порушенням рівноваги з падіннями, формуванням виразок стопи, зниженням працездатності, розладами сну, погіршенням якості життя, а також збільшенням смертності хворих на ЦД.
Встановлено, що основною причиною формування діабетичних ускладнень є стан тривалої гіперглікемії, хоча можливе виявлення ДПН в осіб із предіабетом (Feldman E. L. et al., 2017). Багатьма дослідниками вивчалася можливість профілактики розвитку ДПН лише за допомогою належного контролю глікемії, для чого використовували інтенсивну терапію інсуліном або цукрознижувальними препаратами з реальним досягненням нормоглікемії. В огляді результатів досліджень з вивчення впливу посилення контролю ЦД на ДПН, наявних у Кокранівській базі даних, зроблено висновок, що хворі на ЦД 1 і 2 типу по-різному відповідають на задовільний контроль глікемії (Callaghan B. C. et al., 2012). У разі ЦД 1 типу (1228 пацієнтів) цільовий контроль глікемії достовірно зменшував ризик розвитку ДПН, натомість у хворих на ЦД 2 типу (6669 осіб) не спостерігалося достовірних змін імовірності розвитку ДПН. Автори підкреслюють, що посилення контролю глікемії підвищує ризик виникнення гіпоглікемічних станів, тому при призначенні інтенсивної терапії слід ретельно зважувати співвідношення ризик/користь.
У дослідженні ACCORD відзначалася можливість збільшення смертності при використанні у хворих на ЦД 2 типу інтенсивної терапії за відсутності істотного впливу на ризик розвитку мікросудинних порушень, що призвело до припинення подальшого спостереження (Ismail-Beigi F. et al., 2010). Поза сумнівом, належний контроль ЦД залишається пріоритетним у профілактиці розвитку ДПН. Однак основний висновок, якого можна дійти при аналізі досліджень стосовно впливу інтенсивної терапії ЦД на ДПН, полягає в тому, що лише ретельного контролю глікемії недостатньо. Необхідне спеціальне лікування ДПН, що ґрунтується на використанні препаратів із впливом на патогенетичні механізми формування патології нервових клітин.
Патогенез ДПН визначається метаболічними порушеннями в нервових і епітеліальних клітинах, що виникають унаслідок гіперглікемії та призводять до порушення функції мікроциркуляторних судин і волокон периферичних нервів. Добре вивчений взаємозв’язок метаболічних і судинних чинників. Ще 2001 р. американський дослідник M. Brownlee узагальнив експериментальні та клінічні дані про молекулярні й біохімічні основи патогенезу ДПН, вказавши на конкретні механізми порушення метаболізму, які спричиняють ураження нервових волокон і судин мікроциркуляторної системи. У формуванні патологічного процесу в ендотелії, судинній стінці й нервових волокнах провідну роль відіграє оксидантний стрес, який призводить до блокади засвоєння глюкози з нагромадженням проміжних продуктів обміну глюкози, запуску поліолового шляху утилізації глюкози, активації протеїнкінази С і утворення великої кількості кінцевих продуктів надлишкового глікування білків (AGEs). Оксидантний стрес, причиною розвитку якого при ЦД є утворення великої кількості вільних радикалів на тлі недостатньої активності власної антиоксидантної системи (антиоксидантних ферментів) організму, виступає пусковим фактором порушення обміну глюкози. Певною мірою цю теорію підтверджують факти поєднання розвитку ДПН у хворих на ЦД з поліморфізмом визначених генів. Встановлена асоціація розвитку ДПН з поліморфізмом генів мітохондріальної та ендотеліальної супероксиддисмутази і гена PARP, що добре узгоджується з провідною роллю мітохондріального супероксиду у формуванні ускладнень. Аналіз сучасних результатів вивчення патофізіологічних механізмів розвитку і перебігу ДПН принципово не змінює усталений погляд на патогенез ДПН (Hissain N. et al., 2017).
Медико-соціальна і медико-економічна значущість ДПН формують пильну увагу до її діагностики та лікування. У 2010 р. були опубліковані результати наради групи експертів із ДПН (Tesfaye S. et al., 2010), до якої увійшли відомі в усьому світі вчені й лікарі, що займаються вивченням ДПН. У цій публікації подано настанови з класифікації, діагностики та лікування ДПН. Відповідно до сучасних класифікацій, розрізняють генералізовані й фокальні/мультифокальні форми ДПН. Експерти звернули увагу на наявність двох різних підгруп ДПН. Перша – типова хронічна симетрична сенсомоторна – є найпоширенішим варіантом ДПН. Інший варіант позначають як атипову ДПН з гострим або підгострим початком з монофазним перебігом. До облігатних проявів належать біль та автономні порушення. При цьому слід зазначити, що термін «атипова форма» щодо ДПН не є вдалим. Відомо, що до 10% випадків полінейропатії у хворих на ЦД мають недіабетичне походження. Запровадження терміна «атипова ДПН» може призвести до діагностичних помилок, наприклад при розвитку у хворого на ЦД хронічної демієлінізуючої запальної полінейропатії. Остання навіть включена як коморбідна патологія до класифікації діабетичних нейропатій.
Не надто вдалою також виглядає пропозиція експертів розділити ДПН залежно від наявності скарг і неврологічного дефіциту на можливу та ймовірну форми ДПН. До того ж ще одна форма – достовірна ДПН – повинна мати електроміографічне підтвердження або супроводжуватися виявленням уражень тонких волокон (кількісне сенсорне тестування, біопсія шкіри). Зрозуміло, що реальна клінічна практика в Україні й сучасний стан практичної охорони здоров’я не дозволяють широко використовувати ці терміни. У наступних переглядах різних характеристик ДПН принципових змін не внесено (Juster-Switlyk K. et al., 2016; Ang L. et al., 2018). Основним дискутабельним питанням на сьогодні залишається патогенетична терапія ДПН, оскільки стосовно лікування больового синдрому вдалося досягнути консенсусу.
Патогенетичне лікування ДПН ґрунтується на сучасних уявленнях про механізми її виникнення і прогресування. У першу чергу використовують препарати з антиоксидантним ефектом.
З‑поміж них найкраще доведена ефективність при ДПН альфа-ліпоєвої (тіоктової) кислоти (АЛК). У літературі опубліковано чимало оглядів, присвячених застосуванню АЛК у разі ДПН (Rochette L. et al., 2015; Papanas N., Ziegler D., 2014). В Україні в аптечній мережі наявні різні препарати АЛК, з котрих звернемо увагу на лікарські засоби Тіогама Турбо та Тіогама таблетки («Вьорваг Фарма Гмбх і Ко. КГ», Німеччина). Для зручності використання препарат випускається в дозі 600 мг. АЛК може використовуватися у вигляді внутрішньовенних крапельних інфузій і в таблетованій формі.
АЛК – природний коензим мітохондріального мультиензимного комплексу, каталізуючого окислювальне декарбоксилювання α-кетокислот, таких як піруват і α-кетоглуторат. Це потужний ліпофільний антиоксидант, що визначає можливість його терапевтичного використання. АЛК є рацемічною сумішшю R (+) і S (–) ізомерів, погано розчиняється у воді й добре – у ліпофільних розчинниках. При введенні в організм АЛК відновлюється в основному з R‑ізоформи до дигідроліпоєвої кислоти, яка й забезпечує основні терапевтичні ефекти, зокрема за рахунок дії як «пастки» основного вільного радикала – супероксиду. Дигідроліпоєва кислота не використовується як лікарський препарат, оскільки при зберіганні легко окислюється.
Експериментальні дослідження на щурах зі стрептозотоциновим і спадковим ЦД показали, що АЛК зменшує перекисне окиснення ліпідів (ПОЛ), збільшує активність супероксиддисмутази, покращує ендоневральний кровоток і швидкість поширення збудження в сідничному нерві, збільшує утилізацію глюкози в кардіоміоцитах, пригнічує розвиток катаракти, запобігає ураженню гломерулярного апарату нирок. У клінічних дослідженнях із застосуванням АЛК у хворих на ЦД відзначено поліпшення стану системи мікроциркуляції, зменшення ПОЛ, нормалізацію вмісту оксиду азоту і стрес-білків, зменшення активації фактора транскрипції NF‑κB, покращення ендотелій-залежних реакцій судинної стінки, фільтраційної функції нирок і засвоєння глюкози. З проведених експериментальних і клінічних досліджень механізму дії АЛК можна зробити висновок про те, що АЛК впливає на патогенетичні механізми формування та прогресування ДПН.
Перше визначення ефективності таблетованої форми АЛК відноситься до Oral Pilot (ORPIL) Study, в якому вивчали вплив прийому протягом 3 тиж таблеток АЛК тричі на день (сумарна денна доза – 1800 мг) у 12 хворих на ЦД 2 типу з ДПН у порівнянні з ефектом плацебо в аналогічній групі (n=12). Бальна оцінка за шкалою TSS достовірно більшою мірою зменшувалася в групі прийому АЛК (p=0,021). Рахунок за шкалою NDS достовірно зменшувався в групі АЛК у порівнянні з групою плацебо (p=0,025). Відмінностей у частоті побічних ефектів між групами не відзначалося. Основним недоліком роботи можна вважати невелику кількість обстежених, що ускладнює статистичну обробку. У дослідженні Deutsche Kardiale Autonome Neuropathie (DEKAN) у 73 хворих на ЦД 2 типу з порушенням варіабельності серцевого ритму використовували для лікування або АЛК у таблетках (200 мг 4 р/день, сумарна доза – 800 мг), або плацебо протягом 4 міс. Виявлено достовірне збільшення варіабельності серцевого ритму в групі АЛК у порівнянні з групою плацебо (p<0,05). Частота побічних ефектів у групах достовірно не відрізнялася.
Численні рандомізовані подвійні сліпі плацебо-контрольовані клінічні дослідження показали високу ефективність внутрішньовенного крапельного введення і перорального прийому АЛК у хворих на ДПН.
Важливим з практичного погляду є питання про здатність АЛК зменшувати больовий синдром. Останніми роками нідерландськими вченими опубліковано дві роботи, присвячені цій темі (Mijnhout G. S. et al., 2012). Автори узагальнили всі наявні в літературі клінічні дослідження з інфузійного і таблетованого застосування АЛК у хворих на ДПН. Встановлено, що інфузії 600 мг АЛК протягом 3 тиж швидко зменшують вираженість больового синдрому при ДПН. Стосовно здатності таблетованої форми АЛК швидко зменшувати вираженість болю залишаються сумніви, оскільки тривалість прийому таблеток АЛК у дослідженнях не перевищувала 1,5 міс. Здатність АЛК зменшувати больовий синдром при ДПН пов’язана не лише з поліпшенням стану периферичних нервових волокон, що належать до соматосенсорної системи. Недавно було виявлено, що АЛК може модулювати Т‑тип кальцієвих каналів зі зміною больової імпульсації (Boulton A. J. et al., 2013). Якщо інтенсивність болю при ДПН перевищує 3 бали за візуально-аналоговою шкалою, доцільно одночасно з АЛК підключати до лікування стандартну терапію нейропатичного болю: препарати габапентин, прегабалін, антидепресанти. При інтенсивності болю до 3 балів можна використовувати інфузії АЛК, яка хоча і більш повільно, ніж антиконвульсанти й антидепресанти, зменшує біль, але досить надійно впливає на цей процес. Доцільно навести думку провідних фахівців із ДПН щодо ефективності лікування АЛК: «Антиоксидант АЛК, що вводиться внутрішньовенно, залишається єдиним патогенетичним засобом лікування ДПН із доведеною в рандомізованих контрольованих дослідженнях і при метааналізі ефективністю з рівнем доказовості А» (Tesfaye S. et al., 2010).
В огляді A. J. Bolton і співавт. (2013) вказується, що антиоксидантна терапія АЛК використовується для лікування ДПН понад 40 років. Метааналіз (n=1258) показав, що внутрішньовенне введення АЛК протягом 3 тиж значно зменшує симптоми нейропатії та неврологічний дефіцит. Показано, що пероральне лікування протягом 5 тиж також ефективне. У цій же статті зазначено, що деякі варіанти патогенетичного лікування показали значне клінічне поліпшення за показниками симптомів нейропатії.
Серед препаратів, що використовуються при лікуванні ДПН, слід виокремити бенфотіамін. Цей лікарський засіб використовується для терапії симптомної ДПН у багатьох країнах Європи. На фармацевтичному ринку України бенфотіамін представлений препаратом Бенфогама («Вьорваг Фарма Гмбх і Ко. КГ», Німеччина).
Бенфотіамін є жиророзчинним похідним тіаміну. У клінічних умовах дефіцит тіаміну призводить до розвитку неврологічних і циркуляторних розладів. ЦД також є одним з патологічних станів, асоційованих з дефіцитом цієї сполуки. У нещодавньому дослідженні Qiujian Yu і співавт. (2018) вивчали вплив тіаміну на гіперметаболізм глюкози в головному мозку, оскільки цей фактор розглядається як нейродегенеративний індекс хвороби Альцгеймера і тісно пов’язаний з рівнем когнітивної дисфункції. Результати дослідження показали, що дефіцит тіаміну зумовлює синаптичну дисфункцію, яка є важливою патогенетичною ланкою хвороби Альцгеймера.
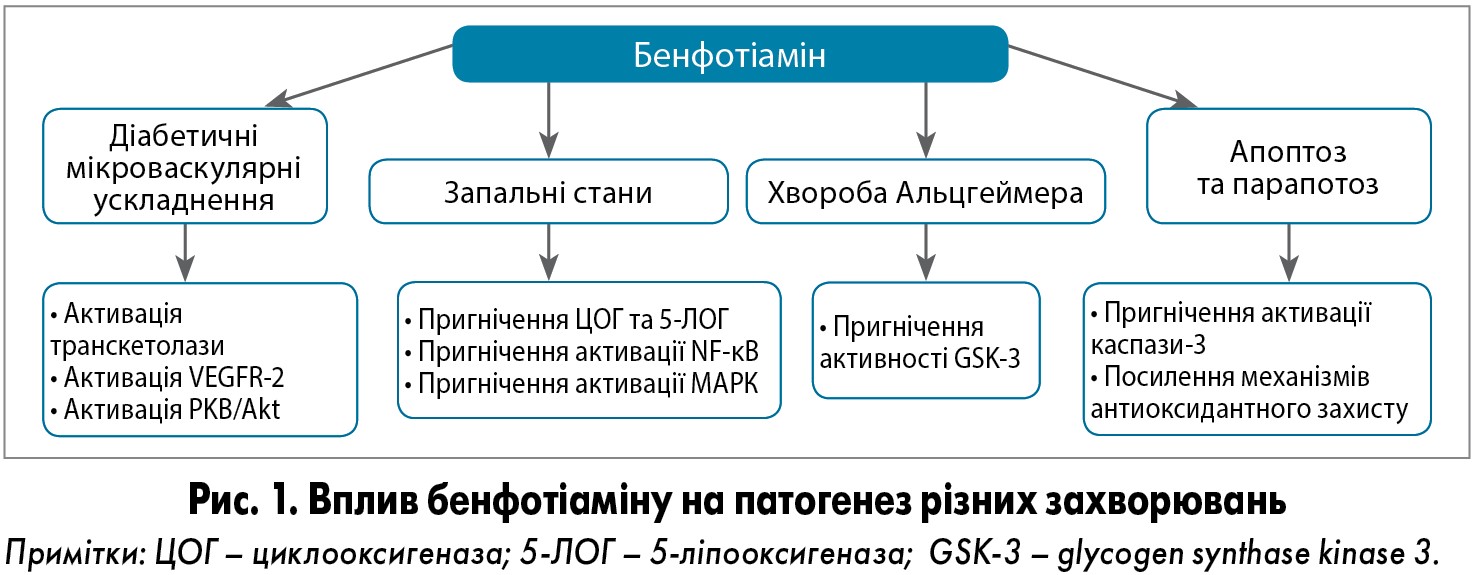
У порівнянні з еквівалентною дозою тіаміну для бенфотіаміну характерна більш висока біодоступність при пероральному використанні. Крім того, бенфотіамін може виявляти вищу ефективність у лікуванні неврологічних захворювань, ніж тіамін, що було підтверджено в дослідженнях (рис. 1).
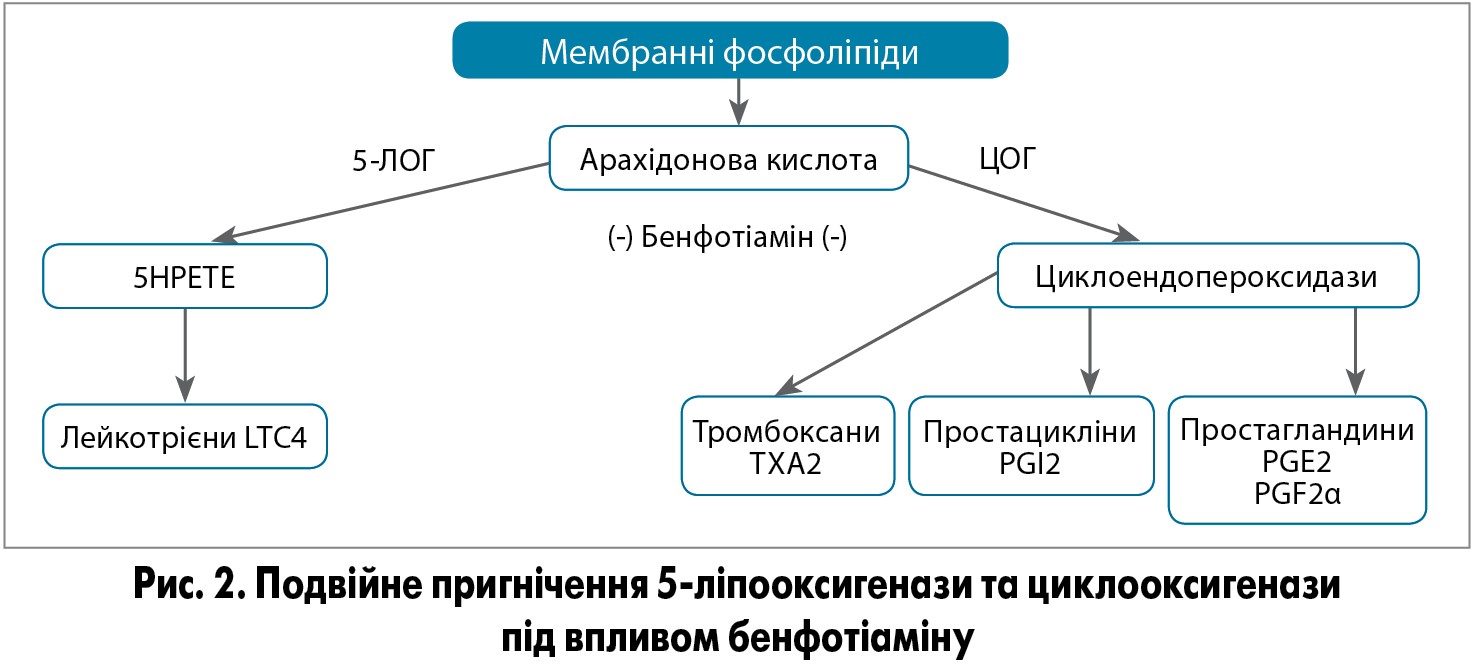
Були проведені дослідження впливу бенфотіаміну на процес утворення AGEs, що є важливими факторами старіння та розвитку дегенеративної патології. Добре вивчено ефект бенфотіаміну на AGEs-залежний метаболічний шлях. Завдяки цим властивостям бенфотіамін здатний модулювати різноманітні патологічні прояви ЦД, зумовлені AGEs, особливо нейропатії, нефропатії та ретинопатії. Відповідно до свого профілю ефективності та безпеки, бенфотіамін є важливим нутрієнтом для превенції прогресування діабетичної нейропатії (Sanchez-Ramirez G.M. et al., 2006). Підвищення активності транскетолази, індуковане введенням бенфотіаміну, характеризується сприятливими ефектами при експериментальній діабетичній нейропатії. У клінічному дослідженні було показано, що застосування бенфотіаміну у високих дозах значно знижує рівень нейропатичного болю. У деяких дослідженнях була також продемонстрована здатність бенфотіаміну впливати на метаболізм арахідонової кислоти, NF‑κВ, протеїнкінази B, мітоген-активованої протеїнкінази та рецептора фактора росту ендотелію 2 (Raj V. et al., 2018). Завдяки впливу на метаболізм арахідонової кислоти бенфотіамін виявляє протизапальні властивості, що подібні до таких у нестероїдних протизапальних препаратів (рис. 2).
В експериментах in vivo були отримані багатообіцяючі результати щодо можливостей лікування неврологічних патологій за допомогою бенфотіаміну. Так, у дослідженні V. Tapias і співавт. (2018) було показано, що бенфотіамін та його метаболіти (але не тіамін) запускають експресію Nrf2/ARE‑залежних генів у головному мозку та фібробластах дикого типу в експерименті на мишах, причому активні метаболіти бенфотіаміну чинять більш виражений ефект, ніж материнська молекула. Крім того, бенфотіамін та його активні метаболіти мають високу афінність до білка Keap1, що є перспективною терапевтичною мішенню в пацієнтів з метаболічними порушеннями. Результати дослідження свідчать про те, що бенфотіамін активує метаболічний шлях Nrf2/ARE і є перспективним терапевтичним агентом для лікування таких захворювань, як хвороба Альцгеймера, лобово-скронева деменція та прогресуючий супрануклеарний парез. Ці механізми можуть пояснювати результати клінічного дослідження X. Pan і співавт. (2016), у якому бенфотіамін зменшував прогресування когнітивної дисфункції в пацієнтів із хворобою Альцгеймера.
Враховуючи хронічний перебіг ЦД і необхідність постійного прийому ліків, перевагу слід віддавати препаратам, що забезпечують максимальний лікувальний ефект і не викликають побічної дії в цієї категорії пацієнтів. Одним з таких препаратів є Бенфогама («Вьорваг Фарма Гмбх і Ко. КГ», Німеччина). Забезпечення хворих на ЦД широким спектром високоякісних препаратів (з урахуванням аспектів фармакоекономіки, індивідуальної чутливості та переносимості конкретного препарату) є запорукою не тільки профілактики та/або призупинення виникнення діабетичних мікро- та макросудинних порушень, а й забезпечення належної якості життя та збереження працездатності.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 7 (452), квітень 2019 р