1 липня, 2019
Анализ эффективности применения механической тромбэктомии у пациентов с ишемическим инсультом
На сегодняшний день накоплено недостаточно данных относительно эффективности тромбэктомии при остром ишемическом инсульте в бассейне сонной артерии, поэтому однозначного мнения о пользе такого вмешательства не сложилось. Этой проблеме посвящена статья Kaesmacher et al., опубликованная в журнале Stroke (2019; 50: 880‑888), обзор которой предлагается вашему вниманию.
Целесообразно ли проводить механическую тромбэктомию пациентам с ишемическим инсультом и низким показателем по шкале ASPECTS – программе Alberta для оценки ранних изменений по данным компьютерной томографии (КТ) при инсульте головного мозга? Этот вопрос остается нерешенным, поскольку в недавние опорные исследования по тромбэктомии было включено лишь небольшое количество таких пациентов (Goyal et al., 2016; Yoo et al., 2016). Соответственно, в действующих руководствах Американской ассоциации по инсульту и Американской кардиологической ассоциации (ASA/AHA) нет однозначных рекомендаций по лечению больных с оценкой 0‑5 баллов по ASPECTS, а только предполагается, что у них можно использовать механическую тромбэктомию (Powers et al., 2018). Пациенты с низким значением по ASPECTS имеют более высокий риск симптоматического внутримозгового кровоизлияния (СВМК) с увеличением зоны повреждения ткани мозга, что объясняет снижение у них функциональных показателей (Kaesmacher et al., 2017; Yonggang et al., 2017; Nezu et al., 2011; Soize et al., 2013; Goyal et al., 2016).
Результаты предыдущих исследований позволяют предположить, что успешная реперфузия может быть полезной для пациентов с оценкой по ASPECTS 0‑5 или 0‑6 баллов (при использовании диффузионно-взвешенной КТ) (Danière et al., 2015; Dargazanli et al., 2017; Mourand et al., 2018). Цель исследования Kaesmacher et al. (2019), по определению авторов, состояла в том, чтобы проанализировать влияние успешной реперфузии на функциональный исход, смертность и проявления СВМК у больных с показателем 0‑5 по ASPECTS. Они были включены в Bernese-European Registry для пациентов с ишемическим инсультом после проведения тромбэктомии (вне соответствия с действующим руководством) с использованием прибора SOLITAIRE FR (BEYOND-SWIFT). В дальнейшем безопасность и эффективность эндоваскулярного лечения больных оценивали в сравнении с группой лиц, чьи оценки по шкале ASPECTS составляли 6‑10 баллов.
Материалы и методы исследования
BEYOND-SWIFT – это ретроспективный международный многоцентровой регистр наблюдений. Центры-участники предоставляли данные о пациентах с острым ишемическим инсультом, которым проводили нейротромбэктомию с применением зарегистрированного устройства производства компании Medtronic (Дублин, Ирландия). В исследование вошло 2046 субъектов; исходные характеристики – возраст, пол и оценка по шкале инсульта Национального института здравоохранения США (NIHSS). Большинство пациентов (n=1820), включенных в регистр BEYOND-SWIFT, проходили лечение по поводу инсультов в бассейне сонной артерии вследствие окклюзии крупных внутричерепных сосудов (внутренняя сонная артерия [ВСА], сегменты М1 и М2). Из них для 1630 больных имелись документированные данные наблюдений (в течение не менее 90 дней), а для 1532 – дополнительно оценки по шкале ASPECTS перед тромбэктомией. В 237 случаях показатели по ASPECTS составляли 0‑5 баллов.
Переменные и анализ изображений
Место окклюзии разделяли на внутричерепную ВСА, каротидные сегменты T/L, M1, M2 и M3 средней мозговой артерии, сегменты A1 и A2 передней мозговой артерии, позвоночную, базилярную артерии, сегменты P1 и P2 задней мозговой артерии на основании нейровизуализации: компьютерной томографической ангиографии / магнитно-резонансной томографии (МРТ) сосудов. У 7 пациентов данные о зоне окклюзии не были внесены. Показатели модифицированной шкалы оценки эффективности тромболизиса при церебральном инфаркте (mTICI) определялись оператором центра и, в отдельных случаях, независимым сотрудником. Значение 2b по mTICI соответствовало реперфузии не менее 50% от первоначально окклюзированной (Zaidat et al., 2013). Баллы по ASPECTS анализировали в каждом центре, у 910 из 1532 пациентов с окклюзией крупных внутричерепных сосудов оценка была основана на данных КТ при поступлении. В 600 случаях баллы по ASPECTS определяли с помощью диффузионной МРТ, а в 22 способ визуализации неизвестен. Функциональный клинический исход с использованием модифицированной шкалы Рэнкина (mRS) оценивали врач или сертифицированная медсестра через 90 дней. Во всех центрах баллы по mRS анализировали при проведении плановых стандартизированных телефонных опросов или визитах пациентов. Неврологические симптомы при поступлении и через 24 часа после вмешательства оценивались неврологом по шкале NIHSS.
Статистический анализ
Первичной конечной точкой анализа была оценка 0‑3 балла по mRS (благоприятный исход) на 90-й день (Rangaraju et al., 2017). Вторичные результаты и безопасность определяли как 0‑2 балла по mRS (функциональная независимость) на 90-й день, значительное раннее неврологическое улучшение (показатели по NIHSS при поступлении минус баллы по NIHSS через сутки ≥8 или показатель по NIHSS через сутки после поступления <1) (Brown et al., 2004), смертность в период до 90 суток с момента инсульта и частота СВМК.
Однофакторные сравнения проводили с использованием стандартных статистических методов (точный критерий Фишера для категориальных переменных, U-критерий Манна – Уитни для аномального распределения или ординарно масштабированные переменные и t-критерий Уэлча для нормально распределенных данных). Связь успешной реперфузии со всеми параметрами исхода оценивали с использованием многопараметрической логистической регрессии с поправкой на следующие заранее определенные факторы: возраст, пол, балл по NIHSS при поступлении, наличие/отсутствие тандемной окклюзии (>90% стеноза/окклюзии в области шеи), особенности проведения обследования в зависимости от центра, баллы по ASPECTS (с разделением на ≤3 и 4‑5), внутривенный тромболизис, артериальная гипертензия, дислипидемия, курение, инсульт в анамнезе, сахарный диабет, инсульт в стационаре, тип визуализации при поступлении, окклюзия внутричерепной ВСА / каротидного сегмента Т против каротидных сегментов М1/М2. Для оценки чувствительности анализы были проведены повторно либо отдельно для когорты пациентов с 0‑4 баллами по шкале ASPECTS, либо с применением следующих эффектов взаимодействия:
- успешная реперфузия (1: успешно) * процедура при поступлении (1: КТ).
- успешная реперфузия (1: успешно) * возраст ≤70 и >70 лет (1: возраст ≤70 лет).
При окончательном анализе чувствительности показатели ASPECTS, согласно результатам диффузионной МРТ, были увеличены на 1 балл, чтобы оценить соответствующие значения ASPECTS по данным неконтрастной КТ в соответствии с таковыми регистра SAMURAI (Nezu et al., 2011). После этого состоялся повторный анализ с пересчетом для группы пациентов с показателем 0‑5 баллов по ASPECTS. Оценка была добавлена в план статистического анализа после завершения протокола и проверки данных.
Результаты исследования
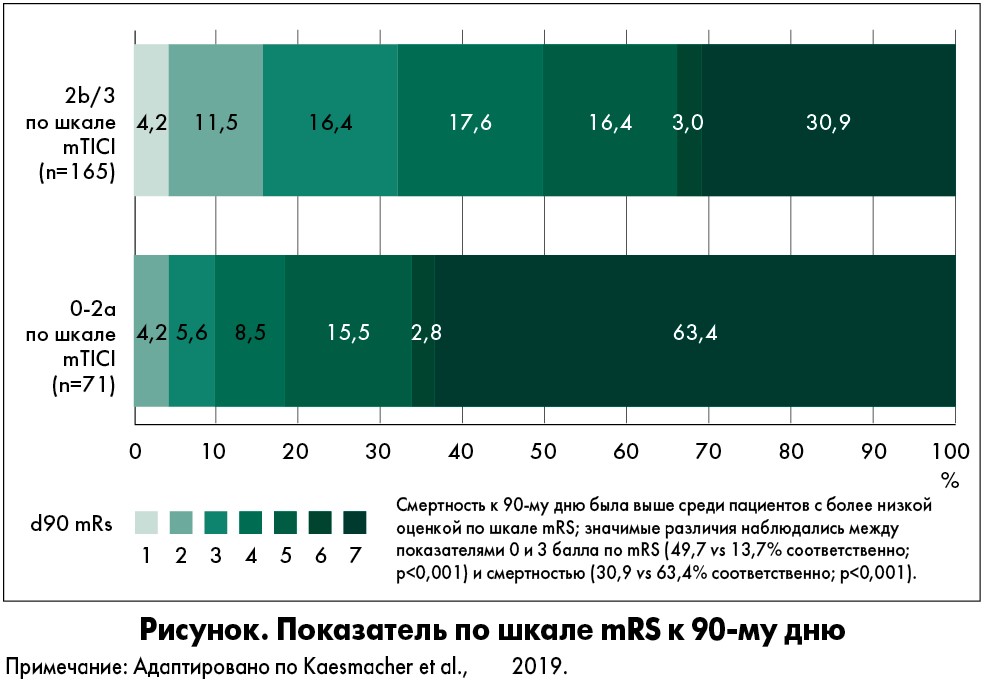
Из 1532 пациентов, включенных в анализ, у 237 показатель по шкале ASPECTS составил 0‑5 баллов, у 1295 – менее 5. Средний возраст больных в группе с оценкой 0‑5 баллов по ASPECTS (n=237) был 67,1±14,4 года, из них 43,5% (n=103) – женщины. У 93 субъектов значение составило 5 баллов, у 60 – 4 и у 84 – 0‑3. Лица с тяжелым неврологическим дефицитом (медиана показателя по NIHSS 18, межквартильный размах [МКР] 15‑22) были госпитализированы со средней задержкой от момента появления симптомов до поступления в 173 мин (МКР 85‑278 мин; показатель доступен для 190 пациентов). Реперфузия являлась успешной у 69,9% (n=165 из 236; в 1 случае отсутствовала информация о статусе реперфузии); медиана временного интервала от пункции в паховой области до достижения значения 2b по шкале mTICI была 48 мин (МКР 30‑79; n=164). Общие показатели благоприятного исхода (по шкале mRS ≤3 баллов) и смертности до 90-го дня составили 40,1% (n=95 из 237) и 40,9% (n=97 из 237) соответственно. Раннее неврологическое улучшение наблюдалось у 21,2% (n=32) из 151 пациента, которых тестировали по NIHSS через сутки после госпитализации.
Внутри когорты больных с показателем 0‑5 баллов по ASPECTS не было никакой разницы по исходным характеристикам, способу получения изображений, зоне окклюзии или причинам инсульта между лицами с успешной и неуспешной реперфузией (р>0,05). Однако однофакторное сравнение показало значимое превосходство у пациентов с удачной реперфузией по результатам лечения (рисунок).
В исследовании была выявлена связь между методом нейровизуализации и исходом – у пациентов, отобранных с помощью МРТ, результаты лечения были лучше, что подтверждает наблюдавшуюся в целом тенденцию. Эффект отмечался у субъектов с показателями по ASPECTS 5 и 4, но не 0‑3, однако у последних прослеживалась тенденция к снижению смертности после успешной реперфузии (47,4 vs 66,7%; р=0,108). После корректировки с учетом заранее определенных клинических факторов было выявлено, что успешная реперфузия ассоциировалась с благоприятным клиническим исходом (оценка по mRS 0‑3 балла; скорректированное отношение шансов [сОШ] 5,534; 95% доверительный интервал [ДИ] 2,363‑12,961), функциональной независимостью (mRS 0‑2 балла; сОШ 5,583; 95% ДИ 1,964‑15,873), значительным ранним улучшением неврологического статуса (сОШ 11,635; 95% ДИ 3,980‑34,011) и снижением смертности (сОШ 0,180; 95% ДИ 0,083‑0,390). После успешной реперфузии частота СВМК также снижалась (сОШ 0,235; 95% ДИ 0,062‑0,887). Связи между видом нейровизуализации или возрастными показателями и эффектом удачной реперфузии не выявлено. Значимый эффект реперфузии наблюдался для оценки по mRS 0‑3 балла и смертности, независимо от вида визуализации. В подгруппе пациентов с успешной реперфузией достижение показателя 3 (по сравнению с 2b) по шкале mTICI демонстрировало дополнительные преимущества. Когда оценка ограничивалась пациентами со значением 0‑4 по ASPECTS (n=144), положительная корреляция между успешной реперфузией и исходными переменными оставалась статистически значимой только для смертности (сОШ 0,168; 95% ДИ 0,056‑0,499). При окончательном определении чувствительности показатели ASPECTS по результатам диффузионной МРТ были увеличены на 1 балл, чтобы оценить соответствующие показатели ASPECTS по данным неконтрастной КТ в соответствии с таковыми регистра SAMURAI. Повторный анализ данных 172 пациентов со скорректированными баллами по ASPECTS ≤5 продемонстрировал сопоставимые исходы, за исключением того, что связь между успешной реперфузией и снижением частоты СВМК была незначимой.
При сравнении исходных характеристик субъектов с оценками 0‑5 и 6‑10 по ASPECTS выявлено, что в первой группе больные были моложе, а также у них чаще наблюдалась окклюзия проксимальных сегментов сосудов, обусловленная диссекцией шейного участка каротидной артерии. У пациентов с 0‑5 баллами были хуже показатели частоты успешной реперфузии (69,9 vs 83,9%; р<0,001) и времени от начала тромбэктомии до реперфузии (медиана 53 мин; МКР 33‑85 мин vs медиана 45 мин; МКР 30‑74 мин; р=0,009). Среди лиц с успешной реперфузией (mTICI ≥2b, n=1252) относительная частота показателя 3 по mTICI являлась сопоставимой (49,7 vs 55,2%; р=0,208). В этой группе также чаще возникали различные периоперационные осложнения (16,9 vs 12,2%; р=0,058). Распространенность СВМК в обеих группах оказалась сопоставимой (7,2 vs 6,0%; р=0,466). Частота благоприятных исходов у пациентов с оценкой 0‑5 баллов по ASPECTS была значимо ниже (mRS 0‑3; 40,1 vs 61,2%; р<0,001), а смертность возрастала вдвое (40,9 vs 21,2%; р<0,001) по сравнению с субъектами при показателе 6‑10. Однако относительные преимущества обеспечения успешной реперфузии были сопоставимы.
Обсуждение
Вопрос о необходимости проведения механической тромбэктомии у пациентов с ишемическим инсультом и низкими баллами по ASPECTS остается актуальным. Авторы считают, что данный анализ большого многоцентрового ретроспективного регистра групп позволил сделать четыре основных вывода:
- У пациентов с оценкой по ASPECTS 0‑5 баллов успешная реперфузия (при лучших показателях по mTICI) была ассоциирована с повышением функциональных показателей, снижением смертности и частоты СВМК (Kaesmacher et al., 2018; Rizvi et al., 2019).
- Эти эффекты оставались значимыми после корректировки дисперсии, связанной с модальностью визуализации, но были менее заметными у пациентов с показателем 0‑4 по ASPECTS, у которых только снижение смертности было значимым.
- Как и ожидалось, у субъектов с 0‑5 баллами по ASPECTS клиническое течение было более тяжелым, чем при значении 6‑10.
- У пациентов с оценкой по ASPECTS 0‑5 баллов тромбэктомия менее успешно обеспечивала реперфузию и чаще сопровождалась осложнениями, чем у участников с показателем 6‑10, однако частота СВМК в этих группах была сопоставимой.
Согласно данным регистра BEYOND-SWIFT, 15,5% пациентов (237 из 1532), которым провели тромбэктомию по поводу инсультов в бассейне сонной артерии вследствие окклюзии крупных внутричерепных сосудов, имели оценку 0‑5 баллов по ASPECTS. По результатам Mourand et al. (2018), у субъектов с показателем 0‑5 по ASPECTS после эндоваскулярной тромбэктомии исходы были благоприятнее, чем у таковых без выполнения процедуры. Другой недавний многоцентровой анализ выявил одинаковую частоту СВМК, однако более благоприятные исходы в группе больных с успешной реперфузией (mRS 0‑2; СОШ 3,00; 95% ДИ 1,71‑5,29) (Dargazanli et al., 2017). Авторы отмечают, что в этом исследовании, которое включало только пациентов с оценкой по ASPECTS ≤5 (по данным КТ или диффузной МРТ), у лиц с успешной реперфузией наблюдались более благоприятные исходы и снижение частоты СВМК, что также подтверждают результаты других исследований (Wang et al., 2015). Следовательно, можно утверждать, что риск СВМК не возрастает при реперфузии несмотря на быстрое восстановление кровотока в обширной зоне инфаркта.
Стоит отметить вероятность более благоприятных исходов после эндоваскулярного вмешательства, однако общая доля пациентов с функциональной независимостью (mRS 0‑2) через три месяца была ограниченной (25% в целом и 32% при реперфузии). Следовательно, больных и их семьи необходимо информировать о том, что тромбэктомия в таких ситуациях все еще ассоциирована с высокой вероятностью инвалидизации или летального исхода, а при принятии решения о лечении необходимо учитывать и другие прогностические факторы. Авторы отмечают, что у больных с оценкой 0‑5 баллов по ASPECTS частота реканализации была ниже, несмотря на одинаковое количество попыток тромбэктомии, что, возможно, связано с решением нейрохирурга о прекращении процедуры из-за ее неэффективности при больших ишемических поражениях. Однако важно учитывать, что у субъектов с показателями 0‑5 и 6‑10 по ASPECTS имелись значительные различия в отношении распределения участков окклюзии, частоты диссекции шейного отдела каротидной артерии и причин инсульта, что также может влиять на развитие осложнений.
Существует множество причин, обусловливающих клиническую пользу успешной реперфузии, несмотря на низкие баллы по ASPECTS, что, возможно, частично обусловлено ограничениями методики ASPECTS (Schröder, Thomalla, 2017). Во-первых, шкала ASPECTS является лишь неким суррогатом для оценки объема инфаркта, не учитывающим ряд факторов (de Margerie-Mellon et al., 2013). Во-вторых, некоторые поражения, принимаемые во внимание при оценке по ASPECTS, могут быть обратимыми, особенно в первые три часа после появления симптомов, что приводит к переоценке инфарктного ядра (Soize et al., 2015; Labeyrie et al., 2012). Однако было показано, что клиническое значение и объемы тканей, связанные с реверсией поражения, минимальны (Inoue et al., 2014; Albach et al., 2013). В-третьих, ASPECTS предполагает просто дихотомическое течение ишемических поражений (инфаркт vs неинфаркт), что, вероятно, не соответствует действительности. В нескольких исследованиях оценивали важность постепенного снижения значений измеряемого коэффициента диффузии и его паттернов внутри очага поражения для исхода и риска геморрагической трансформации (Lestro Henriques et al., 2015; Tong et al., 2000). С учетом этого, а также различной ишемической толерантности серого и белого вещества (серое более чувствительно к гипоксии), ткани могут подвергаться инфаркту в разные моменты времени (Koga et al., 2005; Falcao et al., 2004; Arakawa et al., 2006). Есть возможность спасти проводящие пути белого вещества в ASPECTS-позитивном участке (где серое в значительной степени подверглось инфаркту) благодаря быстрой реперфузии (Kleine et al., 2017; Tisserand et al., 2014; Rosso et al., 2011; Payabvash et al., 2017). Однако при низких баллах по ASPECTS ядро инфаркта переоценивается, и недооценивается потенциальный положительный эффект успешной реперфузии в этой области (Kleine et al., 2017).
В целом инсульт в пожилом возрасте зачастую связан с плохим исходом, в основном из-за большего количества сопутствующих заболеваний и снижения функционального резерва (Fischer et al., 2012). Установлено, что возраст является основным предиктором во всех многомерных моделях логистической регрессии, применяемых в группе пациентов с оценкой 0‑5 по ASPECTS. Mourand et al. (2018) предположили, что польза от эндоваскулярного вмешательства особенно значительна у пациентов до 70 лет с показателем 0‑5 по ASPECTS, однако полученные данные не показали связи между успешной реперфузией и возрастом больных.
Анализ Kaesmacher et al. (2019) включал пациентов с оценкой 0‑5 по ASPECTS на основании данных как КТ (n=78), так и диффузной МРТ (n=154), в 5 случаях информация о способе визуализации отсутствовала. Выявлено, что у лиц с КТ, проведенной при поступлении, прогноз был хуже. Анализ чувствительности (с увеличением на 1 балл показателей ASPECTS по данным диффузионной МРТ) также не выявил изменения связи между успешной реперфузией и улучшением клинического исхода.
Ограничения исследования
Анализ баллов по АSPECTS проводили в каждом центре, участвовавшем в исследовании. Данные не были подтверждены в основной лаборатории, следовательно, возможны отклонения в оценках. Следует принимать это во внимание, поскольку согласованность показателей МРТ-ASPECTS и КT-ASPECTS ограничена (Fahed et al., 2018; Farzin et al., 2016). В данном анализе использовали дихотомизацию показателей 0‑5 по ASPECTS, которая в некоторой степени уменьшила различия в оценке (Fahed et al., 2018). Кроме того, больные с низкими баллами по ASPECTS были выявлены в основном в трех центрах, что ограничивает возможность обобщения результатов. Другим ограничением оценки по ASPECTS является то, что метод не учитывает ишемию вне зоны кровоснабжения средней мозговой артерии. Добавление даже 1 балла к показателю по ASPECTS может исказить соотношение данных, полученных при КT и диффузной МРТ в когорте, поскольку регистр SAMURAI не включал исключительно пациентов с окклюзией крупных сосудов (22,5% с окклюзией М2/М3 и 28,3% без видимой окклюзии) и содержал данные лишь немногих субъектов с низкими значениями по ASPECTS. К тому же важную роль играет неоднородная оценка по шкале mTICI исследователями разных центров, что может привести к дальнейшему искажению результатов. В-третьих, есть вероятность невыполнения обязательств и потери данных (10,1%). В-четвертых, в этот регистр включены только пациенты, подвергнутые эндоваскулярным процедурам, что может привести к смещению выборки по отношению к таковым с оценкой 0‑5 по ASPECTS, у которых шансы на хороший исход были оценены как значимые (в соответствии с другими клиническими факторами, не скорректированными для многомерного показателя). Наконец, этот анализ включает вмешательства с использованием только одного устройства.
Таким образом, авторы считают, что из-за ретроспективного нерандомизированного характера данных и отсутствия необработанной контрольной группы полученные результаты следует рассматривать как основание для генерирования гипотез, предполагающих необходимость проведения рандомизированного контролируемого исследования в будущем. Если учесть, что исход для неудачно реперфузированных пациентов напоминает естественное течение заболевания и, вероятно, частично заменит контрольную группу, текущий анализ подтверждает мнение о том, что быстрая и полная реперфузия полезна. Однако следует принимать во внимание, что неуспешная процедура может фактически навредить больному, например, из-за осложнений и наркоза. Кроме того, в исследовании подчеркивается потенциальное влияние метода визуализации, используемого для оценки ASPECTS. Результаты подтверждают мнение о том, что ограничения для лечения, возможно, не могут быть напрямую сопоставимы между центрами, в которых применяют КТ или МРТ.
Выводы
В подгруппе пациентов с оценкой 0‑5 баллов по шкале ASPECTS успешная реперфузия способствовала улучшению исхода и профиля безопасности по сравнению с теми, у кого реперфузия была неудачной. Снижение смертности оставалось значимым даже у больных с 0‑4 баллами по ASPECTS. Кроме того, частота СВМК являлась сопоставимой у субъектов с показателями 0‑5 и 6‑10 по ASPECTS. Это свидетельствует о том, что резкое восстановление кровотока в очаге крупного инфаркта после успешной реперфузии не обязательно повышает риск развития СВМК.
Авторы подчеркивают, что полученные данные подтверждают необходимость проведения рандомизированного контролируемого испытания с целью сравнить эффективность эндоваскулярного вмешательства и золотых стандартов лечения таких пациентов. В заключение, в таких исследованиях следует отдельно оценивать группы больных, для отбора которых используются разные методы визуализации.
Подготовила Марьяна Павленко
Ведення пацієнтів у гострий період інсульту: рекомендації NICE 2019 року
 На сайті Національного інституту здоров’я і досконалості медичної допомоги (NICE) 1 травня 2019 р. були опубліковані клінічні рекомендації з діагностики й лікування інсульту та транзиторної ішемічної атаки (ТІА) протягом 48 годин від появи симптомів. Керівництво оновлює та замінює рекомендації NICE від липня 2008 р.
На сайті Національного інституту здоров’я і досконалості медичної допомоги (NICE) 1 травня 2019 р. були опубліковані клінічні рекомендації з діагностики й лікування інсульту та транзиторної ішемічної атаки (ТІА) протягом 48 годин від появи симптомів. Керівництво оновлює та замінює рекомендації NICE від липня 2008 р.
Ключові аспекти рекомендацій стосувалися ролі швидкого й доступного обстеження пацієнта за допомогою тесту «Обличчя – рука – мова» (FAST) на догоспітальному етапі, виявлення гіпоглікемії в осіб із раптовою неврологічною симптоматикою та використання шкали розпізнання інсульту у відділенні невідкладної допомоги (ROSIER). Оновлення торкалися призначення ацетилсаліцилової кислоти (АСК, 300 мг/добу) пацієнтам із ймовірною ТІА та ініціювання вторинної профілактики, додатково до АСК, якомога швидше після підтвердження діагнозу ТІА.
Питання візуалізації було розглянуте детально: не рекомендується комп’ютерно-томографічне (КТ) обстеження головного мозку особам із ТІА. Натомість слід розглянути можливість проведення магнітно-резонансної томографії (МРТ), зокрема використання дифузійно-зваженої та чутливої до крові послідовності. До того ж кожному пацієнтові з ТІА, який є кандидатом на каротидну ендартеректомію, необхідно терміново проводити каротидну візуалізацію та визначати подальшу тактику, керуючись результатами обстеження.
Проведення у пацієнтів із підозрою на наявність гострого інсульту КТ без контрастного посилення рекомендоване при визначенні показань до тромболізису/тромбектомії, антикоагулянтної терапії, а також у разі відомої тенденції до кровотечі, зниження рівня свідомості (оцінка за шкалою коми Глазго <13) та інтенсивного головного болю, що супроводжує появу симптомів інсульту. За наявності перспективи виконання тромбектомії необхідно провести візуалізацію за допомогою КТ-ангіографії після початкової КТ без контрастного посилення та перфузійну КТ (або еквівалент МРТ), якщо тромбектомію показано після шести годин від появи симптомів.
Тромболізис із використанням альтеплази у пацієнтів з гострим ішемічним інсультом залишається ефективним та бажаним методом терапії. За наявності проксимальної оклюзії передньої або задньої циркуляції вирішується питання тромбектомії разом із внутрішньовенним тромболізисом, враховуючи термін виникнення симптомів (до 6 годин і від 6 до 24 годин) та стан тканини головного мозку, визначений за допомогою КТ-перфузії або МРТ у дифузійно-зваженому режимі.
Додатково були детально розглянуті питання призначення антикоагулянтів за наявності супутніх захворювань (фібриляція передсердь, стан після протезування клапанів, тромбоз проксимальних глибоких вен, легенева емболія), ініціювання статинотерапії, залучення додаткової кисневої терапії, контролю цукру в крові, менеджменту артеріального тиску в пацієнтів із гострою внутрішньомозковою кровотечею та гострим ішемічним інсультом, хірургічної допомоги в осіб із гострим інсультом і багато іншого.
Більш детальний огляд рекомендацій буде представлений у виданні «Неврологія. Психіатрія. Психотерапія», № 3 (50), 2019
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 2 (49) червень 2019 р.