24 липня, 2019
Алкогольна кардіоміопатія: сучасний стан проблеми
 Зловживання алкоголем – серйозна соціально-економічна й медична проблема, оскільки алкоголь є однією з токсичних речовин, що широко споживається у всьому світі [53, 132]. Надмірне його вживання відповідальне за 88 тис. смертей у США щорічно, зокрема, за 1 із 10 летальних випадків серед дорослих працездатного віку (20‑64 роки) [132]. Зловживання алкоголем є причиною/фактором ризику більш ніж 200 захворювань чи уражень, серед яких алкогольна залежність, цироз печінки, рак, травма тощо [141]. Варто зауважити, що значна частина летальних подій, асоційованих з алкоголем, виникає внаслідок алкогольної кардіоміопатії (АКМП) [11]. Тривале надмірне споживання алкоголю може призводити до розвитку вторинної дилатаційної кардіоміопатії (ДКМП) – АКМП, через його токсичний вплив на серце [54, 89]. З огляду на те, що АКМП складає приблизно 3,8% усіх зареєстрованих випадків кардіоміопатій та 21‑36% – неішемічної ДКМП, це захворювання є основним фактором розвитку серцевої недостатності (СН) [108].
Зловживання алкоголем – серйозна соціально-економічна й медична проблема, оскільки алкоголь є однією з токсичних речовин, що широко споживається у всьому світі [53, 132]. Надмірне його вживання відповідальне за 88 тис. смертей у США щорічно, зокрема, за 1 із 10 летальних випадків серед дорослих працездатного віку (20‑64 роки) [132]. Зловживання алкоголем є причиною/фактором ризику більш ніж 200 захворювань чи уражень, серед яких алкогольна залежність, цироз печінки, рак, травма тощо [141]. Варто зауважити, що значна частина летальних подій, асоційованих з алкоголем, виникає внаслідок алкогольної кардіоміопатії (АКМП) [11]. Тривале надмірне споживання алкоголю може призводити до розвитку вторинної дилатаційної кардіоміопатії (ДКМП) – АКМП, через його токсичний вплив на серце [54, 89]. З огляду на те, що АКМП складає приблизно 3,8% усіх зареєстрованих випадків кардіоміопатій та 21‑36% – неішемічної ДКМП, це захворювання є основним фактором розвитку серцевої недостатності (СН) [108].
За наявними даними, АКМП являє собою причину раптової серцевої смерті в 19% випадків серед неішемічних причин у Північній Фінляндії [57]. Як видно з результатів дослідження, провідними причинами смерті й скорочення життя населення через вживання алкоголю у 2015 р. в Україні були: АКМП (34,7%), алкогольна хвороба печінки (17,9%), розлади психіки та поведінки внаслідок приймання алкоголю (7,4%), дегенерація нервової системи (6,8%) [1]. Необхідно відмітити, що на кожний випадок смерті від алкогольної хвороби печінки припадає два від АКМП. Це свідчить про те, що серед усіх органів насамперед найчастіше страждає міокард.
Медико-соціальне значення шкідливого вживання алкоголю та тягар його впливу на громадське здоров’я полягають у скороченні тривалості життя. Серед померлих від патологій алкогольного ґенезу вона не перевищує 50‑52 роки, що на 20 років менше від загальної тривалості життя [1]. Тому рання діагностика АКМП є важливою для запобігання розвитку і прогресування СН та інших ускладнень цього захворювання, що, безумовно, покращить прогноз [90].
Метою цього огляду літератури є викладення особливостей АКМП, зокрема епідеміології, патофізіології, клінічних проявів, діагностики, лікування та прогнозу з метою поліпшення ведення таких пацієнтів. Краще розуміння АКМП є важливим для лікарів сімейної практики, кардіологів та інших спеціальностей для оптимальної терапії осіб з АКМП.
Споживання алкоголю та вплив на організм людини
Надмірним вважається вживання алкоголю, що включає випивання (≥4 дози для жінок і ≥5 доз для чоловіків протягом близько двох годин, за один раз), тяжке пиття (≥8 доз на тиждень або ≥4 дози на день для жінок і ≥15 доз на тиждень або ≥5 доз на день для чоловіків) чи будь-яке приймання алкоголю вагітними або особами менше за 21 рік (табл. 1) [132]. У США помірним вважається вживання ≤1 дози алкоголю на день для жінок і ≤2 доз на день для чоловіків. Одна стандартна доза спиртного напою містить 14 г алкоголю (0,6 рідких унцій, 30 мл), що відповідає 360 мл пива (5% спирту), 150 мл вина (12% спирту) або 45 мл міцного алкогольного напою (40% спирту) [132].
Короткострокові ризики для здоров’я надмірного вживання алкоголю (найчастіше є результатом випивання) включають: травми (автокатастрофи, падіння, утоплення та опіки), насильство, зокрема вбивство, самогубство, сексуальне насильство та насильство з боку інтимних партнерів, aлкогольне отруєння, ризикову сексуальну поведінку, зокрема незахищений секс або секс із кількома партнерами [5, 63, 141]. Це може призвести до незапланованої вагітності або захворювань, що передаються статевим шляхом, з-поміж яких ВІЛ-інфекції [98], викиднів і мертвонародження або спектра алкогольних розладів у плода (FASD) серед вагітних жінок [13, 98, 141].
Довгострокові ризики для здоров’я надмірного вживання алкоголю. Із часом воно може призвести до розвитку хронічних захворювань та інших патологій, що включають: підвищення артеріального тиску, хвороби серця, інсульт, захворювання печінки та розлади травлення, рак молочної залози, рота, горла, стравоходу, печінки і товстої кишки, труднощі з навчанням та порушення пам’яті, зокрема деменцію, психічні розлади, з-поміж яких депресія і тривожність, соціальні проблеми, зокрема зниження продуктивності праці, сімейні проблеми та безробіття, алкогольна залежність [31, 59, 86, 119, 141].
Вплив алкоголю на серцево-судинну систему
Дискусія щодо користі та шкідливого впливу алкоголю на серцево-судинну систему (ССС) все ще продовжується [68, 138]. Помірне вживання алкоголю (≥1‑2 дози на день для чоловіків та 1 доза на день для жінок) асоційоване зі зниженням ризику смерті; з іншого боку, більше споживання алкоголю пов’язане з підвищенням серцево-судинного ризику і виникненням артеріальної гіпертензії, атеросклерозу та АКМП [102]. За даними Rodriguez et al. показано, що тривале зловживання алкоголем призводить до зниження скоротливості міокарда, розвитку АКМП і СН зі зниженою фракцією викиду (ФВ) лівого шлуночка (ЛШ) за несприятливого прогнозу із виживанням <25% протягом понад трьох років [121]. На відміну від цього, низьке споживання алкоголю пов’язане зі зменшенням ймовірності виникнення захворювань ССС [121].
Добре відомо, що одноразовий прийом великої кількості алкоголю, а також хронічне зловживання чинять токсичний вплив на всі органи й системи [9], особливо на центральну нервову систему, печінку, серце, систему гемопоезу тощо [10, 42, 67, 125]. Зокрема, тяжке, надмірне зловживання алкоголем є причиною розвитку АКМП, артеріальної гіпертензії, порушень серцевого ритму, зокрема фібриляції (ФП) та тріпотіння передсердь, цирозу печінки, панкреатиту, інсульту й може призводити до раптової смерті [24, 34, 47, 57, 93, 113, 125].
Слід відмітити, що помірне вживання алкоголю є причиною «французького парадоксу», а саме незначної частки захворюваності на ішемічну хворобу серця (ІХС) у регіонах, в яких населення вживає червоне вино [107]. Є повідомлення, що низький та помірний рівень споживання алкоголю асоційований зі зниженням серцево-судинного ризику, передусім розвитку ІХС та ішемічного інсульту, СН [6, 20, 68, 93, 112, 122]. Проте з наступним збільшенням споживання алкоголю його шкідливий вплив переважає користь, що призводить до J-подібної кривої між вживанням алкоголю і виживаністю [131]. Так, в осіб середнього та похилого віку смерть від усіх причин і серцево-судинна летальність були нижчими за помірного вживання алкоголю, яка зростала при прийомі >2 доз на день [131]. Слід зазначити, що навіть помірні дози алкоголю унеможливлюють процес ішемічного прекондиціонування (форма ендогенного захисту міокарда від ішемічного пошкодження) [99]. До ІХС, зокрема ІМ, атеросклерозу, пацієнти з АКМП не доживають приблизно 25 років. Тому для підтвердження захисної ролі алкогольних напоїв (серед яких червоне вино) відносно ССС немає вагомих доказів.
Необхідно підкреслити, що не варто вживати алкоголь з урахуванням можливого позитивного ефекту на розвиток захворювань ССС, оскільки ризик прогресування алкогольної залежності невідомий, а «корисної» дози не існує [1, 132, 141]. За даними метааналізу Mostofsky et al., приймання навіть помірної кількості алкоголю пов’язане з негайним підвищенням серцево-судинного ризику, який знижується через 24 години, зменшенням ймовірності розвитку інфаркту міокарда та геморагічного інсульту на 30% (при споживанні приблизно 2‑4 доз) та ішемічного – на 19% протягом тижня (близько 6 доз). Споживання значних доз алкоголю асоційоване з вищим серцево-судинним ризиком вже наступного дня (приблизно 6‑9 доз, відносний ризик [ВР] 1,3‑2,3) і впродовж тижня (близько 19‑30 доз, ВР 2,25‑6,2) [92].
Одноразовий прийом значної кількості алкоголю може призводити до запалення/ушкодження міокарда з підвищенням рівня тропоніну в сироватці крові, розвитку передсердних тахіаритмій, таких як ФП і рідко – фібриляція шлуночків [137, 139]. Ці хворі здебільшого молодого віку, без захворювань ССС, в яких симптоми розвиваються у вихідні дні або після відпустки, що називають ще «синдромом святкового серця» [22].
Ризик розвитку дисфункції ЛШ і АКМП пов’язаний як із середньодобовим споживанням алкоголю, так і з загальною його тривалістю [77, 78]. Однак слід зазначити, що алкогольне ураження серця може виникнути за переважно помірного вживання алкоголю і не проявлятися при його тяжких хронічних формах, що, ймовірно, залежить від генетично детермінованого запасу ензимів [3]. Цю гіпотезу підтверджують результати роботи, за якими алкоголь може викликати безсимптомну дисфункцію серця навіть при потраплянні в організм здорових осіб у малій кількості [115].
Точна частка і тривалість вживання алкоголю, що асоційовані з розвитком АКМП, залишаються до кінця не з’ясованими. За даними більшості літератури, токсична дія алкоголю є дозозалежною [141]. Так, відомо, що ризик АКМП корелює з кількістю спожитого етилового спирту і тривалістю його регулярного споживання, однак єдиної мінімальної дози, за якої може розвиватися це захворювання, і встановленого терміну прийому немає [108]. Хронічне вживання алкоголю (зловживання) визначається як добове приймання понад 80 г впродовж не менш ніж п’яти років [62]. На основі проспективних досліджень вважається, що вживання алкоголю більш ніж 90‑120 г/день (приблизно 7‑15 стандартних доз на добу) протягом 5‑15 років асоційоване зі зміною структури і функції серця [34], зниженням скоротливості кардіоміоцитів, дилатації шлуночків, фіброзу і, насамкінець, виникненням СН внаслідок неішемічної ДКМП – АКМП [4, 46, 53, 77, 78, 93, 108]. Більшість пацієнтів, у яких розвивається АКМП, споживають понад 80‑90 г етанолу на день більш ніж п’ять років (за деякими даними – в середньому 15 років) [34, 77, 78, 84]. Це відповідає приблизно одному літру вина, восьми дозам пива або половині пінти міцного напою щодня.
Необхідно відзначити, що ризик базується на абсолютній кількості етанолу [115]. Крім того, розвиток патології, асоційованої з прийомом алкоголю, залежить від індивідуальної чутливості та захисних або несприятливих ефектів, зокрема генетичних факторів чи способу життя [108]. При АКМП, особливо на ранній стадії, можливе відновлення функцій серця за умови відмови від алкоголю або зменшення його вживання [34, 35, 46, 49].
За даними дослідження Lazarevic et al., дилатація ЛШ розвивалася через 5‑9 років у тих, хто споживав >90 г алкоголю на день протягом ≥4 днів на тиждень. Дилатація і порушення процесів розслаблення ЛШ були виявлені при хронічному тяжкому вживанні алкоголю у безсимптомних пацієнтів. За допомогою множинної регресії визначено тривалість пияцтва як найважливішої змінної, що впливає на показники діастолічної дисфункції ЛШ, такі як швидкість піку пізнього діастолічного наповнення в систолу передсердь (хвиля А), час сповільнення раннього діастолічного наповнення [77].
Епідеміологія
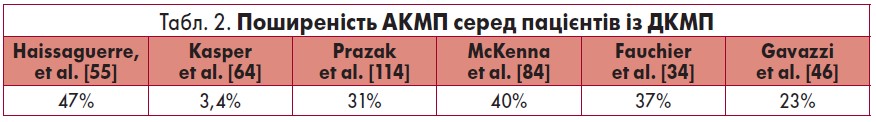
Хоча в декількох дослідженнях автори намагалися оцінити точну поширеність АКМП, результати не є остаточними [37, 118]. За даними Kasper et al., частота АКМП серед пацієнтів із ДКМП становила 3,4% випадків.
Однак слід відмітити, що діагноз АКМП встановлювали на основі порогу споживання алкоголю 200 г/добу протягом шести місяців [64]. Цей висновок не узгоджується з декількома дослідженнями, проведеними у Європі, в яких приймали за поріг споживання алкоголю 80 г на день упродовж принаймні п’яти років [34, 46, 55, 114]. За отриманими результатами, поширеність АКМП становила 23‑47% серед осіб із ДКМП (табл. 2) [34, 46, 55, 84, 114].
Згідно з даними дослідження за участю безсимптомних хворих – 50 жінок і 100 чоловіків, що зловживали алкоголем, приблизно у третини з них спостерігали дисфункцію ЛШ [133]. Окрім того, виявлено кореляцію між дисфункцією ЛШ і цирозом печінки. Так, останній був діагностований у 43% пацієнтів з АКМП і в 6% осіб, що зловживали алкоголем, без АКМП. Також 50% хворих на цироз печінки, що зловживали алкоголем, мали ознаки і симптоми ДКМП. Слід відмітити, що функція серця була незміненою у контрольній групі суб’єктів із неалкогольним цирозом печінки [32].
Є повідомлення, що поширеність АКМП однакова у чоловіків і жінок без істотних відмінностей у віці [39, 46, 84, 120]. Вищі рівень споживання алкоголю і частота алкогольних проблем у хворих чоловіків компенсуються більшою сприйнятливістю жінок до алкогольного пошкодження органів і систем. Тобто концентрація алкоголю у крові досягає вищої межі в жінок через нижчий загальний вміст води в організмі та зменшення числа й активності ферментів, що метаболізують алкоголь [8]. Окрім того, у жінок відзначали значно нижчу добову дозу етанолу (p=0,002), менші тривалість зловживання (p=0,017) і загальну дозу споживання етанолу (р=0,001), нижчий функціональний клас (ФК) СН за класифікацією Нью-Йоркської асоціації кардіологів (NYHA) порівняно з чоловіками. При проведенні багатофакторного аналізу систолічна дисфункція ЛШ була асоційована із загальною дозою споживання етанолу (р<0,04), але не зі статтю [39]. Ці дані підтверджують результати роботи Ren et al., за якими ймовірність розвитку АКМП корелює із загальною дозою етанолу, яку вживають протягом життя незалежно від статі [120]. Проте жінки приймають меншу загальну дозу етанолу (з урахуванням нижчого індексу маси тіла) порівняно з чоловіками.
Необхідно відзначити, що є також повідомлення щодо гендерних відмінностей поширеності АКМП [11]. Жінки чутливіші до кардіотоксичного впливу алкоголю, ніж чоловіки; аналогічну схильність виявлено для алкогольної хвороби печінки та алкогольної міопатії [48, 120]. Серед запропонованих механізмів гендерної різниці щодо чутливості до алкоголю – надлишкове накопичення метаболітів етанолу та суттєвіша частка жирових відкладень у жінок і, як було зазначено вище, більша кількість води в організмі чоловіків [30, 115]. Окрім того, активність алкогольдегідрогенази (АДГ) у жінок удвічі менша, ніж у чоловіків [2]. Не до кінця зрозумілий вплив естрогенів у жінок на розвиток АКМП. Тому необхідні наступні дослідження для кращого розуміння статевих відмінностей і потенційних ефектів естрогенів при зловживанні алкоголем [110].
До того ж генетична варіація деяких білків міокарда (наприклад, ангіотензину II) або ферментів, пов’язаних із метаболізмом етанолу (як-то АДГ і альдегіддегідрогеназа), може впливати на індивідуальну сприйнятливість до індукованої етанолом токсичності міокарда [110]. Ці фактори частково пояснюють, чому в жінок АКМП розвивається швидше і при меншому споживанні алкоголю на добу (приблизно 40% дози) порівняно з чоловіками [130]. Проте потрібно провести додаткові дослідження, щоб зрозуміти варіабельність індивідуальної схильності до індукованого алкоголем пошкодження [89].
Piano et al. вивчали вплив тривалого споживання алкоголю протягом восьми місяців. У всіх досліджуваних групах щурів були виявлені зміни при проведенні ехокардіографії (ЕхоКГ), однак суттєвіші відмінності, викликані етанолом, – у самців порівняно з самками. Крім того, у щурів-самців спостерігали значне зниження показників скоротливості ЛШ [109]. Це підтверджують дані Fogle et al., за якими у щурів-самців після 18 тижнів споживання алкоголю було виявлене зменшення маси ЛШ, ударного об’єму, серцевого викиду і кінцево-діастолічного розміру ЛШ порівняно з контрольною групою. Можливо, такі результати пов’язані зі зниженням вмісту білка внаслідок зменшення його синтезу [43].
Докази зв’язку тривалого вживання алкоголю і розвитку АКМП
Мета низки експериментальних та епідеміологічних досліджень полягала у вивченні епідеміологічних характеристик АКМП з акцентом на причини, клінічні прояви, поширеність, а також можливі механізми контролю. Прямий причинно-наслідковий зв’язок між хронічним зловживанням алкоголю і виникненням АКМП залишається спірною темою у кардіології [20, 53, 81, 110]. Одні дослідники вважають, що алкоголь може викликати AКМП [110], інші – що він виступає у ролі тригера розвитку AКМП [93]. Однак дані, які демонструють кореляцію хронічного вживання алкоголю з виникненням АКМП, відзначені у великій кількості епідеміологічних, експериментальних, гістологічних, ехокардіографічних та інших випробувань [11, 39, 53, 84]. Огляд літератури показав, що тривалий щоденний прийом ≥3 доз алкоголю є фактором ризику розвитку АКМП [94].
McKenna et al. показали, що частота надмірного зловживання алкоголем серед 100 хворих на ДКМП становила 40% порівняно із 23% групи контролю, що включала 211 здорових суб’єктів [84]. Однак основним обмеженням дослідження було прийняття порогу споживання алкоголю 30‑40 г на день, що нижче за встановлений (понад 80 г/добу). Fernandez Solà et al. продемонстрували вищу поширеність ДКМП серед осіб, що зловживали алкоголем, ніж тих, що його не приймали [39].
У дослідженнях, спрямованих на виявлення механізму індукованого алкоголем пошкодження кардіоміоцитів, також доведено зв’язок між надмірним вживанням алкоголю та АКМП. Патофізіологічні механізми розвитку АКМП багатофакторні та асоційовані як з етанолом, так і з ацетальдегідом, який є його основним метаболітом [53]. Незважаючи на численні наукові випробування, послідовність змін, що характеризують пошкодження міокарда внаслідок надмірного споживання алкоголю, залишається досить суперечливим аспектом. Деякі дослідники повідомляють, що розвиток гіпертрофії ЛШ є початковим проявом індукованого алкоголем пошкодження міокарда, тоді як за даними іншої роботи загибель кардіоміоцитів характеризує основні зміни через пошкодження міокарда, індукованого алкоголем [53].
ЕхоКГ-дослідження, в яких аналізували вплив надмірного споживання алкоголю на структуру та функцію міокарда, також свідчать про зв’язок між хронічним зловживанням алкоголю та АКМП [53]. Показано, що навіть низькі концентрації етанолу в крові погіршують функцію ЛШ [21]. Це підтверджують результати роботи Guzzo Merello et al., які встановили пригнічувальну дію алкоголю на скоротливість ЛШ [53]. У пацієнтів, що споживали понад 80 г алкоголю протягом п’яти років, виявлено гіпертрофію ЛШ, помірне збільшення кінцевосистолічного та кінцеводіастолічного об’ємів ЛШ [77].
Гістопатологічні дослідження також вказують на кореляцію між надмірним вживанням алкоголю та АКМП [53, 81, 115]. Однак структурні зміни при АКМП не є специфічними і не дозволяють відрізнити ідіопатичну ДКМП і АКМП [53].
Історія
Взаємозв’язок тяжкого ураження міокарда і зловживання алкоголем вивчали упродовж тривалого часу [81, 89]. Алкогольні напої вживали люди з різних суспільних груп протягом століть і культур. Поняття «алкоголь» набагато молодше, ніж напої, що його містять. Наприклад, розпилену сурму використовували єгипетські жінки як тіні для повік і називали al-Kol. У ХVI ст. Paracelsus застосовував термін «алкоголь» [82]. У середньовічні часи алкоголь використовували при стенокардії та СН. Так, H. von Bingen (1098‑1179), чорниця, авторка містичних книг, рекомендувала вино як універсальний засіб для серця [105]. Протягом століть вивчали «добрі» й «погані» властивості алкоголю. Ще 1855 р. P. Wood розглядав його як причину СН. У 1861 р. Friedrich повідомив про гіпертрофію міокарда, що пов’язана зі зловживанням алкоголю [81]. Термін «винне серце» (wine heart) описаний 1877 р. німецьким патологоанатомом університету Тюбінгена W. Münzinger [96]. Цей патологічний стан сьогодні називають «алкогольною кардіоміопатією» з гістологічними особливостями, такими як дилатація, міофібрилярний некроз і фіброз з ультраструктурними змінами (зменшення міофібрил, зміна форми і збільшення мітохондрій) [45]. У 1884 р. O. von Bollinger описав «мюнхенське пивне серце» з фіброзом, гіпертрофією і жировою дегенерацією кардіоміоцитів при автопсії осіб, які вживали у середньому 432 л пива на рік [136]. У 1887 р. Maguire повідомив про двох хворих із тяжким зловживанням алкоголю і запідозрив, що зміни з боку серця пов’язані з його токсичним впливом [81].
У 1890 р. Strümpel припустив той факт, що зловживання алкоголем є причиною дилатації серця і гіпертрофії [81]. У 1892 р. це підтвердив W. Oslerу в підручнику «Принципи і практика медицини» (Principles and Practices of Medicine). У 1893 р. G. Steell (відомий як вчений, що описав шум Грехема Стілла за недостатності клапана легеневої артерії внаслідок легеневої гіпертензії або мітрального стенозу) повідомив про 25 випадків, у яких він визнав зловживання алкоголем однією з причин виникнення міокардіальної недостатності [126]. J. MacKenzie у своєму виданні «Дослідження серцевого ритму» (The Study of the Pulse) 1906 р. описав випадки виникнення СН внаслідок надмірного вживання алкоголю і вперше використав термін «алкогольна хвороба серця» [79]. У 1972 р. вперше в оглядовій статті W. Bridgen застосував термін «алкогольна кардіоміопатія» [18]. У 1989 р. у доповіді A. Urbano Marquez et al. показаний чіткий взаємозв’язок споживання алкоголю зі структурними і функціональними змінами міокарда та скелетних м’язів у осіб зі зловживанням [133].
Патогенез
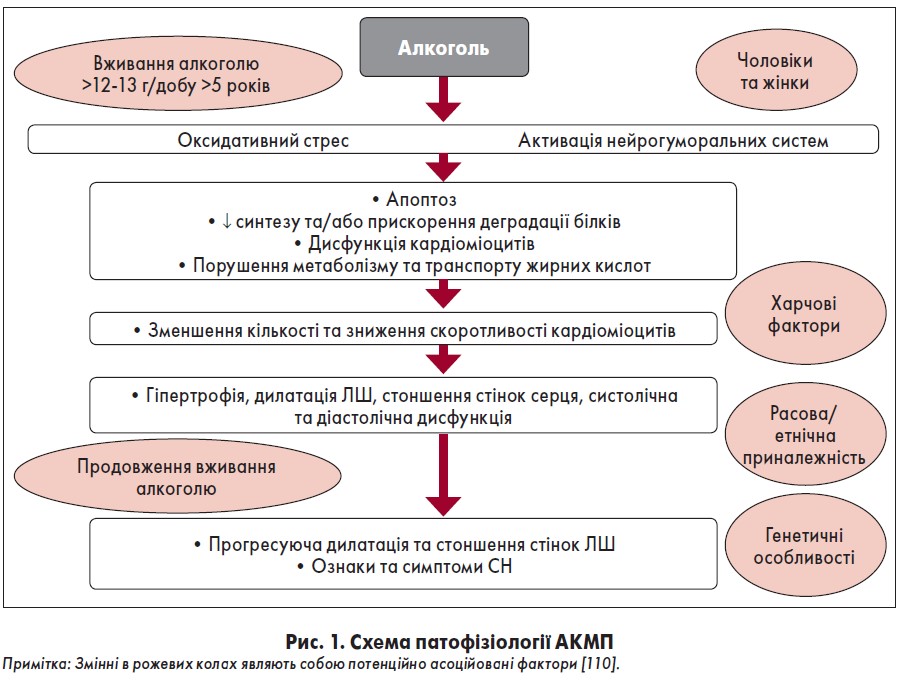
Патогенез АКМП (рис. 1) до кінця не з’ясований, патофізіологічні механізми АКМП все ще вивчаються [89]. Як зазначено вище, точна тривалість споживання та сумарна доза алкоголю, що призводять до появи АКМП у людини, є різними. Послідовність розвитку АКМП залишається неповністю зрозумілою, однак дані екпериментальних досліджень на тваринних моделях і клінічні спостереження свідчать, що оксидантний стрес, можливо, є раннім та ініціювальним процесом [110]. Необхідно підкреслити, що етанол є джерелом хімічно дуже активного та функціонально важливого метаболіту – ацетальдегіду, який відіграє ключову роль у виникненні АКМП [3, 51]. Є декілька механізмів, за допомогою яких алкоголь прямо чи опосередковано може викликати пошкодження міокарда із розвитком АКМП [11].
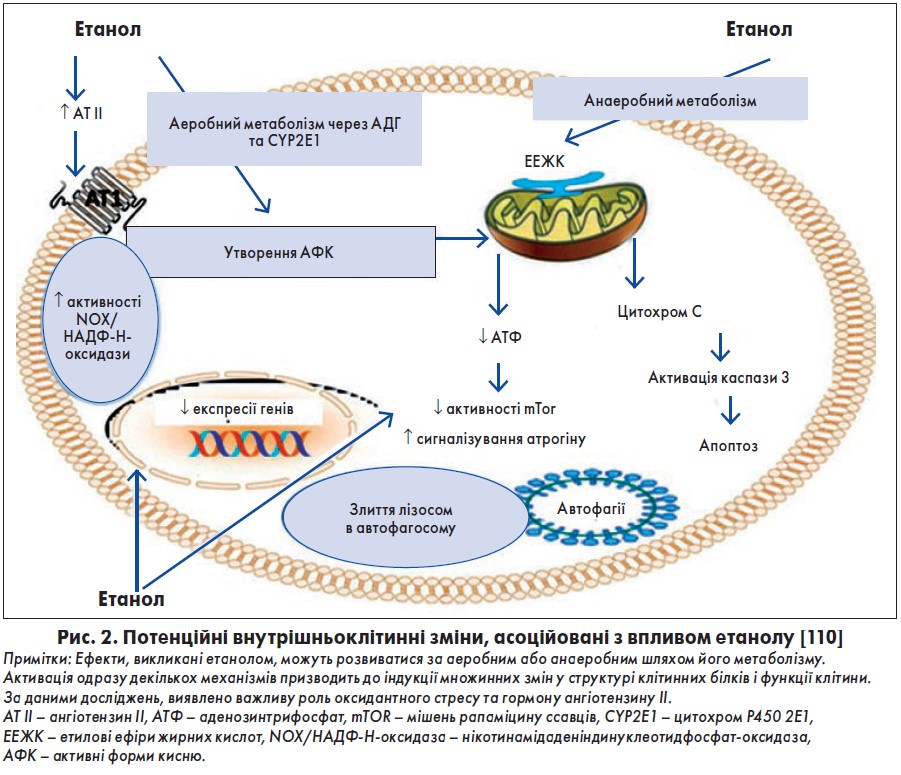
Серед них основним є прямий токсичний вплив етанолу та його метаболіту ацетальдегіду на кардіоміоцити з їхнім пошкодженням або загибеллю [11, 38]. Дія етанолу та ацетальдегіду призводить до зміни структури і функції клітин та їхніх органел, розладів внутрішньоклітинного обміну (рис. 2) [110]. Основними з них є: порушення структури і функції мітохондрій, зниження синтезу білка і прискорений його катаболізм, оксидантний стрес, посилення синтезу ліпідів і порушення обміну, транспорту жирних кислот, посилення апоптозу, зміни внутрішньоклітинного гомеостазу Са2+, дисфункція саркоплазматичного ретикулуму, зміни в регуляції аденозинтрифосфатази (АТФази) міозину, порушення синтезу і фрагментація скоротливих білків та їхня дезорганізація, розлад метаболізму ліпідів, накопичення жирних кислот у внутрішньоклітинних органелах, зниження чутливості міофібрил до Са2+, активація симпатоадреналової та ренін-ангіотензинової системи (РАС), порушення електролітного обміну (зниження рівня магнію, калію, фосфору) тощо [3, 11, 17, 24, 35, 51, 58, 61, 110, 115, 125, 135, 144].
Окрім того, відзначають прямий вплив етанолу на електромеханічне зчеплення [81]. Необхідно зауважити, що взаємодія між генетичними (асоціація з HLA-B8, алельний поліморфізм алкогольної дегідрогенази) і негенетичними факторами, такими як дефіцит тіаміну, вплив інших кардіотоксичних речовин, наприклад кокаїну, добавок до пива, які раніше використовувалися (кобальт, миш’як), відіграють важливу роль у патогенезі АКМП [48, 81]. Дослідники відмічають також індукцію експресії мРНК ANP і p21 у міокарді шлуночків серця [60]. Під впливом етанолу зростає агрегація тромбоцитів, виникає сладжування (утворення безладної, суцільної агрегації) форменних елементів крові з явищем стазу. Крім того, спостерігаються підвищення проникності мікросудин, набряк ендотеліальних клітин, аневризматичні розширення та розриви стінок, тромбоз судин [3].
Оксидантний стрес
Наявні дані свідчать, що тривале і надмірне споживання алкоголю призводить до розвитку оксидантного стресу в міокарді безпосередньо внаслідок гіперпродукції активних форм кисню (АФК) та виникнення патологічних внутрішньоклітинних змін або опосередковано після активації інших систем чи продукції біологічно активних речовин, приміром ангіотензину ІІ [36]. При зловживанні алкоголем гіперпродукція АФК і оксидантний стрес можуть розвиватися внаслідок метаболізму етанолу і накопичення ацетальдегіду, їхнього утворення в дихальному ланцюзі мітохондрій, впливу етанолу на антиоксидантні білки (наприклад, глутатіону за рахунок пригнічення його транспортних білків) та зниження активності антиоксидантних ферментів (як-то супероксиддисмутаза), активації/пошкодження нейрогормональних систем, зокрема, підвищення автоокислення катехоламінів, рівня ангіотензину ІІ і норепінефрину тощо [36].
Численні негативні внутрішньоклітинні ефекти, характерні для оксидантного стресу, при хронічному споживанні алкоголю включають наступні:
- загибель кардіоміоцитів та їхня дезорганізація [110];
- дисфункція саркоплазматичного ретикулуму і зміни гомеостазу Са2+ [110, 144];
- порушення структури, функції мітохондрій зі зміною біоенергетичних процесів [110];
- зниження активності АТФази міофібрил [110];
- зменшення чутливості міофібрил до Са2+ [110, 111];
- фрагментація скоротливих білків та їхня дезорганізація [61];
- накопичення жирних кислот у внутрішньоклітинних органеллах [58].
Накопичення АФК може викликати зміни внутрішньоклітинних органел чи процесів шляхом вільнорадикального окислення ліпідів та/або інших хімічних модифікацій структурних, цитоскелетних, транспортних білків і ферментів [27]. Також існує зв’язок між індукованим алкоголем оксидантним стресом і апоптозом при АКМП [127].
Наявність активації вільнорадикального окислення, гіперпродукції АФК й зниження активності антиоксидантних систем і рівня ендогенних антиоксидантів під дією етанолу та продуктів його метаболізму доведено даними експериментальних досліджень [25, 65, 129, 134, 144]. До того ж у щурів, яким давали алкоголь, окрім активації вільнорадикального окислення, в субепікардіальних і субендокардіальних шарах міокарда виявлене підвищене накопичення фібронектину з помірним ступенем фіброзу в 20% випадків [134]. Khanna et al. продемонстрували активацію індуцибельної форми синтази оксиду азоту (iNOS) в кардіоміоцитах щурів, які зазнавали впливу етанолу протягом одного місяця (13 г/добу, дієта Lieber-DeCarli) [65]. Як відомо, підвищений рівень iNOS може призвести до утворення супероксиду і пероксинітриту [56]. У тварин, яким давали етанол, відмічали зниження скоротливості міокарда та відповіді на адренергічні стимули, фіброз міокарда і дезорганізацію кардіоміоцитів АКМП [61, 65]. Ці зміни запобігали використанням валсартану (блокатора рецепторів ангіотензину II) або антиоксиданту карнітину, що свідчить про роль ангіотензину II та оксидантного стресу в пошкодженні міокарда при АКМП [61]. Окрім того, виявлено етанол-індуковане накопичення колагену і фібронектину, загибель апоптотичних клітин і ремоделювання шлуночків [129].
Показано, що захисна дія антиоксидантної системи починається незабаром після вживання етанолу. Однак одночасно відзначали зміни структури або функції серця, що може свідчити про потенційний причинно-наслідковий зв’язок між оксидантним стресом і розвитком АКМП [110]. На додаток, дані досліджень продемонстрували захисну роль введення антиоксидантів, таких як супероксиддисмутаза, вітамін Е або IGF‑1, чи агентів, які зменшують активність цитохрому Р450 2Е1 (CYP2E1) або пригнічують дію ангіотензину II, що може вказувати на пряму чи опосередковану роль оксидантного стресу в пошкодженні міокарда [110].
Апоптоз
При АКМП відзначають посилення апоптозу, що призводить до загибелі кардіоміоцитів і може розвиватися внаслідок вільнорадикального окислення ліпідів у багатьох органах і системах, зокрема серці [38, 60, 97]. Апоптоз кардіоміоцитів у осіб із тривалою історією надмірного вживання алкоголю може бути важливим компонентом розвитку дисфункції органів і патологічних станів/захворювань, включно з АКМП [97, 110]. Це підтверджують результати дослідження, за якими тривале і постійне споживання надмірної кількості алкоголю може призвести до апоптотичної загибелі клітин і, як наслідок, виникнення АКМП [33].
Chen et al. оцінювали дію різних концентрацій алкоголю – 500 і 1000 мг/дл – на кардіоміоцити. Обидві потенціювали апоптоз клітин, при цьому відзначалося підвищення рівня проаптотичного білка Bax (сигнальний білок апоптозу) та активності каспази 3 (відноситься до родини внутрішньоклітинних протеаз, що активуються при апоптозі). Крім того, було виявлено, що інсуліноподібний фактор росту 1 (IGF‑1) частково пригнічував індукцію білка Bax, активацію каспази 3, фрагментацію ДНК, підвищував виживаність кардіоміоцитів і, таким чином, послаблював вплив етанолу на процеси апоптозу [23].
За даними дослідження на щурах, яким давали різні дози алкоголю протягом 4‑5 місяців, встановлено, що серед тих, на які впливали низькі дози, зменшувалася активність каспази 3 (як маркера апоптозу) зі збереженням чи підвищенням скоротливості міокарда. Що стосується групи щурів, яким давали високі дози алкоголю, відзначалося підвищення активності каспази 3 і зниження скоротливості міокарда [121].
Tan et al. в експериментальному дослідженні відмітили апоптотичну загибель клітин у мишей дикого типу після 2-місячного вживання етанолу (дієта Lieber-DeCarli) й активацію каспази 3. Однак ці зміни не були виявлені у мишей із нокаутом гена рецептора 1-го типу ангіотензину II (ATI-KO). Також, за даними ЕхоКГ, споживання етанолу в групі мишей дикого типу було пов’язане з дилатацією ЛШ [129].
Порушення функції/структури мітохондрій
Доведено, що порушення функції/структури мітохондрій можуть сприяти як розвитку, так і прогресуванню АКМП [110]. Наявні численні докази виникнення мітохондріальної дисфункції та порушення енергоутворення в кардіоміоцитах при дослідженні впливу етанолу на серце. Прикладом цього може слугувати зміна мітохондріальної ультраструктури та/або пригнічення енергоутворення й окисного фосфорилювання. Це відбувається через те, що мітохондрії є основною мішенню при оксидантному стресі [83, 110]. Доведено, що як за разового, так і хронічного введення етанолу послаблюється активність дихального ланцюга мітохондрій [3]. Етанол та ацетальдегід впливають на енергоутворення в кардіоміоциті. Гальмується активність НАД-залежних гідрогеназ, ферментів електронно-транспортного ланцюга мітохондрій, пригнічується їхня дихальна функція, розвивається гіпоксія міокарда, активується анаеробний гліколіз. Зниження енергоутворення, активності Са2+-залежної АТФази, а також Са2+-транспортної системи ендоплазматичної мережі спричиняють порушення біомеханіки серця [3]. Дисфункціональні мітохондрії не лише пов’язані з генерацією АФК та є біоенергетично менш ефективними, але і, ймовірно, ініціюють апоптоз. Крім того, мітохондріальна ДНК чутливіша до оксидантного стресу [83].
При оцінюванні біоптатів міокарда пацієнтів, що зловживали алкоголем, відмічали збільшення мітохондрій та їхню дезорганізацію, а також дегенерацію крист [11]. Аналіз зразків автопсії в осіб з АКМП показав атрофію міофібрил, збільшення мітохондрій, розширення саркоплазматичного ретикулуму, зростання кількості лізосомно-подібних структур, а також ознаки мітохондріозу [135]. Однак слід відзначити, що, на відміну від вищезгаданих досліджень, Mirόet al. не виявили даних мітохондріального пошкоження, зокрема ознак вільнорадикального окислення ліпідів. Подібні розбіжності можуть бути наслідком таких факторів, як тривалість вживання алкоголю, ступінь дисфункції міокарда та медикаментозна терапія [91].
Згідно з даними дослідження виявлено, що підвищений рівень етилових ефірів жирних кислот у міокарді нерідко порушує функцію мітохондріального дихання [16]. Результати іншого експериментального випробування показали, що етанол може опосередковувати зміни мітохондріальної функції на геномному рівні внаслідок зміни експресії генів мітохондріальних білків [44].
Порушення метаболізму і транспорту жирних кислот
Результати досліджень демонструють несприятливий вплив на міокард зміненого метаболізму і транспорту жирів при зловживанні алкоголем [16, 58]. При низці індукованих алкоголем патологій, таких як цироз і стеатоз печінки, виявляли порушення в обміні та транспорті жирних кислот. Накопичення етилових ефірів жирних кислот (ЕЕЖК) було встановлено при індукованому етанолом клітинному пошкодженні. ЕЕЖК – це продукти етерифікації етанолу та жирних кислот [110]. Було продемонстровано значне збільшення вмісту ЕЕЖК у міокарді при автопсії у пацієнтів, які тривало зловживали алкоголем, що може чинити несприятливий вплив на функцію мітохондрій [11, 110]. Підвищення частки ЕЕЖК та зміни активності синтази жирних кислот можуть виступати механізмами розвитку AКМП [16].
Hu et al. виявили дозозалежне підвищення тригліцеридів, значною мірою ЕЕЖК, та зниження на 30% рівня АТФ у кардіоміоцитах мишей, які отримували етанол протягом чотирьох тижнів порівняно з групою контролю. Також мало місце зменшення скоротливості міокарда (ФВ ЛШ), що негативно корелювало з рівнем тригліцеридів [58].
Прискорений катаболізм білків і автофагія
Наявні дані, що тривалий вплив етанолу знижує синтез білка у міокарді та прискорює його деградацію. Ці зміни можуть бути ключовим патофізіологічним механізмом, який лежить в основі несприятливого впливу етанолу на міокард [72]. Fogle et al. досліджено вплив 16-тижневого споживання етанолу на білки кардіоміоцитів у щурів та, зокрема, виявлено зменшення синтезу білків міофібрил (міозину і актину приблизно на 39%), мітохондрій (десь на 30‑40% мітохондріальних дегідрогеназ та електронно-транспортних білків) і вмісту антиоксидантних ферментів [44]. Вживання алкоголю асоційоване зі зниженням скоротливої функції міокарда [50]. Так, Meehan et al. відзначили, що навіть короткочасний його прийом призводить до зміни ізоформ міозину і скорочення активності АТФази [85].
Індуковане етанолом зменшення синтезу білка в міокарді частково опосередковане зниженням активності у ссавців центрального протеїнкіназного комплексу mTOR (мішені рапаміцину ссавців) [73]. Кіназа mTOR регулює ріст, проліферацію, виживання клітин, синтез білка і транскрипцію тощо [28]. Подібно до інших захворювань, пов’язаних з атрофією м’язів, індуковані етанолом зниження та порушення регуляції активності mTOR можуть залучатися до зменшення синтезу білка у міокарді, витончення стінки шлуночків та їхньої дилатації [110].
Окрім того, зміни білкового метаболізму також можуть бути викликані прискореною деградацією білка [74]. За даними експериментальної роботи виявлено, що споживання алкоголю протягом 20 тижнів призвело до підвищення синтезу атрогіну‑1 і MuRF‑1. У цьому ж дослідженні встановлено збільшення маркерів автофагії та зниження активності mTOR [72].
Автофагія – катаболічний механізм, який здійснюється лізосомами та є важливим для деградації непотрібних або пошкоджених внутрішньоклітинних білків, таким чином зберігаючи клітину здоровою. Цей механізм також має значення для виживання клітин і організму під час стресу й депривації поживних речовин. Є докази того, що за деяких патологічних станів, для яких характерне підвищення рівня ангіотензину ІІ, як-то СН, кардіоміопатія і гіпертрофія міокарда, спостерігається підвищення процесів автофагії [52]. Цікаво, що прийом ангіотензину II індукує атрофію скелетних м’язів у гризунів, і механізми включають підвищену експресію Е‑3-лігази атрогін‑1/MuRF‑1 [128].
Існують докази щодо істотної ролі автофагії у регуляції структури і функції серця [143]. Guo et al. в експериментальному дослідженні на мишах показали, що споживання етанолу упродовж восьми тижнів було пов’язане з посиленням автофагії у кардіоміоцитах. На додачу, ацетальдегід призводив до порушення скоротливої здатності кардіоміоцитів та індукції автофагії з утворенням автофагосом разом із порушенням лізосомної деградації, що, ймовірно, спричиняло ураження міокарда [50]. Гіпотеза про те, що підвищена автофагія є можливим механізмом, який лежить в основі несприятливого ефекту етанолу на міокард, є дуже цікавою, особливо з огляду на взаємозв’язок mTOR та автофагії. Відомо, що через активацію mTOR відбувається пригнічення автофагії. Хронічний вплив алкоголю призводить до зниження активності mTOR і підвищення автофагії [73]. Крім того, процеси автофагії швидко посилюються при виснаженні АТФ, мітохондріальній дисфункції та оксидантному стресі. Таким чином, опосередковане етанолом посилення автофагії може бути важливим механізмом, що лежить в основі негативного впливу етанолу на міокард [110]. З іншого боку, підвищення автофагії може призводити до аномального видалення внутрішньоклітинного білка, оксидантного стресу, зниження продукції АТФ, порушення клітинних катаболічних процесів, загибелі кардіоміоцитів [104].
Активація РАС
Активація РАС може сприяти розвитку АКМП. Шестимісячне споживання алкоголю викликало стійку активацію РАС із прогресуючим підвищенням рівнів у плазмі крові ангіотензину II, активності реніну, ангіотензинперетворювального ферменту (АПФ) та експресії рецепторів ангіотензину ІІ типу І в кардіоміоцитах собак. Активація РАС супроводжувалася прогресуючим зниженням скорочувальної здатності ЛШ. Слід відзначити, що застосування блокатора рецепторів ангіотензину ІІ ірбесартану запобігало зменшенню індукованого алкоголем скорочення кардіоміоцитів [24].
Поліморфізм генів АПФ
У розвитку АКМП можлива роль поліморфізму генів АПФ. Рівні АПФ у плазмі крові та серці у 1,5‑3 рази вищі в пацієнтів із генотипом DD гена АПФ порівняно з такими з генотипом II; вони є проміжними в осіб із генотипом ID. Генотип DD гена АПФ асоційований із підвищеним ризиком низки серцевих розладів, включно з гіпертрофією ЛШ, ідіопатичною ДКМП і, ймовірно, АКМП. У дослідженні 30 чоловіків із симптоматичною кардіоміопатією порівнювали з 27 чоловіками з нормальною функцією серця, усі вони зловживали алкоголем. Генотип DD був набагато поширенішим серед таких із АКМП (57 та 7% відповідно). Відношення шансів (ВШ) розвитку дисфункції ЛШ в осіб, що зловживали алкоголем із генотипом DD порівняно з ID, становило 16,4 [40].
Структурно-функціональні зміни в міокарді при АКМП
Як було викладено вище, за даними досліджень, при АКМП у міокарді спостерігається низка несприятливих клітинних, структурних і функціональних змін під впливом етанолу і ацетальдегіду. Це оксидантний стрес, апоптотична загибель клітин, порушення гомеостазу кальцію, мітохондріальної біоенергетики та обміну і транспорту жирних кислот, модифікація скоротливих білків, прискорений катаболізм білка тощо, що призводить до дисфункції внутрішньоклітинних структур і фіброзу [16, 110]. Окрім прямого впливу, етанол і його метаболіти здатні порушувати процеси збудження та скорочення, зменшувати синтез АТФ, міофібрилярних білків і спричиняти зміну експресії генів різних ізоформ міозину, що призводить до пригнічення скоротливості міокарда [67, 80]. Ці внутрішньоклітинні ефекти пов’язані з активацією симпатоадреналової системи та РАС, продукції цитокінів, які є складовими патогенезу АКМП і зумовлюють гіпертрофію кардіоміоцитів, збільшення маси ЛШ, дилатації та дисфункції ЛШ, зниження серцевого викиду [75, 108]. Lang et al. відмічали ультраструктурні зміни скорочувального апарату міокарда внаслідок зниження синтезу білка, зокрема і міофібрилярних білків, після експозиції етанолом, що призводило до зниження скоротливості міокарда [71, 106].
Фіброз міокарда безперечно впливає на його ремоделювання при АКМП. За експериментальними даними, при культивуванні фібробластів, виділених із серця щурів, у розчині, що містить 100 мг/дл етанолу, вже через 24 годин спостерігалася активація фібробластів, підвищувався синтез колагену I типу та трансформувального фактора росту β (TGF-β – цитокін, що індукує апоптоз) [76]. В іншому експерименті на мишах прийом 4% розчину етанолу протягом шести тижнів сприяв розвитку скоротливої дисфункції ЛШ, фіброзу і апоптозу кардіоміоцитів, причому ці процеси супроводжувалися підвищенням фосфорилювання cJun-NH(2)-термінальної протеїнкінази (JNK) і кінази 1 (ASK‑1 – апоптоз сигнал-регулювальної кінази 1) [143].
Структурні зміни залежать від стадії захворювання [115]. Рання характеризується просторовою перебудовою мітохондріального ретикулуму; міжмітохондріальні переходи зникають, а мітохондрії утворюють окремі кластери, рівномірно розподілені в межах кардіоміоцитів. На пізній стадії розвиваються деструктивні незворотні зміни в ультраструктурній організації мітохондрій. З’являються мегамітохондрії та такі, що розділені мембраною. У мітохондріях спостерігають багато гранул ліпофусцину внаслідок накопичення ліпідів у мітохондріях [115].
Ультраструктурні зміни при АКМП включають некроз та фіброз міофібрил з їхнім зменшенням, дезорганізацію міофібрил і наявність гігантських мітохондрій [81]. Однак ці дані є неспецифічними і не допомагають при проведенні диференційної діагностики АКМП з іншими формами ДКМП [37].
При гістохімічному дослідженні відзначали накопичення ліпідів у м’язових волокнах, зміни ферментативної активності в міокарді. Виявлено зниження активності більшості окисно-відновних мітохондріальних ферментів, нормальної або підвищеної активності малатдегідрогенази, підвищеної активності лізосомальних і мікросомальних ферментів. Проте такі зміни майже ідентичні тим, які спостерігаються у пацієнтів з ідіопатичною ДКМП [115].
Клінічна картина
Варто зауважити, що тривалий час АКМП може перебігати безсимптомно, клінічні прояви відзначають при тяжкому та незворотному пошкодженні серця. Окрім того, часто пацієнти приховують свою залежність від алкоголю впродовж тривалого часу [37].
Перебіг АКМП характеризується двома стадіями на підставі наявності/відсутності у хворих ознак/симптомів застійної СН:
- у доклінічній (асимптоматичній) відсутні симптоми (відзначають гіпертрофію, збільшення маси, діастолічну дисфункцію ЛШ) [77, 108, 115];
- у клінічній (симптоматичній) наявні симптоми СН унаслідок розвитку систолічної дисфункції ЛШ [37, 77, 88, 108, 115].
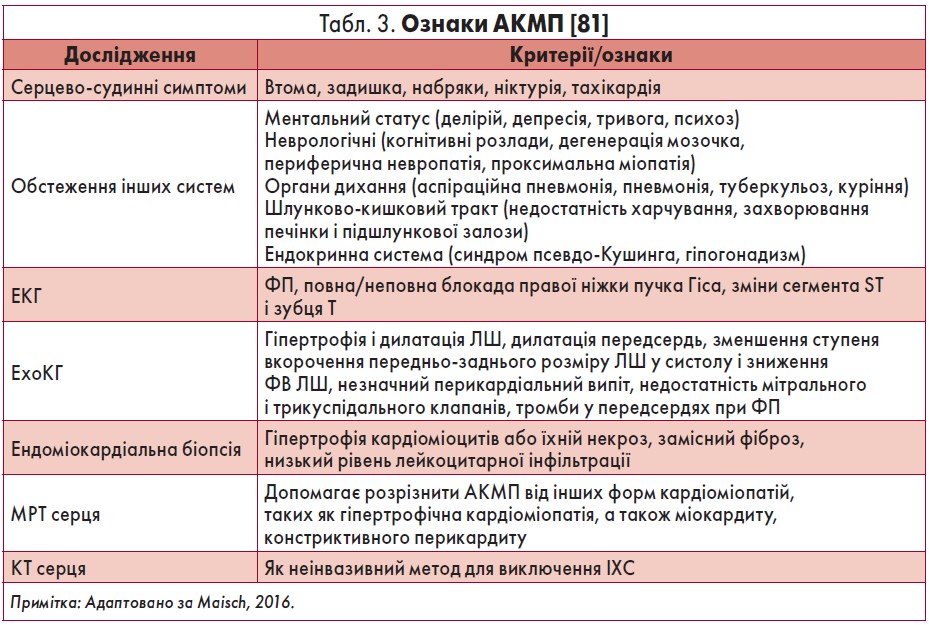
У таблиці 3 наведені основні критерії/ознаки АКМП [81].
При АКМП симптоми не є специфічними. Для цього захворювання притаманні ознаки чи симптоми ДКМП будь-якої етіології: ознаки застійної СН, порушення ритму і провідності серця [67, 88, 115, 120]. Симптоми розвиваються поступово, хоча у деяких пацієнтів СН може виникати гостро. Часто відзначають задишку, втомлюваність, ортопное, пароксизмальну нічну задишку. Іноді відмічають серцебиття, синкопе при тахіаритміях, переважно суправентрикулярних, зокрема ФП. Стенокардію не спостерігають, якщо немає супутньої ІХС або аортального стенозу [115]. При фізикальному обстеженні можна виявити набухання яремних вен, кардіомегалію, протодіастолічний (S3) і пресистолічний (S4) ритм галопу, систолічний шум мітральної недостатності, хрипи в легенях, асцит, периферичні набряки [37, 53, 67, 75, 115]. Prazak et al. показали, що у пацієнтів з АКМП нетяжка СН є зворотною, якщо пацієнти утримуються від прийому алкоголю. Однак наявність ознак ліво- і правошлуночкової СН, а також розміри ЛШ були прогностичними ознаками фатальних наслідків [114]. Слід відзначити, що, незважаючи на медикаментозну терапію, СН III‑IV ФК за NYHA була у 52% пацієнтів з АКМП та у 47% – з ідіопатичною ДКМП [114]. Окрім того, у таких хворих можуть бути наявні ознаки патології печінки, периферичної невропатії та інших неврологічних розладів (наприклад, синдром Верніке – Корсакова), недостатнього харчування тощо [10].
В осіб з АКМП можуть розвиватися порушення ритму і провідності серця, зокрема блокада лівої ніжки пучка Гіса [54]. Найпоширенішими є суправентрикулярні аритмії, особливо ФП, але також нерідко виникають шлуночкові аритмії, серед яких шлуночкова тахікардія (ШТ), фібриляція шлуночків (ФШ) [24, 34, 35, 38, 66, 75, 110]. Так, у 5% пацієнтів з АКМП спостерігали ФШ [54]. За даними Mukamal, споживання ≥35 доз алкоголю на тиждень у чоловіків пов’язане з розвитком ФП: коефіцієнт ризику – 1,45; 95% довірчий інтервал (ДІ) 1,02‑2,04. Таким чином, тяжке споживання алкоголю асоційоване з більшою ймовірністю виникнення ФП, принаймні серед чоловіків [94]. Слід зауважити, що за відмови від алкоголю відзначали відсутність ФП [66]. У дослідженні Kaiser Permanente Study частота передсердних аритмій у 1322 пацієнтів, які вживали >6 доз алкоголю за добу, була співставна з такою серед 2644 осіб, які споживали незначну його кількість, що свідчить про подвоєний ВР розвитку передсердних аритмій при тяжкому зловживанні алкоголем [66]. Зазначимо, що відмова від алкоголю знижує частоту аритмічних подій [35].
За результатами дослідження Fauchier, поширеність передсердних аритмій, стійкої чи нестійкої ШТ достовірно не відрізняється у жодній групі пацієнтів з ідіопатичною ДКМП і АКМП. Дослідження показало, що в осіб з ідіопатичною ДКМП і АКМП, які не відмовилися від вживання алкоголю, прогноз щодо основних аритмічних подій (раптова смерть, стійка ШТ і ФШ) подібний, а у суб’єктів з АКМП, які відмовилися від нього, прогноз набагато кращий (шлуночкові порушення ритму серця спостерігали тільки у 2% за період спостереження 51±42 місяці). У пацієнтів з АКМП, що продовжували вживати алкоголь, порівняно із тими, хто відмовився, ВР раптової смерті й основних аритмічних подій (стійка ШТ і ФШ) складав 8,0 (логранговий критерій, p=0,01) та 7,3 для осіб з ідіопатичною ДКМП (логранговий критерій, p=0,03). Таким чином, прогноз хворих на ідіопатичну ДКМП і осіб з АКМП, що продовжують вживати алкоголь, однаковий щодо розвитку шлуночкових порушень ритму серця. Проте відмова від алкоголю пацієнтами з АКМП асоційована зі значним покращанням прогнозу стосовно розвитку раптової смерті, що, можливо, пов’язано з поліпшенням функції ЛШ. Це є вагомим аргументом на користь агресивного підходу щодо припинення вживання алкоголю в осіб з АКМП [35].
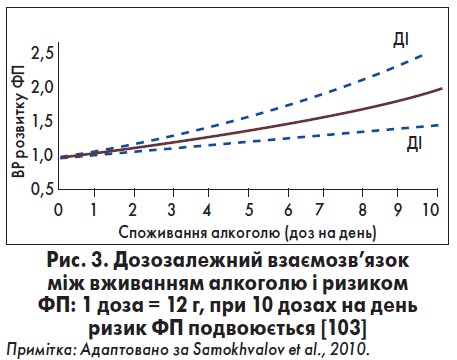 Згідно з даними дослідження (рис. 3) показано, що споживання ≤2 доз алкоголю на день у жінок суттєво не пов’язане з ризиком виникнення ФП порівняно з особами, які не вживають алкоголь. З іншого боку, в жінок, які вживали >2‑3 доз алкоголю щодня, спостерігали збільшення вірогідності розвитку ФП на 17% (ВР 1,17; 95% ДІ 1,01‑1,36; p=0,032), тоді як серед тих, хто споживав >4 доз щодня, – дворазове підвищення ризику ФП (ВР 2,18; 95% ДІ 1,38‑3,43; p=0,001). Серед чоловіків споживання алкоголю до 3 доз щодня не асоціювалося з більшою ймовірністю виникнення ФП. Однак споживання алкоголю >3‑4 доз на день було пов’язане з підвищеним ризиком ФП (ВР 1,25; 95% ДІ 1,01‑1,55; p=0,045), як і >4 доз щодня (ВР 1,53; 95% ДI 1,23‑1,91, р=0,0001) порівняно з тими, хто не вживав алкоголь [123].
Згідно з даними дослідження (рис. 3) показано, що споживання ≤2 доз алкоголю на день у жінок суттєво не пов’язане з ризиком виникнення ФП порівняно з особами, які не вживають алкоголь. З іншого боку, в жінок, які вживали >2‑3 доз алкоголю щодня, спостерігали збільшення вірогідності розвитку ФП на 17% (ВР 1,17; 95% ДІ 1,01‑1,36; p=0,032), тоді як серед тих, хто споживав >4 доз щодня, – дворазове підвищення ризику ФП (ВР 2,18; 95% ДІ 1,38‑3,43; p=0,001). Серед чоловіків споживання алкоголю до 3 доз щодня не асоціювалося з більшою ймовірністю виникнення ФП. Однак споживання алкоголю >3‑4 доз на день було пов’язане з підвищеним ризиком ФП (ВР 1,25; 95% ДІ 1,01‑1,55; p=0,045), як і >4 доз щодня (ВР 1,53; 95% ДI 1,23‑1,91, р=0,0001) порівняно з тими, хто не вживав алкоголь [123].
Споживання алкоголю, гостре або хронічне, впливає на електричну активність серця [123]. Крім прямої кардіотоксичності алкоголю, дилатації передсердь, ремоделювання лівого передсердя внаслідок АГ (яка своєю чергою асоційована з алкоголем), проаритмогенний ефект може виникати внаслідок гіперадренергічної активності під час вживання алкоголю та абстиненції, зміни тонусу блукаючого нерва та порушення процесів збудження і проведення тощо [15, 81, 124, 125]. До того ж гіпомагніємія і гіпокаліємія, які з підвищеною частотою спостерігають в осіб, що хронічно зловживають алкоголем, можуть бути факторами, які сприяють розвитку аритмій [35]. Подовження коригованого інтервалу QTc на електрокардіографії (ЕКГ), що є фактором ризику розвитку шлуночкових аритмій, виявлене у значної частки осіб, що зловживають алкоголем, порівняно з тими, хто не зловживає [115]. Кожний з описаних вище факторів призводить до зміни швидкості провідності або скорочення рефрактерного періоду. Таким чином, у сукупності вони сприяють розвитку мікроріентрі, що є основним механізмом виникнення ФП [15, 123].
Діагностика
У зв’язку з тим, що відсутні специфічні клінічні ознаки чи біомаркери та гістологічні, імуногістохімічні, імунологічні або інші критерії діагностики АКМП, вона досі ґрунтується на виключенні інших причин ДКМП у пацієнта з надмірним і тривалим анамнезом вживання алкоголю та наявності ознак чи симптомів СН [34, 46, 53, 108, 114, 115]. Ключовим фактором у діагностиці АКМП є тривалий анамнез тяжкого зловживання алкоголем за відсутності ІХС або інших захворювань серця (зокрема, міокардиту). Він відіграє важливу роль, оскільки полегшує виключення інших причин ДКМП, як-от застосування кокаїну, препаратів антрацикліну та наявність патологій серця, що асоційовані з ішемією міокарда [47, 88, 110]. Як було сказано вище, надмірне приймання алкоголю може бути виявлене приблизно в 40% випадків розвитку ДКМП [34, 46, 54, 108, 144]. За результатами більшості досліджень, щоденне споживання понад 80 г алкоголю протягом принаймні п’яти років поспіль є порогом для встановлення діагнозу АКМП [34, 46, 62, 114]. Однак ці порогові значення не підтверджені достатньою кількістю епідеміологічних або експериментальних даних [53].
Окрім того, при встановленні діагнозу АКМП допомагають критерії, викладені у Діагностичному і статистичному посібнику із психічних розладів 5-го видання (DSM-5), та консультація фахівця з лікування алкогольної залежності [13, 89].
Лабораторні тести
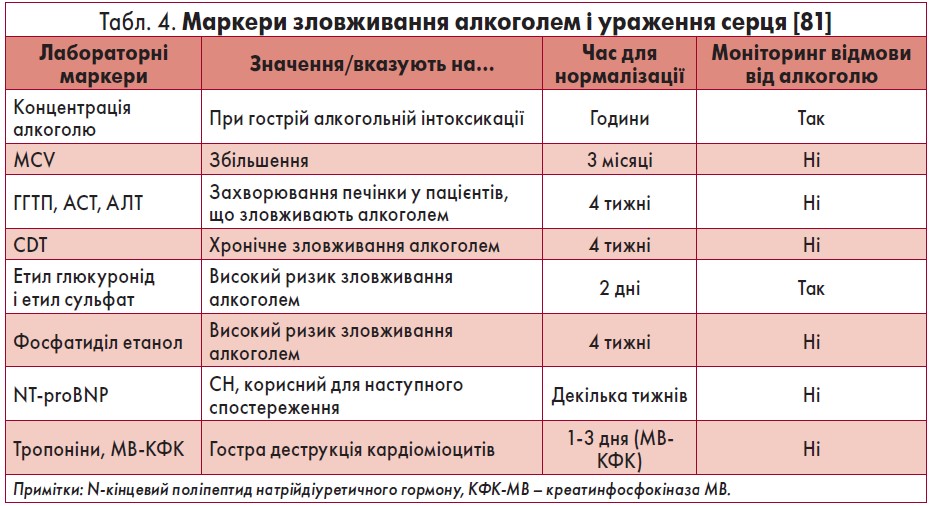
Незважаючи на те що рутинні лабораторні тести не є діагностично специфічними при АКМП, вони допомогають виявити зміни, які можуть свідчити про зловживання алкоголем серед пацієнтів із ДКМП. Для підтвердження зловживання алкоголем, коморбідної патології печінки можна використовувати такі дослідження крові, як визначення рівня гамма-глутамілтранспептидази (ГГТП), вуглевод-дефіцитного трансферину й етил глюкуроніду, середнього корпускулярного об’єму еритроцитів (MCV) тощо (табл. 4) [10, 81].
Підвищення аспартатамінотрансферази (АСТ), аланінамінотрансферази (АЛТ), особливо співвідношення АСТ/АЛТ більш ніж удвічі може свідчити про алкогольну хворобу печінки. Кращим маркером, що вказує на хронічне споживання алкоголю, є вуглевод-дефіцитний трансферин (CDT) або у комбінації з іншими ферментами, такими як ГГТП [14, 26]. Дослідження показників, як-то етил сульфат, фосфатиділ етанол та ефіри жирних кислот, рутинно не проводиться [81].
Інструментальні методи дослідження
Зміни на ЕКГ не є специфічними. У пацієнтів з АКМП спостерігають неспецифічні зміни сегмента ST та/або зубця T, порушення ритму серця [75].
ЕхоКГ допомагає виключити інші причини СН та виявити, зокрема, гіпертрофію, дилатацію, діастолічну та систолічну дисфункцію ЛШ, які протягом років можуть передувати настанню клінічних проявів [37, 77]. Ранніми змінами при АКМП є гіпертрофія міокарда та діастолічна дисфункція ЛШ, яка зазвичай передує систолічній дисфункції [41, 81, 115]. Так, приблизно у половини безсимптомних хворих на АКМП відзначають незначну гіпертрофію ЛШ за відсутності зниження скоротливості міокарда [115]. Ступінь діастолічної дисфункції пов’язаний із тривалістю тяжкого вживання алкоголю, що було найбільш очевидним в осіб, що зловживали алкоголем понад 16 років [77]. Як вже зазначалося, функція ЛШ порушена у багатьох безсимптомних пацієнтів, які зловживали алкоголем, або таких із цирозом печінки [32]. Крім того, для АКМП характерні збільшення маси ЛШ, дилатація порожнин серця, нормальна/знижена товщина стінок і дисфункція ЛШ, зокрема зменшення ФВ ЛШ [47, 108].
За даними дослідження Rajzer et al., хронічне зловживання алкоголем значно погіршує діастолічну функцію ЛШ незалежно від впливу на артеріальний тиск та масу міокарда ЛШ. Також зниження систолічної функції ЛШ суттєво пов’язане з рівнем і тривалістю вживання алкоголю [116].
У чоловіків і жінок часте споживання алкоголю асоціювалося з більшими кінцево-діастолічним і кінцево-систолічним діаметрами ЛШ і діаметром лівого передсердя (р<0,05). У чоловіків підвищення вживання алкоголю було пов’язане з більшою масою ЛШ і вищим співвідношенням Е/е´, а в жінок – із меншою ФВ ЛШ і тенденцією до погіршення глобальної поздовжньої деформації ЛШ [48]. За даними Reant et al., у здорових осіб після гострої алкогольної інтоксикації через 4‑6 годин спостерігали збільшення кінцево-діастолічного (108,3±20,1 мл проти 95,5±14,6 мл, р=0,037) і кінцево-систолічного (41,6±11,4 мл проти 33,7±6,9 мл, р=0,024) об’ємів ЛШ порівняно з контрольною групою. Визначення поздовжньої глобальної систолічної деформації ЛШ при проведенні спекл-трекінг ЕхоКГ дозволяє рано виявити порушення скоротливості ЛШ порівняно з таким ФВ ЛШ [117].
Рентгенографія органів грудної клітки допомагає виявляти кардіомегалію, застій у легенях та плевральний випіт [90].
Ендоміокардіальна біопсія на практиці зазвичай не виконується у разі наявності анамнезу тривалого і надмірного вживання алкоголю [81]. За даними дослідження 7 пацієнтів з анамнезом зловживання алкоголем, виявлений гемохроматоз у 2 випадках, амілоїдоз – в 1, доксорубіцин-асоційована токсичність – в 1 і АКМП – у 3 [101].
Диференційна діагностика
Диференційна діагностика грунтується на виключенні інших причин ДКМП. Діагноз АКМП встановлюється переважно у пацієнтів з анамнезом тяжкого і тривалого споживання алкоголю [101].
Вплив відмови від зловживання алкоголем на перебіг АКМП
Необхідність повної відміни алкоголю при АКМП залишається суперечливою темою [34, 46, 53, 93, 114]. Проте у низці досліджень отримані дані про зв’язок між відмовою від алкоголю та зниженням ризику AКМП [113]. Окрім того, показано, що перебіг АКМП покращується у пацієнтів, котрі припинили вживати алкоголь [34, 35, 46, 49]. Однак результати інших випробувань продемонстрували, що повна відмова від алкоголю не є вкрай необхідною для підвищення ФВ ЛШ [100]. Так, протягом року спостереження підвищення ФВ ЛШ було однаковим у тих пацієнтів, які відмовилися і контролювали приймання алкоголю (20‑60 г етанолу на добу). І навпаки, у тих, хто продовжував зловживати алкоголем (>80 г/добу), відзначали наступне погіршення ФВ ЛШ. Смертність останньої групи пацієнтів з АКМП за чотири роки склала 18,18%. Однак, оскільки не можна легко виміряти або контролювати споживання алкоголю, найбільш доцільною тактикою є припинення вживання алкоголю [100]. На думку Addorado et al., така відмова є золотим стандартом у лікуванні індукованих алкоголем мультисистемних уражень, а доказів щодо кореляції між зниженням його споживання та поліпшенням функції серця недостатньо [10].
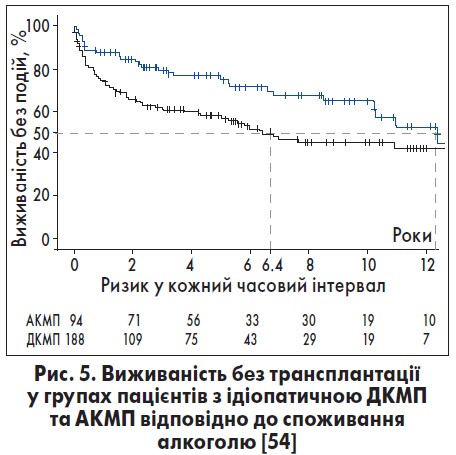
 Потенційна ефективність відмови від алкоголю ілюструється наступними даними. За середній період спостереження (59 місяців) смертність хворих на АКМП складала 30,2%; 13,3% перенесли трансплантацію серця. Семирічна виживаність без трансплантації серця була нижчою з-поміж пацієнтів, що вживали алкоголь – 41%, ніж у таких з ідіопатичною ДКМП – 53% (p=0,026) і значно нижчою в осіб з АКМП, які продовжували зловживати алкоголем, ніж у таких з ідіопатичною ДКМП і АКМП, котрі відмовилися від нього (27, 53 і 45% відповідно) [46].
Потенційна ефективність відмови від алкоголю ілюструється наступними даними. За середній період спостереження (59 місяців) смертність хворих на АКМП складала 30,2%; 13,3% перенесли трансплантацію серця. Семирічна виживаність без трансплантації серця була нижчою з-поміж пацієнтів, що вживали алкоголь – 41%, ніж у таких з ідіопатичною ДКМП – 53% (p=0,026) і значно нижчою в осіб з АКМП, які продовжували зловживати алкоголем, ніж у таких з ідіопатичною ДКМП і АКМП, котрі відмовилися від нього (27, 53 і 45% відповідно) [46].
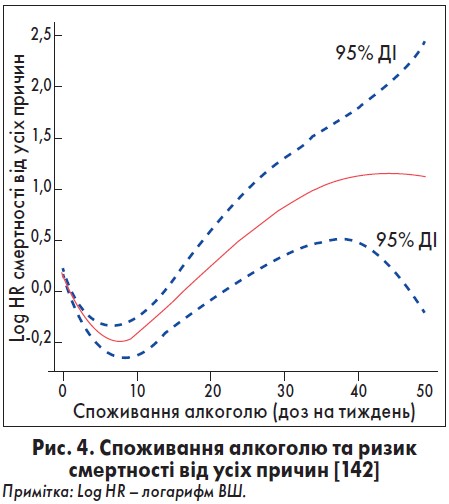
За даними Guillo et al., у більшості пацієнтів з АКМП і тяжкою СН, що відмовилися від алкоголю, відмічали значне покращення перебігу АКМП після шести місяців спостереження [49]. Це підтверджують результати дослідження, за якими в осіб з АКМП, які припинили вживання алкоголю, спостерігали значне підвищення ФВ ЛШ, а стійке його зловживання корелювало з гіршим прогнозом [46]. За даними Xi et al., у хворих, котрі вживали алкоголь у високих дозах, відмічали значне підвищення ризику смертності від усіх причин (рис. 4) [142]. ФВ ЛШ у пацієнтів з АКМП, які утримувалися від прийому алкоголю, значно покращилася через шість місяців спостереження (середнє значення становило 37% порівняно з вихідною ФВ ЛШ 22%) з наступним її підвищенням через 36 місяців (середнє значення – 43%) [49].
В осіб з АКМП, що зменшили вживання алкоголю до помірного рівня, відзначали кращі наслідки, ніж при ідіопатичній ДКМП. Результати були схожі з такими у пацієнтів з АКМП, які повністю відмовилися від алкоголю (рис. 5). До того ж ФВ ЛШ за час спостереження збільшилася як у хворих, котрі припинили споживати алкоголь, так і в тих, що знизили його приймання до помірного рівня [54]. Ці дані подібні до описаних у дослідженні, яке свідчить про те, що низьке/помірне споживання алкоголю пов’язане з нижчою смертністю і частотою неішемічної СН [6].
 Інші роботи показують, що низьке/помірне щоденне споживання алкоголю може сприятливо впливати на прогноз пацієнтів з АКМП [6, 20, 49]. За отриманими результатами, низьке/помірне приймання алкоголю щодня є предиктором кращого прогнозу при СН та ішемічній кардіоміопатії [6, 20]. Дані ЕхоКГ також свідчать про те, що у пацієнтів, які не повністю відмовилися від споживання алкоголю (мінімізували щоденний прийом), може відновитися ФВ ЛШ, як і в тих, що його не вживають [53].
Інші роботи показують, що низьке/помірне щоденне споживання алкоголю може сприятливо впливати на прогноз пацієнтів з АКМП [6, 20, 49]. За отриманими результатами, низьке/помірне приймання алкоголю щодня є предиктором кращого прогнозу при СН та ішемічній кардіоміопатії [6, 20]. Дані ЕхоКГ також свідчать про те, що у пацієнтів, які не повністю відмовилися від споживання алкоголю (мінімізували щоденний прийом), може відновитися ФВ ЛШ, як і в тих, що його не вживають [53].
Лікування
Найбільш ефективною стратегією терапії патології, що асоційована з алкоголем, включно з АКМП, є повна відмова від його приймання з метою відновлення скоротливої функції ЛШ, яка повинна бути рекомендована всім пацієнтам [11, 35, 37, 46, 49, 108]. Хоча припинення чи зменшення вживання алкоголю все ще є предметом дискусії, відмова від нього або принаймні значне зменшення вживання до дози низького ризику є наріжним каменем лікування пошкодження органів, що індуковані алкоголем, зокрема АКМП [37, 42, 49, 68, 93, 102, 138].
Необхідно підкреслити, що зміни при АКМП потенційно зворотні при припиненні приймання алкоголю, особливо до розвитку фіброзу [49]. За даними Rafie et al. показано, що є два фактори, пов’язані зі сприятливим перебігом захворювання: коротка тривалість симптомів СН до початку терапії (у пацієнтів із меншим фіброзом загалом кращі наслідки) та відмова від алкоголю [115]. Однак межа між зворотними і незворотними пошкодженнями, іншими словами – «точка неповернення» (point no-return), невідома [70].
Ведення хворих на АКМП має розглядатися в контексті розладів внаслідок вживання алкоголю [7, 9]. Оскільки порушення, асоційовані з алкоголем, є складними і багатофакторними станами, необхідний мультидисциплінарний підхід до терапії таких пацієнтів, оптимальне ведення яких включає спостереження лікарем-наркологом, психосоціальну реабілітацію та медикаментозне лікування алкогольної залежності [10, 26, 42, 81, 87].
Терапію СН слід проводити відповідно до рекомендацій Європейського товариства кардіологів (ESC, 2016) [4]. У пацієнтів зі стійкою тяжкою дисфункцією ЛШ, незважаючи на оптимальне фармакологічне лікування, можуть розглядатися імплантація кардіовертера-дефібрилятора, трансплантація серця та використання ресинхронізуючої терапії [35, 54]. Так, трансплантацію серця проведено у 15% пацієнтів, імплантацію кардіовертера-дефібрилятора – 34%, застосування ресинхронізувальної терапії – 19% [54]. Однак з огляду на специфічні патофізіологічні механізми і можливість усунення причини АКМП, на сьогодні використання імплантованих кардіовертерів-дефібриляторів при кардіоміопатіях неішемічного ґенезу є предметом дискусії після публікації випробування DANISH, в якому не виявлено значного зменшення смертності від усіх причин порівняно з оптимальною медикаментозною терапією [69]. Порушення ритму серця лікують за стандартними протоколами [115].
Прогноз
Основними причинами смерті з-поміж пацієнтів з АКМП та ідіопатичною ДКМП є прогресуюча СН і раптова серцева смерть [34, 47]. Загалом при АКМП прогноз кращий, ніж при ідіопатичній ДКМП, у разі відмови від вживання алкоголю принаймні на ранній стадії захворювання [49, 100, 114]. Однак дані досліджень суперечливі, причому деякі відзначали кращий прогноз при АКМП, ніж при ідіопатичній ДКМП, інші – ні [34, 46, 114]. Так, смертність серед осіб з ідіопатичною ДКМП і АКМП (які відмовилися від алкоголю) була однаковою. В пацієнтів, котрі продовжували зловживати алкоголем, відзначалася вища летальність порівняно з ідіопатичною ДКМП і АКМП (які відмовилися від алкоголю). Продовження зловживання алкоголем є предиктором серцевої смерті у хворих на АКМП за умови невживання алкоголю (ВР серцевої смерті – 4,99; 95% ДІ 1,77‑14,1) [34].
Дані іншого дослідження показали, що швидкість прогресування захворювання і смертність у пацієнтів з АКМП були нижчими, ніж у таких з ідіопатичною ДКМП. Слід зауважити, що летальність серед осіб із тяжкою застійною СН та дилатацією ЛШ при АКМП значно менша, ніж у таких з ідіопатичною ДКМП та подібним ФК СН. Так, 1-, 5- і 10-річна загальна виживаність становила 100, 81 і 81% для пацієнтів з АКМП і 89, 48 і 30% – з ідіопатичною ДКМП відповідно (р=0,041); різниця була навіть більшою для виживаності без трансплантації серця (р=0,005) [114].
Інші автори виявили, що 10-річна виживаність осіб з АКМП без трансплантації серця, які припинили прийом алкоголю, складала приблизно 50%, серед тих, що продовжували вживати, – 32% [34], 7-річна у всіх хворих – 41%, у пацієнтів, що припинили приймання алкоголю – 45%, продовжили – 27% [46].
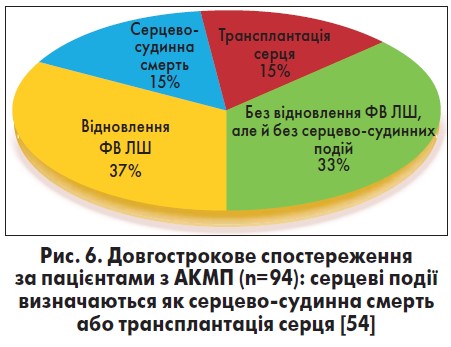 Наявні дані, що упродовж середнього періоду спостереження 59 місяців смертність від серцево-судинних причин (СН, раптова серцева смерть) складала 15% (рис. 6). Окрім того, 15% пацієнтів перенесли трансплантацію серця, у 37% відмічали відновлення функції ЛШ, а 33% залишалися клінічно стабільними без поліпшення систолічної функції ЛШ. У цьому дослідженні попереднє помірне споживання алкоголю, тривалість його зловживання і тип напоїв не пов’язані з виникненням основних кардіальних подій (серцево-судинна смерть або трансплантація серця). Виживаність без трансплантації серця була вищою у хворих на АКМП порівняно з такими з ідіопатичною ДКМП (р=0,002). Варто зазначити, що 1-, 3-, 5- і 10-річна виживаність без трансплантації серця у пацієнтів з АКМП складала 88±3, 80±4, 75±5 і 65±6%, а із ДКМП – 74±3, 61±4, 58±4 і 46±5% відповідно (p=0,01 у всіх випадках). Окрім того, АКМП асоціювалася з більш сприятливим прогнозом порівняно з ідіопатичною ДКМП (ВШ 0,4; 95% ДІ 0,2‑0,8; p=0,01) [54].
Наявні дані, що упродовж середнього періоду спостереження 59 місяців смертність від серцево-судинних причин (СН, раптова серцева смерть) складала 15% (рис. 6). Окрім того, 15% пацієнтів перенесли трансплантацію серця, у 37% відмічали відновлення функції ЛШ, а 33% залишалися клінічно стабільними без поліпшення систолічної функції ЛШ. У цьому дослідженні попереднє помірне споживання алкоголю, тривалість його зловживання і тип напоїв не пов’язані з виникненням основних кардіальних подій (серцево-судинна смерть або трансплантація серця). Виживаність без трансплантації серця була вищою у хворих на АКМП порівняно з такими з ідіопатичною ДКМП (р=0,002). Варто зазначити, що 1-, 3-, 5- і 10-річна виживаність без трансплантації серця у пацієнтів з АКМП складала 88±3, 80±4, 75±5 і 65±6%, а із ДКМП – 74±3, 61±4, 58±4 і 46±5% відповідно (p=0,01 у всіх випадках). Окрім того, АКМП асоціювалася з більш сприятливим прогнозом порівняно з ідіопатичною ДКМП (ВШ 0,4; 95% ДІ 0,2‑0,8; p=0,01) [54].
Дані іншого дослідження показали, що пацієнти з АКМП, які перенесли трансплантацію серця, мали гірші наслідки порівняно з такими з ідіопатичною ДКМП. При АКМП спостерігали вищу смертність від ІХС, відторгнення трансплантанту та печінкової недостатності [19]. При проведенні множинного логістичного регресійного аналізу незалежними предикторами смерті або необхідності у трансплантації серця при АКМП були: ФП (ВШ 9,7; 95% ДІ 2,56‑36,79; p=0,001), ширина комплексу QRS >120 мс (ВШ 7,2; 95% ДI 2,02‑26; p=0,002) і відсутність терапії β-адреноблокаторами (ВШ 4,4; 95% ДI 1,35‑14,49; p=0,014) [54]. За наявними даними, у групі пацієнтів з АКМП виявлено більшу частку чоловіків, курців, вищі індекс маси тіла, частоту захворювань печінки та хронічного обструктивного захворювання легень [34, 46, 54].
Отже, у пацієнтів із хронічним зложиванням алкоголю і тяжкою СН прогноз несприятливий, оскільки продовження його приймання призводить до виникнення рефрактерної застійної СН. Раптова смерть може розвиватися внаслідок порушення ритму серця, системної або легеневої емболії. Рання та абсолютна відмова від вживання алкоголю сприятливо впливає на функцію міокарда ЛШ [81]. У разі відмови від алкоголю було відзначено покращання гемодинаміки та клінічне поліпшення або принаймні повільніше прогресування захворювання порівняно з ідіопатичною ДКМП [49, 114].
Висновки
Таким чином, АКМП не є рідкісним захворюванням, а продовження вживання алкоголю асоційоване з несприятливим прогнозом. Патогенез АКМП до кінця не з’ясований. У жінок відмічають підвищену чутливість до токсичного впливу алкоголю. Основою терапії АКМП є відмова від алкоголю, оскільки особливістю АКМП є потенційно зворотний перебіг, особливо на ранній стадії. Покращання/відновлення систолічної функції ЛШ відзначене у деяких пацієнтів після припинення приймання алкоголю або його зниження до помірного рівня. Медикаментозну терапію СН проводять згідно з рекомендаціями ESC (2016), що аналогічна такій при ідіопатичній ДКМП. Однак необхідні наступні дослідження із включенням як асимптоматичних, так і симптоматичних пацієнтів з АКМП з метою ранньої діагностики і лікування таких хворих для поліпшення прогнозу.
Література
- Дорогой А.П. Алкогольна кардіоміопатія і алкогольна хвороба печінки: проблеми та наслідки вживання алкоголю // Укр. кардіол. ж. – 2016. – Додаток 1. – С. 22‑30.
- Москвичев В.Г., Цыганков Б.Д., Волохова Р.Ю. и др. Гендерспецифические аспекты алкоголь обусловленных соматических заболеваний // Трудный пациент. – 2006. – Т. 4, № 9. – С. 57‑62.
- Харченко О., Гавриш Л., Остапченко Л. Токсична дія етанолу та його продуктів на організм // Вісн. НАН України, 2006, № 3. – С. 57‑64.
- 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC // European Heart Journal. – 2016. – 37. – Р. 2129‑2200.
- Abbey A. Alcohol-related sexual assault: A common problem among college students // J Stud Alcohol Suppl. – 2002. – 14. – Р. 118‑128.
- Abramson J.L., Williams S.A., Krumholz H.M., et al. Moderate alcohol consumption and risk of heart failure among older persons // JAMA. – 2001. – 285. – Р. 1971‑1977.
- Addolorato G., Abenavoli L., Leggio L., Gasbarrini G. How many cravings? Pharmacological aspects of craving treatment in alcohol addiction: a review // Neuropsychobiology. – 2005. – 51 (2). – Р. 59‑66.
- Addolorato G., Capristo E., Caputo F. et al. Nutritional status and body fluid distribution in chronic alcoholics compared with controls // Alcohol Clin Exp Res. – 1999. – 23 (7). – Р. 1232‑1237.
- Addolorato G., Leggio L., d’Angelo C. et al. Physical considerations for treatment complications of alcohol and drug use and misuse. In: Johnson BA, editor. Addiction medicine. Springer Science + Business Media, LLC; 2011.
- Addolorato G., Mirijello A., Barrio P., Gual A. Treatment of alcohol use disorders in patients with alcoholic liver disease // J Hepatol. – 2016. – 65 (3). – Р. 618‑630.
- Albakri A. Alcoholic cardiomyopathy: A review of literature on clinical status and meta-analysis of diagnostic and clinical management methods // Clin Med Invest. – 2018. – Vol. 3 3). Р. 1‑14.
- American Academy of Pediatrics, Committee on Substance Abuse and Committee on Children with Disabilities, 2000. Fetal alcohol syndrome and alcohol-related neurodevelopmental disorders // Pediatrics. – 2000. – 106. – Р. 358‑361.
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders. DSM‑5 5th ed. – Washington, DC: American Psychiatric Association, 2013.
- Arndt T. Carbohydrate-deficient transferrin as a marker of chronic alcohol abuse: A critical review of preanalysis, analysis, and interpretation // Clin Chem. – 2001. – 47. – Р. 13‑27.
- Balbo C.E.B, de Paola A.A.V, Fenelon G. Effects of alcohol on atrial fibrillation // Ther Adv Cardiovasc Dis. – 2009. – 3. – Р. 53‑63.
- Beckemeier M.E., Bora P.S. Fatty acid ethyl esters: potentially toxic products of myocardial ethanol metabolism // J Mol Cell Cardiol. – 1998. – 30. – Р. 2487‑2494.
- Bing R.J., Tillmanns H., Fauvel J.M., Seeler K., Mao J.C. Effect of prolonged alcohol administration on calcium transport in heart muscle of the dog // Circulation Research. – 2017. – 35. – Р. 33‑38.
- Brigden W., Robinson J. Alcoholic heart disease // Brit Med J. – 1964. – 2. – Р. 1283‑1289.
- Brinkley D.M., Geltman E.M. Alcohol cardiomyopathy is associated with worse graft survival after cardiac transplant // J Card Fail. – 2011. – 12. – S75.
- Bryson C.L., Mukamal K.J., Mittleman M.A., Fried L.P., Hirsch C.H. et al. The association of alcohol consumption and incident heart failure: The cardiovascular health study // J Am Coll Cardiol. – 2006. – 48. – Р. 305‑311.
- Cameli M., Ballo P., Garzia A., Lisi M., Bocelli A. et al. Acute effects of low doses of ethanol on left and right ventricular function in young healthy subjects // Alcohol Clin Exp Res. – 2011. – 35. – Р. 1860‑1865.
Повний список літератури, що включає 144 пункти, знаходиться у редакції.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (64) червень 2019 р.