3 жовтня, 2019
Застосування еверолімусу як ад’ювантної терапії у пацієнтів з парціальними нападами судом, асоційованими з туберозним склерозом
Туберозно-склерозний комплекс (TSC) – це мультисистемне генетичне захворювання з аутосомно-домінантним типом успадкування, частота якого серед новонароджених становить приблизно 1:6000. Патологія пов’язана з мутаціями генів TSC1 і TSC2, які призводять до втрати функції білків гамартину та туберину, що супроводжується подальшою активацією комплексу мішені рапаміцину ссавців (mammalian target of rapamycin complex 1, mTORC1). Результатом гіперактивації mTORC1 є ріст доброякісних пухлин у різних органах із переважною локалізацією у головному мозку, нирках, шкірі, легенях, органі зору, печінці. Існують також повідомлення про наявність пухлин таких рідкісних локалізацій, як кістки та підшлункова залоза.
Найчастішими клінічними проявами TSC є неврологічні порушення, зокрема майже у 90% хворих розвивається епілепсія, часто цей прояв маніфестує у дітей до 1 року. За результатами ретроспективного дослідження приблизно у 2/3 пацієнтів з TSC-асоційованими нападами судом виявляють так звану рефрактерну епілепсію. Це стан, при якому застосування щонайменше трьох протиепілептичних препаратів (ПЕП) не забезпечувало контролю судом. До запровадження інгібіторів mTOR для лікування субепендимальної гігантоклітинної астроцитоми (SEGA), лімфангіолейоміоматозу, ангіоміоліпоми нирок у пацієнтів з TSC специфічної терапії не існувало, і при клінічній маніфестації хвороби застосовували лише симптоматичну терапію.
Сьогодні діагностика та лікування пацієнтів з TSC проводиться відповідно до консенсусних рекомендацій, прийнятих ще у 2012 р., у яких обґрунтовується доцільність застосування ПЕП як 1-ї лінії терапії. На вибір ПЕП впливають вік хворого, варіант епілептичного синдрому та тип нападів судом. Зазвичай перевагу надають монотерапії (як варіанту з меншою кількістю побічних ефектів), проте за відсутності бажаного ефекту призначають комбіновані схеми. Застосування комбінації ПЕП, спрямованих на різні механізми розвитку судом, більш ефективне, особливо через те, що така стратегія дозволяє підсилити ергічні гальмівні процеси γ-аміномасляною кислотою. Інші методи лікування застосовують як 2-гу та 3-ю лінії терапії, вони включають введення кортикостероїдів або адренокортикотропного гормону (при інфантильних спазмах), хірургічне втручання, стимуляцію блукаючого нерва, кетогенну дієту та застосування інгібіторів mTOR. Оперативне втручання як метод лікування слід розглянути негайно у пацієнтів з рефрактерною епілепсією (щонайменше до двох ПЕП), особливо у дітей раннього віку, оскільки раннє проведення операції може збільшити шанси на повне усунення нападів судом.
Нещодавно у США та країнах Європейського Союзу на підставі результатів подвійного сліпого плацебо-контрольованого дослідження III фази був схвалений інгібітор mTOR еверолімус як препарат для ад’ювантної терапії рефрактерних TSC-асоційованих парціальних нападів судом.
Еверолімус
Результати дослідження III фази EXIST‑3 показали, що введення еверолімусу, який раніше застосовули для лікування TSC-асоційованої SEGA та ангіоміоліпоми нирок, сприяє редукції нападів судом. Згодом ці висновки стали підставою для схвалення препарату для лікування рефрактерних парціальних нападів судом у хворих із TSC. Ще одним інгібітором mTORC1, ефективність якого оцінювали у пацієнтів з TSC, є сиролімус. Проте результати відкритого кросовер-дослідження, у якому вивчали дію сиролімусу як додаткової терапії фармакорезистентної TSC-асоційованої епілепсії, показали, що прийом цього засобу не супроводжується зниженням частоти нападів судом.
Клінічна ефективність. Першим клінічним дослідженням, результати якого продемонстрували ефективність еверолімусу у лікуванні TSC-асоційованих судом, стало відкрите дослідження I-II фази щодо вивчення ефективності препарату при TSC-асоційованій SEGA (Krueger et al., 2010). В основній фазі випробування взяли участь 28 пацієнтів ≥3 років з діагностованою SEGA. Хворі отримували еверолімус протягом 6 міс у дозі 3 мг/м2 площі поверхні тіла (концентрація у крові, визначена шляхом титрування, становила від 5 до 15 нг/мл). Основною метою дослідження було вивчення ефективності еверолімусу при SEGA, а вплив препарату на напади судом виступав як другорядна ціль. Було виявлено, що після 6-місячного лікування еверолімусом частота нападів зменшилася (p=0,02). Із 16 хворих, у яких проводили відеоелектроенцефалографію, у 9 пацієнтів відзначено зниження частоти епізодів судом, 6 хворих не відмітили жодних змін, а 1 пацієнт повідомив про збільшення частоти нападів. Пацієнтів, які могли продовжити прийом еверолімусу, включили у наступну фазу дослідження. Результати проміжного аналізу показали, що частка пацієнтів, які повідомляли про відсутність нападів судом з моменту останнього візиту, зросла з 38,5 до 65,2% на 24-му тижні. Крім того, на 24‑му тижні лікування лише 13% хворих повідомили про наявність щонайменше одного нападу судом на добу, що значно менше порівняно з початковим показником (26,9%). При фінальному аналізі результатів дослідження цей показник склав 11% на 60-му тижні. Частка пацієнтів без нападів судом зросла з 38,5 до 66,7% на 18-му тижні лікування і залишалася незмінною до кінця дослідження.
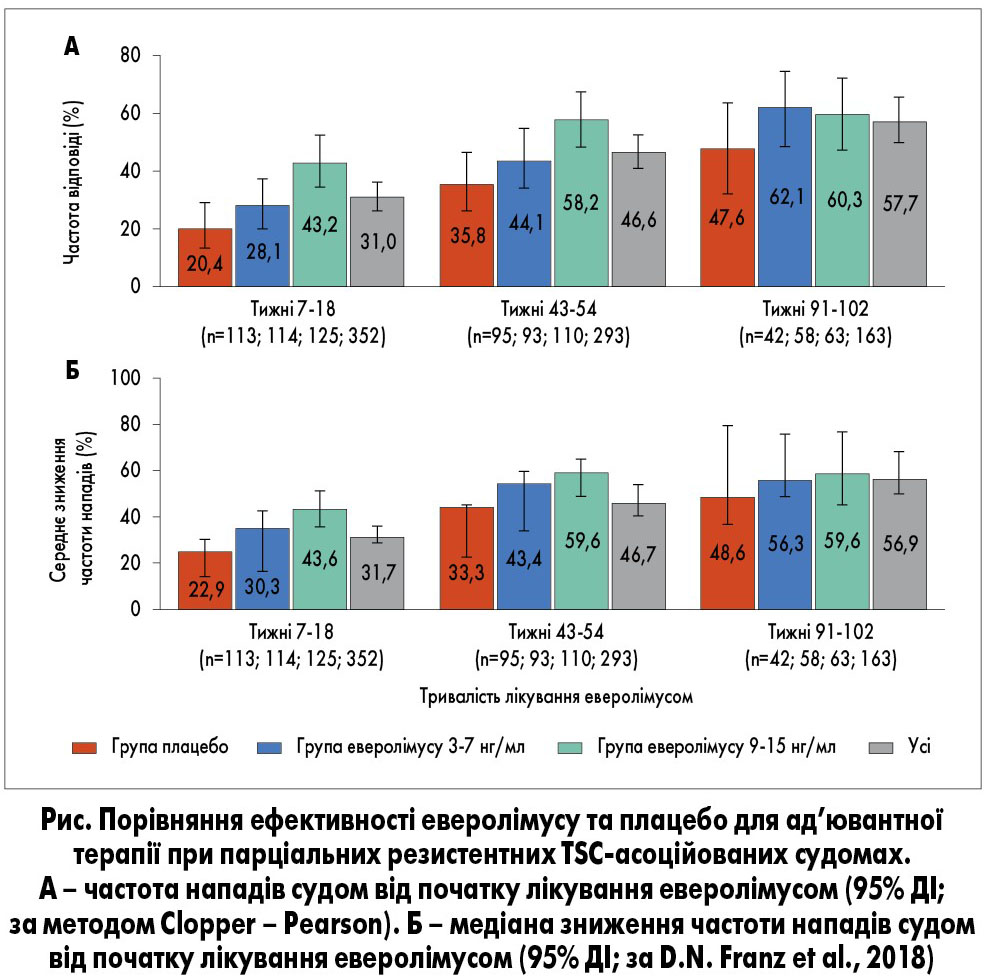
З метою порівняння ефективності еверолімусу (у двох різних дозуваннях) та плацебо для ад’ювантної терапії при парціальних резистентних TSC-асоційованих судомах було проведено рандомізоване мультицентрове плацебо-контрольоване дослідження III фази EXIST‑3. В основній фазі дослідження пацієнти бути рандомізовані на 3 групи: група високої експозиції еверолімусу (high exposure – HE, 9-15 нг/мл, n=130), група низької експозиції еверолімусу (low exposure – LE, 3-7 нг/мл, n=117) та група плацебо (n=119). Тривалість лікування становила 18 тижнів (6 тижнів – період титрування дози препарату, 12 тижнів – підтримувальний період).
Під час дослідження отримано такі дані: зниження частоти нападів судом у групі плацебо (14,9%) було значно меншим порівняно з групою еверолімусу HE (39,6%; p<0,0001) та LE (29,3%; p=0,0028). Тобто показники клінічної відповіді у групах еверолімусу HE (40,0%; p<0,0001) та LE (28,2%; p=0,0077) були значно вищими, ніж у групі плацебо (15,1%).
Усі учасники дослідження EXIST‑3 відповідали критеріям включення у наступну фазу випробування, де вони (враховуючи пацієнтів групи плацебо) отримували іншу дозу еверолімусу в межах 3-15 нг/мл протягом 48 тижнів і довше. Загалом дані 361 з 366 учасників дослідження EXIST‑3, які отримували еверолімус в основній і/або продовженій фазі, були використані для довготермінового аналізу. З часом частота клінічної відповіді зростала (з 31,7% на 18-му тижні лікування до 56,9% через 2 роки; рис.).
Розширений аналіз показав, що через 1 рік лікування кращі результати отримано у дітей молодшого віку (до 6 років), ніж у старших пацієнтів (6-18 років), хоча з часом частота нападів судом істотно знизилася і серед старших дітей. Це спостереження узгоджується з тим, що раннє та навіть профілактичне призначення вігабатрину може супроводжуватися покращенням перебігу TSC. Мета наступних досліджень – визначити, чи може рання терапія інгібіторами mTOR бути такою ж ефективною, чи навіть більш ефективною, ніж вігабатрином.
Висновки
Дані клінічних досліджень підтверджують ефективність і безпечність еверолімусу як ад’ювантної терапії для контролю TSC-асоційованих парціальних нападів судом. Безпечність та ефективність довготермінової терапії потребує подальшого вивчення. Перспективним напрямом дослідження є визначення потенційної користі препарату для швидкого досягнення контролю над судомами, що може мати сприятливі віддалені наслідки для розвитку дитини.
До обговорення
На відміну від усіх видів лікування епілептичних нападів, які є ефективними незалежно від етіологічного чинника захворювання, інтерес до еверолімусу базується на його здатності пригнічувати mTOR та змінювати молекулярні механізми, що лежать в основі TSC. Оскільки гіперактивація mTOR становить основу різних клінічних проявів TSC, не дивно, що еверолімус позитивно впливає на їх перебіг (зокрема, це стосується SEGA, ангіоміоліпоми нирок, ураження шкіри – ангіофіброми шкіри обличчя, гіпопігментні плями; рабдоміоми серця). Таким чином, еверолімус чинить полісистемну дію, змінюючи перебіг хвороби. У цьому аспекті обґрунтованим є припущення, що інгібітори mTOR можуть бути ефективними для лікування інших генетичних захворювань і вад розвитку, пов’язаних з гіперактивацією mTOR, та/або синдромами, в основі яких лежить мутація генів AKT/PI3K/mTOR.
https://doi.org/10.1080/14737175.2019.1635457
Переклала з англ. Ілона Цюпа
Тематичний номер «Педіатрія» №3 (50), 2019 р.