12 листопада, 2019
Карпатські читання: актуальні питання неврології
У межах школи клінічних нейронаук «Карпатські читання», що відбулася 13‑15 червня 2019 р. на базі Ужгородського національного університету, були розглянуті нюанси терапії різних типів інсультів, детально обговорені питання їхньої вторинної профілактики, генетичного підґрунтя ішемічного інсульту, а також тактика при нейроваскулярних компресійних синдромах, об’ємних утвореннях мозку, цервікогенному головному болю та потиличній невралгії. Проведення цієї наукової події стало можливим завдяки підтримці громадської організації «Українська асоціація боротьби з інсультом». До вашої уваги представлено огляд доповідей провідних науковців та нейрохірургів-практиків, які взяли участь у заході.
 «Вирішення питання курації ішемічних та геморагічних інсультів» – так назвав свою доповідь президент ГО «Українська асоціація боротьби з інсультом», д. мед. н., професор Микола Єфремович Поліщук. Він наголосив на необхідності проведення безконтрастної візуалізації та комп’ютерної томографічної ангіографії особам з інсультом. Призначення подвійної антиагрегантної терапії протягом 21 дня після інсульту виправдане багатьма дослідженнями, в котрих доведене суттєве (інколи на 100%) збільшення тромбу в просвіті судини протягом декількох годин після судинної катастрофи за умови відсутності адекватного антитромботичного лікування. Призначення низькомолекулярного гепарину та використання компресійних панчіх дозволяє запобігти фатальній тромбоемболії в іммобілізованих пацієнтів унаслідок неврологічного дефіциту та терапевтичного режиму.
«Вирішення питання курації ішемічних та геморагічних інсультів» – так назвав свою доповідь президент ГО «Українська асоціація боротьби з інсультом», д. мед. н., професор Микола Єфремович Поліщук. Він наголосив на необхідності проведення безконтрастної візуалізації та комп’ютерної томографічної ангіографії особам з інсультом. Призначення подвійної антиагрегантної терапії протягом 21 дня після інсульту виправдане багатьма дослідженнями, в котрих доведене суттєве (інколи на 100%) збільшення тромбу в просвіті судини протягом декількох годин після судинної катастрофи за умови відсутності адекватного антитромботичного лікування. Призначення низькомолекулярного гепарину та використання компресійних панчіх дозволяє запобігти фатальній тромбоемболії в іммобілізованих пацієнтів унаслідок неврологічного дефіциту та терапевтичного режиму.
Своєю чергою рання активація пацієнта, підіймання головного кінця ліжка, сидіння та ходьба призводять до погіршення кровопостачання головного мозку в гострому періоді інсульту. У цьому контексті доповідач продемонстрував результати дослідження, в котрому автори дійшли висновку, що в першу добу після інсульту не слід використовувати будь-які антигіпертензивні препарати через ризик погіршення колатерального кровообігу.
За словами М.Є. Поліщука, ефективність реканалізації за допомогою ферментативного методу вища при збереженні часткової проникності, а не за оклюзії судини. Якщо тромб непроникний, то обґрунтованим є використання механічної тромбекстракції.
Також доповідач зазначив, що механічна тромбектомія змінила долю багатьох осіб з інсультом, а показник ефективності при її застосуванні становить 2,6 (тобто пролікувавши 2,6 пацієнта, лікар отримує позитивний результат). Неврологічний дефіцит зменшується вдвічі на наступну добу. Найліпше використовувати такий метод при закупорці великих судин. За обструкції судин меншого калібру кращий варіант – тромболізис.
Професор М.Є. Поліщук наголосив, що проводити комп’ютерну томографічну ангіографію необхідно якомога раніше, не очікуючи на результати біохімічного дослідження крові на вміст креатиніну (адже «вибір між нейронами та нефронами є очевидним»), а також представив показання до нейрохірургічного втручання при геморагічних інсультах:
- наявність аневризми, артеріовенозної мальформації, ангіокаверном;
- лобарні крововиливи до 2 см від кори, екстракапсулярні;
- внутрішньомозковий крововилив >4 см у поперечному зрізі, оцінка за шкалою ком Глазго (GCS) ≤13 балів;
- крововиливи у задню черепну ямку з симптомами компресії стовбура чи гідроцефалії;
- наростання дислокації при латеральних крововиливах;
- крововилив у шлуночки та розвиток гідроцефалії;
- індивідуальні показання.
Втім, на думку лектора, оперативні втручання при внутрішньомозкових крововиливах є недоцільними за наявності таких протипоказань:
- ≤8 балів при оцінюванні за GCS;
- масивний крововилив із грубою неврологічною симптоматикою;
- великі внутрішньомозкові крововиливи у домінуючу півкулю;
- внутрішньомозковий крововилив у базальні ганглії;
- крововилив у таламус діаметром ≥3 см;
- коагулопатія;
- вік понад 75 років;
- оцінка за GCS >10 балів та незначний геміпарез.
На завершення професор М.Є. Поліщук закликав зважено приймати рішення про доцільність оперативного втручання, оскільки за наявності вагомих протипоказань вірогідність успішної операції зводиться до мінімуму, а її проведення може скоротити термін життя та його якість. Так, декомпресійна краніотомія сприяє збільшенню частки пацієнтів, що виживають, втім їхній стан здебільшого потребує сторонньої допомоги через тяжку інвалідизацію. Тож застосовувати це втручання рекомендовано за умови стабілізації вітальних функцій хворого.
 Із доповіддю «Вторинна профілактика інсульту: вибір, оснований на даних доказової медицини» в межах заходу виступив професор Натан Борнштейн (Ізраїль). Лектор зазначив, що неможливо ігнорувати проблему значного підвищення частоти повторних інсультів у популяції. Першочергово увагу було акцентовано на різних механізмах дії антитромбоцитарних препаратів. Так, клопідогрель є блокатором рецепторів до аденозиндифосфату, ацетилсаліцилова кислота (АСК) інгібує циклооксигеназу та тромбоксан А2, дипіридамол збільшує концентрацію аденозину в плазмі та інгібує тромбоцитарну фосфодіестеразу. Але питання призначення сталої дози та комбінації препаратів є досі дискутабельними, тому професор навів дані останніх випробувань, які дозволяють зробити правильний вибір, обґрунтований даними доказової медицини.
Із доповіддю «Вторинна профілактика інсульту: вибір, оснований на даних доказової медицини» в межах заходу виступив професор Натан Борнштейн (Ізраїль). Лектор зазначив, що неможливо ігнорувати проблему значного підвищення частоти повторних інсультів у популяції. Першочергово увагу було акцентовано на різних механізмах дії антитромбоцитарних препаратів. Так, клопідогрель є блокатором рецепторів до аденозиндифосфату, ацетилсаліцилова кислота (АСК) інгібує циклооксигеназу та тромбоксан А2, дипіридамол збільшує концентрацію аденозину в плазмі та інгібує тромбоцитарну фосфодіестеразу. Але питання призначення сталої дози та комбінації препаратів є досі дискутабельними, тому професор навів дані останніх випробувань, які дозволяють зробити правильний вибір, обґрунтований даними доказової медицини.
Метааналіз даних досліджень пацієнтів з інсультом та транзиторною ішемічною атакою (ТІА) свідчить про ефективність АСК у середньому (75‑300 мг) та високому (650‑1500 мг) дозуванні. Згідно з останніми рекомендаціями, слід призначати АСК по 300 мг протягом 30 днів після інсульту, а надалі – 100 мг/добу.
Окрім того, доповідач навів дані щодо порівняння ефективності антитромбоцитарних препаратів.
Порівняння АСК та клопідогрелю. При аналізі різниці щодо кількості повторних серцево-судинних (СС) катастроф у пацієнтів, які приймали АСК (350 мг) або клопідогрель (75 мг), було встановлено статистично значуще (p=0,043) зниження ризику таких подій на 8,7% на користь клопідогрелю (CAPRIE Steering Committee, 1996).
Порівняння АСК + клопідогрель та клопідогрелю. Головною метою дослідження MATCH було порівняння ефективності сумісного застосування АСК (75 мг) із клопідогрелем (75 мг) та клопідогрелю (75 мг) у вигляді монотерапії для вторинної профілактики після недавнього ішемічного інсульту або ТІА у пацієнтів високого ризику. Частота СС-подій становила 15,7% через 18 місяців з-поміж хворих, які приймали комбінацію, порівняно з 16,7% – клопідогрель. Відносне зниження ризику (на 6,4%) було незначущим (р=0,244). Але у пацієнтів, які отримували комбінацію препаратів, було зафіксовано більше небезпечних для життя кровотеч, ніж у групі монотерапії (2,6 та 1,3% відповідно; р<0,001) (Calvet et al., 2006).
Порівняння АСК + клопідогрель та АСК. В іншому дослідженні пацієнти із клінічно очевидними СС-захворюваннями або множинними факторами ризику (n=15 603) отримували клопідогрель (75 мг) + АСК у низькому дозуванні (75‑162 мг) або лише АСК протягом 28 місяців. Частота виникнення інфаркту міокарда (ІМ), інсульту або смерті від СС-катастроф становила 6,8% у групі подвійного антитромбоцитарного лікування та 7,3% – монотерапії (р=0,22). Поширеність масивної кровотечі склала 1,7 та 1,3% відповідно (р=0,09). Серед пацієнтів із множинними факторами ризику частота катастроф становила 6,6% при прийманні комбінації та 5,5% – лише АСК (р=0,20); рівень летальності від СС-причин також був вищим у групі подвійної антитромбоцитарної терапії (3,9 проти 2,2%, р=0,01). Серед осіб із клінічно очевидним атеротромбозом цей показник склав 6,9% при використанні подвійної антитромбоцитарної та 7,9% – монотерапії АСК (р=0,046). Тож у цьому дослідженні було виявлено користь залучення до подвійного антитромбоцитарного лікування пацієнтів із симптоматичним атеротромбозом та зроблено припущення про шкоду для хворих із множинними факторами ризику. Загалом комбінація не була значущо ефективнішою, ніж АСК у монотерапії щодо зниження ризику ІМ, інсульту або смерті від СС-причин (Bhatt et al, 2006).
У випробуванні за участю пацієнтів із нещодавніми лакунарними інсультами при додаванні клопідогрелю до АСК несуттєво знизився ризик повторного інсульту (подвійна антитромбоцитна терапія – 125 випадків, монотерапія АСК – 138), але значно підвищився такий кровотечі (105 та 56 випадків відповідно) й смерті (113 та 77 випадків відповідно) (Benavente et al., 2012).
У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні, проведеному в 114 центрах Китаю, 5170 пацієнтам протягом 24 годин після початку малого ішемічного інсульту або ТІА високого ризику призначали подвійне лікування клопідогрелем (початкова доза – 300 мг, упродовж наступних 90 днів – по
Один з останніх метааналізів даних 16 рандомізованих контрольованих досліджень із загальною кількістю 29 032 пацієнтів показав, що застосування подвійної антитромбоцитарної терапії асоційоване зі значно нижчою частотою інсультів (коефіцієнт ризику [КР] 0,80; 95% довірчий інтервал [ДІ] 0,72‑0,89) та ішемічного інсульту (КР 0,75; 95% ДІ 0,66‑0,85). Хоча було зафіксоване збільшення кількості внутрішньочерепних (КР 1,55; 95% ДІ 1,20‑2,01) та інших масивних кровотеч (КР 1,90; 95% ДІ 1,33‑2,72), пов’язаних із подвійним лікуванням, при короткочасному використанні комбінації АСК + клопідогрель (≤1 місяць), розпочатому під час гострої фази ішемії, зареєстровано меншу частку кровотеч, ніж при тривалому, та із суттєвим зниженням частоти рецидиву інсульту порівняно з монотерапією. Інші клінічні результати щодо частоти рецидиву TIA, ІМ, смерті внаслідок СС-катастрофи та з будь-якої іншої причини були подібними для двох груп (Kheiri et al., 2019).
Саме тому, за словами Н. Борштейна, останні клінічні рекомендації сприяють тактиці призначення подвійної антитромбоцитарної терапії, що ініціюють упродовж 24 годин після початку симптомів малого інсульту, а триває вона протягом 21 дня. Таке рішення сприяє зменшенню ризику повторного інсульту протягом 90 днів від початку симптомів.
Порівняння АСК + дипіридамол та АСК. Результати дослідження, в якому 1363 пацієнтам призначали приймання АСК (30‑325 мг) разом із дипіридамолом (200 мг двічі на день) або лише АСК (n=1376) протягом шести місяців після ТІА чи малого інсульту, ймовірно, артеріального походження, свідчать, що події первинного результату (інсульт, інфаркт, смерть внаслідок СС-катастрофи) виникли у 173 (13%) хворих на комбінації та у 216 (16%) на монотерапії. Додавання даних дослідження ESPRIT до метааналізу попередніх випробувань сприяло формуванню достатньої кількості доказів на користь схеми сумісного застосування АСК та дипіридамолу. Однак хворі, які приймали комбінацію препаратів, відміняли їх частіше (470 проти 184), що було переважно зумовлено появою головного болю (Halkes et al., 2006).
Порівняння АСК + дипіридамол та клопідогрелю. У подвійному сліпому дослідженні пацієнтам призначали супутнє використання АСК (25 мг) та дипіридамолу (200 мг двічі на день) або лише клопідогрель (75 мг). Всього протягом 2,5 років спостерігали за 20 332 пацієнтами. Рецидив інсульту відбувся у 916 хворих (9,0%), які отримували комбінацію, і у 898 (8,8%) – клопідогрель. Інсульт, ІМ або смерть внаслідок СС-катастроф мали місце в 1333 пацієнтів (13,1%) у кожній із груп. Геморагічні катастрофи сталися у 419 (4,1%) та 365 (3,6%) хворих відповідно. Ризик повторного інсульту або масивного геморагічного крововиливу був подібним для двох груп: 1194 (11,7%) – комбінації та 1156 (11,4%) – клопідогрелю відповідно (Sacco et al., 2008).
Порівняння АСК, АСК + ривароксабан та ривароксабану. Серед 27 395 пацієнтів зі встановленою судинною патологією через 23 місяці ті, хто отримував ривароксабан (2,5 мг двічі на день) у комбінації з АСК (100 мг), мали нижчий ризик СС-катастроф (інсульт, інфаркт) та смерті внаслідок ССЗ, ніж лише АСК: 379 (4,1%) та 496 (5,4%) випадків відповідно (p<0,001). Своєю чергою у групі сумісної терапії були виявлені серйозніші кровотечі: 288 (3,1%) та 170 (1,9%) хворих відповідно (р<0,001). Ривароксабан у монотерапії (5 мг двічі на день) не сприяв кращим СС-наслідкам, ніж АСК, і призвів до масивніших кровотеч (Eikelboom et al., 2017).
Насамкінець професор Н. Борнштейн зауважив, що застосування АСК у дозі 50‑150 мг/добу дозволяє на 15% знизити ризик повторного інсульту та/або ТІА. Всі варіанти антитромбоцитарної терапії є ефективними для ініціального лікування; деякі переваги над АСК має використання комбінації АСК із дипіридамолом та лише клопідогрелю. При застосуванні антитромбоцитарнї терапії слід враховувати наявність виразкової хвороби шлунка, дванадцятипалої кишки та за необхідності призначати інгібітори протонної помпи, особливо пацієнтам віком понад 80 років.
У бесідах із хворими важливо наголошувати на наявності доступної можливості знизити ризик СС-катастроф за допомогою жорсткого контролю артеріального тиску, показників ліпідограми, вмісту глюкози у крові та об’єму талії; дозованих фізичних навантажень, відмови від куріння, дотримання рекомендацій щодо режиму харчування, обмеження вживання алкоголю.
.jpg) Із лекцією «Ішемічний інсульт: генетичне підґрунтя прокоагуляції та судинної патології» виступив завідувач кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету, д. мед. н., професор Михайло Михайлович Орос. Доповідач присвятив промову цікавому питанню генетичного підґрунтя розвитку ішемічного інсульту.
Із лекцією «Ішемічний інсульт: генетичне підґрунтя прокоагуляції та судинної патології» виступив завідувач кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету, д. мед. н., професор Михайло Михайлович Орос. Доповідач присвятив промову цікавому питанню генетичного підґрунтя розвитку ішемічного інсульту.
На початку виступу пан Михайло нагадав авдиторії продукти транскрипції генів-предикторів, серед яких:
- ангіотензинперетворювальний фермент, ангіотензиноген (ренін-ангіотензинова система);
- аполіпопротеїн Е, ліпопротеїнліпаза, параоксоназа (ліпідний обмін);
- метилентетрагідрофолатредуктаза (обмін гомоцистеїну);
- фактори згортання крові (V, VII, XII) й фібринолізу, протромбін (система гемостазу);
- ендотеліальну NO-синтетазу (ендотеліальна система).
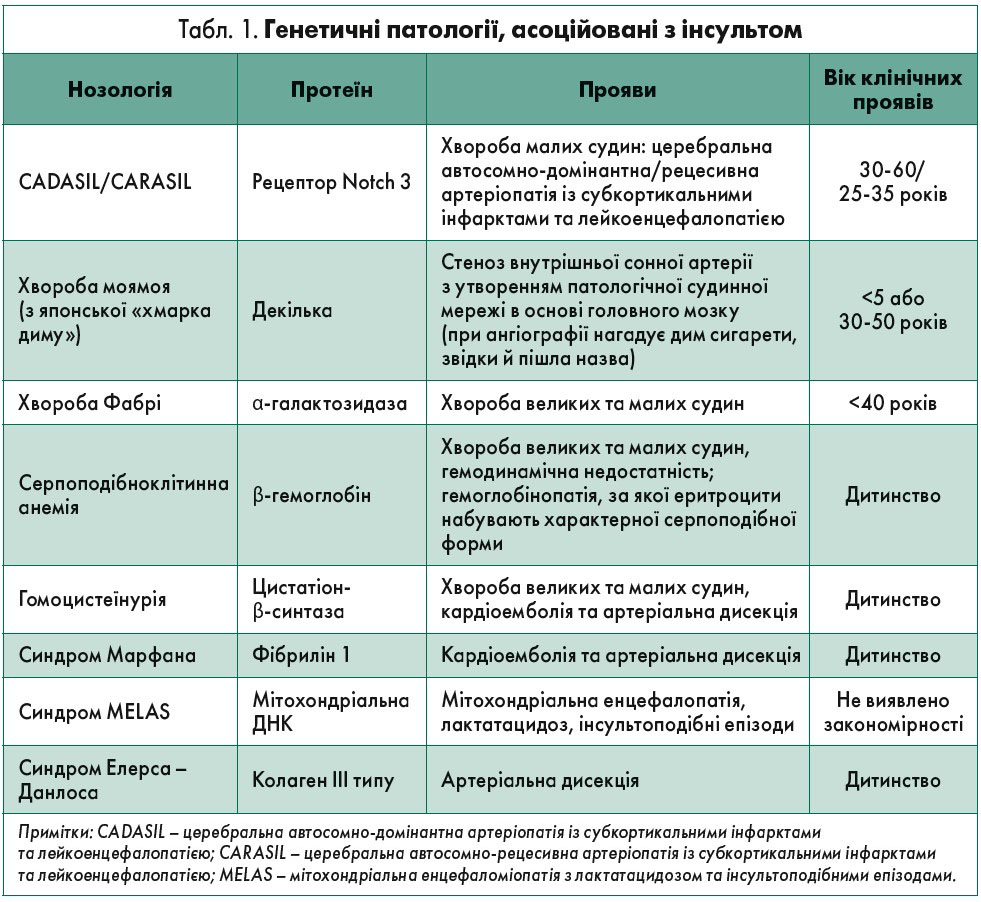
Підвищений рівень прокоагулянтів (фактори V, VII, VIІІ, ІX, XI; мутація в гені протромбіну G20210A), зменшення вмісту ендогенних антикоагулянтів (антитромбін, протеїни С та S), аномалії фібринолізу (дефіцит плазміногену, тканинного активатора плазміногену, підвищення рівня інгібітора активатора плазміногену) корелюють із випадками ішемічного інсульту. Професор рекомендував за кожного розвитку інсульту виключити генетично зумовлені патології, представлені в таблиці 1.
За даними багатьох досліджень, АСК неефективна у 5% пацієнтів, що може бути пов’язано з поліморфізмом гена, який кодує циклооксигеназу 1. Клопідогрель, своєю чергою, не викликає потрібного зниження агрегації більше ніж у 15% пацієнтів, оскільки ефективність препарату залежить від активності печінкових ізоферментів CYP3A, а також варіанта гена, що кодує рецептор аденозиндифосфату. Блокатори глікопротеїнових ІІb/ІІІа-рецепторів тромбоцитів недостатньо ефективні у 20% хворих, що асоційовано з поліморфізмом генів, які кодують рецептори глікопротеїнів.
Таким чином, за словами доповідача, для підбору антиагрегантної терапії необхідно застосовувати індивідуальний підхід із використанням генетичних тестів, що ґрунтуються на даних фармакогенетичних досліджень, та чітко встановлювати причину розвитку інсульту, бо ця судинна катастрофа може бути проявом генетично зумовленої патології.
.jpg) Голова Української асоціації нейрохірургів, член тренувального комітету Європейської асоціації нейрохірургічних товариств, завідувач кафедри неврології, нейрохірургії та психіатрії медичного факультету Ужгородського національного університету Володимир Іванович Смоланка виступив із доповіддю «Нейроваскулярні компресійні синдроми: обґрунтованість нейрохірургічної тактики». Він детально висвітлив інформацію про нейроваскулярний конфлікт – стан, що виникає внаслідок компресії аномально розташованою судиною одного з черепно-мозкових нервів та характеризується гіперзбудливістю й невропатією відповідного нерва (III, V, VII, VIII, IX, XI). Найуразливішим місцем для судинної компресії є зона поблизу входу нерва у стовбур мозку – саме там відбувається перехід периферичного (шванівські клітини) у центральний мієлін (олігодендроглія). Результатом нейроваскулярного конфлікту є демієлінізація в цій зоні та розвиток нейрональної гіперактивності, порушення деполяризації, генерація ектопічних імпульсів та периферична сенситизація.
Голова Української асоціації нейрохірургів, член тренувального комітету Європейської асоціації нейрохірургічних товариств, завідувач кафедри неврології, нейрохірургії та психіатрії медичного факультету Ужгородського національного університету Володимир Іванович Смоланка виступив із доповіддю «Нейроваскулярні компресійні синдроми: обґрунтованість нейрохірургічної тактики». Він детально висвітлив інформацію про нейроваскулярний конфлікт – стан, що виникає внаслідок компресії аномально розташованою судиною одного з черепно-мозкових нервів та характеризується гіперзбудливістю й невропатією відповідного нерва (III, V, VII, VIII, IX, XI). Найуразливішим місцем для судинної компресії є зона поблизу входу нерва у стовбур мозку – саме там відбувається перехід периферичного (шванівські клітини) у центральний мієлін (олігодендроглія). Результатом нейроваскулярного конфлікту є демієлінізація в цій зоні та розвиток нейрональної гіперактивності, порушення деполяризації, генерація ектопічних імпульсів та периферична сенситизація.
Із метою діагностики нейроваскулярних компресійних синдромів використовують магнітно-резонансну томографію (МРТ) у режимі швидкої візуалізації з імпульсними послідовностями (FIESTA), аналогічному TrueFISP та balanced-FFE.
Доповідач докладно повідомив про етіологію:
- геміфасціального спазму, що, вірогідно, є наслідком компресії VII нерва задньою нижньою мозочковою або хребтовою артерією;
- невралгії язикоглоткового нерва, яка часто спричинена компресією задньою нижньою мозочковою та хребтовою артеріями.
Результати довготривалих досліджень свідчать про ефективність хірургічного лікування згаданих вище синдромів.
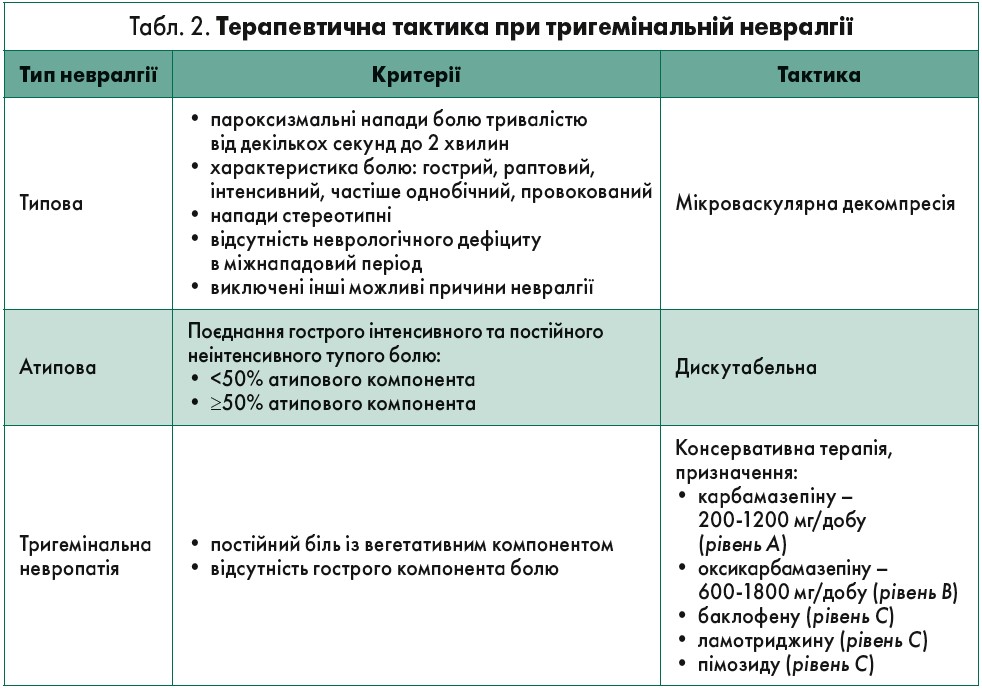
В.І. Смоланка детально розглянув мікроваскулярну декомпресію VІІІ пари черепних нервів при тинітусі. На жаль, це питання залишається дискутабельним, а тактика лікаря при виявленні тригемінальної невралгії залежить від клінічної картини (табл. 2).
За відсутності судинно-нервового конфлікту доступними хірургічними методами є радіочастотна та гліцеринова різотомія, балонна мікрокомпресія, радіохірургія. Загалом своєчасне хірургічне втручання з метою декомпресії нерва дозволяє вчасно зупинити прогресування демієлінізації. За словами доповідача, консервативна терапія не впливає на цей патологічний процес, а лише зменшує больовий синдром та маскує проблему до моменту незворотної демієлінізації нерва. «Необхідно зважено приймати рішення щодо показань до хірургічного лікування. Наприклад, ефективна консервативна терапія із застосуванням препаратів у невеликих дозах, наявність протипоказань до загальної анестезії є підставами для продовження використання консервативних методів», – підсумував В.І. Смоланка.
 «Виклик до українських нейрохірургів: не пропустити об’ємного процесу» – так звучала назва доповіді лікаря-нейрохірурга, онколога, асистента опорної кафедри нейрохірургії Національної медичної академії післядипломної освіти імені П.Л. Шупика (м. Київ) Антона Антоновича Шкіряка. За його твердженням, в Україні нараховується 975 тис. онкохворих, і близько 60% із них мають чи матимуть вторинні метастази в головний мозок. У 2017 р. загальна кількість випадків захворювання становила 1869; із числа пацієнтів, у яких патологія була вперше виявленою, 49,2% не прожили одного року, а в 3,3% діагноз встановили посмертно. Лектор рекомендує керуватися сучасним протоколами, розробленими Національною комплексною онкологічною мережею (NCCN).
«Виклик до українських нейрохірургів: не пропустити об’ємного процесу» – так звучала назва доповіді лікаря-нейрохірурга, онколога, асистента опорної кафедри нейрохірургії Національної медичної академії післядипломної освіти імені П.Л. Шупика (м. Київ) Антона Антоновича Шкіряка. За його твердженням, в Україні нараховується 975 тис. онкохворих, і близько 60% із них мають чи матимуть вторинні метастази в головний мозок. У 2017 р. загальна кількість випадків захворювання становила 1869; із числа пацієнтів, у яких патологія була вперше виявленою, 49,2% не прожили одного року, а в 3,3% діагноз встановили посмертно. Лектор рекомендує керуватися сучасним протоколами, розробленими Національною комплексною онкологічною мережею (NCCN).
Пан Антон представив алгоритм роботи з пацієнтом із пухлиною головного мозку:
- Виявлення на МРТ ознак пухлини головного мозку.
- Виклик мультидисциплінарної команди: визначення об’єму максимально безпечної резекції.
- Стереотаксична або відкрита біопсія.
- Проведення контрольної МРТ.
«За кожним клінічним випадком необхідно бачити життя пацієнта та надавати лікування згідно з актуальними протоколами», – підсумував доповідь А.А. Шкіряк.
 Із доповіддю «Цервікогенний головний біль та потилична невралгія: критерії діагностики і тактика» виступив лікар-нейрохірург універсальної клініки «Оберіг» (м. Київ) Вадим Ігоревич Ілляшенко. Спікер поділився досвідом курації пацієнтів із цервікогенним головним болем, патогенез якого пов’язаний із розладами та ураженнями в межах шийного відділу хребта та м’яких тканин шиї: потиличних нервів, атланто-потиличного, верхньошийних міжхребцевих суглобів (С1-С2, С2-С3, С3-С4) і дисків, зв’язок, нервових корінців, хребтової артерії, м’язів. Особливий акцент було зроблено на потиличній невралгії, яка проявляється одно- або двобічним пароксизмальним стріляючим або колючим болем у задній частині скальпу, в зоні розташування великого, малого та третього потиличного нерва, й супроводжується зниженням чутливості, дизестезією в області іннервації.
Із доповіддю «Цервікогенний головний біль та потилична невралгія: критерії діагностики і тактика» виступив лікар-нейрохірург універсальної клініки «Оберіг» (м. Київ) Вадим Ігоревич Ілляшенко. Спікер поділився досвідом курації пацієнтів із цервікогенним головним болем, патогенез якого пов’язаний із розладами та ураженнями в межах шийного відділу хребта та м’яких тканин шиї: потиличних нервів, атланто-потиличного, верхньошийних міжхребцевих суглобів (С1-С2, С2-С3, С3-С4) і дисків, зв’язок, нервових корінців, хребтової артерії, м’язів. Особливий акцент було зроблено на потиличній невралгії, яка проявляється одно- або двобічним пароксизмальним стріляючим або колючим болем у задній частині скальпу, в зоні розташування великого, малого та третього потиличного нерва, й супроводжується зниженням чутливості, дизестезією в області іннервації.
Діагностичні критерії потиличної невралгії включають:
1. Одно- або двобічний біль у зоні розташування великого, малого та третього потиличного нерва.
2. Біль відповідає як мінімум двом характеристикам:
- пароксизмальні напади, що повторюються, тривалістю від декількох секунд до хвилин;
- виразна інтенсивність;
- стріляючий, колючий гострий біль.
3. Біль відповідає таким критеріям (першому та другому або третьому):
- дизестезія/алодинія при звичайній стимуляції скальпа та/або волосся;
- болючість над ураженими гілками нервів;
- тригерні точки в місці виходу великого потиличного нерва або зоні поширення С2.
4. Біль короткочасно зникає після блокування ураженого нерва місцевим анестетиком.
5. Біль не можна пояснити іншими діагнозами.
В.І. Ілляшенко зазначив, що біль може поширюватися у фронтотемпоральну ділянку через тригеміно-цервікальні міжнейрональні зв’язки у спінальному ядрі трійчастого нерва. Компресію потиличних нервів може зумовлювати їхній перетин і проходження через м’язи, фасції, апоневрози, артерії, а також рухомість краніовертебрального переходу.
Із терапевтичною метою лікар рекомендував призначати нестероїдні протизапальні препарати, міорелаксанти, габапентиноїди (150‑450 мг протягом 12 тижнів); застосовувати блокади під ультразвуковим контролем (дозволяє зменшити біль та провести гідродисекцію), використовувати мануальну терапію, модифікацію рухової активності, належну організацію робочого місця.
Підготувала Маргарита Марчук
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 3 (50) жовтень 2019 р.