6 березня, 2020
Діабетична автономна нейропатія: основні аспекти патогенезу, діагностики та оптимізація ведення пацієнтів
За оцінками Міжнародної федерації діабету, у 2017 році цукровий діабет (ЦД) був діагностований у 451 млн людей в усьому світі. Крім цього, очікується, що до 2045 р. ця цифра зросте до 693 млн. Проблему загострює ще й той факт, що діагноз ЦД офіційно встановлений лише приблизно в половини фактично хворих. Отже, усі ці люди не отримують належного лікування, що призводить до швидкого прогресування захворювання та розвитку тяжких, загрозливих для життя ускладнень і смерті [1]. Одним із таких ускладнень, яке чи не найбільше впливає на якість життя пацієнтів і при цьому недостатньо добре діагностується та лікується, є діабетична автономна нейропатія (ДАН). Найчастіше це захворювання проявляється симптомами з боку серцево-судинної системи та шлунково-кишкового тракту [2].
Патогенез
В основі розвитку ДАН лежить ураження периферичної і вегетативної нервової системи гіперглікемією. Цей процес зумовлений складним мультифакторіальним механізмом руйнування клітин нервової тканини та їх відростків, який включає декілька
складових:
1. Поліольний шлях.
При його активації внутрішньоклітинна глюкоза перетворюється на сорбітол, що енергозалежним шляхом обмежує активність ферменту альдозоредуктази, через нікотинамідаденіндинуклеотид фосфат [3]. Усе це може призвести до осмотичного пошкодження та зменшення активності Na+/K+ -ATФ-ази [4]. Ці процеси спричиняють підвищення рівня внутрішньоклітинного оксидативного стресу [5].
2. Гексозамінний шлях.
При цьому фруктоза-6-фосфат перетворюється на глюкозамін-6-фосфат, що обмежує активність ферменту глютамін фруктози-6-фосфат-амідотрансферази.
3. Утворення активних форм кисню.
Реактивні форми кисню (РФК) відіграють важливу роль у розвитку серцево- судинних захворювань через надмірне утворення оксидантів, зниження біодоступності оксиду азоту та антиоксидантних процесів у судинному руслі та нирках [6].
4. Активація діацилгліцерольного та асоційованого з протеїнкіназою-С шляхів.
Активація поліольного шляху та зниження активності Na+/K+ -ATФ-ази запускає діацилгліцерольний та асоційований із протеїнкіназою-С шляхи. Останній збільшує активність цитозольної фосфоліпази А2 і провокує продукцію прозапальних медіаторів,
таких як простагландин Е2, який інгібує клітинну (Na+/K+) АТФ-азу [7].
5. Утворенння кінцевих продуктів гліколізу.
Гіперглікемія зумовлює утворення кінцевих продуктів гліколізу, представлених глікозильованими сполуками білків та ліпідів, що призводить до зниження окислювально-відновлювальних процесів у нейронах [8].
Сукупність цих біохімічних шляхів, у поєднанні з активацією системи комплементу, утворює кумулятивний каскад, який ініціює та підтримує запальний процес у нейронах, що й спостерігається при ДАН [9].
Класифікація
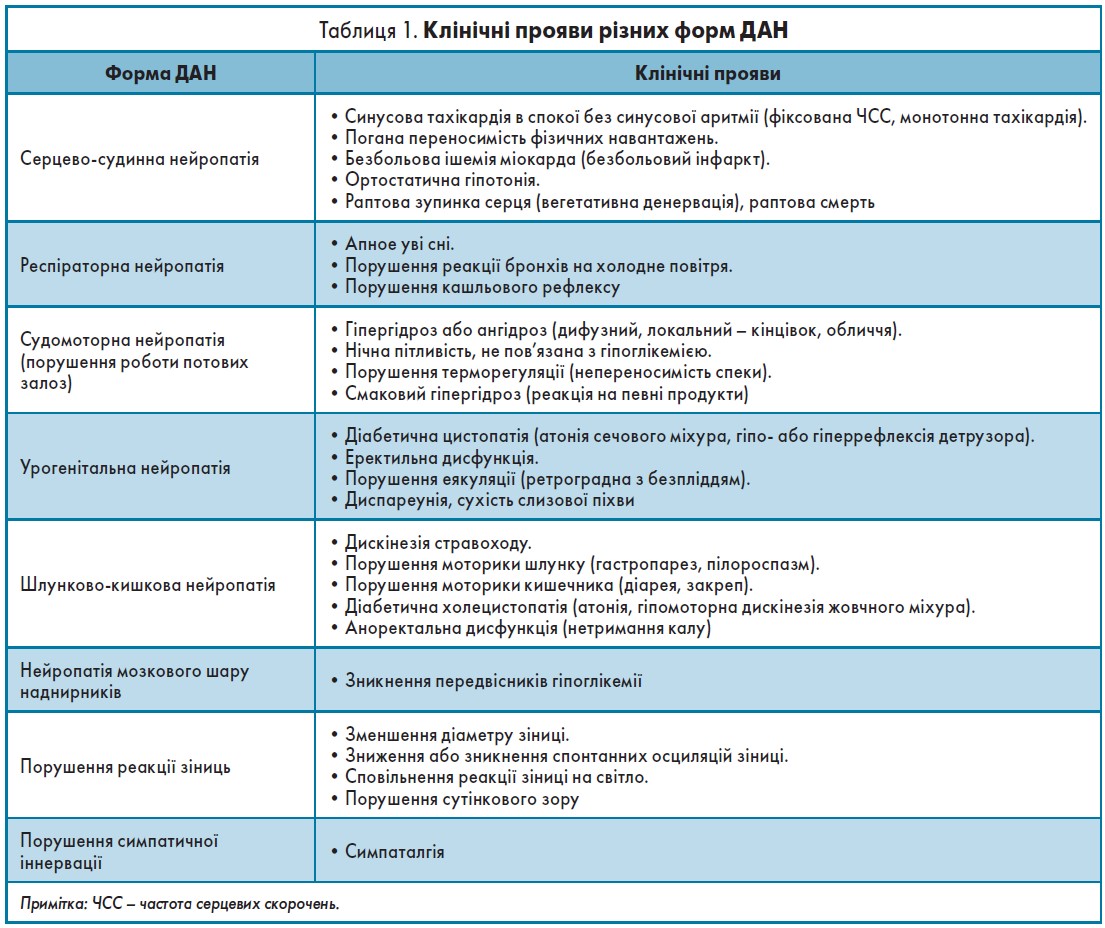
Вегетативні порушення, спричинені ДАН, поділяють на органоспецифічні та системні. У межах цих груп можна виділити різноманітні клінічні форми ДАН, які представлені в таблиці 1 [10].
Як було зазначено, найпоширенішими проявами ДАН є симптоми з боку серцево-судинної системи та шлунково- кишкового тракту.
Серцево-судинна автономна нейропатія (ССАН)
У низці масштабних контрольованих клінічних досліджень було підтверджено, що наявність ССАН достовірно підвищує рівень смертності в пацієнтів із ЦД. Так, згідно з результатами одного з останніх метааналізів середній рівень смертності пацієнтів із ЦД за 5,5 року становить 5%, але цей показник зростав до 27% у пацієнтів з ознаками ССАН [12].
Основні прояви ССАН [11]:
1. Тахікардія в спокої та непереносимість фізичного навантаження.
Рання маніфестація ССАН проявляється саме цими симптомами. Клінічно значимим є те, що в зазначеній категорії пацієнтів відсутня звична реакція ЧСС на фізичне навантаження, наприклад глибоке дихання або проба Вальсальви.
Зниження систолічного артеріального тиску (САТ) до ≥20 мм рт. ст. або діастолічного АТ (ДАТ) до ≥10 мм рт. ст. через 3 хв після зміни горизонтального положення тіла на вертикальне визначається як ортостатична гіпотензія. Указаний симптом достовірно підвищує 10-річний ризик смерті в пацієнтів із ЦД. Ортостатична гіпотензія може ускладнюватися:
- утратою добової варіабельності АТ, що супроводжується нічною артеріальною гіпертензією;
- посиленням щоденної варіабельності симптомів при використанні інсуліну, який провокує гіпотензію у пацієнтів з/без ЦД;
- постпрандіальною гіпотензією.
3. Постуральна тахікардія.
4. Безбольова ішемія міокарда.
У дослідженні DIAD аденозиновий стрес-тест із радіонуклідною оцінкою перфузії міокарда виявив ішемію у 22% хворих на ЦД без клінічних проявів cтенокардії.
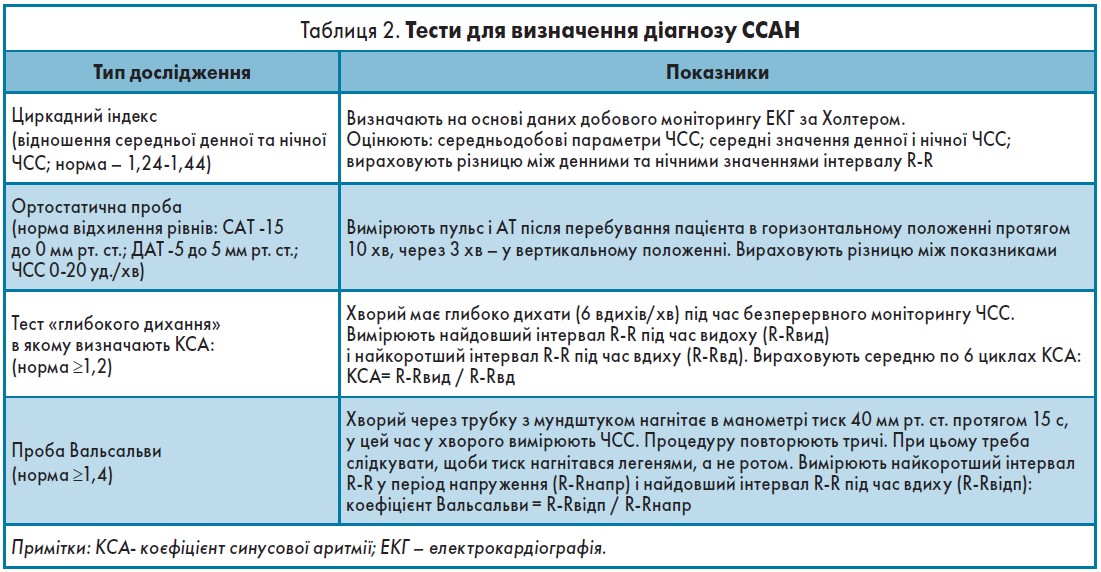
Діагноз ССАН можна встановити за допомогою простих і доволі інформативних тестів [10], представлених у таблиці 2. Принципово, що жоден із цих тестів не дає можливості достовірно діагностувати автономну серцево-судинну нейропатію, їх потрібно оцінювати в комплексі.
Шлунково-кишкова нейропатія (ШКН)
Показники поширеності ШКН у пацієнтів із ЦД широко варіюють в різних дослідженнях і залежать від тривалості, тяжкості та ступеня контролю ЦД. У різноманітних популяційних дослідженнях поширеність гастропарезу в пацієнтів із ЦД варіювала від 1 до 5%, а діареї – від 8 до 12% [13].
ШКН проявляється симптомами [13]:
1. Гастроезофагеальної рефлюксної хвороби (ГЕРХ).
Симптоми не відрізняються від класичного перебігу ГЕРХ та включають печію, регургітацію і, у деяких випадках, кашель.
2. Гастропарезу.
Основні скарги:
- нудота;
- блювання;
- відчуття швидкого насичення їжею;
- метеоризм;
- і/або біль в епігастрії.
3. Діабетичної діареї (рідше – стеатореї).
Основні складові патогенезу діареї в пацієнтів із ЦД:
- посилена моторика тонкого кишечника;
- надмірний ріст бактерій;
- порушення моторики товстого кишечника;
- аноректальна дисфункція – знижений ректальний сенсорний поріг, слабкий внутрішній анальний сфінктер;
- підвищена кишкова секреція;
- екзокринна недостатність підшлункової залози.
У пацієнтів із діабетичною ентеропатією діарея безболісна, водяниста, частіше виникає вночі та може супроводжуватися нетриманням калу.
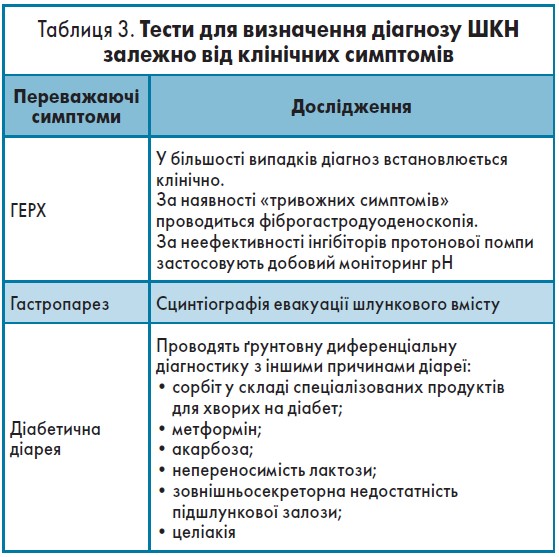 Діагностичні тести [13] представлені в таблиці 3.
Діагностичні тести [13] представлені в таблиці 3.
Лікування ДАН
Основна мета лікування – уповільнення прогресування симптомів та покращання якості життя пацієнтів. Загальні рекомендації включають [11]:
1. Контроль рівня глікемії.
2. Відмову від куріння.
3. Контроль рівня АТ.
4. Лікування дисліпідемії.
Медикаментозна терапія, з одного боку, має впливати на основні ланки патогенезу захворювання, а з іншого – зменшувати його клінічні прояви.
Оскільки вагому роль у патогенезі ДАН відіграє оксидативний стрес, повністю виправданим є призначення пацієнтам антиоксидантів. Добре відомим препаратом цієї групи, ефективність та безпека якого продемонстровані в низці контрольованих клінічних досліджень, є тіоктова (α-ліпоєва) кислота (АЛК). АЛК знищує вільні радикали, посилює активність нативних антиоксидантів, захищає дистальні нерви від перекисного окислення ліпідів та підвищує активність каталази та супероксиддисмутази – усе це сприяє нормалізації порушеного ендоневрального кровотоку й швидкості нервової провідності, що обґрунтовує доцільність застосування АЛК у лікуванні хворих на ДАН [14].
Ефективність і безпека
Позитивний вплив AЛК на моторику товстого кишечника та внутрішньокишковий транзит у хворих на ЦД був показаний на доклінічній моделі [17].
В одному рандомізованому плацебо-контрольованому подвійному сліпому багатоцентровому дослідженні пацієнти були випадковим чином розподілені на 2 групи. Перша група отримувала AЛК у пероральній дозі 600 мг/добу протягом перших 12 тиж, а потім 1200 мг/добу протягом наступних 12 тижнів. Друга група отримувала плацебо протягом 24 тижнів. ССАН оцінювали шляхом вимірювання варіабельності серцевого ритму (ВСР). Початкові показники ВСР були порівнюваними в обох групах. Після 24-тижневого періоду дослідники виявили позитивну тенденцію в деяких параметрах ВСР у групі, що приймала АЛК. Стандартні відхилення інтервалів R-R у положенні стоячи збільшилися на 1,87 мс у групі AЛК і зменшилися на -3,97 мс у групі плацебо (р=0,06). Спектральна потужність низькочастотного діапазону в положенні стоячи збільшилася на 15,77 мс2 у групі AЛК, у групі плацебо – зменшилася на -15,04 мс2 (р=0,08). Коефіцієнт спектральної потужності низькочастотного діапазону у вертикальному положенні в групі AЛК збільшився на 0,35, у групі плацебо – знизився на -0,42 (р=0,06). Не було відмінностей між двома групами щодо частоти побічних реакцій [15].
Аналогічні результати отримали Ziegler та співавт. у рандомізованому подвійному сліпому плацебо-контрольованому багатоцентровому дослідженні за участю пацієнтів із ССАН, які не отримували інсулін. Випадковим чином вони були розподілені на 2 групи, одна з яких отримувала AЛК, а інша – плацебо. Оцінка показників ВСР через 4 тиж показала, що AЛК добре переносилася хворими та покращила симптоматику ССАН [16].
Позитивний вплив AЛК на моторику товстого кишечника та внутрішньокишковий транзит у хворих на ЦД було продемонстровано на доклінічній моделі [17].
AЛК німецької якості є активною діючою речовиною препарату Берлітіон®, представлений на фармацевтичному ринку компанією «Берлін-Хемі/А.Менаріні ГмбХ Україна». Берлітіон® випускається у вигляді двох лікарських форм: концентрати 300 ОД та 600 ОД для розчину інфузій та капсули. Ін’єкційні форми особливо зручні в умовах стаціонару, вони нівелюють можливі фармакокінетичні взаємодії з іншими препаратами, які застосовують хворі на ЦД перорально, наприклад цукрознижувальними. Капсули Берлітіон® 600 мають желатинову оболонку, не містять лактозу (на відміну від інших АЛК на ринку України) та забезпечують безперервність лікування та належний комплаєнс в амбулаторних пацієнтів, які завершили лікування в стаціонарі. Таким чином, висока ефективність та безпека цього лікарського засобу, підтверджені результатами клінічних досліджень та довготривалим успішним застосуванням в умовах реальної клінічної практики, робить Берлітіон® оптимальним препаратом для комплексного лікування проявів діабетичної автономної нейропатії.
Література
- Cho N.H., Shaw J.E., Karuranga S. et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045.
- Christina Brock, Birgitte Brock, Anne Grave Pedersen et al. Assessment of the cardiovascular and gastrointestinal autonomic complications of diabetes. World J Diabetes. 2016 Aug 25; 7(16):321-332.
- Kitada M., Zhang Z., Mima A., King G.L. Molecular mechanisms of diabetic vascular complications. J. Diabetes Investig. 2010;1:77-89.
- Williamson J.R., Chang K., Frangos M. et al. Hyperglycemic pseudohypoxia and diabetic complications. Diabetes. 1993;42:801-813.
- Chung S.S., Ho E.C., Lam K.S., Chung S.K. Contribution of polyol pathway to diabetes-induced oxidative stress. J Am Soc Nephrol. 2003;14:233-236.
- Paravicini T.M, Touyz R.M. NADPH oxidases, reactive oxygen species, and hypertension: clinical implications and therapeutic possibilities. Diabetes Care. 2008; 31 Suppl 2:170-180.
- Koya D., King G.L. Protein kinase C activation and the development of diabetic complications. Diabetes. 1998;47:859-866.
- Goldin A., Beckman J.A., Schmidt A.M., Creager M.A. Advanced glycation end products: sparking the development of diabetic vascular injury. Circulation. 2006;114:597-605.
- Flyvbjerg A. Diabetic angiopathy, the complement system and the tumor necrosis factor superfamily. Nat Rev Endocrinol. 2010;6:94-101.
- Котов С.В., Рудакова И.Г., Исакова Е.В., Волченкова Т.В. Диабетическая нейропатия: разнообразие клинических форм (лекция). РМЖ «Медицинское обозрение» № 11 от 31.05.2017. – С. 822-830.
- Christopher H. Gibbons. Diabetic autonomic neuropathy. Literature review current through: Sep 2019. | This topic last updated: Mar 12, 2019.
- Ziegler D. Cardiovascular autonomic neuropathy: clinical manifestations and measurement. Diabetes Reviews 1999; 7:342.
- Thomas Frieling. Diabetic autonomic neuropathy of the gastrointestinal tract.
- Victoria Serhiyenko, Ludmila Serhiyenko, Alexandr Serhiyenko. Alpha-lipoic acid and diabetic cardiac autonomic neuropathy. MOJ Public Health. 2019;8(1):8-10.
- Sol Jae Lee, Su Jin Jeong, Yu Chang Lee et al. Effects of High-Dose α-Lipoic Acid on Heart Rate Variability of Type 2 Diabetes Mellitus Patients with Cardiac Autonomic Neuropathy in Korea. Diabetes Metab J. 2017 Aug; 41(4):275-283.
- Ziegler D., Schatz H., Conrad F. et al. Effects of treatment with the antioxidant alpha-lipoic acid on cardiac autonomic neuropathy in NIDDM patients. A 4-month randomized controlled multicenter trial (DEKAN Study). Deutsche Kardiale Autonome Neuropathie. Diabetes Care. 1997 Mar;20(3):369-73.
- Kumar M.S., Prashanth K.V. alpha-Lipoic acid ameliorates altered colonic contractility and intestinal transit in STZ-diabetic rats. Indian J Exp Biol. 2004 Mar;42(3):279-82.
Підготувала Ганна Кирпач
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 3 (47) жовтень 2019 р.