27 квітня, 2020
Сучасні підходи до діагностики та лікування діабетичної соматичної та вегетативної нейропатії
Рання діагностика та моніторинг діабетичної периферичної нейропатії (ДПН) передбачені низкою міжнародних настанов, зокрема Торонтським консенсусом і офіційною позицією Американської діабетичної асоціації (ADA) щодо ДПН. Згідно з викладеними в цих документах рекомендаціями для встановлення діагнозу ДПН достатньо хоча б одного симптому чи ознаки нейропатії в поєднанні з аномальними результатами нейрофізіологічних досліджень.
Для діагностики ДПН застосовують різноманітні опитувальники, комплексні неврологічні шкали та кількісне сенсорне тестування (КСТ) (табл. 1). Шкала NDS (Neuropathy Disability Score), комплексна оцінка неврологічного дефіциту, Клінічна оцінка нейропатії Торонто та Мічиганський опитувальник для скринінгу нейропатії, безумовно, не зайві для моніторингу ДПН, однак залишаються недостатньо чутливими для оцінки параметрів ефективності лікування в клінічних дослідженнях відносно невеликої тривалості (12-24 міс). Утім, їх продовжують використовувати, незважаючи на підтверджену недоцільність.
КСТ є безболісним неінвазивним методом діагностики дисфункції тонких і товстих нервових волокон, заснованим на оцінці порушення температурної, больової та вібраційної чутливості. Підвищений поріг сприйняття вібрації є фактором ризику виникнення виразок стопи та ампутації. Але метод є доволі суб’єктивним. Тактильну чутливість можна оцінити за допомогою 10-грамового монофіламенту, який зазвичай і використовується в якості інструменту скринінгу для ДПН, хоча насправді метод виявляє нейропатію не на початкових стадіях і більш доцільний для виявлення пацієнтів із підвищеним ризиком ампутації. Таким чином, усі описані методи діагностики виявляють ДПН уже на пізніх стадіях, що, своєю чергою, впливає на ефективність лікування.
Дослідження нервової провідності, в яких оцінюють функцію товстих нервових волокон, сьогодні вважаються золотим стандартом для підтвердження діагнозу ДПН. Типовими електрофізіологічними змінами при ДПН є зменшення амплітуди сумарного потенціалу дії м’язів, зменшення швидкості нервової провідності, збільшення латенції F-хвилі і порушення Н-рефлексу. Указаний метод особливо корисний для диференційної діагностики з іншими або супутніми нейропатіями, наприклад хроні чною запальною демієлінізуючою полінейропатією. Результати дослідження нервової провідності також використовують в якості первинної кінцевої точки, однак у більшості клінічних експериментів із вивчення ефективності заходів із лікування ДПН такий підхід не був успішним.
Отже, у разі застосування вищезгаданих тестів для оцінки відповіді на лікування, слід ураховувати декілька моментів. Хоча комплексні шкали та КСТ варті уваги при оцінці нейропатії, вони мають низьку чутливість, відтворюваність та гістопатологічну специфічність. Ці методи можуть бути корисними у великих поздовжніх когортних дослідженнях, але не в окремих пацієнтів або коротких клінічних дослідженнях III фази. Дослідження нервової провідності не можуть виявити нейропатію дрібних волокон і мають низьку відтворюваність, що ускладнює проведення багатоцентрових випробувань. Дійсно, указані методи виявилися неефективними для оцінки відповіді на лікування в клінічних дослідженнях з вивчення нейропатії.
Оцінка щільності внутрішньоепідермальних нервових волокон (ЩВЕНВ) при шкірній біопсії є об’єктивним та більш відтворюваним методом виявлення патології дрібних нервових волокон. ЩВЕНВ знижується уже при предіабеті, прогнозує виникнення нейропатії та покращується при модифікації способу життя. На відміну від нейрофізіологічних методів результати біопсії шкіри не спотворюються залежно від росту й ваги, хоча повідомлено про кореляцію результатів відповідно до віку та статі. На сьогодні опубліковані настанови щодо шкірної біопсії для діагностики ДПН. Однак широке рутинне використання біопсії шкіри в клінічній практиці обмежене вартістю, потребою у спеціалізованому центрі проведення та оцінки результатів тестування, ризиком кровотечі та інфікування після процедури.
Конфокальна мікроскопія рогівки (КМР) – це метод неінвазивної офтальмологічної візуалізації, який є потужною кінцевою точка для оцінки ДПН та інших нейропатій. КМР можна з високою відтворюваністю використовувати для кількісної оцінки патології дрібних волокон. С-волокна рогівки утворюють нервове сплетення під базальною мембраною; вони дуже чутливі до стану метаболізму, тому вражаються навіть при тимчасових і незначних метаболічних порушеннях. Недавно проведені дослідження показали цінність КМР для діагностики та прогнозування ДПН на основі оцінки щільності та довжини нервових волокон рогівки. Крім того, КМР раніше за інші методи, схвалені Агентством із санітарного контролю якості харчових продуктів і медикаментів США (FDA) в якості первинних точок (наприклад, нейрофізіологічне тестування та шкірна біопсія), виявила регенерацію нервів рогівки в клінічних дослідженнях, що значуще впливає на дизайн майбутніх клінічних випробувань.
Хворобо-модифікуюча терапія ДПН
Офіційна позиція ADA 2017 року щодо діабетичної нейропатії рекомендує раннє її виявлення навіть при предіабеті. Сьогодні відсутні затверджені FDA методи лікування, які б впливали на перебіг ДПН; єдиним методом профілактики прогресування захворювання є контроль глікемії. Доведено, що покращення глікемічного контролю при цукровому діабеті (ЦД) 1 типу дає можливість запобігти розвитку та пригальмувати прогресування нейропатії. Але доказів того, що досягнення цільового рівня глікемії сповільнює динаміку появи та перебігу ДПН при ЦД 2 типу, недостатньо. Дослідження EURODIAB IDDM з оцінки ускладнень інсулінзалежного ЦД (n=3 тис) за участю пацієнтів із ЦД 1 типу із європейських діабетологічних центрів тривало 7 років. У процесі експерименту були виявлені такі фактори ризику ДПН: поганий контроль глікемії, підвищений рівень холестерину ліпопротеїнів низької щільності (ЛПНЩ) та тригліцеридів, артеріальна гіпертензія, ожиріння та куріння.
У рандомізованих плацебо-контрольованих дослідженнях було підтверджено, що лікування інгібітором ангіотензинперетворювального ферменту, як у вигляді монотерапії, так і в поєднанні з блокатором кальцієвих каналів, у пацієнтів із ЦД 1 типу покращують перебіг ДПН. Статини і фібрати також показали ефективність у запобіганні розвитку ДПН та були пов’язані зі зменшенням частоти інфекцій діабетичної стопи та ампутацій нижніх кінцівок і збільшенням рівня загоєння виразок стопи. Результати останніх експериментів свідчать на користь застосування комбінованої терапії, націленої на декілька ланок патогенезу в якості найбільш ефективного підходу до лікування ДПН.
Больова форма ДПН
Діагностика
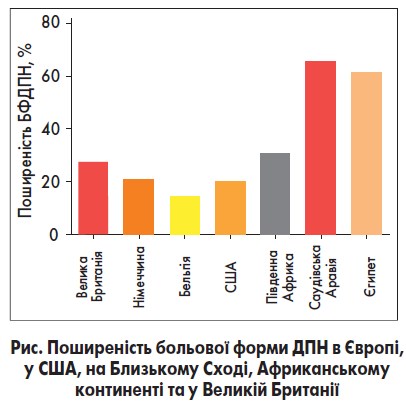 Больова форма ДПН (БФДПН) – це прояв ураження малих нервових волокон, який характеризується появою пекучого болю і поколювання, що посилюються вночі. Ці симптоми суттєво погіршують якість життя пацієнтів та можуть призвести до депресії, тривоги і розладів сну. За різними оцінками, поширеність БФДПН коливається від 14,0 до 65,3% (рис.).
Больова форма ДПН (БФДПН) – це прояв ураження малих нервових волокон, який характеризується появою пекучого болю і поколювання, що посилюються вночі. Ці симптоми суттєво погіршують якість життя пацієнтів та можуть призвести до депресії, тривоги і розладів сну. За різними оцінками, поширеність БФДПН коливається від 14,0 до 65,3% (рис.).
Такий широкий діапазон пояснюється неоднорідністю популяцій та різними методами оцінки, що їх було використовано в кожному з досліджень. Поширеність БФДПН вища на вторинному рівні медичної допомоги порівняно з первинним та в пацієнтів із ЦД 2 типу проти хворих на ЦД 1 типу. Важливо зазначити, що в доволі значної кількості пацієнтів (12,5-61,5%) БФДПН залишається недіагностованою. Хворі часто вважають, що біль не пов’язаний із діабетом, і не розповідають про цей симптом своїм лікарям. Похилий вік, більша тривалість діабету та наявність ДПН збільшують ризик БФДПН. Ожиріння, низька фізична активність, куріння, поганий контроль глікемії, низький рівень холестерину ліпопротеїнів високої щільності та підвищений рівень холестерину ЛПНЩ, тригліцеридів та креатиніну також вважаються незалежними чинниками ризику розвитку БФДПН. Рання діагностика є ключовою в лікуванні БФДПН: результати досліджень показали, що модифікація способу життя в пацієнтів із предіабетом зменшувала симптоми нейропатії та покращувала функцію тонких нервових волокон. Активний скринінг пацієнтів із БФДПН, особливо тих, які мають фактори ризику, не лише забезпечує раннє виявлення та полегшення симптомів, але й дає можливість вплинути на перебіг і прогноз захворювання.
Є кілька скринінгових тестів, за допомогою яких можна диференціювати ноцицептивний і нейропатичний біль. Найпопулярнішими скринінговими тестами БФДПН є опитувальник DN4 (Douleur Neuropathique 4), Шкала нейропатичних симптомів та ознак Університету Лідса (LANSS) та Опитувальник нейропатичного болю (NPQ). Опитувальник DN4 складається з 10 питань (7 – щодо симптомів і 3 – щодо неврологічного дефіциту), оцінка ≥4 є високочутливою (83%) та специфічною (90%) для БФДПН. Шкала LANSS складається з 5 питань щодо симптомів і 2 – щодо неврологічного дефіциту, оцінка ≥12 є на 85% чутливою та на 80% специфічною для БФДПН. У NPQ міститься 10 питань щодо характеристики болю і 2 – щодо зміни чутливості, отримана оцінка виявляє БФДПН із чутливістю 74,7% та специфічністю 77,6%.
Лікування
Немає доказів того, що поліпшення глікемічного контролю покращує перебіг БФДПН; навпаки, швидке та різке зниження рівню глікованого гемоглобіну (HbA1c) може викликати гостру больову нейропатію. Традиційний підхід до лікування БФДПН полягає у використанні різних варіантів терапії, поки один із них не спрацює з мінімальною кількістю побічних ефектів. Однак покращення клінічного фенотипування та таргетування терапії, з огляду на механізми, що лежать в основі патології, є більш перспективним. Детальне фенотипування з використанням КСT показало, що пацієнти з фенотипом гіперзбудливих ноцицепторів, на відміну від тих, хто має фенотип ноцицепторів із нормальною збудливістю, краще відповідають на терапію окскарбазепіном: число пролікованих хворих на одного вилікуваного (ЧПХОВ) 3,9 проти 6,9 відповідно. Виявлення відхилень при зниженні амплітуди спінального рефлексу Хофмана (H-рефлексу) під впливом послідовних стимулів (RDD) також може допомогти виявити пацієнтів з оптимальною реакцією на терапію селективним інгібітором зворотного захоплення норадреналіну дулоксетином.
Трициклічні антидепресанти модулюють біль та забезпечують знеболювальний ефект шляхом непрямого впливу на опіоїдну систему головного мозку та за допомогою серотонінергічної та норадреналінової нейромодуляції. Найчастіше для цього використовують амітриптилін. У систематичному огляді Moore та співавт. оцінювали 17 досліджень із вивчення ефективності амітриптиліну (n=1342). Автори дійшли висновку, що якість досліджень була низькою, більшість із них мали високий ризик зацікавленості дослідників та недостатню кількість учасників. Для БФДПН рекомендують два інгібітори зворотного захоплення серотоніну та норадреналіну (ІЗЗСН): дулоксетин і венлафаксин. Механізм їх дії полягає в пригніченні ЗЗСН із потенціацією низхідних гальмівних шляхів. Кокранівський огляд, який включив 8 рандомізованих контрольованих досліджень (РКТ) (n=2728) показав, що дулоксетин у дозі 60 мг/добу перевершує плацебо (ЧПХОВ – 5). Прегабалін також схвалений FDA для лікування БФДПН на основі результатів численних РКТ. Snedecor та співавт. провели порівняльний метааналіз низки препаратів для лікування БФДПН та виявили, що прегабалін був найбільш ефективним у зменшенні болю за оцінкою згідно з візуальною аналоговою шкалою (ВАШ). Відповідно до рекомендацій Національного інституту здоров’я та клінічного вдосконалення (NICE) та офіційної позиції ADA щодо ДПН за 2017 рік дулоксетин і прегабалін вважаються препаратами першої лінії в терапії БФДПН. Мірогабалін також нещодавно продемонстрував належну ефективність і переносимість при лікуванні БФДПН у клінічних дослідженнях II та ІІІ фази. Застосовують у лікуванні БФДПН і трамадол, який проявляє властивості опіоїду та ІЗЗСН. Згідно з Кокранівським оглядом ефективність трамадолу в усуненні нейропатичного болю була підтверджена в невеликих дослідженнях із недостатнім розміром вибірки та ризиком виникнення системної помилки, хоча метааналіз і показав ЧПХОВ 4,4. Тапентадол пролонгованого вивільнення виявився ефективним у кількох РКД і рекомендований FDA для лікування БФДПН.
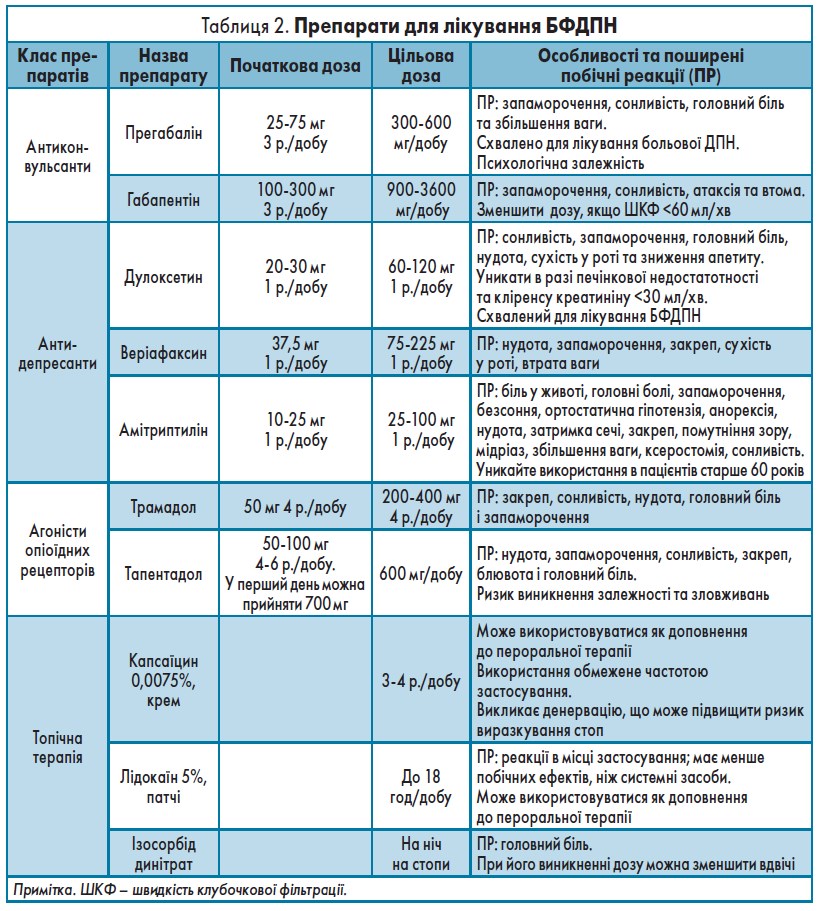
Дослідження COMBO-DN (Комбіноване лікування проти монотерапії прегабаліном і дулоксетином при діабетичній нейропатії) порівнювало монотерапію з комбінацією дулоксетину та прегабаліну. У результаті показники болю були порівнюваними як у комбінації (дулоксетин 60 мг/добу + прегабалін 300 мг/добу), так і в монотерапії у високих дозах (дулоксетин 120 мг/добу або прегабалін 600 мг/добу). Монотерапія виявилася більш доцільною в пацієнтів із сильним болем, тоді як хворі з легким або помірним болем мали переваги при комбінованому лікуванні. У подвійному сліпому паралельному РКТ амітриптилін, дулоксетин і прегабалін мали зіставнузнеболювальну ефективність. Таким чином, в якості препаратів першої лінії для симптоматичного лікування БФДПН можуть використовуватися прегабалін, габапентин, дулоксетин або амітриптилін, а в разі відсутності відповіді на терапію або виникнення побічних ефектів можна перейти на препарат другої лінії або додати до схеми лікування трамадол (табл. 2).
Застосування місцевих засобів, наприклад спрея або патчів із гліцерил тринітратом, забезпечує ЧПХОВ 4. Очікується, що в майбутньому підхід до лікування буде більш персоналізованим, з використанням таких маркерів, як RDD, КМР та геноміки для виявлення конкретних механізмів, вплив на які забезпечуватиме кращу відповідь на терапію.
Кардіальна автономна нейропатія
Консенсусна комісія міста Торонто (Канада) визначила кардіальну автономну нейропатію (КАН) як порушення серцево-судинного вегетативного контролю у хворих на ЦД після виключення всіх інших причин. КАН спостерігається в осіб із порушенням толерантності до глюкози (ПТГ), а аномальні показники при тестуванні серцево-судинних автономних рефлексів (ТСАР) – у 7% пацієнтів при діагнозі ЦД 1 типу та ЦД 2 типу. При цьому згідно з дослідженням DCCT/EDIC через 14 років поширеність ЦД 1 типу зросте до 30%, а відповідно до результатів інших досліджень через ≥15 років цей показник складатиме 70%. КАН є незалежним фактором ризику смерті (ФРС); він був найсильнішим ФРС від усіх причин у дослідженні EURODIAB (ЦД 1 типу) і незалежним ФРС у дослідженні ACCORD (ЦД 2 типу). Метааналіз 15 поздовжніх досліджень виявив зв’язок між КАН і підвищенням ризику смерті. Метааналіз 12 досліджень виявив «німу» ішемію міокарда (ІМ) у 20% пацієнтів із КАН проти 10% у загальній популяції. КАН також асоційований з дисфункцією лівого шлуночка і є незалежним предиктором прогресування діабетичної нефропатії.
Діагностика
 Скринінг КАН рекомендований усім пацієнтам із ЦД 2 типу та хворим на ЦД 1 типу впродовж ≥5 років. Ознаки й симптоми КАН мають оцінюватися в пацієнтів із мікросудинними порушеннями та схильністю до безсимптомної гіпоглікемії. Діагноз КАН встановлюється на основі ознак і симптомів, представлених у таблиці 3; однак кореляція між наявними симптомами та вегетативним дефіцитом є доволі слабкою, і єдиними симптомами можуть бути переривчасте серцебиття та непереносимість фізичного навантаження. На початку КАН може протікати безсимптомно, а єдиною її ознакою є зменшення варіабельності серцевого ритму при глибокому диханні, яка може перейти в тахікардію спокою (>100 уд./хв). Згідно з офіційною позицією ADA щодо ДПН у пацієнтів із вираженими симптомами (тахікардія спокою та неадекватний глікемічний контроль в анамнезі), або якщо діагноз КАН є ймовірним, додаткові обстеження не проводять. Важливо виключити інші причини, зокрема ідіопатичну ортостатичну гіпотензію (ОГ), синкопальний стан і синдром постуральної ортостатичної тахікардії (СПОТ). ТСАР включає оцінку варіабельності серцевого ритму при глибокому диханні, ортостатичну пробу та пробу Вальсальви.
Скринінг КАН рекомендований усім пацієнтам із ЦД 2 типу та хворим на ЦД 1 типу впродовж ≥5 років. Ознаки й симптоми КАН мають оцінюватися в пацієнтів із мікросудинними порушеннями та схильністю до безсимптомної гіпоглікемії. Діагноз КАН встановлюється на основі ознак і симптомів, представлених у таблиці 3; однак кореляція між наявними симптомами та вегетативним дефіцитом є доволі слабкою, і єдиними симптомами можуть бути переривчасте серцебиття та непереносимість фізичного навантаження. На початку КАН може протікати безсимптомно, а єдиною її ознакою є зменшення варіабельності серцевого ритму при глибокому диханні, яка може перейти в тахікардію спокою (>100 уд./хв). Згідно з офіційною позицією ADA щодо ДПН у пацієнтів із вираженими симптомами (тахікардія спокою та неадекватний глікемічний контроль в анамнезі), або якщо діагноз КАН є ймовірним, додаткові обстеження не проводять. Важливо виключити інші причини, зокрема ідіопатичну ортостатичну гіпотензію (ОГ), синкопальний стан і синдром постуральної ортостатичної тахікардії (СПОТ). ТСАР включає оцінку варіабельності серцевого ритму при глибокому диханні, ортостатичну пробу та пробу Вальсальви.
Лікування
Неадекватний глікемічний контроль та більша тривалість діабету є встановленими факторами ризику КАН. Результати дослідження DCCT показали, що інтенсивний контроль глікемії в пацієнтів із ЦД 1 типу знижує частоту розвитку КАН на 45%. Гіпертонія, ожиріння, гіперліпідемія та куріння також пов’язані з розвитком КАН; у дослідженні Steno‑2 було виявлено, що інтенсифіковане багатофакторне лікування в пацієнтів із ЦД 2 типу знизило ризик прогресування КАН на 68%. Схвалена FDA хворобо-модифікуюча терапія КАН на сьогодні відсутня. Невеликі дослідження виявили сприятливу дію α-ліпоєвої кислоти (AЛК).
Симптоми ОГ з’являються при переході у вертикальне положення, це запаморочення, слабкість і втрата свідомості. Діагноз ОГ встановлюється в разі зниження АТ при переході у вертикальне положення більш як на 20/10 мм рт. ст. (зниження більш як на 30/15 для тих, у кого АТ понад 150/90 мм рт. ст.) без відповідного збільшення частоти серцевих скорочень (<15 уд./хв). Лікування ОГ включає оцінку ліків, які приймає пацієнт, підтримку водно-сольового балансу та заохочення фізичної активності для уникнення детренованості. Флудрокортизон не схвалений FDA для лікування ОГ. Його дія зумовлена затримкою натрію і скороченням стінки частково денервованих кровоносних судин, однак прийом препарату може спровокувати виникнення гіпотензії в горизонтальному положенні, гіпокаліємії, застійної серцевої недостатності та периферичних набряків. Мідодрин і дроксидопа затверджені FDA для лікування симптоматичної нейрогенної ОГ.
Гастропарез
Гастропарез – це затримка випорожнення шлунка, не асоційована з механічною перешкодою. Випорожнення шлунка слід оцінювати за допомогою сцинтиграфії через 4 год після прийому легкозасвоюваної твердої їжі з інтервалом 15 хвилин. Терапевтичні опції включають модифікацію харчування з частими прийомами невеликої кількості їжі та прийом прокінетиків для підвищення моторики шлунка. Метоклопрамід – єдиний препарат, схвалений FDA для лікування гастропарезу. Але через обмежену ефективність і ризик виникнення пізньої дискінезії FDA та Європейське агентство з лікарських засобів (EMA) рекомендують приймати цей препарат не довше 5 днів. Досліджуються нові методи лікування, зокрема агоністи мотилінових рецепторів, агоністи рецепторів греліну та антагоністи рецепторів нейрокініну. Механічні варіанти лікування включають транспілоричне стентування, електростимуляцію шлунка та пероральну ендоскопічну міотомію шлунка; у тяжких випадках гастропарезу, які не піддаються лікуванню, можлива лапароскопічна пілоропластика або гастректомія.
Діабетична діарея
Діабетична діарея – шлунково-кишкове ускладнення ЦД, яке характеризується водянистою безболісною діареєю, частіше вночі. При проведенні диференційної діагностики необхідно передусім виключити інші причини діареї, зокрема побічний ефект терапії метформіном та екзокринну недостатність підшлункової залози (фекальний жир понад 6 г/72 год). Фармакологічне лікування включає протидіарейні засоби (наприклад, ломотил або імодіум[ПW1]), антибіотики (тетрациклін або метронідазол) для лікування синдрому надмірного бактеріального росту, аналоги соматостатину (октреотид) та селективні антагоністи серотонінових 5-гідрокситриптамінових рецепторів 3 типу (рамосетрон).
Дисфункція сечового міхура
Дисфункція сечового міхура може виникнути в 50% пацієнтів із діабетом унаслідок урогенітальної автономної нейропатії. Підвищення порогу рефлексу сечовипускання є першим проявом нейропатії, який в подальшому призводить до зниження активності детрузора та неповного випорожнення сечового міхура. Лікування включає: надавлювання в надлобковій області; антимускаринові препарати (оксибутинін 5-30 мг 3 рази на добу; толтеродин 2-8 мг двічі на добу) для детрузорної гіперрефлексії; парасимпатоміметичні препарати для зменшення скоротливості детрузора та переривчасту самокатетеризацію.
ЕД є поширеним проявом діабетичної нейропатії в чоловіків. ЕД у хворих на ЦД спостерігається втричі частіше, починається на 10-15 років раніше і є більш тяжкою і нечутливою до лікування порівняно із загальною популяцією. У пацієнтів-чоловіків із ЦД 1 типу ЕД асоціюється з підвищеним рівнем HbA1c, метаболічним синдромом, артеріальною гіпертензією, атерогенною дисліпідемією, зниженою ШКФ, більш високим співвідношенням альбумін/креатинін та тяжчим перебігом нейропатії тонких волокон. Сексуальна дисфункція також частіше виникає в жінок, хворих на діабет: 47% жінок із діабетичною нейропатією скаржаться на розлади з боку статевої системи. Зниження сексуального збудження, сухість піхви та біль під час статевого акту є найпоширенішими скаргами в жінок, хворих на діабет. Останні терапевтичні рекомендації включають відмову від куріння (зменшує ЕД приблизно на 30%), лікування дефіциту тестостерону та статини. У більш тяжких випадках призначають інгібітори 5-фосфодіестерази (ФДЕ 5), інтракавернозні й трансуретральні простагландини та імпланти в статевий член. Майже 50% пацієнтів із діабетом залишаються нечутливими до лікування, оскільки вони гірше відповідають на терапію інгібіторами ФДE5. Інші методи, наприклад екстракорпоральна ударно-хвильова терапія низької інтенсивності, є перспективною, але потребує проведення більш масштабних клінічних випробувань.
За матеріалами: Azmi S., Petropoulos I.N., Ferdousi M. et al. An update on the diagnosis and treatment of diabetic somatic and autonomic neuropathy [version 1; referees: 3 approved]. F1000Research 2019, 8(F1000 Faculty Rev):186. https://doi.org/10.12688/f1000research.17118.1
Підготувала Ганна Кирпач
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 1 (49) 2020 р.