28 листопада, 2016
Світові підходи до емпіричної антибіотикотерапії інтраабдомінальних інфекцій

Ускладнена інтраабдомінальна інфекція (ІАІ) – це інфекція, яка проявляється ураженням вісцеральних органів черевної порожнини та асоціюється в подальшому з формуванням абсцесів або перитоніту. ІАІ становить значну проблему практичної медицини з огляду на фінансові, моральні й фізичні витрати з боку пацієнтів та медичного персоналу. ІАІ є другою за частотою причиною смертності у відділеннях інтенсивної терапії [12].
Нозологію ІАІ становлять гострий апендицит, дивертикуліт і холецистит. Так, у США щорічно реєструють 300 тис. випадків гострого апендициту, і рівень захворюваності становить, за різними даними, від 5 до 50% у деяких категорій пацієнтів (особи похилого віку, критичні хворі).
Дивертикулярна хвороба – це хвороба людей похилого віку, що виявляється у 70% пацієнтів, які досягли 80 років, із них тільки 10-25% випадків стають клінічно значущими.
Гострий холецистит спостерігається у 2-4% населення і становить одну з найчастіших шлунково-кишкових причин для госпіталізації. На грунті обструкції міхура конкрементами виникає 90% випадків, і лише 10% пацієнтів мають гострі некротично-запальні зміни без конкрементів (чоловіки похилого віку, ішемія, критичні хворі, тривала парентеральна терапія, СНІД) [12, 13].
Успіх лікування ІАІ на сучасному етапі залежить від двох основних компонентів: коректного контролю за анатомічним джерелом інфекції та антибіотикотерапії (АБТ).
Згідно з останніми рекомендаціями протимікробні препарати, які призначають для емпіричної терапії, мають бути активними стосовно грамнегативних аеробів, факультативних анаеробів, ентеральних грампозитивних стрептококів. Препарати з активністю щодо облігатних анаеробних бактерій слід застосовувати за наявності інфекції дистальних відділів тонкої кишки, апендиксу і товстої кишки. Лікування ІАІ здійснюють на основі балансу між оптимізацією АБТ й ускладненнями, які часто виникають у ході застосування протимікробних препаратів (зростання полірезистентних штамів та інфекція, спричинена Clostridium difficile).
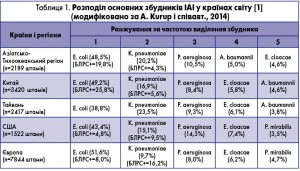
У сучасній науковій літературі зазначається про подальше зростання резистентності бактеріальних інфекцій до сучасних широко застосовуваних антибактеріальних препаратів та зменшення кількості нових антибіотиків, що створює відповідну проблему щодо лікування різних типів інфекції, у тому числі ІАІ. Насамперед це стосується гострих форм грамнегативної нозокоміальної ІАІ. Особлива увага звертається на зазначену групу збудників з огляду на їх властивість швидко набувати резистентності до ліків, що потребує постійного опрацювання нових підходів і режимів АБТ для подолання інфекції. Антибіотикорезистентні штами грамнегативних збудників становлять 1/4-1/3 від усіх штамів нозокоміальної ІАІ [7]. Основні збудники ІАІ у різних країнах світу наведені в таблиці 1.
Бета-лактамні антибіотики – традиційний клас препаратів для лікування інфекцій, викликаних грамнегативними бактеріями. Останні мають тенденцію до швидкої адаптації, а отже, появи високорезистентних штамів завдяки продукції бета-лактамаз розширеного спектра (БЛРС) з тенденцією резистентності до деяких інших класів антибіотиків (фторхінолонів, аміноглікозидів, комбінації триметоприму та сульфаметоксазолу). Відтак наведені класи препаратів асоціюються із незадовільними результатами лікування за наявності штамів, які продукують БЛРС. Карбапенеми й надалі залишаються препаратами вибору для емпіричної терапії грамнегативної інфеції як засоби першої лінії. Хоча згідно з даними досліджень думки авторів різняться щодо режимів АБТ. Останні роботи рекомендують звернути увагу на нові цефалоспорини ІІІ покоління, які захищені інгібіторами бета-лактамаз (цефтолозан/тазобактам і цефтазидим/авібактам).
Емпірична терапія грамнегативної нозокоміальної ІАІ потребує постійного врахування локальної чутливості штамів та ймовірного ризику наявності полірезистентних збудників, у тому числі ентеробактерій, які продукують карбапенемази, мультирезистентних Acinetobaсter baumannii і Pseudomonas aeruginosa. Тому емпірична терапія має постійно балансувати між ефективністю й відповідністю лікування наявній інфекції та можливістю селекції резистентних штамів [6, 7].
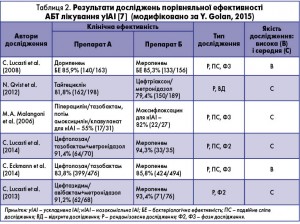
Це підтверджується епідеміологічними даними. Так, у США щорічно реєструють 35 тис. випадків нозокоміальної ІАІ внаслідок резистентних штамів ентеробактерій, які продукують БЛРС і карбапенемази, що у 2300 випадків стає причиною летальних наслідків. Дослідники відзначають стрімке зростання резистентних до карбапенемів ентеробактерій (з 1,2% у 2001 р. до 4,2% у 2011 р.). Щодо карбапенемрезистентних штамів K. pneumoniae, то їх розповсюдженість залишається на незначних рівнях, хоч і асоціюється з вищою захворюваністю, смертністю і значними витратами на лікування. Вибіркові дані клінічної й бактеріологічної ефективності, у яких фігурують карбапенеми, наведено в таблиці 2.
Аналіз наведених досліджень засвідчує, що до пацієнтів із нозокоміальною ІАІ не включають хворих, отримавших за шкалою APACHE II >30 балів, які відповідають наявності супутніх захорювань. У більшості робіт цей показник у пацієнтів із нозокоміальною ІАІ в середньому становив 5-7 балів, що дещо знижує очевидність наявних рекомендацій з емпіричної АБТ інфекцій, спричинених грамнегативними збудниками.
Загалом карбапенеми як в монотерапії, а в деяких випадках в комбінації з іншими антибіотиками й надалі залишаються препаратами першої лінії емпіричної терапії нозокоміальної ІАІ. Результатами більшості досліджень доведено їх високу ефективність у лікуванні інфекцій, у тому числі спричинених грамнегативними бактеріями, які продукують БЛРС.
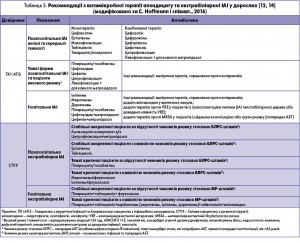
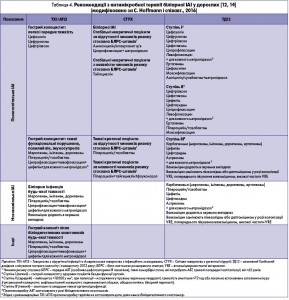
Слід зазначити, що дорипенем має дещо вищу активність порівняно з іміпенемом, але він менш стійкий порівняно з іміпенемом і меропенемом стосовно деяких штамів, які продукують карбапенемази [7]. В таблицях 3 і 4 подано сучасні світові рекомендації щодо лікування екстрабіліарних і біліарних ІАІ.
P. Montravers та співавт. (2015) засвідчили, що довідники, які містять рекомендації з АБТ ІАІ, не покращили сучасну ситуацію щодо результатів лікування ІАІ, особливо за наявності дифузних перитонітів, ІАІ у педіатричній практиці та нозокоміальних ІАІ. Згідно з оглядом літератури окреслено шість основних напрямів для покращення ситуації: методи діагностики, контроль за джерелом інфекції, мікробіологічна верифікація, специфіка лікування у педіатричній практиці, медикаментозна складова лікування перитонітів, стратегія усунення ускладнень. Аналіз, зроблений на основі 62 рекомендацій, засвідчив тяжкість досягнення консенсусу з усіх питань зазначеної проблеми. Повної згоди досягнуто стосовно 44 (100%) рекомендацій з ведення перитоніту, у тому числі щодо стратегії діагностики й місця візуалізаційних процедур, термінів їх проведення; матеріалу для мікробіологічних досліджень; мішені для АБТ і тривалості лікування. Серед зазначеного на практиці особливу роль відводять лапароскопії, черезшкірному дренуванню під контролем ультразвукової діагностики, комп’ютерній томографії, магнітно-резонансній томографії, показанням до лікування ентерококової та грибкової інфекцій. Підтверджено необхідність застосування діагностичних біомаркерів, програмованих релапаротомій, пролонгації АБТ, особливо у дітей [4, 9].
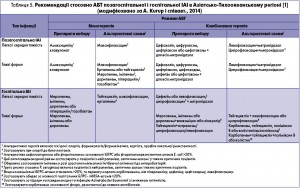
L.L. Huang і співавт. (2016) визнали, що наявність довідників із рекомендаціями з АБТ ІАІ не асоціюється зі значним покращенням результатів лікування. Водночас вузький підхід згідно з наявними рекомендаціями призводить до подовження термінів лікування та високих показників летальності. Відтак виникає необхідність у координації спільних зусиль та адаптації схем і режимів АБТ до конкретної медичної установи (регіон, університет, госпіталь) [8]. Усе вищезазначене містять рекомендації АБТ для Азіатсько-Тихоокеанського регіону (табл. 5).
Y.P. Chong і співавт. (2015) звернули увагу на той факт, що випадки неефективної стартової АБТ призводять до значних витрат на лікування. Автори вирішили з’ясувати чинники ризику, які спричиняють невдачі стартової емпіричної терапії, і як це впливає на віддалені наслідки лікування ІАІ. З цією метою провели ретроспективний аналіз даних 11 регіональних медичних установ (залучено 514 пацієнтів з ІАІ). Неефективність стартової АБТ трактували як необхідність заміни антибіотиків унаслідок відсутності покращення симптомів та клінічних проявів ІАІ впродовж першого тижня лікування. Встановлено неефективність стартової терапії у 9% пацієнтів, що призвело до пролонгації парентеральної АБТ на 2,9 дня, 5,3 додаткового дня госпіталізації та, відповідно, до збільшення витрат на лікування. До чинників ризику неефективності початкової АБТ віднесли випадки нозокоміальної інфекції, солідний рак і оцінку за шкалою APACHЕ II ≥13 балів. На думку авторів, для покращення результатів лікування, а відтак зниження витрат необхідні вчасне виявлення чинників ризику, верифікація тяжкості захворювання й адекватний хірургічний контроль за джерелом інфекції і відповідна АБТ [3].
Цікавим напрямом АБТ ІАІ є скорочення тривалості застосування антибіотиків. На думку більшості дослідників, цей аспект залишається досі не з’ясованим. Так, R.G. Sawyer і співавт. (2015) провели рандомізоване дослідження 518 пацієнтів з ускладненою ІАІ після адекватного хірургічного контролю за джерелом інфекції, під час якого одна група пацієнтів (контрольна) додатково отримувала антибіотики дві доби після нормалізації температури, показників крові та відновлення функції кишок із максимальною терапією 10 діб, а друга група (експериментальна) отримувала фіксований курс антибіотиків 4±1 календарні доби. До основних показників порівняння віднесли розвиток ранової інфекції, рецидиви ІАІ, летальні випадки впродовж 30 діб після оперативного втручання, до другорядних – тривалість лікування й супутні інфекції. Післяопераційна ранова інфекція, рецидиви ІАІ та смертельні випадки відзначено у 56 з 257 пацієнтів експериментальної групи (21,8%) і у 58 з 260 хворих контрольної групи (22,3%) (абсолютна різниця – 0,5%, 95% довірчий інтервал (ДІ) 7,0-8,0; р=0,92). В експериментальній групі тривалість лікування становила 4 доби (коливання 4-5 днів). У контрольній групі цей показник сягав 8 днів (коливання 5-10 днів) (абсолютна різниця – 4 доби, 95% ДІ 4,7-3,3; р<0,001). Автори дійшли висновку, що фіксоване застосування антибіотиків (у середньому 4 доби) дає схожі результати й суттєво не відрізняється від тривалішої (у середньому 8 діб) АБТ [13]. T.L. Zakrison (2015), C. Roger і співавт. (2015), а також інші дослідники підтримують цю стратегію АБТ [11, 13, 15].
L.M. Riccio і співавт. (2014) висловили гіпотезу, що пролонгація АБТ ІАІ може призводити до появи екстраабдомінальної інфекції (ЕАІ) та зростання частоти летальності. Матеріал охоплював період з 1997 по 2009 р. Пацієнтів з ІАІ розподіли на дві групи – одна із супутньою ЕАІ внаслідок ІАІ, друга – без ЕАІ (співвідношення становило 1:2). За основу було взято шкалу APACHЕ II ±1 бал. До дослідження залучили 2552 випадки ІАІ, з яких у 549 пацієнтів (21,5%) встановлено ЕАІ. У пацієнтів з ІАІ, у яких в подальшому розвинулась ЕАІ, попередня АБТ була тривалішою порівняно з пацієнтами без ЕАІ (у середньому 14 діб (9-22 дні) проти 11 діб (7-16 днів) відповідно (р<0,01), і у них була вищою госпітальна летальність (14,9 проти 9% відповідно, р<0,01). Отримані дані засвідчили, що тривалість АБТ для ІАІ є незалежним предиктором супутньої ЕАІ (р<0,001). Таким чином, пролонговане застосування антибіотиків при ІАІ асоціюється з ризиком ЕАІ та летальності [2].
M. Sartelli і співавт. (2016) звертають увагу загальних хірургів на необхідність дотримання базових принципів АБТ ІАІ. Адекватна тривалість застосування антибіотиків – важлива складова оптимізації емпіричної терапії, що сприяєзниженню ризику появи резистентних штамів бактерій. Питання оптимальної тривалості АБТ і надалі дискутується в наукових колах. У стабільних пацієнтів допускають короткий курс (3-5 діб) антимікробної терапії після адекватного хірургічного контролю за джерелом інфекції (контролем адекватності можуть бути нормалізація температури й лейкоцитозу). До критичних пацієнтів із тяжким сепсисом і септичним шоком необхідний індивідуальний підхід із постійним моніторингом показників загальної запальної відповіді організму на інфекцію та інших специфічних маркерів (наприклад, прокальцитоніну) [5].
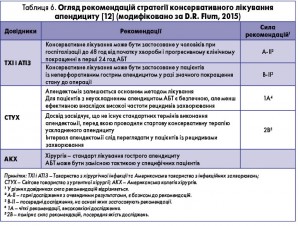
За останній період у літературі виникла дискусія стосовно тактики лікування гострого апендициту. Відомо, що основу лікування становить оперативне втручання, яке іноді включає доопераційну інфузійну терапію і затосування антибіотиків із профілактичною метою. Зазвичай апендектомія – процедура, яка асоціюється з гарними результатами, однак можливий розвиток ускладнень (ранова інфекція, формування абсцесів, ілеус), що потребують подальшого хірургічного лікування. Деякі автори пропонують сучасний підхід лікування апендициту. Його суть полягає у тому, що розпочинають емпіричну АБТ й апендектомію виконують у випадку відсутності розрішення захворювання або наявності рецидиву – так звана стратегія «спочатку антибіотики». Результати низки рандомізованих досліджень і метааналізів, під час яких порівнювали вищенаведену стратегію з апендектомією у пацієнтів на гострий неускладнений апендицит, довели вищий ефект хірургічного методу лікування, хоч і з вищим рівнем ускладнень. Результати досліджень відрізняються висновками й рекомендаціями внаслідок різноманіття застосованих методик у рандомізації пацієнтів і порівняння визначених параметрів. У таблиці 6 представлено огляд існуючих рекомендацій стосовно стратегії лікування гострого апендициту.
Крім питань АБТ ІАІ. велику увагу приділяють також застосуванню протимікробних засобів із профілактичною метою. Так, S. Hagel і співавт. (2014) в оглядовій статті акцентували увагу на щорічному зростанні резистентності збудників до антибіотиків першої і другої ланки, особливо грамнегативних бактерій, і зменшення кількості нових антимікробних субстанцій, що в підсумку змінює стратегію лікування ІАІ. За таких обставин доопераційна антибіотикопрофілактика (АБП) набуває особливого значення. Ефективність і безпечність АБП доведено результатами низки метааналізів у цій галузі. Загальновизнаною є тактика одноразового дооопераційного введення антибіотика (наприклад, цефалоспорину ІІ покоління) за 30-40 хв до оперативного втручання. Пролонгованої АБП (1-3 доби після операції) слід уникати, оскільки вона не зменшує частототу післяопераційної ранової інфекції та асоціюється зі зростанням резистентності збудників інфекції і побічними ефектами препаратів. Сучасна АБТ тяжких форм ІАІ потребує делікатного балансу оптимізованої емпіричної терапії, і більшість кращих наслідків лікування корелюють зі зниженням частоти необгрунтованого застосування АБТ. У підсумку автори висловили думку, що протимікробна резистентність створює загрозу для здоров’я людей і потребує контрольованого застосування АБТ, а за своєю значущістю АБП є однією зі стратегій лікування ІАІ [10].
Отже, апендицит, дивертикуліт і холецистит – три основних типи ІАІ, за яких застосовують АБТ. Емпірична антибактеріальна терапія широкого спектра і тривалі курси лікування призводять до зростання резистентності збудників. Ретельний вибір адекватної емпіричної АБТ є надзвичайно важливим для зменшення захворюваності та смертності внаслідок ІАІ. Дані клінічних досліджень і висновки експертів з емпіричної АБТ ІАІ (особливо у разі нозокоміальної інфекції) звертають увагу клініцистів на необхідність застосування антибіотиків, активних стосовно грамнегативних бактерій, штамів, які продукують БЛРС, P. аeruginosa та інших полірезистентних штамів. Урахування регіональних епідеміологічних даних та профілю резистентності – суттєве підгрунтя для відповідного вибору АБТ. Успіх лікування ІАІ на сучасному етапі залежить від двох основних компонентів: коректного контролю за анатомічним джерелом інфекції та АБТ. Доведено, що емпірична антибактеріальна терапія впливає на рівні захворюваності та смертності. Неадекватна антибіотикотерапія ІАІ може призвести до погіршення результатів лікування і зростання витрат на нього.
Висновки
Ускладнені інтраабдомінальні інфекції – актуальна проблема сучасної хірургії, яка асоціюється із незадовільними наслідками, особливо у пацієнтів групи ризику. До чинників, які ускладнюють процесс лікування, належать неадекватна емпірична антимікробна терапія (у тому числі розбіжність рекомендацій у довідниках), тривалість застосування антибіотиків, зростання резистентних штамів.
Згідно із сучасними рекомендаціями серед антибактеріальних засобів для лікування ІАІ препаратами вибору є карбапенеми, цефалоспорини ІІІ-IV покоління (у тому числі захищені, наприклад цефоперазон/сульбактам), фторхінолони, похідні 5-нітроімідазолів (метронідазол/орнідазол).
Література
- Antibiotic management of complicated intra-abdominal infections in adults: The Asian perspective / A. Kurup, K.-H. Liau, J. Ren [et al.] // Annals of Medicine and Surgery. – 2014; 3: 85-91.
- Association of excessive duration of antibiotic therapy for intra-abdominal infection with subsequent extra-abdominal infection and death: a study of 2,552 consecutive infections / L.M. Riccio, K.A. Popovsky, T. Hranjec [et al.] / Surg. Infect. (Larchmt). – 2014; 15 (4): 417-24.
- Clinical and economic consequences of failure of initial antibiotic therapy for patients with community-onset complicated intra-abdominal infections / Y.P. Chong, I.G. Bae, S.R. Lee [et al.] // PLoS One. – 2015; 10 (4): e0119956.
- Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America / J.S. Solomkin, J.E. Mazuski, J.S. Bradley, [et al.] // Clin. Infect. Dis. – 2010; 50: 133-64.
- Duration of Antimicrobial Therapy in Treating Complicated Intra-Abdominal Infections: A Comprehensive Review / M. Sartelli, F. Catena, L. Ansaloni [et al.] // Surg Infect (Larchmt). – 2016; 17 (1): 9-12.
- Gelot S. Intra-abdominal Infections in Adults / S. Gelot, E. Nakhla // US Pharm. –2016; 41 (4): 5-12.
- Golan Y. Empiric therapy for hospital-acquired, Gramnegative complicated intra-abdominal infection and complicated urinary tract infections: a systematic literature review of current and emerging treatment options / Y. Golan // BMC Infectious Diseases. – 2015; 15: 313.
- Guideline-Concordant Versus Discordant Antimicrobial Therapy in Patients With Community-Onse Complicated Intra-abdominal Infections. L.L. Huang, T.C. Van Schooneveld, R.D. Huang [et al.] // Infect. Control Hosp. Epidemiol. – 2016; 37 (7): 855-8.
- Guidelines for management of intra-abdominal infections / P. Montravers, H. Dupont, M. Leone [et al.] // Anaesth. Crit. Care Pain Med. – 2015; 34 (2): 117-30.
- Hagel S. Perioperative Antibiotic Prophylaxis and Antimicrobial Therapy of Intra-Abdominal Infections / S. Hagel, H. Scheuerlein // Viszeralmedizin. – 2014; 30 (5): 310-6.
- Roger C. Short-Course Antimicrobial Therapy for Intraabdominal Infection / C. Roger, M. Bertrand, L. Muller // N Engl. J Med. – 2015; 373 (16): 1577-8.
- Treatment Modalities and Antimicrobial Stewardship Initiatives in the Management of Intra-Abdominal Infections / Ch. Hoffmann, M. Zak, L. Avery [et al.] // Antibiotics. – 2016, 5 (11).
- Trial of short course antimicrobial therapy for intraabdominal infection / R.G. Sawyer, J.A. Claridge, A.B. Nathens [et al.] // N. Engl. J Med. – 2015; 372 (21): 1996-2005.
- 2013 WSES guidelines for management of intra-abdominal infections / M. Sartelli, P. Viale, F. Catena, [et al.] // World J Emerg. Surg. – 2013; 8:3.
- Zakrison T.L. Short-course antimicrobial therapy may be clinically similar to a longer course for complicated intra-abdominal infections / T.L. Zakrison // Evid. Based Med. – 2015; 20 (5): 182-3.