20 червня, 2020
І Міжнародний конгрес «Від народження до зрілості»
3-5 квітня в онлайн-режимі відбувся І Міжнародний конгрес «Від народження до зрілості: міждисциплінарний підхід у збереженні здоров’я людини», організований Асоціацією безперервної професійної освіти лікарів та фармацевтів спільно з Національною медичною академією післядипломної освіти ім. П.Л. Шупика. Протягом трьох днів у межах заходу було розглянуто безліч актуальних питань педіатричної, гастроентерологічної, кардіологічної, отоларингологічної, ендокринологічної, пульмонологічної практики лікарів першого контакту, педіатрів, терапевтів тощо.
.jpg) Питанню сучасної моделі профілактики раку шлунка (РШ) у практиці сімейного лікаря присвятив свій виступ член Міжнародної комісії з нагороди вчених Європи за кращі наукові роботи Bares Award, віцепрезидент Української гастроентерологічної асоціації, директор ДУ «Інститут гастроентерології НАМН України» (м. Дніпро), доктор медичних наук, професор Юрій Миронович Степанов. РШ є однією з найглобальніших проблем у світі. Високий відсоток захворюваності та низький рівень виживаності (<5%) зумовлені відсутністю специфічних ранніх симптомів, застарілими методами діагностики, низькою ефективністю лікування, пізнім зверненням пацієнтів до лікаря. За даними статистики, в Європі щороку на РШ хворіє 83 тис. населення (10,7 на 100 тис.) (Ferley J. et al., 2010).
Питанню сучасної моделі профілактики раку шлунка (РШ) у практиці сімейного лікаря присвятив свій виступ член Міжнародної комісії з нагороди вчених Європи за кращі наукові роботи Bares Award, віцепрезидент Української гастроентерологічної асоціації, директор ДУ «Інститут гастроентерології НАМН України» (м. Дніпро), доктор медичних наук, професор Юрій Миронович Степанов. РШ є однією з найглобальніших проблем у світі. Високий відсоток захворюваності та низький рівень виживаності (<5%) зумовлені відсутністю специфічних ранніх симптомів, застарілими методами діагностики, низькою ефективністю лікування, пізнім зверненням пацієнтів до лікаря. За даними статистики, в Європі щороку на РШ хворіє 83 тис. населення (10,7 на 100 тис.) (Ferley J. et al., 2010).
У розвитку РШ вагому роль відіграють персистенція інфекції Helicobacter pylori (HP) і наявність CagA-позитивних штамів. Ризик захворювання збільшується в 6 і 28 разів відповідно. Інфекція НР є канцерогеном 1-ї групи для організму людини. Доведено, що від 60 до 80% некардіального РШ виникає на тлі хронічного гелікобактерного гастриту. Патогенез цього процесу полягає в послідовній трансформації клітин слизової оболонки шлунка внаслідок її атрофії, тонкокишковій метаплазії, згодом – товстокишковій метаплазії, що зумовлює дисплазію епітеліоцитів шлунка 1-3 ступенів.
Результати нідерландських досліджень довели закономірність підвищення ризику розвитку РШ протягом 10 років залежно від стадії прогресування метапластичних процесів. Так, при атрофічному гастриті ризик становить 0,8%, інтестинальній метаплазії – 1,8%, помірній метаплазії – 3,9%, тяжкій метаплазії – 32,7%.
Авторами Кіотського глобального консенсусу з гелікобактерного гастриту (2015) зазначено, що діагностувати атрофію й метаплазію шлункових епітеліоцитів можна за допомогою ендоскопії зі збільшенням, що дає змогу відмовитися від біопсії як значно травматичнішого методу. Проте для стратифікації ризику та гістологічної класифікації за OLGA й OLGIM корисною є лише біопсія з антрума та тіла шлунка. Серологічні тести (пепсиноген І або ІІ, антитіла до НР) необхідні для ідентифікації пацієнтів із підвищеним ризиком РШ.
Відповідно до положень Кіотського консенсусу щодо ведення пацієнтів із НР усім хворим з ідентифікованою НР необхідно призначати ерадикаційну терапію незалежно від інших обставин. Максимальний ефект від ерадикації настає при лікуванні НР без атрофії слизової шлунка. Схеми ерадикації мають базуватися на найефективніших для певного регіону, що засновані на тестуванні чутливості до антибіотиків, клінічних дослідженнях ефективності та собівартості.
У 2019 р. відбулося масштабне дослідження MAPS II, під час якого було виявлено, що хворі з хронічним атрофічним гастритом (ХАГ) або кишковою метаплазією мають ризик захворіти на аденокарциному шлунка. Таких пацієнтів потрібно активно обстежувати на ранніх стадіях. Гістологічна діагностика щодо кишкової метаплазії є найнадійнішим маркером атрофії слизової шлунка в таких випадках. Метою лікування хворих із ХАГ є запобігання розвитку дисплазії високого ступеня й інвазивної карциноми. Під час діагностики пацієнтів з ендоскопічно виявленою дисплазією низького/високого ступеня чи карциномою MAPS II рекомендує виділити стадію та проводити відповідне лікування. Ендоскопія високої якості з хромоендоскопією є кращим варіантом для діагностики передракових станів шлунка та ранніх неопластичних уражень, аніж ендоскопія високої якості білого кольору. Віртуальну хромоендоскопію зі збільшенням або без нього необхідно використовувати для діагностики передракових захворювань шлунка з проведенням прицільної біопсії, що важливо для точнішого визначення стадії атрофічного процесу та метапластичних змін. Перша діагностична ендоскопія обов’язково має включати взяття біопсії шлунка зі скомпрометованих ділянок. Щодо пацієнтів із кишковою метаплазією однієї локалізації, але із сімейним анамнезом РШ, або неповної метаплазії, або персистентного НР-гастриту необхідно розглянути можливість ендоскопічного спостереження з хромоендоскопією та взяттям біопсії через 3 роки. Натомість хворим із вираженими стадіями атрофічного гастриту проводиться високоякісна ендоскопія кожні 3 роки. Якщо до цього додається обтяжений сімейний анамнез, доцільним є інтенсивніше спостереження (кожні 1-2 роки після встановлення діагнозу). Пацієнти з автоімунним гастритом проходять ендоскопічний нагляд кожні 3-5 років. У консенсусі також розглядаються важливі питання щодо лікування інфекції НР. Ерадикація НР лікує неатрофічний хронічний гастрит, може спричинити регресію атрофічного гастриту, знижує ризик розвитку РШ у хворих із неатрофічним і атрофічним гастритами на 35% (Fuccio L. et al., 2009). Виявлено, що ерадикація НР у пацієнтів із кишковою метаплазією не значно знижує ризик розвитку РШ хоча би на короткий термін, але зменшує запалення й атрофію. Ерадикація НР рекомендується хворим із неоплазією шлунка після ендоскопічної терапії. Доповідач додав, що згідно з власними спостереженнями ерадикацію НР бажано проводити на будь-якому етапі розвитку НР-асоційованого гастриту, оскільки вона сприяє регресії атрофії та кишкової метаплазії слизової оболонки шлунка.
Відповідно до консенсусу MAPS II інгібітори циклооксигенази 1 чи 2 типу не рекомендується застосовувати для уповільнення процесу прогресування передракових захворювань шлунка. Із цією метою необхідно розглянути прийом низьких доз ацетилсаліцилової кислоти щодня, а також дотримуватися правил первинного (дієта без канцерогенів, контроль екології, відмова від шкідливих звичок), вторинного (формування груп ризику, диспансерний нагляд пацієнтів із передраковими станами, фіброгастродуоденоскопія (ФГДС) у віці >50 років), третинного (призначення антипромоторів або антиоксидантів) методів профілактики. Для групи низького онкологічного ризику ФГДС і гастральну біопсію слід проводити 1 раз на 5 років, середнього ризику – 1 раз на 2-3 роки, високого ризику – 1 раз через 1, 3, 6 міс або виконати ендоскопічну мікозектомію (часткову аргоноплазмову дисекцію слизової оболонки шлунка з ділянками дисплазії).
Президент Європейської асоціації гастроентерології, професор Хуан Мендив (м. Барселона, Іспанія) розповів про функціональні розлади шлунково-кишкового тракту (ШКТ) і Римські критерії з огляду на первинну медико-санітарну допомогу. Ця проблема є досить розповсюдженою серед населення всього світу. На її діагностику в західних країнах припадає близько 10% обсягу всіх консультацій лікарів загальної практики. Поширеним діагнозом, який базується на критеріях Римського консенсусу останньої (IV) версії 2016 р. і не підлягає особливій діагностиці, є синдром подразненого кишечнику (СПК). Окрім цього, до критеріїв також належать функціональна диспепсія, діарея та закреп (Lacy B. et al., 2016).
Відповідно до нових Римських критеріїв IV перегляду, СПК – це функціональний розлад, який проявляється рецидивними болями в животі, котрі виникають щонайменше 1 р/тиж; ці болі характеризуються такими ознаками (двома чи більше): пов’язані з дефекацією, зміною її частоти чи форми (зовнішнього вигляду) випорожнень. Такі ознаки мають проявлятися в пацієнта протягом останніх 3 міс при загальній симптоматиці не менш як 6 міс. Етіологія цього синдрому поліфакторна: гострі чи хронічні стреси, прийом ліків, порушення мікробіому кишечнику, дієта, запальні процеси, порушення центральної регуляції імунного статусу кишечнику тощо.
Професор зазначив, що для точнішої оцінки симптомів із боку ШКТ хворим необхідно надавати Бристольську шкалу форми випорожнень (БШФВ), за допомогою якої вони відмічають тип випорожнень, чим полегшують діагностичний пошук проблеми. Виокремлюють чотири типи СПК (C, M, U, D), які відповідають одному чи двом типам БШФВ із семи можливих. Якщо СПК проявляється діарейним синдромом, то >25% усіх дефекацій відповідає 6 та 7 типам БШФВ, а <25% – від 1 до 4. Існують так звані червоні прапорці, на які слід звертати особливу увагу, оскільки вони можуть бути небезпечними щодо прогнозу: кров у калі, анемія, небажана втрата маси тіла, сімейний анамнез колоректального раку чи СПК, неочікуваний розвиток симптомів у людей віком >50 років.
Діагностичним критеріям функціональної діареї відповідають рихлі чи рідкі випорожнення без абдомінального болю чи здуття при >¼ усіх дефекацій. Такі симптоми мають проявлятися щонайменше 3 міс (із початком симптомів як мінімум за 6 міс до встановлення діагнозу). Хворим, симптоми котрих збігаються з критеріями щодо СПК і домінувальної діареї, необхідно спростовувати діагноз функціональної діареї.
Диференційна діагностика функціональних розладів ШКТ базується на визначенні домінувального симптому: закреп або діарея, здуття чи подразнення кишечнику, а також больовий синдром. Завдяки комбінуванню цих симптомів можна визначити, який саме розлад має пацієнт. Лікування зазвичай симптоматичне (агоністи опіоїдів, дієта, секвестранти жовчних кислот, пробіотики, антидепресанти тощо) (Lacy B. et al., 2016).
Національний інститут здоров’я та клінічного вдосконалення Великої Британії (NICE) рекомендує певні принципи дієти при СПК. Основні з них: регулярно харчуватися, уникати пропусків прийому їжі, пити щонайменше 8 кружок води на день, обмежити споживання кави/чаю до 3 чашок на день, зменшити вживання алкоголю й газованих напоїв, а також продуктів із високим умістом клітковини.
Отже, вчасна діагностика лікарями первинної ланки різних типів функціональних розладів ШКТ дає можливість точно визначити лікувальну тактику та значно покращити якість життя пацієнта.
.jpg) Заслужений діяч науки і техніки України, проректор із науково-педагогічної роботи та післядипломної освіти Української медичної стоматологічної академії (м. Полтава), доктор медичних наук, професор Ігор Миколайович Скрипник озвучив нові досягнення гепатології згідно з останніми позиціями засідання Європейської асоціації з вивчення хвороб печінки (EASL), Всесвітнього конгресу гастроентерологів, щорічної паризької конференції з вивчення неалкогольного стеатогепатиту (НАСГ).
Заслужений діяч науки і техніки України, проректор із науково-педагогічної роботи та післядипломної освіти Української медичної стоматологічної академії (м. Полтава), доктор медичних наук, професор Ігор Миколайович Скрипник озвучив нові досягнення гепатології згідно з останніми позиціями засідання Європейської асоціації з вивчення хвороб печінки (EASL), Всесвітнього конгресу гастроентерологів, щорічної паризької конференції з вивчення неалкогольного стеатогепатиту (НАСГ).
НАСГ є неінфекційною пандемією XXI ст. й однією з основних причин серйозних захворювань печінки та смерті. За статистикою, 20-30% загальної популяції страждають на неалкогольну жирову хворобу печінки (НАЖХП); близько 20% хворих на цю недугу мають НАСГ (Younossi et al., 2016, 2017, 2019). У світі на НАЖХП хворіють 1 млрд людей (європейці – 72 млн, американці – 100 млн).
Існує безліч наукових програм із вивчення НАЖХП/НАСГ. Однією з них є технологічна платформа Litmus, започаткована 2017 р.; її створено на основі європейського реєстру НАЖХП, який був складений на Міжнародному конгресі EASL у квітні 2019 р. для систематичного вивчення та перевірки широкого спектра неінвазивних біомаркерів, візуалізації НАЖХП із посиланням на дані біопсії печінки.
Чому це питання так сильно хвилює широке коло науковців? Згідно з доповідями L. Castera, кількість випадків НАСГ прогнозовано збільшиться на 43% до 2030 р. у різних країнах. На момент первинної діагностики близько 41% хворих мають виражений фіброз печінки, що пов’язаний із підвищеним ризиком випадків смерті, гепатоцелюлярної карциноми, варикозного розширення вен стравоходу, трансплантації печінки. Доведено, що артеріальна гіпертензія, гіперліпідемія, метаболічний синдром (МС), цукровий діабет (ЦД) 2 типу, ожиріння є супутніми станами, асоційованими з НАСГ.
В австрійському дослідженні за участю 342 пацієнтів було відзначено цікаву закономірність: загальна смертність і захворюваність серед худих пацієнтів із НАЖХП були такими ж високими, як і серед хворих з ожирінням, тоді як у пацієнтів із надлишковою вагою ці показники були істотно нижчими. Печінкові проблеми – основна причина смерті худих пацієнтів із НАЖХП, серцево-судинні ускладнення – причина смерті хворих із НАЖХП, які мали ожиріння (Feldman et al., 2017, 2019). Інше дослідження доводить, що НАЖХП підвищує ризик розвитку ЦД у пацієнтів без надлишкової ваги. Десятирічний кардіоваскулярний ризик у худих хворих за шкалою Framingham (FRS) >10% у 5,3 раза вищий при НАСГ. Поширеність ЦД, гіпертензії, МС більша в 15 разів порівняно з контролем (незалежно від віку, індексу маси тіла та фізичних навантажень) (Sung K. et al., 2019). Збільшення маси тіла на >2,3 кг підвищує ризик розвитку жирової інфільтрації печінки (Chang Y. et al., 2019). Лише збільшення маси тіла та стартовий індекс НОМА є незалежними предикторами НАЖХП (Zelber-Sagi S. et al., 2019).
Діагностичний пошук базується на визначенні стадії фіброзу печінки для оцінки ризику смерті, а не на даних біопсії. Спеціалізація з гастроентерології не передбачає проведення біопсії печінки, оскільки процедура інвазивна, дороговартісна, обмежена у виконанні для багатьох гепатологів і спричиняє безліч ускладнень (Castera L., 2019). Окрім функціонального стану печінки, клініцисти повинні оцінювати імунний стан мікробіому кишечнику. У багатьох сучасних дослідженнях доведено: мікроорганізми, зокрема Klebsiella pneumoniae, що продукує алкоголь, можуть зумовити розвиток жирової хвороби печінки (Yuan et al., 2019).
У плацебо-контрольованому дослідженні ІІ фази LUBIPRONE було показано нові підходи до терапії НАЖХП. Виявлено значно нижчу кишкову проникність любіпростону порівняно з плацебо. У клінічному дослідженні ІІІ фази REGENERATE (2019) щодо впливу обетихолевої кислоти (ОХК) на гістологію печінки при НАСГ було доведено, що ОХК у дозі 25 мг досягла первинної кінцевої точки – регрес фіброзу печінки без погіршення НАСГ. Однак свербіж (як побічна дія в групі ОХК) спостерігався аж у 51% учасників (проти 19% у групі плацебо). Це перший успішний дебют дослідження ІІІ фази щодо терапії НАСГ.
У липні 2019 р. був представлений Кокранівський огляд лікування алкогольної хвороби печінки (АХП). У 19 клінічних дослідженнях узяли участь 2545 пацієнтів. Показано, що лікарськими засобами для терапії цього захворювання є стероїди, пентоксифілін, анти-TNF-препарати та G-CSF (хоча результати останнього засідання американського гастротижня 2019 р. доводять неефективність пентоксифіліну у веденні пацієнтів з АХП). Окрім цього, вживання алкоголю зумовлює розвиток кишкового дисбіозу, також виникає надлишковий бактеріальний ріст, порушуються щільні зв’язки кишкової стінки, підвищується її проникність. Це створює дисбаланс кишечної мікробіоти та підвищує кількість патоген-асоційованих молекулярних структур мікроорганізмів (PAMPs). Кишковий дисбіоз спричиняє прогресування АХП завдяки зміні жовчних кислот, переміщенню життєздатних бактерій і PAMPs, зміні мікробних метаболітів і запаленню кишкового тракту. Саме тому новою метою лікування АХП є модифікація кишкової мікрофлори, котра складається з нецільових підходів: дієта, про-, пре- та симбіотики, антибіотики, а також трансплантація кишкової мікрофлори; цільові підходи: відновлення мікробних метаболітів, біоінженірингові бактерії та модуляція мікробних регуляторних шляхів (Milocevic et al., 2019; Sarin et al., 2019; Alvares-da-Silva M., 2019).
.jpg) Член Американської гастроентерологічної асоціації, голова Асоціації дієтологів України, член президії Української гастроентерологічної асоціації, кандидат медичних наук Олег Віталійович Швець представив доповідь, яка стосується харчування в попередженні та лікуванні коронавірусної хвороби (COVID‑19). Нагадаємо, що SARS-CoV‑2 – новий коронавірус, який спричиняє розвиток респіраторних захворювань, зокрема гострої респіраторної хвороби COVID‑19, і може передаватися від людини до людини; вперше був ідентифікований під час спалаху в м. Ухань (Китай) у грудні 2019 р. Триває еволюція наукових знань про особливості нового патогену, а також здійснюється пошук ефективних способів запобігання хворобі та лікування пацієнтів.
Член Американської гастроентерологічної асоціації, голова Асоціації дієтологів України, член президії Української гастроентерологічної асоціації, кандидат медичних наук Олег Віталійович Швець представив доповідь, яка стосується харчування в попередженні та лікуванні коронавірусної хвороби (COVID‑19). Нагадаємо, що SARS-CoV‑2 – новий коронавірус, який спричиняє розвиток респіраторних захворювань, зокрема гострої респіраторної хвороби COVID‑19, і може передаватися від людини до людини; вперше був ідентифікований під час спалаху в м. Ухань (Китай) у грудні 2019 р. Триває еволюція наукових знань про особливості нового патогену, а також здійснюється пошук ефективних способів запобігання хворобі та лікування пацієнтів.
Існує чимало світових і місцевих протоколів терапії цього захворювання, але й дотепер відсутні достовірні терапевтичні стратегії з підтвердженою безпечністю й ефективністю. Зокрема, на сьогодні дієтичні інтервенції за наявності COVID‑19 розглядаються як підтримувальні. За відсутності великих і тривалих досліджень впливу моделей харчування й окремих нутрієнтів на ризик і перебіг хвороби спеціалісти в галузі харчування пропонують використовувати наявну інформацію щодо ролі дієти в оптимізації імунної відповіді стосовно вірусних інфекцій. Вплив більшості нутрієнтів на коронавірус, який зумовлює COVID‑19, іще не був вивчений або відповідні дослідження нещодавно розпочалися.
Потенційні інтервенції в лікуванні чи профілактиці інфекції COVID‑19 можна розподілити на дві групи:
- спрямовані на вплив на імунну систему або імунні клітини;
- безпосередньо впливають на коронавірус.
У цьому контексті саме харчування перебуває в тісній взаємодії з імунною системою організму людини. Ключову роль у контролі реплікації коронавірусу має імунна система. Вірус потрапляє до клітин організму завдяки зв’язку з рецепторами ангіотензинперетворювального ферменту-2, розташованими на клітинній поверхні багатьох тканин (включно зі слизовими оболонками верхньої частини респіраторного тракту), в легенях, травному каналі, печінці, головному мозку тощо. Саме тому як терапевтична мета розглядаються переважно інтервенції, спрямовані на блокування здатності вірусу зв’язуватися з рецепторами та пригнічення його реплікації. Зовнішні та внутрішні джерела надходження нутрієнтів забезпечують достатнє депонування цих речовин у клітинах та органах, а отже, й оптимальну імунну функцію як мікробіому кишечнику, так і організму загалом.
У нещодавніх дослідженнях було з’ясовано, що прозапальні цитокіни є ще однією мішенню терапевтичних і дієтичних інтервенцій і відіграють значну роль у прогресуванні всіх вірусних інфекцій. COVID‑19 асоційована зі збільшенням кількості прозапальних інтерлейкінів (ІЛ‑2, ІЛ‑7), гранулоцитарного колонієстимулювального фактора, інтерферон-γ-індуцибельного білка-10 (IP‑10), фактора хемотаксису моноцитів-1, макрофагального запального протеїну-1а та фактора некрозу пухлини (TNF); вони вважаються терапевтичними мішенями при COVID‑19. Пригнічення продукції зазначених цитокінів дасть можливість контролю надмірного запалення (Mehta P. et al., 2020). Для цього в дієтичному харчуванні наведено ефективні природні інгібітори цитокінів. Наприклад, куркумін продемонстрував здатність зменшувати вивільнення цитокінів при цитокіновому штормі під час спалаху Еболи (Helson L. et al., 2014); бергамот стимулює продукцію протизапального цитокіну ІЛ‑8 і пригнічення запалення в легенях (Diederich M. et al., 2011); флаваноїди (ресвератрол, лютеолін) можуть загалом пригнічувати експресію відповідних генів і секрецію цитокінів (Leyva-Lopez N. et al., 2016).
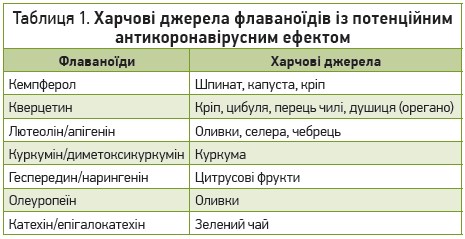
Іншою терапевтичною мішенню є речовини, що пригнічують вірусні протеази. До них належать 3-хімотрипсиноподібна протеаза (3CLpro), папаїноподібна протеаза (PLpro), РНК-залежна РНК-полімераза (RdRp) і протеїн шипів (Spro), які відіграють важливу роль в інвазії, реплікації, транскрипції вірусу на рецепторних клітинах (Canrond Wu et al., 2020). Потенційні можливості впливу флаваноїдів на коронавіруси через пригнічення ключової протеази 3CLpro було досліджено in silico (за допомогою комп’ютерного моделювання). Деякі флаваноїди рослинного походження потенційно здатні інгібувати 3CLpro: кемпферол, кверцетин, лютеолін‑7-глікозид, диметоксикуркумін, геспередин, нарингенін, апігенін‑7-глікозид, олеуропеїн, куркумін, катехін, епігалокатехін (Khaerunnisa S. et al., 2020). Вони наявні в багатьох продуктах рослинного походження (табл. 1).
Геспередин може блокувати білок шипів коронавірусу Spro та запобігати клітинній інвазії. Апельсини, грейпфрути, лимони та мандарини містять цей флаваноїд у значній кількості. Він також доступний у вигляді дієтичних добавок.
Імуномодуляторні нутрієнти та біологічно активні речовини також демонструють позитивний вплив у підвищенні опору організму проти вірусної інфекції. Проте дотепер іще не встановлено специфічної ефективності щодо COVID‑19, декілька досліджень із цією метою проводяться. Відомо, що деякі речовини мають беззаперечний позитивний ефект для здоров’я людини. Однією з них є олія душиці (орегано), що містить природний карвакрол. Це основна біологічно активна речовина, котра демонструє ефективність щодо респіраторної групи вірусів (грипу тощо) (Han F. et al., 2017). Олія орегано доступна у вигляді дієтичних добавок (капсули та розчин).
Лабораторні дослідження та випробування на тваринах демонструють значний противірусний потенціал кверцетину, включаючи дію проти SARS-CoV‑2. У лабораторних гризунів, заражених грипом, кверцетин відновлював у легенях концентрацію багатьох антиоксидантів, включаючи каталазу, глутатіон і супероксиддисмутазу. Отже, кверцетин сприяє захисту легеневої тканини (Kumar P. et al., 2004). Харчові джерела: зелені листові овочі, броколі, цибуля, перець, яблука, виноград, чорний і зелений чай, червоне вино. Дієтичні добавки: кверцетин доступний у вигляді монопрепарату та в комбінації з бромелаїном і вітаміном С, що покращує його абсорбцію.
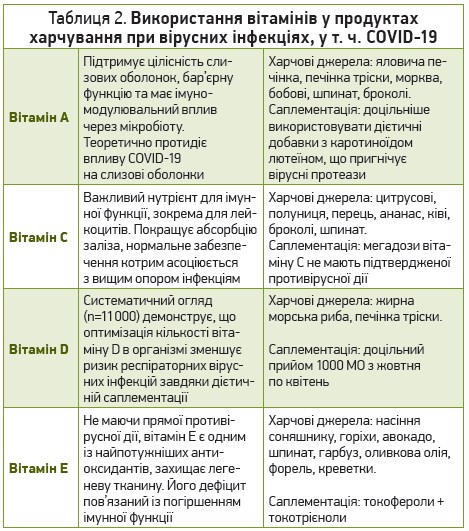
Багато вітамінів мають імуностимулювальну дію, зменшують ризик і полегшують перебіг вірусних інфекцій, у т. ч. COVID‑19 (табл. 2).
Уживання мінералів у харчових продуктах також зменшує вірусне навантаження, покращує перебіг вірусних інфекцій (табл. 3).
Результати деяких досліджень довели, що мелатонін має імуномодулювальні й антиоксидантні властивості (Silvestri M. et al., 2013); він потенційно здатний полегшувати перебіг вірусних інфекцій. Речовина представлена в капсульних і розчинних формах у різних дозуваннях. На жаль, досліджень стосовно коронавірусної інфекції наразі не проведено.
Кокосова олія – це ще одна речовина, що має противірусну дію. Плануються дослідження для визначення дії монолаурину (є похідним лауринової кислоти, котра присутня в кокосовій олії), що запобігає адгезії SARS-CoV‑2. Саме нерафінована кокосова олія містить найбільше лауринової кислоти. Монолаурин також доступний у складі дієтичних добавок.
Отже, правильне та збалансоване харчування, дотримання рекомендацій медичних організацій, достатня фізична активність, оптимальний режим сну й відпочинку здатні значно скоротити ризик зараження вірусними інфекціями, а також покращити стан імунної системи організму, що надзвичайно важливо в умовах COVID‑19.
Підготувала Христина Воськало
Медична газета «Здоров’я України 21 сторіччя» № 9 (478), травень 2020 р.