23 липня, 2020
Онлайн-вебінар – новий метод професійного удосконалення лікарів
У центрі уваги сучасні методи лікування раку легені
Безперервне навчання та постійне вдосконалення практичних навичок є невід’ємною складовою високого рівня професіоналізму лікарів. Проте на початку цього року звичний плин життя людства порушила пандемія COVID‑19. Низка сфер діяльності людини була «поставлена на паузу», однак цього собі не могла дозволити медицина. Через надзвичайну ситуацію усі масові наукові заходи, які є ефективним засобом навчання лікарів, обміну цінним досвідом, були скасовані. Але завдяки сучасним технологіям, ентузіазму науковців, бажанню лікарів здобувати нові знання стало можливим проведення наукових зустрічей у режимі онлайн.
15 травня та 3 червня відбулися два масштабних вебінари з міжнародною участю для лікарів-онкологів. Так, прямий ефір, присвячений дрібноклітинному раку легені (ДКРЛ), об’єднав 167 фахівців з різних куточків України, а відеозапис переглянуло 750 осіб. Другий вебінар розкрив тему недрібноклітинного раку легені (НДРЛ), його переглянули 1059 осіб, а 225 фахівців приєдналися до прямого ефіру. Такий формат дав можливість усім охочим почути виступи провідних вітчизняних експертів, задати питання науковцям у режимі реального часу, не покидаючи власної домівки або робочого кабінету.
Дрібноклітинний рак легені – теорія та практичний досвід
 Завідувач хіміотерапевтичного відділення КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук, доцент Ярослав Васильович Шпарик розповів про нові підходи до лікування ДКРЛ та переваги таргетної й імунотерапії.
Завідувач хіміотерапевтичного відділення КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук, доцент Ярослав Васильович Шпарик розповів про нові підходи до лікування ДКРЛ та переваги таргетної й імунотерапії.
– ДКРЛ – це нейроендокринна пухлина, на яку припадає близько 13-15% від загальної кількості випадків раку легені. ДКРЛ є агресивним злоякісним новоутворенням, і до появи медикаментозних методів лікування медіана виживаності таких пацієнтів становила близько 12 тижнів. У 1985 р. із впровадженням комбінації цисплатин + етопозид для лікування ДКРЛ розпочалася нова ера у лікуванні таких хворих. Однак прогрес у терапії ДКРЛ був незначним. Аналіз показників виживання 1032 пацієнтів із поширеним і непоширеним ДКРЛ показав незначний приріст за останні десятиліття (з 8,3% у 1986-1999 рр. до 11,0% у 2000‑2008 рр.; Schabath et al., 2014). При поширеному ДКРЛ відповідь на 1-шу лінію терапії досягається у 68-84% хворих, проте у більшості випадків захворювання прогресує. Про це свідчить низька медіана виживаності без прогресування (ВБП) – близько 6 міс, медіана загальної виживаності (ЗВ) – близько 10 міс та рівень 5-річної ЗВ – 2% (рис. 1). Така невтішна статистика спонукала до пошуку нових терапевтичних можливостей лікування пацієнтів з ДКРЛ. З 1970 р. було проведено понад 40 досліджень ІІІ фази, але близько 60 агентів не підтвердили свою ефективність у лікуванні ДКРЛ.
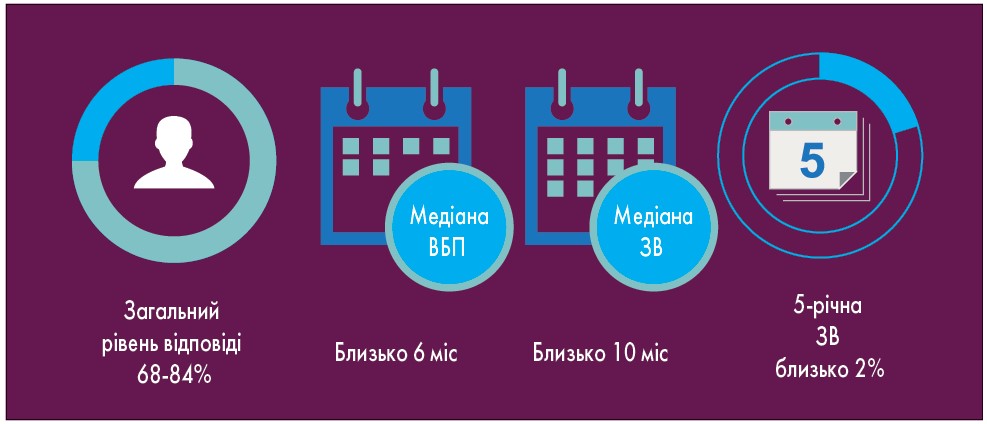 Рис. 1. Ефективність хіміотерапії при ДКРЛ
Рис. 1. Ефективність хіміотерапії при ДКРЛ
Важливим чинником, котрий впливає на ефективність імунотерапії, є рівень експресії ліганда рецептора програмованої клітинної смерті 1 (PD-L1). На відміну від НДРЛ, у пацієнтів з ДКРЛ експресію PD‑L1 виявляють рідко.
Найбільш значущі наукові публікації щодо вивчення ефективності імунотерапії при ДКРЛ вийшли протягом 2018 р. У дослідженні KEYNOTE‑158, у якому вивчали ефективність пембролізумабу як 2-ї лінії терапії при ДКРЛ, виявили, що медіана ЗВ була значно більшою у пацієнтів з експресією PD-L1, а у пацієнтів без експресії PD‑L1 ефективність зазначеної терапії була недостатньою. Пембролізумаб також не продемонстрував ефективності як підтримувальна терапія при ДКРЛ (Gadgeel, 2018). Увагу дослідників також привернув лікарський засіб іпілімумаб (не зареєстрований в Україні), ефективність якого підтверджена при меланомі. Проте при ДКРЛ у комплексній схемі з хіміотерапією (ХТ) цей засіб виявився неефективним (Lynch, 2014; Rech, 2016). З огляду на результати цих досліджень препарати пембролізумаб та іпілімумаб не зареєстровані для лікування ДКРЛ.
Після затвердження комбінації препаратів платини та етопозиду для лікування пацієнтів з ДКРЛ протягом кількох десятиліть не спостерігалося жодного прогресу у терапії цієї хвороби. Незважаючи на те що у пацієнтів з поширеним ДКРЛ спочатку відзначається хороша відповідь на ХТ, хвороба прогресує, а середній рівень ЗВ не досягає навіть 1 року. З метою створення сприятливішого середовища для підвищення потенціалу імунної системи в усуненні раку, а, отже – покращення показників виживаності таких пацієнтів активізувалися дослідження у напрямі поєднання хіміо- й імунотерапії.
Помітний внесок у вивчення терапевтичних можливостей при ДКРЛ за останні роки зробило велике рандомізоване плацебо-контрольоване дослідження IMpower133, у якому порівнювали ефективність комбінації атезолізумаб + ХТ та ХТ + плацебо. 403 хворих на ДКРЛ були розподілені на 2 групи. У фазі індукції терапії (чотири 21-денні цикли) 1-ша група (n=201) отримувала атезолізумаб 1200 мг із ХТ (карбоплатин + етопозид), 2-га група (n=202) – плацебо з ХТ (карбоплатин + етопозид). Підтримувальну терапію проводили атезолізумабом
У дослідженні IMpower133 експресія PD-L1 не була критерієм включення або фактором стратифікації з низки причин: при ДКРЛ експресія PD-L1 трапляється нечасто, не підтверджене її прогностичне значення, немає чіткої кореляції користі від лікування з експресією PD-L1, особливо на клітинах пухлин (Pujol et al., 2016; Ott et al., 2015; Antonia et al., 2016). Крім того, ДКРЛ характеризується швидким прогресуванням та клінічним погіршенням стану пацієнта, а тестування на біомаркери потребує часу, що може сповільнити прийняття рішень щодо лікування ДКРЛ.
У дослідженні IMpower133 вперше вдалося подолати 12-місячну межу медіани ЗВ. У групі атезолізумаб + ХТ цей показник склав 12,3 міс (95% довірчий інтервал – ДІ – 10,8-15,9), а у групі плацебо – 10,3 міс (95% ДІ 9,3-11,3) з відносним ризиком 0,7 (95% ДІ 0,54-0,91; p=0,0069). У групі атезолізумаб + ХТ також були кращі показники ВБП порівняно з групою ХТ + плацебо: 6-місячна ВБП дорівнювала 30,9 проти 22,4%, а 12-місячна ВБП – 12,6 проти 5,4% відповідно. Медіана ВБП становила 5,2 міс у 1-й групі та 4,3 міс – у 2-й групі (рис. 2).
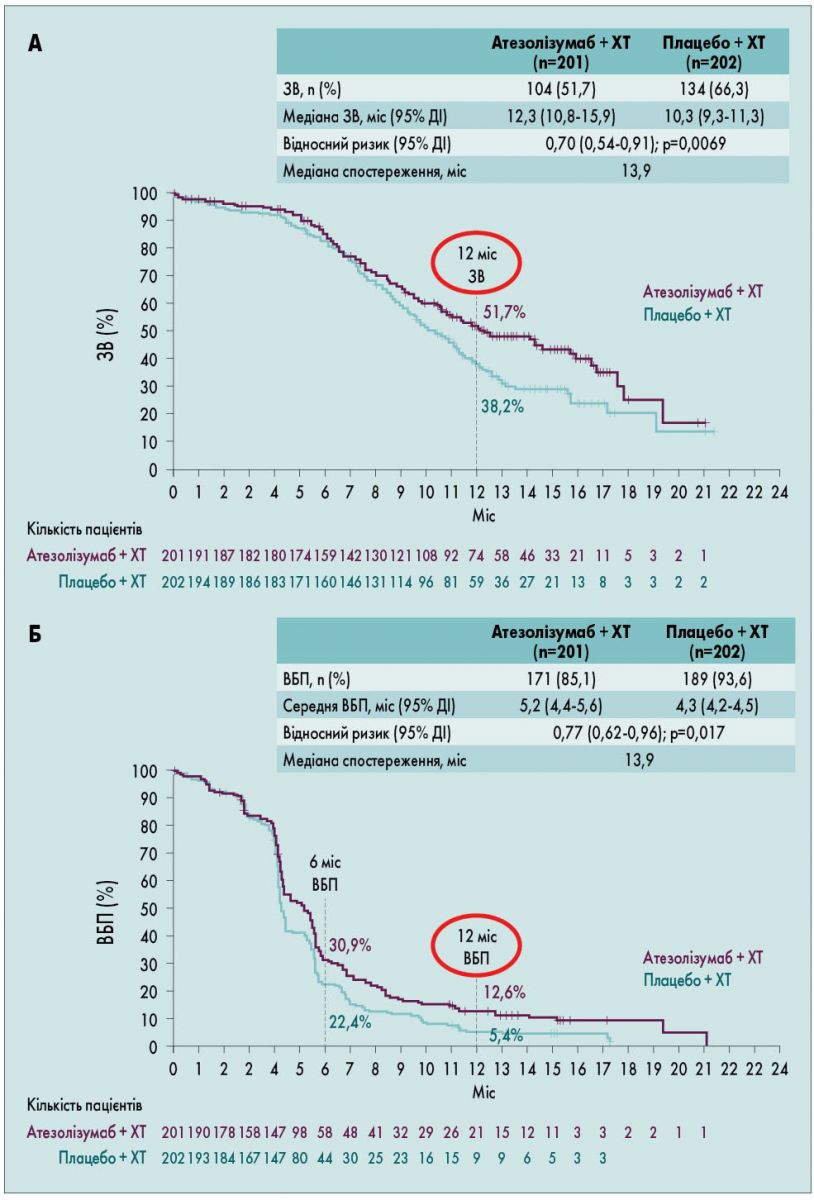 Рис. 2. Результати дослідження IMpower133: ЗВ (А) та ВБП (Б)
Рис. 2. Результати дослідження IMpower133: ЗВ (А) та ВБП (Б)
Профіль безпеки комбінації атезолізумабу з карбоплатином та етопозидом відповідав уже відомим профілям безпеки кожного агента окремо, нових побічних реакцій не виявлено. Пацієнти, які отримували атезолізумаб + ХТ, повідомляли про раннє та помітне поліпшення симптомів, пов’язаних із раком легені (кашель, біль у грудях, задишка), та фізичної активності (L. Horn et al., 2018).
Таким чином, отримані дані дослідження IMpower133 стали підставою для впровадження нового стандарту
Я.В. Шпарик також навів дані, які стосуються COVID‑19 та раку, частки пацієнтів з раком та інфекцією SARS-CoV‑2, розповів про особливості перебігу COVID‑19 в онкологічних хворих, а також рекомендації щодо ведення пацієнтів з раком в умовах пандемії. Як зазначив спікер, базовим принципом усіх рекомендацій є оцінювання ризику та користі від затримки протипухлинного лікування у кожному конкретному випадку.
 Завідувачка відділення хiмiотерапiї Центру мiжнародних клiнiчних дослiджень (м. Днiпро), кандидат медичних наук Наталія Григорівна Уржумова поділилася досвідом лікування хворих на ДКРЛ комбінацією ателізолізумабу з карбоплатином та етопозидом. Вона представила два клінічних випадки, де 1-ша лінія терапії дозволила істотно продовжити ЗВ пацієнтів. Н.Г. Уржумова також розповіла про найпоширеніші небажані явища (НЯ), асоційовані із застосуванням інгібіторів контрольних точок.
Завідувачка відділення хiмiотерапiї Центру мiжнародних клiнiчних дослiджень (м. Днiпро), кандидат медичних наук Наталія Григорівна Уржумова поділилася досвідом лікування хворих на ДКРЛ комбінацією ателізолізумабу з карбоплатином та етопозидом. Вона представила два клінічних випадки, де 1-ша лінія терапії дозволила істотно продовжити ЗВ пацієнтів. Н.Г. Уржумова також розповіла про найпоширеніші небажані явища (НЯ), асоційовані із застосуванням інгібіторів контрольних точок.
– Проведення імунотерапії в онкологічних хворих супроводжується виникненням імуноопосередкованих НЯ, які є очікуваними та піддаються корекції. Одним із найпоширеніших імуноопосередкованих явищ є ураження шкіри, що проявляється появою макуло-папульозного висипу, свербежем, почервонінням, вітиліго. Зазвичай це НЯ має легкий перебіг і коригується за допомогою невисоких доз кортикостероїдів або припинення терапії.
Ендокринопатії також виникають при застосуванні імунотерапії в онкологічних хворих. Ураження гіпофіза (гіпофізит) частіше розвивається на тлі застосування анти-CTL4-препаратів (іпілімумабу, тремілімумабу), дуже рідко – при анти-PD-L1/PD‑1 терапії. Гіпофізит характеризується головним болем, порушенням зору. До ендокринопатій також належить ураження щитоподібної залози. На початку імунотерапії може виникати короткочасний гіпертиреоз (внаслідок зниження продукції тиреотропного гормону), який згодом переходить у тривалий субклінічний гіпотиреоз. Це НЯ частіше розвивається на тлі застосування комбінації анти-CTL4 та анти-PD-L1/PD‑1 препаратів (10-20%), рідше – при терапії анти-PD-L1/PD‑1 (5‑10%). Ведення пацієнтів з ендокринопатіями має здійснювати мультидисциплінарна команда за участю ендокринолога.
Гепатотоксичність – це імуноопосередковане явище, яке ідентифікується на основі результатів лабораторних досліджень, оскільки зазвичай має безсимптомний перебіг. Найчастіше у таких пацієнтів виявляють підвищення рівня аланін- та аспартатамінотрансферази без патологічних змін рівня білірубіну й інших трансаміназ. Імуноопосередковану гепатотоксичність необхідно диференціювати від прогресування захворювання, гепатиту, індукованого іншими медикаментозними засобами чи фітопрепаратами, алкогольного, вірусного гепатиту, аутоімунного ідіопатичного гепатиту, обструкції жовчовивідних проток, оклюзії печінкових вен.
Невиражена клінічна картина характерна також для імуноопосередкованої нефротоксичності. При цьому можлива поява незначного набряку обличчя, кінцівок, схильності до гіпотензії, можливі судомні скорочення м’язів ніг. При аналізі сечі виявляють підвищення рівня креатиніну, азоту сечовини та зниження рівня калію, при комп’ютерній томографії нирок – збільшення об’єму ниркової паренхіми. Нефротоксичність необхідно диференціювати від гострої інфекції чи обструкції сечових шляхів, стискання сечових шляхів пухлинними конгломератами, токсичного впливу ХТ чи інших лікарських препаратів, метаболічного ураження нирок. Ведення таких пацієнтів має відбуватися за участю досвідченого нефролога.
У період пандемії проблема імуноопосередкованого пневмоніту в онкологічних пацієнтів стоїть дуже гостро. Складність диференційної діагностики імуноопосередкованого пневмоніту полягає у схожості клінічної картини (сухий кашель, прогресуюча задишка, лихоманка, розсіяні сухі хрипи при аускультації, тахіпное, біль у грудній клітці, ознаки гіпоксії) та даних візуалізаційних методів дослідження з інфекційним ураженням легені (у тому числі при COVID‑19).
Слід зазначити, що більшість імуноопосередкованих явищ є добре вивченими та піддаються корекції. Покроковий алгоритм ведення пацієнтів з імуноопосередкованими побічними ефектами представлений у рекомендаціях NCCN та Європейського товариства медичної онкології (ESMO). Що стосується атезолізумабу, то цей препарат характеризується сприятливим профілем безпеки, що було продемонстровано у дослідженні A. Rittmeyer та співавт. (2017; рис. 3).
 Рис. 3. Порівняння профілю безпеки атезолізумабу та доцетакселу
Рис. 3. Порівняння профілю безпеки атезолізумабу та доцетакселу
На завершення майстер-класу менеджер з роботи з ключовими клієнтами фармацевтичної компанії Roche (м. Дніпро) Михайло Гундарчук розповів про програми підтримки пацієнтів, ініційовані фармацевтичною компанією Roche. В умовах відсутності загальнодержавних програм фінансування онкохворих в Україні компанія Roche поставила перед собою завдання забезпечити їм максимальний доступ до високоефективної терапії. Детальна інформація представлена на офіційних вебпорталах компанії, на які можна перейти за QR-кодами, представленими у кінці статті.
Сучасні підходи до лікування пацієнтів з НДРЛ: нові досягнення таргетної та імунотерапії
 Завідувач кафедри онкології ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», доктор медичних наук, професор Олексій Олексійович Ковальов звернув увагу на важливість визначення різних фенотипів, молекулярних типів і підтипів раку легень для вибору оптимальної тактики лікування.
Завідувач кафедри онкології ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», доктор медичних наук, професор Олексій Олексійович Ковальов звернув увагу на важливість визначення різних фенотипів, молекулярних типів і підтипів раку легень для вибору оптимальної тактики лікування.
Останнім часом зростає увага вчених до гена кінази анапластичної лімфоми (Anaplastic lymphoma kinase, ALK). Мутацію гена ALK при НДРЛ частіше діагностують у молодих жінок з НДРЛ, які ніколи не курили. На етапі скринінгу таким пацієнтам необхідно проводити імуногістохімічне дослідження. Згідно з рекомендаціями Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA), мутацію ALK можна визначити за допомогою молекулярного тесту з використанням FISH-методу. В останніх настановах FDA також було вказано про доцільність застосування мультиплексних платформ для молекулярного профілювання у зв’язку з появою нових мутацій та ампліфікацій, які призводять до розвитку резистентності.
За сучасними рекомендаціями у лікуванні пацієнтів з ALK+ НДРЛ необхідно застосовувати таргетні препарати (кризотиніб, алектиніб), які покращують виживаність таких хворих (B. Gutierrez et at., 2017; F. Barlesi et al., 2016). Клінічні дослідження свідчать про неефективність застосування ХТ у хворих з ALK+ НДРЛ (A.T. Shaw et al., 2013). Іншою проблемою лікування таких хворих є зростання резистентності до ALK-інгібіторів. У 2017 р. у рандомізованому дослідженні III фази ALEX у пацієнтів з ALK+ НДРЛ було встановлено значно більші значення медіани ВБП у групі алектинібу, ніж у групі кризотинібу (S. Peters et al., 2017). Крім того, згідно з оновленими результатами дослідження ALEX 2020 р., 5-річна виживаність у хворих, які приймали алектиніб, складала 62,5%, а у пацієнтів групи кризотинібу – 45,5%. Нових випадків побічних реакцій, пов’язаних із застосуванням алектинібу, не виявлено.
Проблема сучасної терапії при метастазах у центральній нервовій системі (ЦНС) полягає у тому, що ракові клітини можуть легко проходити крізь гематоенцефалічний бар’єр (ГЕБ) порівняно з більшістю онкологічних препаратів, які у зв’язку із взаємодією з системою P-глікопротеїдів не можуть проникнути через ГЕБ. Загальні принципи терапії при метастазах у ЦНС полягають у застосуванні системної терапії у пацієнтів з мінімальними симптомами та призначенні тільки дексаметазону по 4 мг/добу у разі виражених проявів метастазів у головному мозку. Згідно з результатами дослідження ALEX алектиніб виявився ефективним у пацієнтів з ALK+ НДРЛ, незалежно від наявності метастазів у ЦНС, оскільки механізм дії цього лікарського засобу не пов’язаний із системою P-глікопротеїдів, що сприяє проникненню молекули через ГЕБ.
Отже, EML4-ALK – потужний онкоген, наявність якого свідчить про поганий прогноз і швидкий розвиток метастазів у ЦНС, плеврі та грудній клітці при НДРЛ. Застосування ХТ не покращує виживаність цієї групи хворих, тому більш доцільним є використання таргетної терапії.
 Переваги комбінованих режимів імунотерапії в лікуванні НДРЛ висвітлила завідувачка відділення хіміотерапії № 1 Київського міського клінічного онкологічного центру, доцент кафедри онкології Національної медичної академії післядипломної освіти ім. П.Л. Шупика, кандидат медичних наук Ольга Володимирівна Пономарьова.
Переваги комбінованих режимів імунотерапії в лікуванні НДРЛ висвітлила завідувачка відділення хіміотерапії № 1 Київського міського клінічного онкологічного центру, доцент кафедри онкології Національної медичної академії післядипломної освіти ім. П.Л. Шупика, кандидат медичних наук Ольга Володимирівна Пономарьова.
– Сьогодні науковці активно вивчають різні молекулярні мутації у хворих на рак легені. Це відкриває нові можливості для використання сучасних методів впливу на імунні клітини шляхом повторної активації пригнічених T-клітин через зупинку взаємодії PD-L1, який експресується на клітинах пухлини з рецепторами PD‑1, що розташовані на поверхні T-клітин. Цей механізм реалізується за допомогою інгібіторів контрольних точок. Тецентрик® (атезолізумаб) є моноклональним антитілом, що зв’язується з PD-L1 і блокує його взаємодію з рецепторами PD-1 і B7.1. У 2016 р. отримано перші результати дослідження III фази ОАК, згідно з якими 1‑річна ЗВ у пацієнтів з НДРЛ після 2‑лінії лікування атезолізумабом складала 55%, а доцетакселом – 41%. 2‑річна ЗВ у групі препарату Тецентрик® становила 31%, у групі доцетакселу – 21%. Застосування препарату Тецентрик® було також більш ефективним навіть у пацієнтів з PD‑L1 негативним статусом та у хворих з метастазами у ЦНС.
У клінічному дослідженні IMpower150 з вивчення ефективності комбінації препарату Тецентрик® з антиангіогенною (анти-VEGF) терапією та ХТ у 1-й лінії у пацієнтів з НДРЛ. Основними критеріями включення пацієнтів у дослідження були попередньо діагностований неплоскоклітинний НДРЛ IV стадії чи метастатичний рецидивний НДРЛ, відсутність ХТ в анамнезі та наявність зразка пухлини для дослідження на біомаркери та будь‑який статус за PD‑L1. Хворих стратифікували на підгрупи залежно від статі, експресії PD‑L1 та наявності метастазів у печінці.
Усіх учасників (n=1202) було рандомізовано на 3 групи: пацієнти 1‑ї групи отримували атезолізумаб, карбоплатин і паклітаксел (ACP), 2‑ї групи – препарат Тецентрик®, бевацизумаб, карбоплатин і паклітаксел (ABCP), 3‑ї групи – бевацизумаб, карбоплатин і паклітаксел (BCP). Більшість учасників входили до ITT‑WT популяції (від wild type – дикий тип, тобто без мутацій EGFR чи транслокацій ALK). Початкові дані пацієнтів у 3 групах щодо віку, статі, експресії PD‑L1, профілю генної експресії, мутаційного статусу були зіставні.
У популяції ITT‑WT медіана ВБП становила 8,3 та 6,8 міс у 2‑й і 3‑й групах відповідно (відносний ризик – ВР – 0,59; 95% ДІ 0,50‑0,70; р <0,0001), що свідчить про зниження ризику смерті чи прогресування захворювання на 41% у пацієнтів групи ABCP порівняно з групою BCP (рис. 4). Також у всіх підгрупах популяції ITT‑WT медіана ВБП була кращою у 2‑й групі, ніж у 3‑й, навіть у пацієнтів з первинними метастазами у печінці. У це дослідження були включені пацієнти, що отримували інгібітори тирозинкіназ у зв’язку з наявністю драйверних мутацій, у яких відзначалося прогресування захворювання. У пацієнтів з мутаціями EGFR чи транслокаціями ALK медіана ВБП була значно більшою у 2‑й групі, ніж у 3‑й (9,7 проти 6,1 міс; ВР 0,59; 95% ДІ 0,37‑0,94; рис. 5). При наявності делеції EGFR в зоні 19 чи мутації L858R медіана ВБП була більшою у пацієнтів групи ABCP порівняно з хворими, які приймали комбінацію BCP (10,2 проти 6,9 міс; ВР 0,41; 95% ДІ 0,22‑0,78). ЗВ у хворих з метастазами у печінці також була значно кращою у 2‑й групі порівняно з 3‑ю (рис. 6).
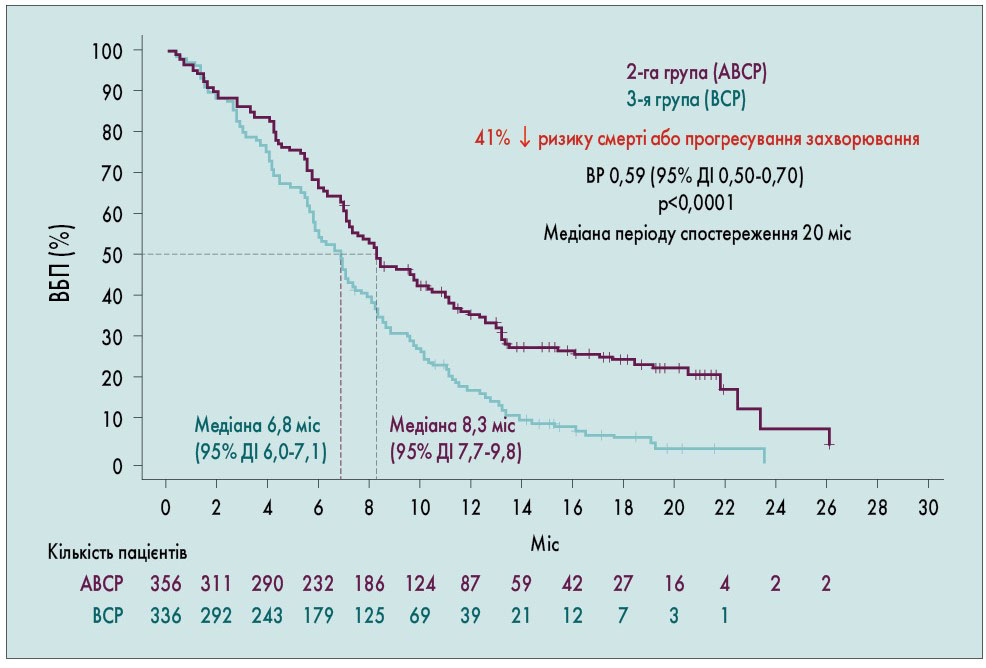 Рис. 4. ВБП у пацієнтів популяції ITT-WT (2-га та 3-я групи)
Рис. 4. ВБП у пацієнтів популяції ITT-WT (2-га та 3-я групи)
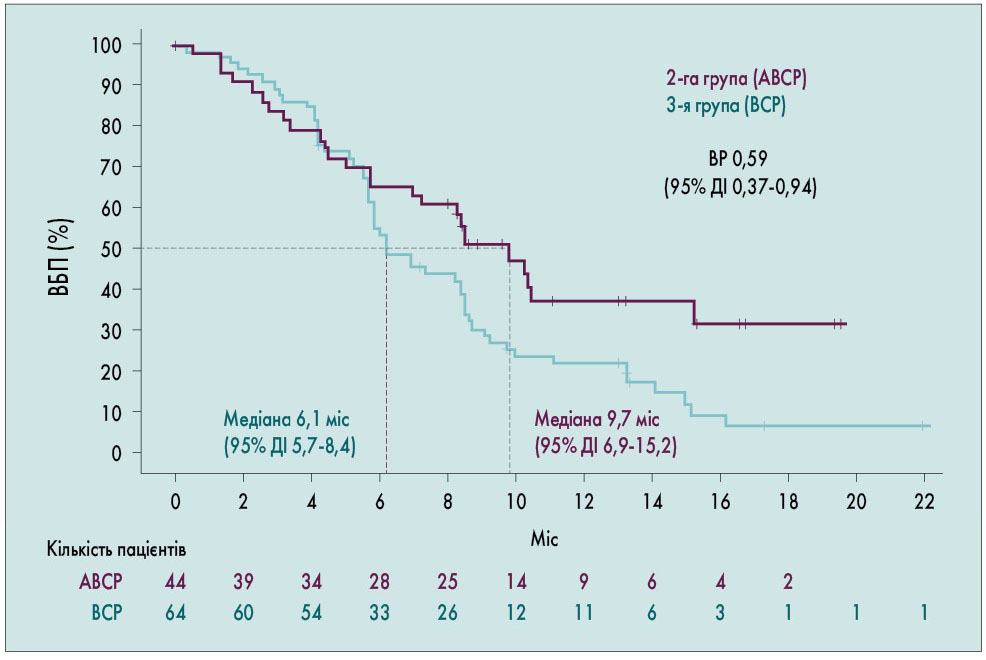 Рис. 5. ВБП у пацієнтів з мутаціями EGFR+/ALK+
Рис. 5. ВБП у пацієнтів з мутаціями EGFR+/ALK+
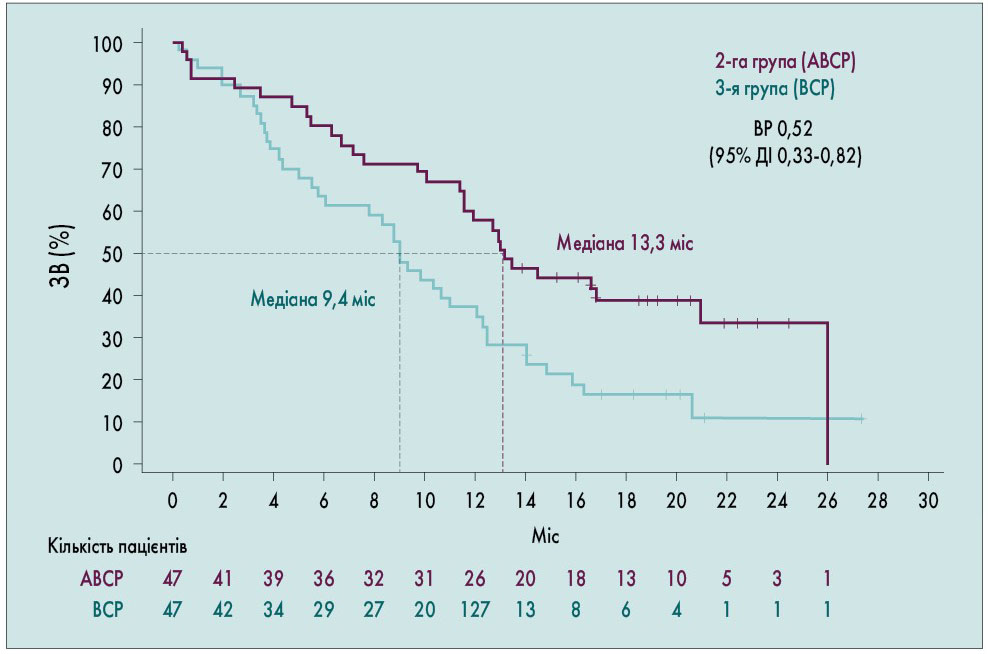 Рис. 6. ЗВ у пацієнтів з метастазами у печінці
Рис. 6. ЗВ у пацієнтів з метастазами у печінці
Медіана ВБП у всіх субпопуляціях була кращою у пацієнтів, які приймали ABCP, ніж у хворих групи BCP. Оцінка ЗВ у популяції ITT‑WT показала зростання медіани ЗВ до 19,8 міс у 2‑й групі проти 14,9 міс у 3‑й групі (ВР 0,76; 95% ДІ 0,63‑0,93). Обнадійливим є те, що у пацієнтів 2‑ї групи з EGFR+/ALK+ ще не отримані результати щодо ЗВ (медіана ЗВ у 3‑й групі склала 17,5 міс). Дані щодо безпеки комбінацій ABCP та BCP у процентному співвідношенні між групами майже не відрізняються.
Отже, Impower150 – це перше клінічне дослідження III фази з використанням препарату Тецентрик®, яке продемонструвало статистично та клінічно значущу перевагу щодо ВБП і ЗВ в 1‑й лінії терапії майже у всіх групах пацієнтів з неплоскоклітинним НДРЛ, включаючи хворих з мутаціями EGFR+/ALK+, PD‑L1 негативним статусом та метастазами в печінці.
У дослідженні IMpower 130 у популяції ITT‑WT було встановлено кращу медіану ЗВ у групі лікування препаратом Тецентрик® у поєднанні з карбоплатином та наб‑паклітакселом (в Україні не зареєстрований), ніж у групі атезолізумабу, карбоплатину та паклітакселу (18,6 проти 13,9 міс; ВР 0,79; 95% ДІ 0,64‑0,98; p=0,033).
На підставі отриманих результатів клінічних досліджень у 2019 р. препарат Тецентрик® схвалений для 1-ї лінії лікування у комбінації з бевацизумабом, паклітакселом і карбоплатином при метастатичному неплоскоклітинному недрібноклітинному раку легені без геномних пухлинних аберацій EGFR або ALK. У пацієнтів з EGFR- або ALK-геномними пухлинними абераціями до отримання препарату Тецентрик® повинно спостерігатися прогресування захворювання на фоні терапії, що схвалена для НДРЛ з такими абераціями. Комбінація препарату Тецентрик® з наб-паклітакселом і карбоплатином затверджена FDA як 1‑ша лінія терапії пацієнтів з метастатичним неплоскоклітинним НДРЛ та відсутністю мутацій EGFR чи транслокацій ALK. Також рекомендовано застосовувати атезолізумаб як 1-шу лінію лікування у комбінації з карбоплатином та етопозидом у дорослих пацієнтів з дрібноклітинним раком легені у поширеній стадії.
Про інноваційні соціально спрямовані програми розповів менеджер з роботи з ключовими клієнтами компанії Roche Євген Салко. Зокрема, він представив програму підтримки пацієнтів «2+3», згідно з якою у хворих є можливість придбати 2 упаковки препарату Тецентрик® за повну вартість та 3 – за акційною ціною за умовами програми. Доповідач наголосив на необхідності застосування цього лікарського засобу 1 раз на 3 тижні згідно з інструкцією до моменту прогресування захворювання чи розвитку клінічної непереносимості.
Вебресурси:
https://www.roche.ua/
https://tcntr.com.ua/
https://www.roche-psp.com.ua/
Підготували Ілона Цюпа та Ірина Неміш
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 3 (64) 2020 р.


