25 липня, 2020
Вплив ендокринних порушень на реалізацію репродуктивної функції жінки: яка допомога можлива?
Пристосовуючись до сучасного темпу життя, репродуктивна медицина дедалі більше почала зосереджуватися на питаннях впливу стресових факторів і метаболічних змін на жіноче здоров’я. Адже саме стрес, порушення нутритивного статусу й гормонального фону призводять до розвитку ендокринних захворювань, репродуктивних розладів та проліферативних процесів. Саме цій проблематиці була присвячена ІІ Міжнародна школа з гінекологічної та репродуктивної ендокринології (USGRE), що відбулася 3-4 квітня в онлайн-форматі.
Однією з центральних стала доповідь завідувача кафедри акушерства, гінекології та перинатології факультету післядипломної освіти Львівського національного медичного університету ім. Данила Галицького, доктора медичних наук, професора Віри Іванівни Пирогової «Гіпотиреоз та дефіцит вітаміну D як предиктори розвитку гінекологічного раку».
– В Україні нараховується понад 1 млн пацієнтів з онкологічними захворюваннями. За даними Міжнародного агентства з дослідження раку (International Agency for Research on Cancer, IARC), щорічно у світі реєструють близько 500 тис. нових випадків новоутворень шийки матки, майже 320 тис. раку ендометрія і 240 тис. раку яєчників. Онкогінекологічні захворювання посідають 6‑8-ме місця у структурі смертності жіночого населення (рак яєчників – 5,7%, тіла матки – 4,9%, шийки матки – 4,8%). Крім зростання частоти, зокрема поширених форм злоякісних новоутворень, спостерігається тенденція до зміщення піку захворюваності в бік осіб молодого віку (Maltaris L. et al., 2012).
У структурі загальної гінекологічної патології одними з найпоширеніших є поєднані доброякісні дисгормональні проліферативні захворювання органів репродуктивної системи. Дедалі частіше останні відзначаються на фоні різних коморбідних станів, таких як ожиріння, цукровий діабет 2-го типу, дисфункція щитоподібної залози (ЩЗ) тощо. До гіперпроліферативних гінекологічних синдромів відносяться:
- міома матки;
- ендометріоз (аденоміоз);
- гіперплазія ендометрія;
- дисгормональна дисплазія молочних залоз.
Можливими причинами вищезазначених станів виступають патологія ЩЗ, дефіцит магнію та вітаміну D, гіперестрогенія та гіперпролактинемія.
Серед ендокринологічних порушень захворювання ЩЗ за частотою посідають 2-ге місце після цукрового діабету. Згідно з останніми науковими даними, в Україні патологія ЩЗ виявляється приблизно у 42‑52% дорослого населення та у 20% дітей. Станом на 1.01.2014 р. в Україні зареєстровано понад 103 тис. хворих на гіпотиреоз. Поширеність гіпотиреозу в загальній популяції сягає 3,7% і залежить від віку, статі та рівня споживання йоду. Частота маніфестного гіпотиреозу в популяції становить 0,2‑2,0% випадків, субклінічного – 10% у жінок і до 3% – у чоловіків (Паньків В. І., 2011).
Гормони ЩЗ виступають в організмі у ролі регуляторів обмінних процесів, забезпечують тканини киснем і мають антиоксидантні властивості. Не менш значущим є властивість тиреоїдних гормонів впливати на клітинну проліферацію, диференціювання та апоптоз, що дозволяє розглядати їх як учасників процесу пухлинного ґенезу.
Частота розладів менструального циклу при гіпотиреозі у 3 рази вища, ніж у загальній популяції жінок репродуктивного віку і, за даними різних дослідників, становить 23,4‑70%. Тривалий некомпенсований гіпотиреоз призводить до хронічної ановуляції та маткових кровотеч. За відсутності адекватної замісної терапії при гіпотиреозі закономірно розвивається вторинна гіперпролактинемія.
Механізм впливу гіпотиреозу на репродуктивну систему пояснюється тим, що в умовах дефіциту тиреотропін-рилізинг-гормону посилюється ріст тиреотрофів, які продукують збільшену кількість тиреотропного гормону (ТТГ). Крім того, пригнічується функція клітин гіпофіза, які виробляють лютеїнізуючий гормон, знижується реактивність рецепторів гіпофіза стосовно пригнічуючої дії естрогенів на фолікулостимулюючий гормон, що призводить до гіперпродукції останнього. Усе це спричиняє розвиток тривалого естрогенного впливу на фоні хронічної ановуляції (Глушаков Р. І., Прошин С. Н., 2011).
Тиреоїдний статус пацієнток із гіперпроліферативними гінекологічними захворюваннями є незалежним прогностичним фактором відповіді на лікування та ризику розвитку рецидиву (Tang H., Lin H. et al., 2004).
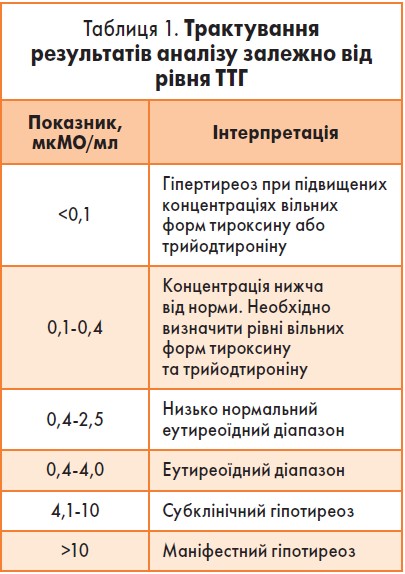
Скринінг патології ЩЗ передбачає: ультразвукове дослідження ЩЗ із вимірюванням її об’єму (до 18 мм); визначення рівнів ТТГ (табл. 1), антитіл до тиреопероксидази (до 35 МО/мл) та вільного тироксину (10,3‑24,5 пмоль/л).
Згідно із сучасними рекомендаціями жінкам, які планують вагітність, та вагітним слід прагнути до діапазону рівнів ТТГ 0,4‑2,5 мкМО/мл. Такі показники ТТГ асоціюються з більш частим настанням вагітності та нижчим ризиком загрози її переривання й викидня.
На сьогодні для покращення функції ЩЗ на етапі планування вагітності та в перші її триместри рекомендований прийом вітамінно-мінеральних комплексів із доведеним впливом на залозу. Найбільше практичне значення для покращення функціонування ЩЗ та метаболізму її гормонів мають такі мікроелементи, як йод та селен. Йод необхідний як будівельний матеріал, з якого утворюються тиреоїдні гормони, а селен задіяний у біосинтезі селенопротеїнів, що беруть участь у тиреоїдному метаболізмі. Селен-вмісні йодтироніндейодинази контролюють переробку надлишку тиреоїдних гормонів, а селен-вмісні глутатіонпероксидази забезпечують антиоксидантний захист ЩЗ.
Відомо, що залізодефіцитна анемія знижує ефективність препаратів йоду, призначених із терапевтичною або профілактичною метою за йододефіцитних станів. Дефіцит заліза призводить до зниження рівня тиреоїдних гормонів: трийодтироніну – на 43%, а тироксину – на 67% (Bastian T. W., 2010).
Наступним мікроелементом, який тісно пов’язаний із функціонуванням ЩЗ, є цинк. Дефіцит цинку позначається на функції ЩЗ, а рівень тиреоїдних гормонів, у свою чергу, впливає на метаболізм цинку, модулюючи всмоктування й виведення останнього. Цинк входить до складу рецепторів до трийодтироніну. Такий висновок зроблений на основі виявлення у структурі цих рецепторів так званих цинкових пальців – спеціалізованих фрагментів білка, що хелатують цинк.
Премама Дуо – мультивітамінний і мультимінеральний комплекс, що містить достатню кількість йоду, селену та цинку для забезпечення оптимального функціонування ЩЗ у жінок під час вагітності, лактації та на етапі планування вагітності. Ці мікроелементи підтримують оптимальний тиреоїдний статус у матері й дитини, сприяючи тим самим здоровому розвитку нервової системи малюка. Даний комплекс містить також 15 мг заліза, що сприяє еритропоезу, забезпечує профілактику виникнення залізодефіцитної анемії, зменшує втомлюваність, випадіння волосся та ламкість нігтів. Вітамін С, що міститься в комплексі Премама Дуо, покращує засвоєння заліза, а також сприяє роботі неспецифічного імунітету. До складу Премама Дуо входять також вітаміни групи В, вітамін D, фолієва кислота та омега‑3-жирні кислоти.
Приймати комплекс Премама Дуо слід по 1 таблетці або по 1 м’якій капсулі на добу після їди, запиваючи невеликою кількістю води. Тривалість курсу в кожному випадку лікар визначає індивідуально.
Важливим жиророзчинним вітаміном для жіночого організму є вітамін D. Він посідає особливе місце у структурі протипухлинного захисту, є доведеним стимулятором протипухлинного імунітету, який компенсує імунодефіцитні стани, що сприяють метастазуванню. Такий ефект вітаміну D зумовлений прямим впливом активованого рецептора вітаміну D на транскрипцію більш ніж тисячі генів, залучених до процесу регуляції ділення й апоптозу клітин. Саме за рахунок підтримки апоптозу вітамін D сприяє елімінації пухлинних клітин із організму. Дефіцит цього вітаміну (<30 нг/мл) асоційований із швидко проліферуючими пухлинами молочної залози з метастазуванням і більш агресивним перебігом раку молочної залози.
Оцінка статусу вітаміну D в організмі проводиться шляхом визначення рівня 25(OH)D у крові (табл. 2).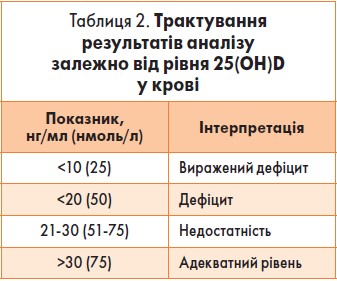
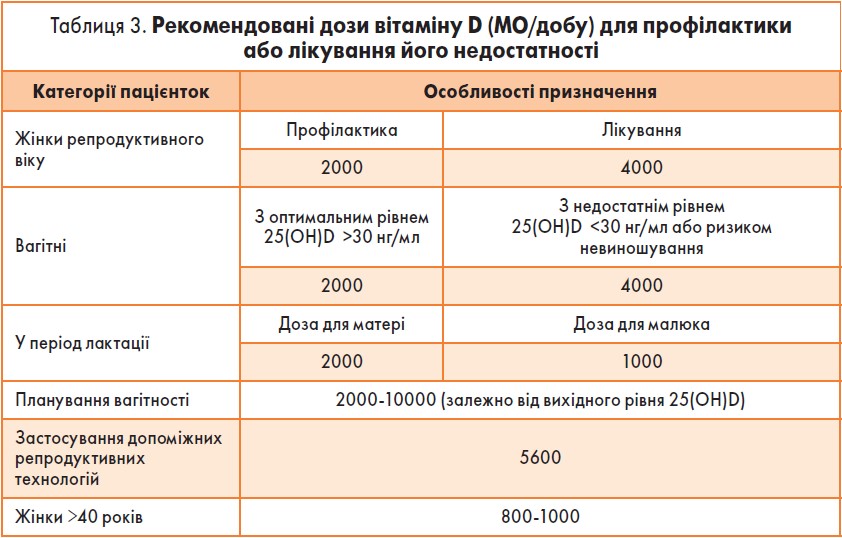
Для профілактики або лікування нестачі вітаміну D слід обирати препарати в дозах, представлених у табл. 3. Так, дози вітаміну D 4000 МО/добу безпечні й не потребують контролю рівня 25(OH)D у крові. При застосуванні більш високої дози повторне дослідження рівня 25(OH)D слід виконувати через 3 і 6 міс від початку прийому препарату.
Оскільки всі обмінні процеси в організмі є взаємопов’язаними, для нормального метаболізму вітаміну D потрібен достатній рівень магнію. Дефіцит останнього знижує інтенсивність гідроксилювання холекальциферолу, а пряма кореляція між рівнями магнію і 25(OH)D свідчить про необхідність проведення одночасної корекції дефіциту магнію та вітаміну D. Забезпечення організму магнієм і кальцієм в адекватних кількостях перешкоджає старту багатьох негативних імунологічних програм, у т.ч. й онкологічних (рак матки, молочної залози, товстого кишечника тощо).
Не меншу цікавість викликала доповідь «Стрес у житті жінки як «мовчазний ворог»: порушення циклу, непліддя, онкологія», яку представила президент Асоціації гінекологів-ендокринологів України, завідувач відділення ендокринної гінекології ДУ «Інститут педіатрії, акушерства і гінекології ім. академіка О.М. Лук’янової НАМН України» (м. Київ), член-кореспондент НАМН України, доктор медичних наук, професор Тетяна Феофанівна Татарчук.
– Ще у 1950 р. було сформульовано загальнонаукове визначення стресу: «Сукупність реакцій організму, спрямованих на збереження гомеостазу в умовах навколишнього середовища, що змінюються». Того ж року з’явилися перші публікації про зв’язок стресу із психологічними та психічними патологіями. Рівень стресу залежить від стресових подій, психологічного типу особистості, що піддається стресу, та генетично зумовлених особливостей функціонування стрес-реалізуючої й стрес-лімітуючої систем.
Для жіночого організму стрес має свої характерні особливості, адже естрогени чинять стимулюючий вплив на гіпоталамо-гіпофізарно-наднирникову систему, а реактивність останньої є набагато вищою, ніж у чоловіків. Цікавим є факт відкриття гонадотропін-інгібуючого гормону, який виробляється під впливом стресу і є найсильнішим супресором фертильності. Його аналог RFRP (RFamide-related peptide), виявлений у ссавців, а також виділений у 2009 р. у людей, синтезується в гіпоталамусі й знижує синтез та вивільнення гіпофізом гонадотропінів (фолікулостимулюючого та лютеїнізуючого гормонів).
Стрес-індукований підвищений рівень кортизолу та окислювальний стрес призводять до апоптозу клітин гранульози, що, у свою чергу, веде до зниження рівня естрадіолу та індукції апоптозу ооцитів. Вплив хронічного стресу призводить до того, що з прегненолону в першу чергу синтезується кортизон, а не прогестерон.
На жіночому здоров’ї стрес позначається такими станами, як-от:
- безпліддя;
- невиношування вагітності;
- патологія ендометрія та молочних залоз;
- рання менопауза;
- тяжкий клімакс.
Якою ж є роль мелатоніну в ліквідації стресу? Мелатонін регулює функціональний стан гіпоталамусу, гіпофізу, автономної нервової системи, а саме:
- формує добові й сезонні біоритми;
- регулює цикл «сон – неспання»;
- забезпечує антиоксидантний захист;
- посилює імуномодулюючу й протипухлинну активність;
- регулює тонус судин та артеріального тиску.
Мелатонін у вигляді препаратів є аналогом епіфізарного нейропептиду мелатоніну, основний ефект якого полягає в гальмуванні секреції гонадотропінів і підвищенні секреції гама-аміномасляної кислоти та серотоніну. Це призводить до нормалізації циркадних ритмів, ритмічності гонадотропних ефектів і статевої функції, зменшує вираженість стресових реакцій. Мелатонін – це універсальний адаптоген зі снодійним ефектом, що має антиоксидантні властивості, покращує стан ендотелію судин та мікроциркуляцію. Крім того, він стимулює клітинний імунітет і чинить імуномоделюючий вплив на організм.
Одним із негативних наслідків хронічного стресу є підвищення рівня пролактину, що пригнічує стероїдогенний регуляторний протеїн, який забезпечує транспорт холестеролу в мітохондрії для синтезу статевих гормонів. Повідомлялося про зниження занепокоєння і поліпшення якості життя у пацієнтів із психоемоційними розладами, а також про нівелювання симптомів депресії за рахунок зниження рівня пролактину. Рекомендовано вимірювати рівень сироваткового пролактину в жінок із тривогою, соматизованими розладами та депресією. Гіперпролактинемія є частою причиною порушення менструального циклу, безпліддя, галактореї, зниження лібідо та фригідності.
Застосування препаратів на основі сухого екстракту плодів прутняку звичайного має доведену ефективність при стресовому безплідді. Вони чинять нормалізуючу дію на рівень статевих гормонів. Дофамінергічні ефекти препаратів зумовлюють зниження продукування пролактину й усувають гіперпролактинемію. Така терапія сприяє ліквідації дисбалансу між естрадіолом та прогестероном, тим самим нормалізуючи другу фазу менструального циклу й зменшуючи прояви мастодинії (Косей Н. В. та співавт., 2016).
Ще одним наслідком хронічного стресу є стрес-індукована недостатність лютеїнової фази, що виникає внаслідок дефіциту прогестерону. Цей стан часто загрожує невиношуванням вагітності. Виходом із даної ситуації є застосування препаратів прогестерону, які нормалізують циклічну продукцію гонадотропінів і допомагають реалізувати репродуктивну функцію жінки.
На етапі становлення репродуктивної функції важливу роль у формуванні стрес-індукованої яєчникової гіперандрогенії має наявність/відсутність інсулінорезистентності. У період пубертату спостерігається фізіологічна інсулінорезистентність, що підсилюється внаслідок підвищення секреції інсуліну, статевих стероїдів та зменшення кількості глобуліну, що зв’язує статеві гормони. У свою чергу, це призводить до формування субстрату для розвитку синдрому полікістозних яєчників та гіперандрогенії. Крім базового лікування синдрому полікістозних яєчників доцільним є використання харчових волокон, наприклад гуарової каміді, що сприяють нормалізації функції кишечника, зменшенню всмоктування вуглеводів, маси тіла, зниженню рівня глікемії і, як наслідок, інсулінорезистентності – основного синдрому при даній патології. Гуарова камідь – натуральне джерело харчових волокон, що має наступні властивості:
- обволікає слизову шлунка та кишечника;
- зменшує відчуття голоду;
- гальмує всмоктування жирів і вуглеводів;
- подовжує час травлення, збільшує тривалість відчуття ситості;
- стимулює моторику кишечника;
- чинить детоксикаційний ефект;
- сприяє зниженню початкового рівня глюкози й холестерину у крові.
Хронічний стрес призводить до виснаження ресурсів організму у вигляді дефіциту заліза, фолієвої кислоти, магнію, цинку та інших мікроелементів.
Фолієва кислота (ФК) бере участь у багатьох метаболічних процесах, її недостатність в організмі вагітної жінки або жінки, що планує вагітність, є фактором ризику розвитку дефекту нервової трубки плода, порушення фізичного та психічного розвитку новонародженого.
Яким чином ФК впливає на метаболізм?
- Бере участь у репарації ДНК
- Запобігає жировій інфільтрації печінки
- Знижує рівень гомоцистеїну
- Покращує функціонування кишечника (підвищує рівень холіну)
- Чинить антидепресивну дію (сприяє утворенню серотоніну)
Добове надходження ФК має складати не менше 400 мкг. ФК краще засвоюється в комплексі з вітаміном В12 та іншими вітамінами групи В.
Ще одним із наслідків хронічного стресу є нестача заліза та внутрішньоклітинного магнію, що призводить до безсоння, підвищеної втомлюваності, лабільності артеріального тиску, головного болю, випадіння волосся, ламкості нігтів та інших неприємних симптомів. Вагітність і лактація є також однією з причин розвитку даних дефіцитів, що важко скоригувати лише змінами в харчуванні. У такому випадку слід застосовувати додаткові джерела вітамінів та мікроелементів.
Премама Дуо – комплексний препарат, який містить достатню кількість вітамінів та мікроелементів в одній таблетці, що за своїм складом максимально відповідає нормам МОЗ України щодо застосування його у жінок під час вагітності та лактації (наказ № 1073 від 03.09.2017 «Про затвердження норм фізіологічних потреб населення України в основних харчових речовинах та енергії»). Премама Дуо містить добову дозу вітамінів D, Е, С та групи В, кальцію, цинку, заліза, магнію та ін., що дозволяє легко усунути наявні дефіцити або профілактувати їх виникнення.
Отже, існує безліч методів, які допомагають вберегти здоров’я та репродуктивну функцію жінки від стресіндукованих захворювань. Кожен із них має розглядатися не ізольовано, а як комплексне лікування.
Висновки
На сьогодні для покращення функції ЩЗ на етапі планування вагітності та в перші її триместри рекомендовано прийом вітамінно-мінеральних комплексів із доведеним впливом на залозу.
Згідно із сучасними рекомендаціями, жінкам, які планують вагітність, та вагітним слід прагнути до діапазону рівнів ТТГ 0,4‑2,5 мкМО/мл.
Премама Дуо – мультивітамінний і мультимінеральний комплекс, що містить достатню кількість йоду, селену та цинку для забезпечення оптимального функціонування ЩЗ. Крім того, такі компоненти препарату, як залізо, вітамін С та фолієва кислота, профілактують розвиток анемії. Приймати Премама Дуо слід по 1 таблетці або по 1 м’якій капсулі на добу після їди, запиваючи невеликою кількістю води.
Вітамін D виступає не лише регулятором фосфорно-кальцієвого обміну, а й стимулятором протипухлинного імунітету, що компенсує імунодефіцитні стани. Прийом вітаміну D у дозі 4000 МО/добу є безпечним і не потребує контролю рівня 25(OH)D у крові.
Важливим кроком у лікуванні стрес-індукованих захворювань у гінекології є комбіноване застосування препаратів на основі екстракту плодів прутняка звичайного та прогестерону. Така комбінація нормалізує другу фазу менструального циклу, зменшує прояви мастодинії, створює оптимальні умови для імплантації заплідненої яйцеклітини.
Підготувала Іванна Садівська
Тематичний номер «Акушерство, Гінекологія, Репродуктологія» № 2 (38) 2020 р.