9 вересня, 2020
Антигіпертензивна терапія залежно від профілю пацієнта: чи є вибір?
 У травні 2020 р. за підтримки компанії «Асіно» Українська медична академія провела вебінар, на якому основну увагу було зосереджено на аспектах індивідуалізованої оптимальної тактики терапії артеріальної гіпертензії (АГ) та ролі різних класів кардіологічних препаратів при хронічній хворобі нирок (ХХН), цереброваскулярних захворюваннях, серцевій недостатності (СН) і ризику раптової смерті. Своєю думкою з цього приводу поділилася Лариса Миколаївна Яковлева, д. мед. н., професорка кафедри кардіології та функціональної діагностики Харківської медичної академії післядипломної освіти.
У травні 2020 р. за підтримки компанії «Асіно» Українська медична академія провела вебінар, на якому основну увагу було зосереджено на аспектах індивідуалізованої оптимальної тактики терапії артеріальної гіпертензії (АГ) та ролі різних класів кардіологічних препаратів при хронічній хворобі нирок (ХХН), цереброваскулярних захворюваннях, серцевій недостатності (СН) і ризику раптової смерті. Своєю думкою з цього приводу поділилася Лариса Миколаївна Яковлева, д. мед. н., професорка кафедри кардіології та функціональної діагностики Харківської медичної академії післядипломної освіти.
Спікерка розпочала доповідь з актуальних правил ініціювання антигіпертензивної терапії (ESC/ESH, 2018). Так, за наявності високого нормального артеріального тиску (АТ) 130‑139/85‑89 мм рт. ст. необхідна модифікація способу життя, а у пацієнтів групи дуже високого ризику за наявності серцево-судинних захворювань (ССЗ) слід розглянути медикаментозне лікування. У разі АГ 1-го ступеня (АТ – 140‑159/90‑99 мм рт. ст.) необхідно змінити спосіб життя та негайно розпочати фармакотерапію у хворих на ССЗ, а також у пацієнтів, що мають патологію нирок та ураження органів-мішеней.
Медикаментозну терапію для осіб груп низького та помірного ризику без ССЗ, захворювання нирок та уражень органів-мішеней доцільно призначити через 3‑6 місяців у разі невдалої спроби знизити АТ шляхом впровадження заходів щодо корекції способу життя. АГ 2-го (АТ – 160‑179/100‑109 мм рт. ст.) та 3-го ступеня (АТ ≥180/110 мм.рт.ст.) потребує зміни способу життя та проведення негайної фармакотерапії у всіх пацієнтів. Цільового рівня АТ має бути досягнуто протягом трьох місяців (Williams et al., 2018).
Серед факторів, що впливають на терапевтичну тактику, слід виділити:
- вік: відомо, що пацієнти похилого віку краще реагують на призначення діуретиків та антагоністів кальцію (АК);
- етнічна належність: представники негроїдної раси гірше відповідають на інгібітори ангіотензинперетворювального ферменту (іАПФ);
- стать;
- аналіз попередньої терапії;
- фармакогенетичні характеристики;
- вихідний рівень АТ;
- серцево-судинний (СС) ризик: фактори ризику, ураження органів-мішеней, ССЗ, ХХН, цукровий діабет (ЦД).
Своєю чергою до чинників, що впливають на СС-ризик у пацієнтів з АГ, відносять (Williams et al., 2018):
1. Демографічні характеристики та лабораторні параметри:
- стать (чоловіки > жінки);
- вік;
- куріння (на даний час або в минулому);
- загальний холестерин (ХС), ХС ліпопротеїнів низької щільності (ЛПНЩ);
- рівень сечової кислоти;
- ЦД;
- надлишкова вага або ожиріння;
- раннє ССЗ у родині (чоловіки віком <55 років, жінки <65 років);
- рання АГ у батьків чи родичів (вік <45 років);
- рання менопауза;
- психологічні або соціально-економічні фактори, гіподинамія;
- частота серцевих скорочень (ЧСС) >80 уд./хв у спокої.
2. Безсимптомне ураження органів-мішеней:
- жорсткість артерій;
- пульсовий тиск >60 мм рт. ст./хв;
- каротидно-феморальна швидкість пульсової хвилі >10 мс;
- ознаки гіпертрофії лівого шлуночка (ГЛШ) за даними електро- або ехокардіографії;
- мікроальбумінурія (30‑300 мг/24 год або співвідношення альбумін/креатинін у сечі >30‑200 мг/г);
- помірна ХХН: швидкість клубочкової фільтрації (ШКФ) становить 30‑59 мл/хв/1,73 м2 або тяжка ХХН (ШКФ <30 мл/хв/1,73 м2);
- кісточково-плечовий індекс <0,9;
- виразна ретинопатія, геморагії або ексудат, набряклість сосочків.
3. Встановлене ССЗ або патологія нирок:
- цереброваскулярні захворювання: ішемічний, геморагічний інсульт, транзиторна ішемічна атака;
- ішемічна хвороба серця (ІХС): інфаркт міокарда (ІМ), стенокардія, коронарна реваскуляризація;
- наявність атероматозних бляшок при візуалізаційних методах діагностики;
- СН, що включає хронічну СН (ХСН) зі збереженою фракцією викиду (ФВ);
- захворювання периферичних артерій;
- фібриляція передсердь.
Окрім того, Л.М. Яковлева додатково акцентувала увагу на важливості врахування ШКФ та наявності ХХН у процесі вибору препарату для контролю АТ. Під ХХН розуміють порушення структури або функції нирок, що персистує понад трьох місяців і впливає на стан здоров’я хворого, а також наявність ≥1 маркера. Це можуть бути альбумінурія (швидкість екскреції альбуміну з сечею ≥30 мг/24 год або співвідношення альбумін/креатинін у сечі ≥30 мг/г), зміни осаду сечі, електролітні та інші порушення внаслідок канальцевої дисфункції, гістологічні зміни, структурні порушення при візуалізаційних методах дослідження, трансплантація нирки в анамнезі, ШКФ >60 мл/хв/1,73 м2 (категорія С3а-С5) (National Kidney Foundation, 2002).
Лекторка рекомендує використовувати шкалу KDIGO для оцінки комбінованого ризику термінальної ниркової недостатності та СС-ускладнень у пацієнтів із ХХН залежно від рівня ШКФ та альбумінурії (табл. 1).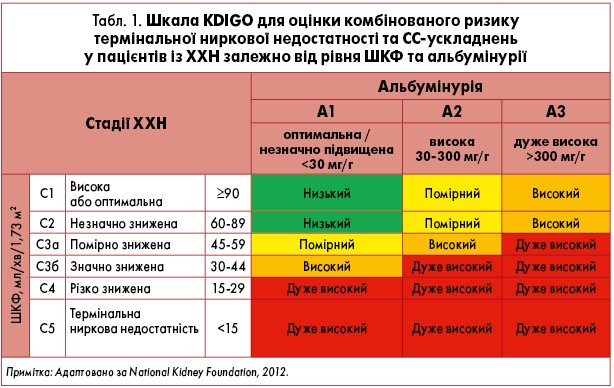
Оцінка ризику за шкалою KDIGO при АГ та наступний контроль рівня АТ, за словами Лариси Миколаївни, має вирішальне значення в патогенезі ураження нирок, оскільки АГ спричиняє перебіг закономірних процесів, серед яких:
- Підвищення систолічного АТ (САТ).
- Активація симпато-адреналової та ренін-ангіотензин-альдостеронової систем (РААС).
- Констрикція приносної артерії клубочка зі зменшенням ефективної перфузії нирок.
- Утворення ангіотензину ІІ, спазм виносної артерії клубочка.
- Внутрішньоклубочкова гіпертензія з наступною гіперфільтрацією та підвищенням проникності білка.
- Зменшення постачання клубочкових капілярів кров’ю – гломерулярна ішемія.
- Апоптоз ендотеліоцитів із розвитком нефроангіосклерозу.
За даними останніх досліджень, причини термінальної стадії ниркової недостатності включають: ЦД (38%), АГ (26%), гломерулонефрит (16%), інші причини (20%) (Centers for Disease Control and Prevention, 2019). Додатково підтверджено асоціацію зниження ШКФ, альбумінурію та зростання ризику розвитку СС-катастроф (Anavecar, 2004). Саме тому слід керуватися специфічними рекомендаціями щодо терапевтичної тактики та корекції рівня АТ у пацієнтів із ХХН, які представлені в таблиці 2.
Професорка Яковлева зазначила, що іАПФ та блокатори рецепторів ангіотензину ІІ (БРА) володіють унікальними властивостями у плані нефропротекції, оскільки їхня дія пов’язана з дилатацією не лише приносної, але й виносної артеріоли. Це значно знижує тиск у клубочку, попереджає альбумінурію та ураження нирок.
Як було вказано вище, важливим критерієм стосовно прогнозу захворювань є досягнення цільового рівня АТ, що наведено у таблиці 3 (ESC/ESH, 2018). Однак 2020 р. були опубліковані оновлені рекомендації KDIGO щодо контролю АТ у пацієнтів із ХХН, згідно з якими цільовий САТ становить <120 мм рт. ст., діастолічний АТ (ДАТ) – 80 мм рт. ст. Для реципієнтів ниркового трансплантату цільовий САТ є 130 мм рт. ст. Використання іАПФ або БРА пропонується в осіб із ХХН та високим АТ з/без ЦД, альбумінурією (≥3 мг/ммоль), нормальною або зниженою ШКФ (15‑90 мл/хв/1,73 м2). Дози препаратів мають бути середніми або високими. Для дорослих реципієнтів ниркового трансплантату з-поміж препаратів першої лінії рекомендовано віддавати перевагу АК або БРА.
Правила призначення іАПФ та БРА при ХХН: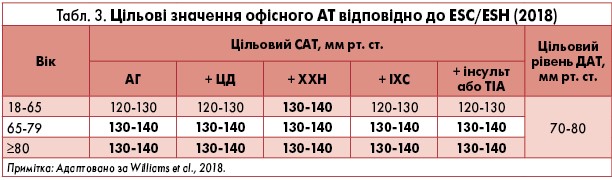
- терапію слід починати з мінімальної дози;
- при зниженні ШКФ до 60‑30 мл/хв доза більшості іАПФ має бути знижена на 50%, при ШКФ <30 мл/хв – на три чверті;
- при вихідному рівні К+ >5,5 ммоль/л призначати не рекомендовано;
- вміст креатиніну з розрахунком ШКФ та К+ визначають перед терапією та надалі один раз на 7‑10 днів (3‑5 при ШКФ <30 мл/хв) до досягнення дози, рекомендованої для даного препарату з огляду на ШКФ;
- при збільшенні креатиніну на >30% або К+ > 5,5 ммоль/л треба знизити дозу вдвічі;
- при зростанні креатиніну на >50% або К+ >6 ммоль/л – відмінити препарат;
- при стійкому (два тижні) підвищенні концентрації креатиніну >30% препарат, що інгібує РААС, варто відмінити, а пацієнта – обстежити на наявність реноваскулярної хвороби.
Проведені порівняння іАПФ та БРА не виявили достовірної різниці ефективності щодо зниження ризику СС-катастроф, ІМ, інсульту, термінальної стадії недостатності нирок у наведених груп препаратів. Однак прихильність до терапії була значно вища серед пацієнтів, що приймали БРА (Messerli et al., 2018).
За словами спікерки, це може бути пояснено наступними перевагами сартанів:
- одноразове приймання;
- менша кількість побічних ефектів (Mancia et al., 2011);
- відсутність феномена вислизання ефекту (при тривалому прийманні іАПФ можливий запуск іншого, не залежного від АПФ шляху синтезу ангіотензину ІІ);
- відсутність побічного ефекту у вигляді кашлю (антибрадикініновий механізм, що притаманний іАПФ);
- немає залежності від генотипу (в носіїв D-алелю I/D поліморфізму гена АПФ ефективність іАПФ нижча).
Л.М. Яковлева поділилася нюансами власного персоналізованого підходу до терапії АГ та представила наступні клінічні приклади.
Клінічні випадки
1. Пацієнт А: АТ – 160‑166/ 100‑106 мм рт. ст., альбумін сечі – 200‑220 мг/24 год, ШКФ = 53 мл/хв/1,73 м2 – помірно знижена, К+ – 5,0 ммоль/л, ХС ЛПНЩ – 3,5 ммоль/л, ГЛШ, відсутність комплаєнсу. Раціональним у даному випадку є призначення препаратів Діокор® (80 мг валсартану + гідрохлортіазиду 12,5 мг) або Діфорс® (80 мг валсартану + 5 мг амлодипіну) та Клівас® (розувастатин) по 20 мг. Корекція дози через 7‑10 днів на підставі лабораторних аналізів.
2. Пацієнт В: АТ = 160‑166/ 100‑106 мм рт. ст., альбумін сечі – 220‑300 мг/24 год, ШКФ = 30 мл/хв/1,73 м2 – значно знижена, К+ – 5,2 ммоль/л, ХС ЛПНЩ – 3,8 ммоль/л, ГЛШ, відсутність комплаєнсу. Оскільки має місце дуже високий ризик термінальної ниркової недостатності та СС-ускладнень за шкалою KDIGO, раціональним у даному випадку є призначення препарату Діфорс® (80 мг валсартану + 5 мг амлодипіну) та аторвастатину по 20 мг. Корекція дози через 7‑10 днів на підставі лабораторних аналізів.
Вибір валсартану зумовлений наявністю ґрунтовних доказів на його користь. Так, ефективність та безпеку препарату вивчено у 150 рандомізованих контрольованих випробуваннях із 45 точками оцінки клінічних наслідків та 100 тис. пролікованих пацієнтів у межах більш ніж 40 тис. досліджень із визначенням захворюваності та смертності: VALUE, Val-HeFT, VALIANT, JІКЕІ Heart, NAVIGATOR, MARVAL, ABCD‑2V, SMART, DROP тощо. Метааналіз семи обсерваційних досліджень з узагальненням результатів приймання різних доз валсартану в монотерапії або комбінації у 19 533 учасників показав, що препарат в умовах реальної клінічної практики знижував АТ і загальний СС-ризик протягом перших 90 днів терапії (Abrahan, 2011). На додачу, внаслідок порівняння валсартану та амлодипіну в дослідженні VALUE було достовірно встановлено протективну дію БРА, а саме більш значуще зниження частоти нових випадків ЦД у групі валсартану (13,1 проти 16,4%, р<0,0001) (Julius et al., 2004).
У випробуванні MARVAL виявили достовірне (р<0,001) зниження альбумінурії у 29,9% пацієнтів, що приймали валсартан протягом 24 тижнів. Для порівняння: у групі амлодипіну альбумінурія регресувала лише у 14,5% хворих (Viberti et al., 2002). У межах дослідження SMART включення до терапії валсартану сприяло регресу альбумінурії у 34% пацієнтів, а перейти у стійку ремісію змогли 23%; у групі амлодипіну – 16 та 11% відповідно (SMART Group, 2007).
Цікавими з точки зору практичної діяльності та актуальності проблеми цереброваскулярних захворювань виявилися клінічні випадки та тактика лікування, запропонована Ларисою Миколаївною.
Клінічні випадки
1. Пацієнт В: АТ = 150‑160/90 мм рт. ст., ШКФ = 55 мл/хв/1,73 м2 – помірно знижена, К+ – 5,0 ммоль/л, ХС ЛПНЩ – 3,6 ммоль/л, курить, регулярно приймає іАПФ. Найоптимальнішим є призначення іАПФ або БРА + АК чи тіазидного діуретика та препарату Клівас® (розувастатин) по 20 мг. Корекція дози через 7‑10 днів на підставі лабораторних аналізів.
2. Пацієнт Г: АТ = 150‑160/90 мм рт. ст., ШКФ = 55 мл/хв/1,73 м2 – помірно знижена, К+ – 5,0 ммоль/л, ХС ЛПНЩ – 3,6 ммоль/л, курить, регулярно приймає іАПФ, переніс ішемічний інсульт з ендартеректомією. Оскільки у хворого в анамнезі має місце гостре порушення мозкового кровообігу, в даному випадку рекомендовано призначити Діфорс® (80 мг валсартану + 5 мг амлодипіну) або Діокор® (80 мг валсартану + 12,5 мг гідрохлортіазиду), Агрель® (клопідогрель) у дозі 75 мг та Клівас® (розувастатин) по 20 мг. Корекція дози через 7‑10 днів на підставі лабораторних аналізів.
Вибір на користь валсартану в клінічному випадку порушення мозкового кровообігу продиктований наявною інформацією про плейотропні нейропротективні ефекти компонентів РААС, а саме блокування ангіотензинових рецепторів 1-го типу (АТ1-рецептори). Це приводить до активації росту відростків нейронів, підвищення життєвої здатності нейронів, покращення церебрального кровотоку, зменшення запальних процесів у головному мозку. Своєю чергою відсутність блокади АТ2- та MAS-рецепторів спричиняє потенціювання позитивного результату блокування АТ1-рецепторів, а також збільшення ендотеліальної NO-синтази, брадикініну (Saavedra et al., 2011).
Клінічні прояви даного механізму дії підтверджені нижче:
- у межах дослідження JІКЕІ Heart було показане зниження відносного ризику первинного та повторного інсульту на 40% у пацієнтів, що приймали валсартан (Mochizuki et al., 2007);
- БРА при зіставленні з іАПФ на 35‑40% краще знижує вірогідність розвитку випадків деменції та хвороби Альцгеймера за рахунок зменшення відкладення амілоїд-подібного пептиду в мозку (Masaki et al., 2009).
- порівняння валсартану та еналаприлу виявило виразніше покращення когнітивної функції у групі приймання БРА протягом 16 тижнів (Fogari et al., 2004).
Як було зазначено, терапія АГ при ХСН зі зниженням ФВ ЛШ потребує призначення β-блокаторів. Додаткову користь β-блокатори підтвердили за наявності предикторів раптової кардіальної смерті, пов’язаних із клінічними проявами ІХС, як-то ІМ, площа ішемії міокарда >10%, зниження ФВ ЛШ та ІІІ‑ІV функціональний клас серцевої недостатності за критеріями Нью-Йоркської асоціації серця (NYHA), синкопе в анамнезі, шлуночкові порушення ритму (ESC, 2015). Для демонстрації ролі β-блокаторів доповідачка представила клінічні випадки.
Клінічні випадки
1. Пацієнтка Д: АТ = 160/100 мм рт. ст., ШКФ = 45 мл/хв/1,73 м2 – помірно знижена, шість місяців тому перенесла ІМ зі стентуванням, ФВ ЛШ – 38%, кашель унаслідок приймання іАПФ, хронічне обструктивне захворювання легень. Оптимально у даному випадку призначити Діокор® (80 мг валсартану + 12,5 мг гідрохлортіазиду) або Діфорс® (80 мг валсартану + 5 мг амлодипіну), Конкор® (бісопролол) у дозі 2,5 мг, подвійну антитромбоцитарну терапію (100 мг ацетилсаліцилової кислоти + 180 мг тікагрелору) та Клівас® (розувастатин) по 20 мг. Корекція дози через 7‑10 днів на підставі лабораторних аналізів.
2. Пацієнтка Е: АТ = 160/100 мм рт. ст., ШКФ = 45 мл/хв/1,73 м2 – помірно знижена, шість місяців тому перенесла ІМ зі стентуванням, ФВ ЛШ – 38%, відчуває перебої в роботі серця, мономорфні шлуночкові екстрасистоли. Оскільки у хворої наявний високий ризик раптової смерті, доцільно зробити вибір на користь блокатора РААС + тіазидоподібного діуретика, препарату Конкор® (бісопролол) у дозі 5 мг, подвійної антитромбоцитарної терапії (100 мг ацетилсаліцилової кислоти + 180 мг тікагрелору) та препарату Клівас® (розувастатин) по 20 мг. Корекція дози через 7‑10 днів на підставі лабораторних аналізів.
Бісопролол є високоселективним блокатором β1-рецепторів, що визначає найменший спектр побічних ефектів у контексті дії на β2-рецептори. Достовірно відомо, що зниження симпатичної гіперактивації після ІМ сприяє зменшенню ЧСС принаймні на 10 уд./хв та, як наслідок, летальності від усіх причин, раптової смерті й повторного ІМ на 30%. Порівняння всіх відомих β-блокаторів у дослідженні CIBIS III дозволило підтвердити найбільшу ефективність саме бісопрололу щодо попереджання розвитку раптової серцевої смерті (Egan et al., 2006). Своєю чергою зіставлення дії бісопрололу та еналаприлу в межах дослідження CIBIS II виявило зниження ризику раптової смерті на 46% серед пацієнтів, що отримували бісопролол (Krum et al., 2011).
Таким чином, індивідуалізований підхід й оптимальний підбір тактики терапії, що ґрунтуються на даних доказової медицини та світових рекомендацій, не лише дозволяють поліпшити якість життя хворого, стабілізувати АТ, попередити ремоделювання серцевого м’яза, нирок й інших органів-мішеней, але й раптову коронарну смерть у пацієнтів із ХСН.
Підготувала Маргарита Марчук
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (70) 2020 р.


