22 січня, 2021
Вплив езетимібу в поєднанні зі статинами на поліпшення ендотеліальної функції після стентування коронарних артерій у пацієнтів з ІХС
Завдяки досягненням у лікуванні серцево-судинних захворювань (ССЗ), включно із розвитком фібринолізу та черезшкірних коронарних втручань (ЧКВ), рівень смертності серед осіб з ішемічною хворобою серця (ІХС) знизився. Це засвідчило важливість фармакотерапії у межах вторинної профілактики для таких пацієнтів. Статини являють собою стандартні препарати для гіполіпідемічної терапії, що також знижують частоту повторних коронарних ускладнень. Проте існує потреба у посиленні лікування статинами для зменшення вірогідності резидуальних коронарних подій. S. Takase et al. провели дослідження, щоб проаналізувати, чи покращує лікування езетимібом у поєднанні зі статинами функцію ендотелію судин-мішеней у хворих на ІХС, що перенесли ЧКВ. Отримані результати опубліковані у виданні Arteriosclerosis, Thrombosis, and Vascular Biology (2017; 37: 350‑358).
Аналіз результатів скандинавського випробування 4S щодо ефекту симвастатину виявив, що високі показники абсорбції холестерину (ХС) пов’язані з більш частими повторюваними коронарними подіями під час лікування статинами, навіть за еквівалентного рівня ХС ліпопротеїнів низької щільності (ЛПНЩ) (Miettinen et al., 1998). У проспективному дослідженні використання високоінтенсивної статинотерапії спричиняло потужніше інгібування синтезу та посилення поглинання ХС (Miettinen et al., 2003). Наведені дані свідчать про наявність потенційного слабкого місця у монотерапії статинами, а саме підвищення абсорбції ХС у кишечнику, що може нівелювати ефект зниження рівня ХС ЛПНЩ і збільшувати поглинання інших атерогенних ліпідів, як-от оксистерини (Brown, Jessup, 1993).
Є дані, що оксистерини, які потрапляли до організму з їжею, прискорювали дестабілізацію атеросклеротичних бляшок у мишей із гіперхолестеринемією (Sato et al., 2012). На цей процес можна вплинути шляхом застосування езетимібу, який сприяє зниженню рівня ХС ЛПНЩ, окислених ЛПНЩ та оксистерину в сироватці крові. Езетиміб – препарат, що блокує активність транспортера ХС Niemann-pick C1-Like 1, який переважно експресується в тонкому кишечнику, опосередковує абсорбцію харчового й біліарного ХС та ефективно знижує рівень ХС ЛПНЩ у сироватці крові при використанні окремо або в комбінації зі статинами (Ballantyne et al., 2003).
Ендотеліальна дисфункція коронарних артерій передує атерогенезу і відіграє важливу роль у прогресуванні атеросклерозу та ІХС (Egashira et al., 1993). Вивчення функції ендотелію коронарних судин є корисним для оцінки захисних ефектів серцево-судинної системи (Flammer et al., 2012). У клінічних дослідженнях було показано, що монотерапія езетимібом покращувала функцію ендотелію периферичних артерій, однак вплив препарату на таку коронарних судин невідомий (Nochioka et al., 2012).
У цьому контексті S. Takase et al. (2017) вирішили провести багатоцентрове рандомізоване контрольоване дослідження CuVIC, присвячене застосуванню езетимібу в поєднанні зі статинами з метою поліпшення функції ендотелію коронарних артерій порівняно з монотерапією статинами у пацієнтів після ЧКВ.
Матеріали та методи дослідження
Пацієнтів, яким успішно виконали ЧКВ (n=260), рандомізували для отримання монотерапії статинами (група S, n=131) або езетимібу в комбінації зі статинами (група E + S, n=129). Із комплексного аналізу було виключено двоє хворих, які не застосовували монотерапію статинами у групі S. Автори оцінювали дисфункцію, недостатність судин-мішеней протягом досліджуваного періоду та ендотеліальну дисфункцію коронарних артерій за допомогою внутрішньокоронарного тестування на ацетилхолін (АХ) при проведенні рутинної коронарної ангіографії через 6‑8 місяців після ЧКВ (Cutlip et al., 2007). На вихідному рівні учасники обох груп були зіставними за демографічними характеристиками, факторами ризику ураження коронарних артерій та фармакотерапією.
Стентовані коронарні артерії (права коронарна артерія, передня низхідна або обвідна гілки лівої коронарної артерії) були зареєстровані як судини-мішені у 42 (33%), 66 (51%) та 21 пацієнта (16%) у групі S та у 30 (23%), 79 (61%) та 20 (16%) – у групі E + S відповідно. Не було значних відмінностей між групами лікування щодо кількості стентів, діаметра та довжини стентів у судинах-мішенях.
Результати дослідження
Оцінка клінічних та лабораторних параметрів
За протоколом дослідження, мета статинотерапії полягала у досягненні еквівалентних цільових рівнів ХС ЛПНЩ (≤2,6 ммоль/л) згідно з рекомендаціями Японського товариства атеросклерозу (JAS) (Teramoto et al., 2013).
! У 2019 р. Європейське товариство кардіологів (ESC) та Європейське товариство з атеросклерозу (EAS) розробило оновлені рекомендації щодо менеджменту пацієнтів із дисліпідеміями. У даних настановах були задекларовані нові цільові рівні ХС ЛПНЩ. Так, цільовий рівень ХС ЛПНЩ для хворих групи дуже високого СС-ризику було знижено до <1,4 ммоль/л, високого СС-ризику – до <1,8 ммоль/л, помірного СС-ризику – до 2,6 ммоль/л. Для осіб низького СС-ризику цільовий рівень залишився без змін: <3,0 ммоль/л. Для пацієнтів з атеросклеротичними ССЗ, які перенесли дві СС-події протягом двох років на тлі статинотерапії, рекомендовано розглянути цільовий рівень ХС ЛПНЩ <1,0 ммоль/л. (Прим. ред.)
У межах дослідження статини у вищих дозах частіше використовували у групі S, ніж E + S. Показники ліпідного профілю й інші лабораторні параметри у хворих обох груп лікування на вихідному рівні та при подальшому спостереженні наведені у таблиці 1.
У двох групах спостерігалися значущі відмінності щодо змін вмісту загального ХС, ХС ЛПНЩ та аполіпопротеїну В. Рівні маркерів поглинання ХС кампестерину та ситостерину суттєво зростали у групі S, тоді як у групі E + S – знижувалися. Концентрація латостерину незначно збільшувалася у групі E + S, де застосовували помірні або нижчі дози статинів. Унаслідок окисної модифікації ЛПНЩ у сироватці крові малоновим диальдегідом (МДА-ЛПНЩ) утворювався окислений ХС ЛПНЩ, який знижувався при додатковому лікуванні езетимібом порівняно з монотерапією статинами. Дослідники зафіксували значне зниження рівня загального оксистерину, 5β-/6β-епоксихолестерину, 4β-/7β-/27-гідроксихолестерину в групі E + S, тоді як зміни у групі S були відсутні.
Середня тривалість спостереження від вихідного рівня до контрольної коронарографії становила 203 та 204 дні у групах S та E + S відповідно. До первинного аналізу результатів були включені 112 пацієнтів групи S та 109 – групи E + S. Кумулятивний коефіцієнт відсіву склав 14,3%, а статистична потужність аналізу підтримувалася на рівні >80%.
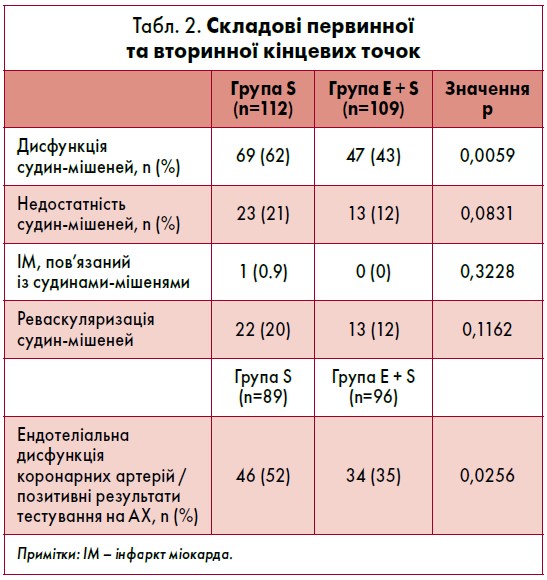 Клінічні наслідки щодо дисфункції судин-мішеней та ендотелію коронарних артерій
Клінічні наслідки щодо дисфункції судин-мішеней та ендотелію коронарних артерій
Аналіз первинних результатів та складових комбінованої кінцевої точки через 6‑8 місяців лікування показаний на рисунку та у таблиці 2. Частота дисфункції судин-мішеней під час спостереження у групі S становила 62%, у групі E + S – 43%, а їхня недостатність була у групі S – 21% та у групі E + S – 12%. Сукупна частота реваскуляризації судин-мішеней, спричиненої ішемією, склала 20 та 12% у групах S і E + S відповідно. При внутрішньокоронарному тестуванні на АХ серед пацієнтів без недостатності судин-мішеней частота ендотеліальної дисфункції коронарних артерій становила 52 і 35% у групах S і E + S відповідно.
Лікування езетимібом суттєво зменшувало вазоконстрикцію, викликану застосуванням додаткових доз АХ. Максимальне звуження судин, зумовлене використанням низьких, середніх або високих доз АХ у кожного учасника, становило 49±19% у групі S та 43±23% у групі E + S. Це свідчило про те, що гіполіпідемічна терапія езетимібом та статинами зменшувала ендотеліальну дисфункцію коронарних артерій.
Аналіз ризику дисфункції судин-мішеней та вмісту ХС ЛПНЩ у підгрупах після лікування
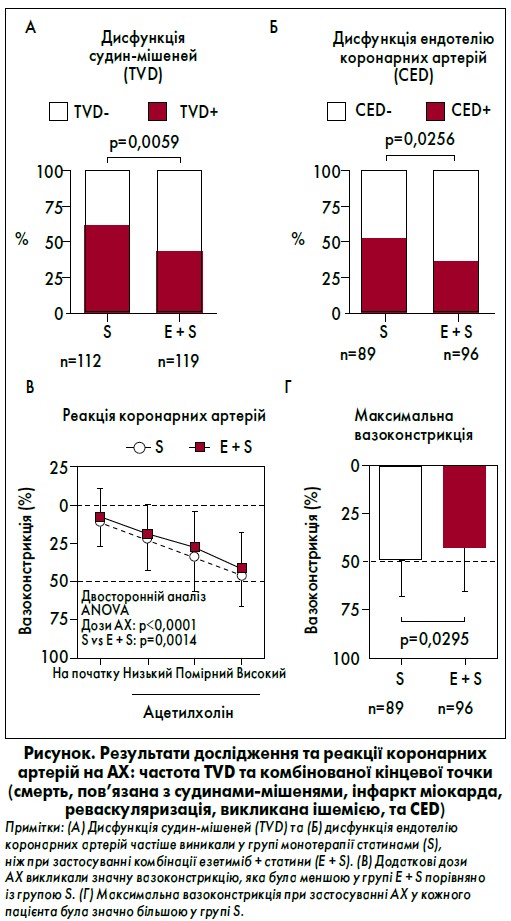 Аналіз ризику дисфункції судин-мішеней за базовими характеристиками хворих показав, що користь від додаткового застосування езетимібу була суттєвою у таких підгрупах: чоловіки та пацієнти віком ≥65 років, особи з метаболічним синдромом, артеріальною гіпертензією, дисліпідемією, металевим стентом, відсутністю цукрового діабету та рівнем С-реактивного білка <0,2 мг/дл.
Аналіз ризику дисфункції судин-мішеней за базовими характеристиками хворих показав, що користь від додаткового застосування езетимібу була суттєвою у таких підгрупах: чоловіки та пацієнти віком ≥65 років, особи з метаболічним синдромом, артеріальною гіпертензією, дисліпідемією, металевим стентом, відсутністю цукрового діабету та рівнем С-реактивного білка <0,2 мг/дл.
Для проведення спеціального аналізу після лікування дослідники згенерували підгрупи шляхом зіставлення рівнів ХС ЛПНЩ у співвідношенні 1:1. З-поміж 62 суб’єктів у кожній групі з еквівалентним рівнем ХС ЛПНЩ (1,9±0,008 ммоль/л) частота дисфункції судин-мішеней при подальшому спостереженні була значно нижчою у групі E + S (37% порівняно із 58% у групі S). Частота ендотеліальної дисфункції коронарних артерій серед пацієнтів без недостатності судин-мішеней становила 48 та 28% у групах S і E + S відповідно.
Концентрація загального оксистерину, яка не змінилася у відповідь на монотерапію статинами, суттєво зменшилася при застосуванні езетимібу та статинів: у групі S (-8%) – з 1772±1125 до 1626±114 нг/мл, а в групі E + S (-22%) – з 1854±1359 до 1453±114 нг/мл.
Слід зауважити, що у підгрупах з еквівалентним рівнем ХС ЛПНЩ більші концентрації оксистерину та ХС ЛПНЩ після лікування були пов’язані з вищою частотою ендотеліальної дисфункції коронарних артерій. Це підтверджує той факт, що значний рівень оксистерину та ХС ЛПНЩ може спричинити розвиток ендотеліальної дисфункції. Езетиміб у комбінації зі статинами суттєво знижував вміст оксистерину, ХС ЛПНЩ і МДА-ЛПНЩ та, відповідно, поліпшував ендотеліальну функцію.
Обговорення
Первинні висновки дослідження CuVIC полягали в тому, що гіполіпідемічне лікування езетимібом у комбінації зі статинами порівняно з монотерапією статинами чинило наступні ефекти:
- Зниження рівня ХС ЛПНЩ, навіть при додаванні езетимібу до статинів у низьких дозах.
- Зменшення дисфункції судин-мішеней, зокрема частоти летальних випадків внаслідок ураження судин-мішеней, нефатального інфаркту міокарда, повторної реваскуляризації, зумовленої ішемією, та ендотеліальної дисфункції коронарних артерій серед хворих на ІХС після ЧКВ.
- Зниження рівня атерогенних ліпідів, зокрема оксистеринів та окислених ЛПНЩ.
Зниження дисфункції судин-мішеней свідчить про сприятливий ефект езетимібу в поєднанні зі статинами, що може сприяти зменшенню майбутніх серцево-судинних подій. Цей висновок підтверджується результатами дослідження IMPROVE-IT, де було показано, що додавання езетимібу до терапії симвастатином знижувало рівень ХС ЛПНЩ і частоту серцево-судинних ускладнень, включно з інфарктом міокарда, порівняно з монотерапією симвастатином у пацієнтів із гострим коронарним синдромом (Cannon et al., 2015).
Метааналіз досліджень продемонстрував, що зниження ризику серцево-судинних подій пропорційне зменшенню вмісту ХС ЛПНЩ (Cannon et al., 2015; Cholesterol Treatment Trialists’ Collaborators, 2012). Це підтверджує концепцію «чим нижче, тим краще» та основний принцип ліпідознижувальної терапії.
На додаток, у дослідженні PRECISE-IVUS спостерігалися додаткові ефекти езетимібу щодо зменшення об’єму коронарних атеросклеротичних бляшок при одночасному використанні зі статинами, особливо у хворих на гострий коронарний синдром (Tsujita et al., 2015).
Висновки
Результати дослідження CuVIC показали, що застосування езетимібу разом зі статинами порівняно з монотерапією статинами поліпшувало функціональні прогнози хворих на ІХС шляхом зменшення дисфункції ендотелію у стентованих коронарних артеріях. Окрім того, що гіполіпідемічне лікування здатне, принаймні частково, знижувати ендотеліальну дисфункцію завдяки зменшенню вмісту окислених ЛПНЩ, інгібітор абсорбції ХС езетиміб чинить сприятливий вплив щодо підтримання функції ендотелію коронарних артерій за рахунок зниження рівня оксистерину. Це своєю чергою дозволяє знизити ризик розвитку вірогідних серцево-судинних подій у цій когорті пацієнтів у майбутньому.
Підготувала Олена Коробка
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (73) 2020 р.