23 травня, 2021
Ефективне та безпечне знеболення при ревматоїдному артриті: основні мішені терапії
За матеріалами науково-практичної конференції «Коморбідність у ревматології: особливості діагностики та лікування» (17-19 березня 2021 року)
Ревматоїдний артрит (РА) – хронічне системне захворювання сполучної тканини автоімунної природи, за якого уражаються переважно дрібні суглоби. РА призводить до стійкої деформації суглобів і порушення їх функції. Без належного лікування протягом перших 5‑6 років після встановлення діагнозу майже половина хворих стають інвалідами. Недуга призводить до погіршення загального стану та якості життя пацієнтів, а також зниження їхньої працездатності. Одними з найважливіших питань ведення осіб із РА є оцінка інтенсивності больового синдрому та методи аналгезії. Про механізми виникнення хронічного больового синдрому (ХБС), а також про методи досягнення безпечного та ефективного знеболення розповідає завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця, д. мед. н., професор Олег Борисович Яременко.
Професор зазначив, що на важливість оцінки больового синдрому вказує те, що до всіх (чи майже всіх) індексів активності РА включено визначення кількості болючих суглобів або оцінку самим пацієнтом інтенсивності болю. Чому необхідно обов’язково враховувати суб’єктивні відчуття хворого щодо виразності больового синдрому?
За даними дослідження Richardson et al. (2007), 65‑70% пацієнтів із ХБС для зменшення болю хоча б на 2 та 5 балів (за 10-бальною шкалою) були готові «прийняти» можливий підвищений ризик розвитку шлунково-кишкової кровотечі, інфаркту міокарда чи інсульту. Також у хворих, які отримують ефективну базисну терапію, не повинна бути або ж має бути мінімальною потреба у застосуванні симптоматичних засобів, зокрема нестероїдних протизапальних препаратів (НПЗП).
Проте, згідно з даними реєстрів Великої Британії, було проведене 3-річне спостереження у трьох когортах хворих на РА (n=9493): осіб із ранніми формами РА; пацієнтів з активними формами РА, яких почали лікувати інгібітором фактора некрозу пухлин α (ФНП-α) після невдалого застосування небіологічних хворобомодифікувальних антиревматичних препаратів (ХМАРП); пацієнтів з активними формами РА, які не розпочали терапію біологічними ХМАРП (McWilliams et al., 2019). Стійкий біль у суглобах спостерігався у 60‑80% хворих, незважаючи на ефективну базисну терапію і досягнуту ремісію. Зокрема у 65% учасників, у котрих виявляли нормальний рівень маркерів запалення, зберігався стійкий суглобовий біль.
На думку дослідників, однією з основних причин таких результатів, імовірно, є формування так званого феномену центральної сенситизації (ЦС) за попередні місяці й роки розвитку захворювання, що значно зменшує ефективність лікування больового синдрому традиційними засобами.
Феномен центральної сенситизації болю
ЦС – підвищення рівня збудливості нейронів центральної нервової системи (ЦНС), насамперед у задніх рогах спинного мозку, у відповідь на інтенсивну стимуляцію периферичних больових рецепторів, при цьому «нормальне» за інтенсивністю стимулювання починає викликати аномальну відповідь. Вважається, що ЦС є основним чинником хронічного болю при остеоартриті (ОА), РА, хронічному неспецифічному болю у спині та низці інших захворювань. Також ЦС, разом із недостатністю інгібіторних антиноцицептивних впливів, розглядають як один із найважливіших механізмів формування хронічного болю загалом.
Важливу роль у формуванні ЦС відіграють прозапальні цитокіни та зменшення фізичної активності. Можливо, деякі базисні препарати також впливають на розвиток цього феномена.
Розглядають дві фази виникнення ЦС, як-то (Davydov, 2016):
- Трансляція – рання фаза негайної відповіді, що є короткою та транзиторною;
- Транскрипція – пізня фаза з повільним початком, що є тривалішою. На цьому етапі на спінальному рівні синтезуються ендогенні опіоїди та циклооксигеназа 2 (ЦОГ‑2), що принципово важливо з позицій розгляду механізмів ЦОГ‑2 – інгібування у профілактиці хронічного болю.
Оцінка та лікування ХБС
За словами спікера, існують клінічні показники, які дозволяють оцінити наявність і виразність ЦС. Зокрема, це розширена гіперчутливість – поява підвищеної чутливості до болю у віддаленій області від ураженого суглоба (наприклад біль у лікті при пошкодженні колінного суглоба). Також існує поняття посиленої часової сумації. Так, часова сумація – це підвищення інтенсивності болю при послідовних натисканнях однакової сили в одну точку через рівні проміжки часу. У пацієнтів із хронічним суглобовим болем часова сумація посилюватиметься (Arendt-Nielsen et al., 2016).
Другою основною складовою у формуванні ХБС є так званий фактор росту нервів (ФРН, або NGF). Рівень ФРН підвищується у тканинах при больових станах, зокрема запальному болю, що призводить як до периферичної сенситизації ноцицепторів (больових рецепорів), так і до центральної сенситизації нейронів заднього рогу спинного мозку у відповідь на больові стимули.
Рівень ФРН підвищується у відповідь на пошкодження тканин, запалення, а також при хронічних больових станах. У короткостроковій перспективі ФРН збільшує експресію рецепторів тирозинкінази (TrkA) та каналів на мембрані, що швидко посилює гіперчутливість. У довготривалій перспективі відбуваються зворотний транспорт комплексу NGF-TrkA та збільшення продукції субстанції Р, кокальцигеніну (CGRP), мозкового нейротрофічного фактора (BDNF), відкриття натрієвих і кальцієвих каналів. З одного боку, вони ускладнюють відповідь на деякі фармакотерапевтичні засоби, а з іншого – є одним із механізмів хронізації больового синдрому (Bеlanger et al., 2018).
На сьогодні доведено, що ФРН виявляється у значній кількості в хондроцитах суглобового хряща як при РА, так і при ОА (Walsh et al., 2010). Як зазначив доповідач, ФРН призводить не лише до патологічної іннервації раніше аневрального хряща, але й до зміни геному нейрона та розвитку його тривалого гіперзбудження. Таким чином, при незначних «нормальних» подразненнях пацієнт відчуватиме сильніший біль (Davydov, 2016).
Експресія ФРН у зразках синовії осіб із РА вища порівняно з пацієнтами зі спондилоартритом. Це вказує на те, що продукція ФРН відбувається місцево, тобто в синовії хворих на РА (Barthel et al., 2009).
Наявні дані щодо механізмів формування ХБС дозволили виділити дві основні мішені, на які потрібно впливати для ефективного зменшення або ліквідації ХБС, який зберігається у пацієнтів із РА навіть на тлі адекватної протизапальної терапії:
- феномен центральної сенситизації;
- фактор росту нервів.
Тому при виборі НПЗП для лікування торпідного больового синдрому бажано робити вибір на користь лікарських засобів, які впливають на обидва ці механізми. Одним із небагатьох таких препаратів є еторикоксиб (Аркоксія®).
Дослідження ефективності еторикоксибу
Еторикоксиб – високоселективний інгібітор ЦОГ‑2, що у клінічно значущих концентраціях здатен проникати у ЦНС. Вже протягом перших двох годин еторикоксиб (Аркоксія®) досягає ефективної концентрації у спинно-мозковій рідині (70 нг/мл), протягом однієї години – у плазмі (3000 нг/мл). Ефективна концентрація препарату зберігається не менш ніж 24 год (Renner et al., 2010).
У клінічному дослідженні L. Arendt-Nielsen et al. (2016) було доведено, що еторикоксиб (Аркоксія®) чинить подвійну анальгетичну дію за рахунок пригнічення центрального та периферичного механізму виникнення болю. Препарат показав нижчий порівняно з іншими НПЗП рівень зв’язку з білками плазми, що зумовлює його здатність проникати до ЦНС і досягати значущих концентрацій у спинно-мозковій рідині (Agrawal et al., 2003; Renner et al., 2010; Kvien et al., 2015; Arendt-Nielsen et al., 2016).
Крім того необхідно зазначити, що еторикоксиб (Аркоксія®) також чинить знеболювальний ефект за межами суглобів, впливаючи на пластичність відповіді нервової системи як на периферичному рівні, так і у ЦНС (Kvien et al., 2015).
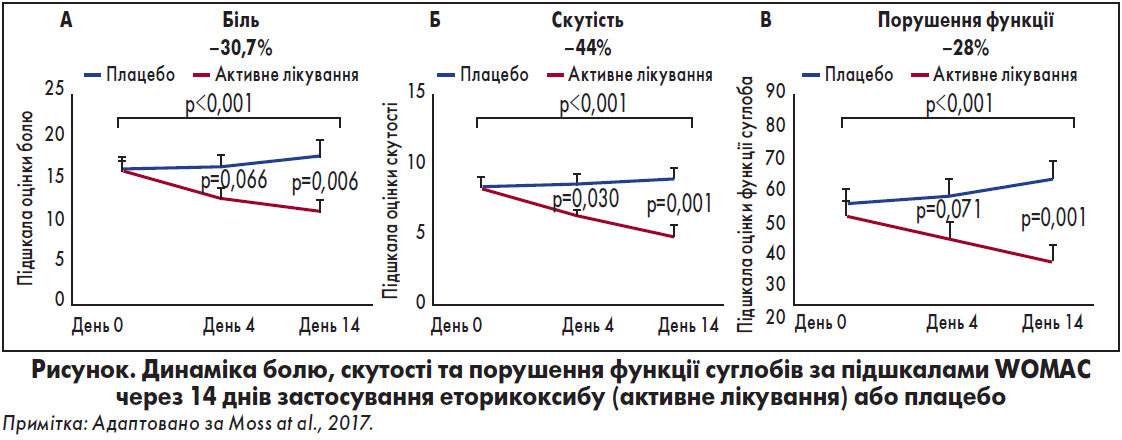
У рандомізованому плацебо-контрольованому випробуванні було показано можливість еторикоксибу (Аркоксія®) додатково впливати на центральний механізм суглобового болю (нейропатичний компонент) (Moss et al., 2017). У дослідженні взяли участь 80 хворих на ОА колінного суглоба, що супроводжувався больовим синдромом: ≥3/10 балів за візуально-аналоговою шкалою (ВАШ). Учасники були випадковим чином розподілені на групи активної терапії (еторикоксибом у дозі 60 мг протягом 14 днів) та плацебо.
Як наслідок, упродовж 14 днів застосування препарату еторикоксиб (Аркоксія®) значно зменшилися інтенсивність та якісне сприйняття болю, скутість, покращилася функція суглобів, а також зменшилася не лише локальна, але й розширена патологічна чутливість (рисунок). У пацієнтів групи плацебо клінічні показники погіршилися.
Так, дуже цікавою виявилася динаміка показників, асоційованих із центральним (нейропатичним) компонентом болю. Зокрема, покращення за даними PainDETECT через 14 днів лікування еторикоксибом становило майже 24%, що відображало зменшення нейропатичного компонента болю. При цьому з 17 пацієнтів групи еторикоксибу (n=40), що на початку дослідження були віднесені до підгруп «невизначена нейропатичність» або «наявна нейропатичність» за PainDETECT, дев’ятеро (що становило 53% від загального розміру підгруп та 22,5% від загальної кількості хворих групи еторикоксибу) перемістилися до групи «відсутня нейропатичність» вже через 14 днів застосування еторикоксибу. Порівняно з цим у групі плацебо (n=40) відбулася зворотна динаміка – 12,5% пацієнтів підгруп «відсутня нейропатичність» та «невизначена нейропатичність» перемістилися до підгрупи «наявна нейропатичність».
Аналогічною була динаміка за шкалою оцінки якості болю PQAS. Так, зменшення нейропатичного компонента болю становило до 37% (-36,9% за PQAS Paroxysmal subscale та -29,4% за PQAS Surface subscale), а ноцицептивного (пов’язаного із запаленням) компонента болю (за PQAS Deep subscale) – 45,5%.
Щодо другого компонента формування ХБС, а саме впливу на ФРН, то в експериментальному дослідженні Z.H. Wen et al. (2019) було отримано досить показові результати, де еторикоксиб зменшував прояви експериментального ОА та ноцицепцію у щурів. Кількісний аналіз показав, що еторикоксиб (Аркоксія®) значно зменшував кількість ФРН-позитивних клітин у колінному хрящі в групах з експериментальним ОА, при цьому збільшувалася кількість TGF-β1-позитивних хондроцитів колінного хряща, що свідчить про хондропротекторний потенціал еторикоксибу. Причому достовірне підвищення експресії TGF-β1 (трансформуючого фактора росту) спостерігалося також у групі контролю (без експериментального ОА), яка отримувала еторикоксиб. Це може бути додатковим свідченням специфічного впливу еторикоксибу на експресію цього хондропротекторного цитокіну.
Наскільки безпечний еторикоксиб?
О.Б. Яременко навів дані метааналізу X. Feng et al. (2018), за даними якого еторикоксиб (Аркоксія®) не підвищував гастроінтестинальні ризики порівняно із плацебо та асоціювався з нижчим ризиком із боку верхніх відділів ШКТ при ОА та РА, ніж диклофенак і напроксен.
Щодо впливу еторикоксибу на розвиток серцево-судинних (СС) подій, за результатами метааналізу 176 досліджень за участю більш як 146,5 тис. пацієнтів, СС-ризики були однаковими для диклофенаку, ібупрофену, напроксену, целекоксибу та еторикоксибу. Тобто підвищеної імовірності СС-ускладнень при застосуванні еторикоксибу порівняно із НПЗП, що часто використовують при ОА та РА, не спостерігалося (van Walsem et al., 2015).
Що стосується взаємодії НПЗП та аспірину, в подвійному рандомізованому плацебо-контрольованому випробуванні було продемонстровано, що еторикоксиб (Аркоксія®) у дозі 120 мг/добу не впливав на агрегацію тромбоцитів при одночасному використанні з аспірином (Dallob et al., 2003).
Висновки
Підсумовуючи вищезазначене, можна дійти висновків, що еторикоксиб (Аркоксія®) можна вважати оптимальним препаратом вибору серед НПЗП для знеболення у пацієнтів із РА, оскільки:
- продемонстрував клінічно доведену ефективність у зниженні виразності ЦС та зменшенні нейропатичного характеру болю;
- показав здатність знижувати рівень ФРН у суглобовому хрящі (експериментальний ОА);
- має хондропротекторний потенціал;
- показав високий рівень безпеки щодо побічних ефектів із боку ШКТ та зіставний з іншими НПЗП рівень СС-ризику;
- не перешкоджає антитромбоцитарній дії аспірину.
Підготувала Мар’яна Гнатів