28 липня, 2021
Місце дулоксетину в консервативній терапії стресового нетримання сечі у жінок*
 У статті представлено історію впровадження дулоксетину в медичну практику, механізми його дії та особливості застосування при консервативному лікуванні стресового нетримання сечі у жінок.
У статті представлено історію впровадження дулоксетину в медичну практику, механізми його дії та особливості застосування при консервативному лікуванні стресового нетримання сечі у жінок.
Ключові слова: стресове нетримання сечі у жінок, дулоксетин, зміцнення м’язів тазового дна, слінгові операції.
Під нетриманням сечі, або інконтиненцією, у жінок розуміють мимовільне, неконтрольоване вольовими зусиллями й не пов’язане з бажанням пацієнтки виділення сечі. За даними літератури [8‑11, 15, 19, 25, 29, 39, 40], нетримання сечі відзначається у кожної третьої‑четвертої жінки після 40 років. Нетримання сечі не загрожує життю, але створює для жінки соціальні, гігієнічні, сексуальні, медичні та психологічні проблеми і значно знижує якість життя. У 2010 році Міжнародна урогінекологічна асоціація (ІUGА) та Міжнародне товариство з вивчення утримання сечі (ICS) опублікували оновлену термінологію та класифікацію дисфукцій нижніх сечових шляхів та пролапсів тазових органів у жінок [24]. Згідно із визначенням ІUGА та ICS, нетримання сечі – скарга на будь-яку мимовільну втрату (у попередніх звітах ICS – мимовільне виділення) сечі. Таким чином, нетримання сечі є симптоматичним діагнозом. З усіх видів нетримання сечі на стресову інконтиненцію припадає близько 50‑80% випадків [8‑11]. Стресове нетримання сечі (СНС) – скарга на мимовільну втрату сечі при фізичному напруженні, чханні чи кашлі. Для уникнення плутанини із психологічним стресом (у зв’язку з особливостями перекладу) ІUGА та ICS рекомендують також вживати термін «нетримання сечі при фізичній активності». Під стресом розуміють підвищення внутрішньочеревного тиску (при фізичному напруженні, чханні, кашлі, швидкій ходьбі, бігу тощо), який призводить до підвищення внутрішньоміхурового тиску (оскільки сечовий міхур знаходиться у черевній порожнині). Останній починає перевищувати внутрішньоуретральний тиск, що проявляється втратою (виділенням) сечі у жінки. Прикро, що в доповідях на конференціях та у статтях вітчизняні професори урологи й гінекологи використовують визначення ICS щодо нетримання сечі 1976 року, згідно з яким нетримання сечі – це мимовільне виділення сечі, що виявлено візуально, і є соціальною та гігієнічною проблемою. У шостому звіті ICS (1988) дало визначення СНС як симптому, ознаці та стану. Ці визначення були незначно змінені та представлені ІUGА та ICS у 2010 році (таблиця).
Із термінологією, класифікацією, епідеміологією, діагностикою та лікуванням різних видів нетримання сечі у жінок у відповідності до останніх рекомендацій ІUGА, ICS, Міжнародної консультації з нетримання сечі (ICІ) та Європейської асоціації урологів (EAU) можна ознайомитись у нашому навчальному посібнику із нетримання сечі у жінок [8]. Остання ICI відбулась у Токіо 2016 року, а у 2017 році вийшло нове двотомне 6-те видання ICІ «Incontinence» під егідою ICS [25]. ICI представила алгоритм початкового та спеціалізованого лікування основних видів нетримання сечі – стресового, імперативного та змішаного. На початковому етапі терапії СНС із медикаментозних препаратів рекомендований лише дулоксетин (ступінь рекомендації В) (схема).
Схема. Початкове обстеження та лікування жінок із нетриманням сечі [8, 25]
 Дулоксетин був синтезований D. Robertson, D. Wong та J. Krushinski у 1986 році в лабораторії компанії Eli Lilly (США), а патент на препарат компанія отримала 1990 року (рис. 1). У 2001 році компанія Eli Lilly подала заявку на новий препарат, але лише 2004 року Управління з контролю за якістю харчових продуктів і медикаментів (FDA, США) зареєструвало дулоксетин (Cymbalta) для лікування депресивних та тривожних станів, діабетичної периферичної нейропатії та нейропатичного болю, фіброміалгій та міофасціальних больових синдромів. Препарат Cymbalta був зареєстрований і в Європі Європейським агентством із лікарських засобів (EMA) того ж року. Ефект дулоксетину зумовлений вибірковим інгібуванням зворотного нейронального захоплення серотоніну та норадреналіну у синапсах центральної нервової системи, що спричиняє накопичення нейромедіаторів у синаптичній щілині та подовження їх дії на постсинаптичні рецепторні ділянки (рис. 2). Продажі Cymbalta у 2012 році становили 5 млрд дол., у 2013‑2014 роках серед всіх призначень антидепресантів дулоксетин найчастіше призначали хворим із депресією. У 2017 році дулоксетин знаходився на 46-му місці серед продажів препаратів у США – на нього було виписано 6 млн рецептів.
Дулоксетин був синтезований D. Robertson, D. Wong та J. Krushinski у 1986 році в лабораторії компанії Eli Lilly (США), а патент на препарат компанія отримала 1990 року (рис. 1). У 2001 році компанія Eli Lilly подала заявку на новий препарат, але лише 2004 року Управління з контролю за якістю харчових продуктів і медикаментів (FDA, США) зареєструвало дулоксетин (Cymbalta) для лікування депресивних та тривожних станів, діабетичної периферичної нейропатії та нейропатичного болю, фіброміалгій та міофасціальних больових синдромів. Препарат Cymbalta був зареєстрований і в Європі Європейським агентством із лікарських засобів (EMA) того ж року. Ефект дулоксетину зумовлений вибірковим інгібуванням зворотного нейронального захоплення серотоніну та норадреналіну у синапсах центральної нервової системи, що спричиняє накопичення нейромедіаторів у синаптичній щілині та подовження їх дії на постсинаптичні рецепторні ділянки (рис. 2). Продажі Cymbalta у 2012 році становили 5 млрд дол., у 2013‑2014 роках серед всіх призначень антидепресантів дулоксетин найчастіше призначали хворим із депресією. У 2017 році дулоксетин знаходився на 46-му місці серед продажів препаратів у США – на нього було виписано 6 млн рецептів.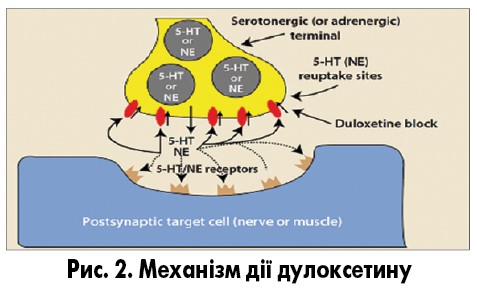
У дослідженнях на тваринах було виявлено, що препарат підвищує тонус посмугованого сфінктера уретри у фазу наповнення сечового міхура. Проведені багатоцентрові рандомізовані подвійні сліпі плацебо-контрольовані дослідження дулоксетину в лікуванні жінок із СНС у Північній та Південній Америці, Європі, Африці та Австралії (за участю понад 5700 жінок) показали, що у половини учасниць зафіксовано зниження частоти епізодів нетримання сечі на 50‑58%. При цьому 56‑74% жінок при застосуванні дулоксетину відмітили покращення якості життя; 6‑10% – почали повністю утримувати сечу через 12 тиж від початку лікування [7, 19, 25‑28, 31, 39, 40, 45]. У 2004 році дулоксетин був зареєстрований EMA у багатьох європейських країнах для лікування СНС у жінок від помірного до тяжкого ступеня, у т.ч. й у деяких пострадянських (Латвія, Литва) під назвою Yentreve (Eli Lilly). FDA не зареєструвало у США препарат для лікування СНС у жінок через високий ризик спроби суїциду. У 2013 році Національний інститут здоров’я та вдосконалення медичної допомоги Великобританії (NICE) не рекомендував використовувати дулоксетин як препарат першої лінії консервативної терапії СНС (через побічні ефекти), а лише у випадках, коли жінки хочуть уникнути хірургічного втручання або ж на період підготовки до операції.
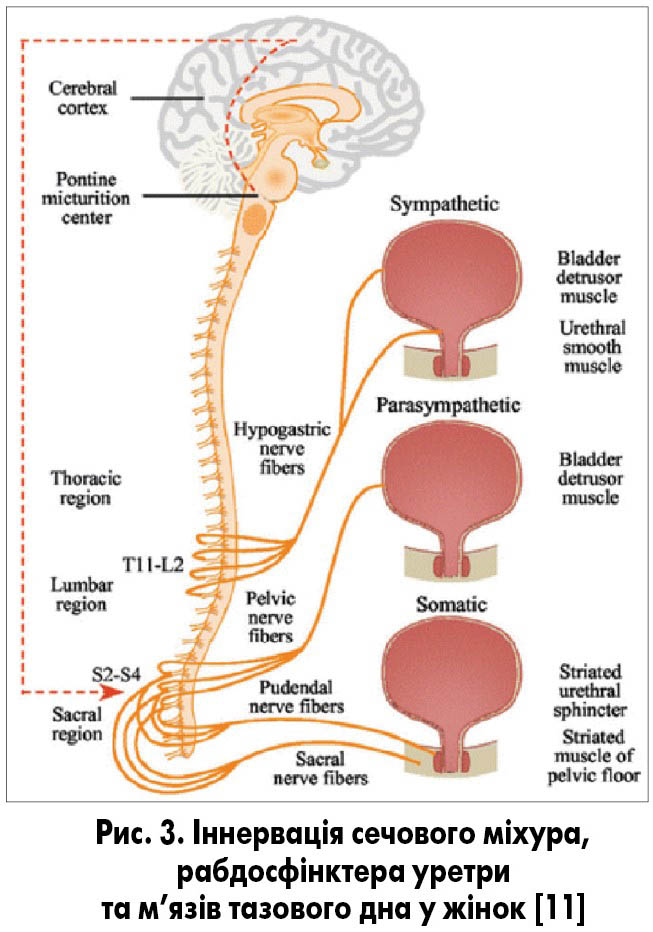 Дулоксетин – збалансований інгібітор зворотного захоплення серотоніну та норадреналіну у синаптичній щілині, що сприяє посиленню скорочень зовнішнього посмугованого сфінктера уретри (рабдосфінктера) та утриманню сечі при підвищенні внутрішньочеревного тиску. Механізм дії препарату наступний. Наповнення та виділення сечі із сечового міхура контролюється центральною та периферичною нервовими системами. Парасимпатичні нервові волокна тазових нервів проводять сигнали для скорочення детрузора та виділення сечі із сечового міхура, натомість як симпатичні гіпогастральні та соматичні соромітні нервові волокна проводять сигнали для розслаблення детрузора, посилення тонусу рабдосфінктера та накопичення сечі у сечовому міхурі (рис. 3). В останні роки встановлено роль нейротрансмітерів у центральному контролі нижніх сечових шляхів. В ядрі Онуфа, розташованому у вентральних рогах крижового відділу спинного мозку, кінцеві гілки нервових трактів із вищих центрів центральної нервової системи знаходяться в синапсах із соромітними мотонейронами. Глутамат є ключовим нейротрансмітером нисхідних нейрогенних шляхів у фазі наповнення сечового міхура. Його ефекти на активність гіпогастрального та соромітного нервів модулюються нейротрансмітерами – серотоніном та/або норадреналіном. Останні сприяють ефектам глутамату в ядрі Онуфа через соромітні моторні волокна зі звільнення ацетилхоліну, який діє на нікотинові рецептори в нейроефекторних з’єднаннях рабдосфінктера, що веде до скорочення (підвищеного тонусу) цього м’яза. У фазі сечовипускання серотонін та норадреналін швидко інактивуються шляхом їх зворотного захоплення термінальними нервовими закінченнями в нейромоторних синапсах ядра Онуфа. При цьому сигнали глутамату інактивуються, що спричиняє розслаблення зовнішнього сфінктера уретри. Дулоксетин блокує нейрональний механізм зворотного захоплення серотоніну та норадреналіну в синаптичній щілині. У результаті цього продовжується накопичення серотоніну та норадреналіну в синапсі та посилення активності постсинаптичного мотонейрона до зовнішнього сфінктера уретри у фазу наповнення сечового міхура, але не під час сечовипускання (рис. 4). Сучасними дослідженнями [5‑9, 11, 15, 39, 40] встановлено, що сфінктерний апарат уретри у жінок складається з рабдосфінктера, розташованого у середній частині уретри, та двох м’язів (уретровагінального сфінктера та компресора уретри), які походять із м’язів тазового дна (рис. 5, 6). Рабдосфінктер уретри у жінок отримує іннервацію від статевого (соромітного) нерва, а уретровагінальний сфінктер та компресор уретри – від інших сакральних нервів (рис. 3). Дія дулоксетину спрямована саме на рабдосфінктер уретри, а вправи для зміцнення м’язів тазового дна (вправи за Кегелем) – на м’язи тазового дна та сфінктерний апарат уретри.
Дулоксетин – збалансований інгібітор зворотного захоплення серотоніну та норадреналіну у синаптичній щілині, що сприяє посиленню скорочень зовнішнього посмугованого сфінктера уретри (рабдосфінктера) та утриманню сечі при підвищенні внутрішньочеревного тиску. Механізм дії препарату наступний. Наповнення та виділення сечі із сечового міхура контролюється центральною та периферичною нервовими системами. Парасимпатичні нервові волокна тазових нервів проводять сигнали для скорочення детрузора та виділення сечі із сечового міхура, натомість як симпатичні гіпогастральні та соматичні соромітні нервові волокна проводять сигнали для розслаблення детрузора, посилення тонусу рабдосфінктера та накопичення сечі у сечовому міхурі (рис. 3). В останні роки встановлено роль нейротрансмітерів у центральному контролі нижніх сечових шляхів. В ядрі Онуфа, розташованому у вентральних рогах крижового відділу спинного мозку, кінцеві гілки нервових трактів із вищих центрів центральної нервової системи знаходяться в синапсах із соромітними мотонейронами. Глутамат є ключовим нейротрансмітером нисхідних нейрогенних шляхів у фазі наповнення сечового міхура. Його ефекти на активність гіпогастрального та соромітного нервів модулюються нейротрансмітерами – серотоніном та/або норадреналіном. Останні сприяють ефектам глутамату в ядрі Онуфа через соромітні моторні волокна зі звільнення ацетилхоліну, який діє на нікотинові рецептори в нейроефекторних з’єднаннях рабдосфінктера, що веде до скорочення (підвищеного тонусу) цього м’яза. У фазі сечовипускання серотонін та норадреналін швидко інактивуються шляхом їх зворотного захоплення термінальними нервовими закінченнями в нейромоторних синапсах ядра Онуфа. При цьому сигнали глутамату інактивуються, що спричиняє розслаблення зовнішнього сфінктера уретри. Дулоксетин блокує нейрональний механізм зворотного захоплення серотоніну та норадреналіну в синаптичній щілині. У результаті цього продовжується накопичення серотоніну та норадреналіну в синапсі та посилення активності постсинаптичного мотонейрона до зовнішнього сфінктера уретри у фазу наповнення сечового міхура, але не під час сечовипускання (рис. 4). Сучасними дослідженнями [5‑9, 11, 15, 39, 40] встановлено, що сфінктерний апарат уретри у жінок складається з рабдосфінктера, розташованого у середній частині уретри, та двох м’язів (уретровагінального сфінктера та компресора уретри), які походять із м’язів тазового дна (рис. 5, 6). Рабдосфінктер уретри у жінок отримує іннервацію від статевого (соромітного) нерва, а уретровагінальний сфінктер та компресор уретри – від інших сакральних нервів (рис. 3). Дія дулоксетину спрямована саме на рабдосфінктер уретри, а вправи для зміцнення м’язів тазового дна (вправи за Кегелем) – на м’язи тазового дна та сфінктерний апарат уретри.
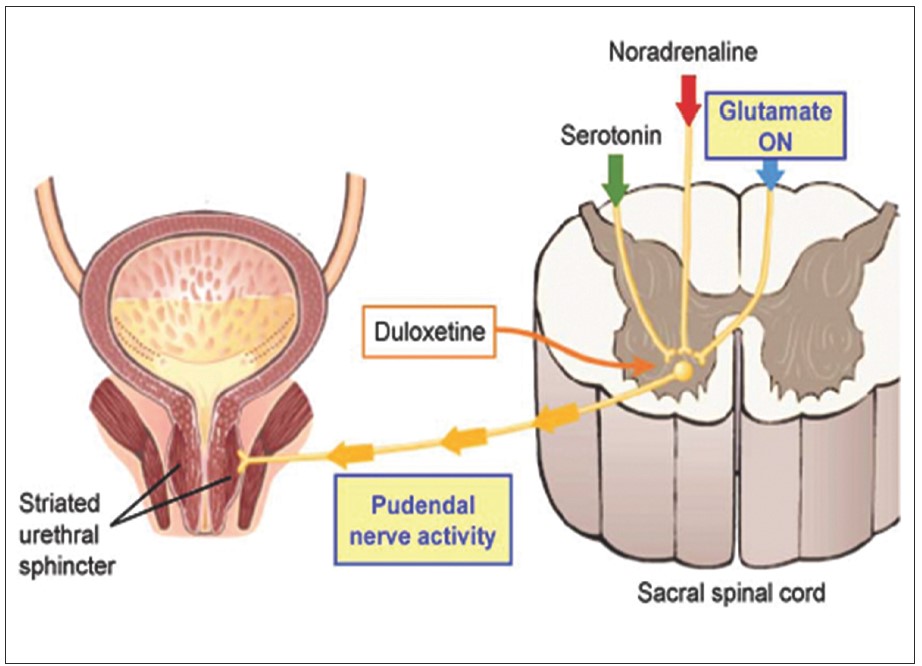 Рис. 4. Механізм дії дулоксетину на посмугований сфінктер уретри (рабдосфінктер) у жінок [36]
Рис. 4. Механізм дії дулоксетину на посмугований сфінктер уретри (рабдосфінктер) у жінок [36]
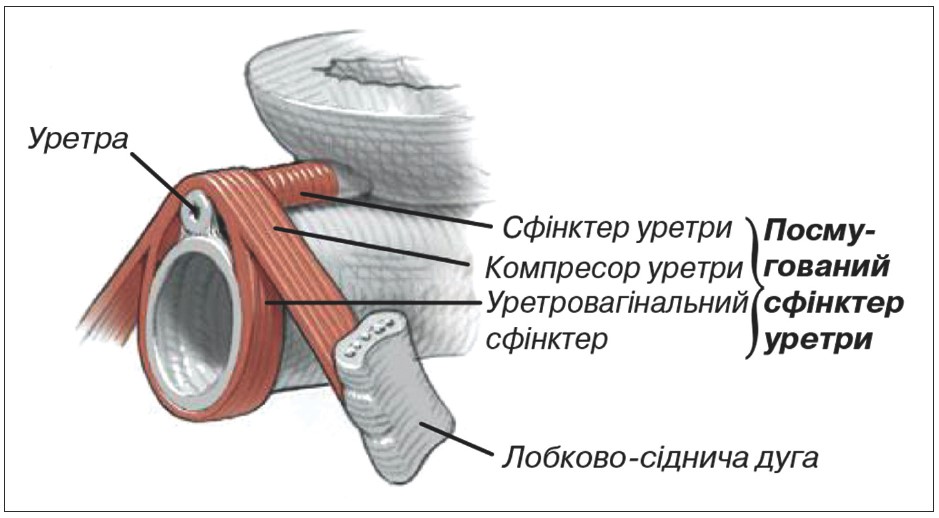 Рис. 5. Будова посмугованого сфінктера уретри у жінок [8]
Рис. 5. Будова посмугованого сфінктера уретри у жінок [8]
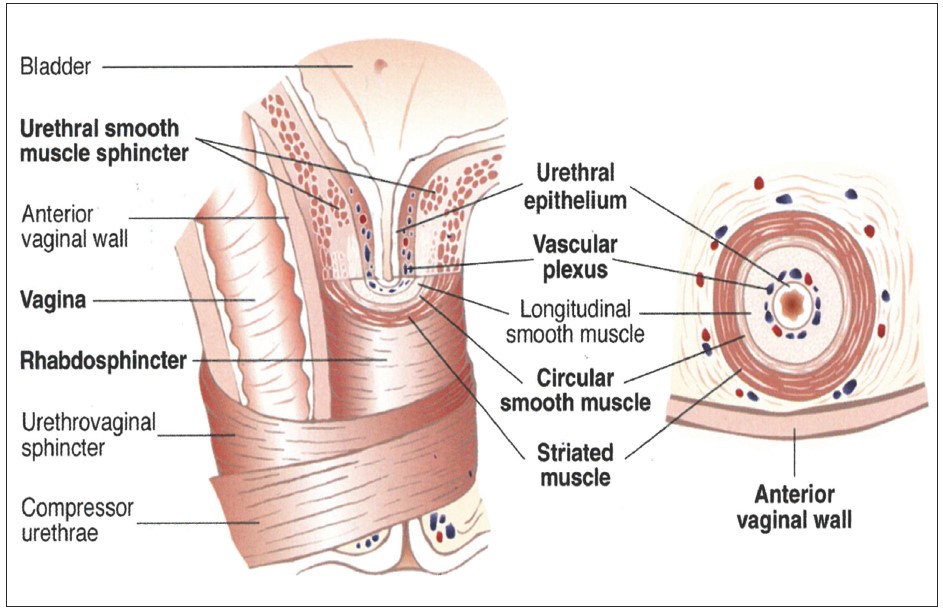 Рис. 6. Будова уретри та посмугованого сфінктера у жінок [11]
Рис. 6. Будова уретри та посмугованого сфінктера у жінок [11]
P. A. Norton et al. (2002) [37] провели дослідження дулоксетину у 553 пацієнток із СНС віком від 18 до 65 років: 138 жінок приймали плацебо, 138 – дулоксетин 20 мг/добу, 137 – дулоксетин 40 мг/добу, 140 жінок – дулоксетин 80 мг/добу протягом 12 тиж. Автори оцінювали результати лікування за щоденником сечовипускань, анкетами PGI‑I (Patient Global Impression of Improvement) та I-QоL (Incontinence Quality of Life). Дослідники виявили, що у половини жінок, які приймали дулоксетин у дозі 80 мг/добу, знизилася частота епізодів нетримання сечі на >64% порівняно із плацебо (р<0,001). При цьому 67% пацієнток відмітили покращення якості життя більш ніж на 50% порівняно із плацебо (р<0,01). Побічні ефекти мали місце у 5% жінок, які приймали плацебо; у 9% – дулоксетин у дозі 20 мг/добу, у 12% – 40 мг/добу й у 15% осіб, які отримували дулоксетин у дозі 80 мг/добу. Нудота була найбільш частим побічним симптомом.
R. R. Dmochowski et al. (2003) [18] оцінювали ефекти дулоксетину у 683 жінок із СНС із Північної Америки віком від 22 до 84 років: 339 жінок приймали плацебо, 344 – дулоксетин 40 мг двічі на добу протягом 12 тиж. Автори оцінювали результати лікування за щоденником сечовипускань із врахуванням показника частоти епізодів нетримання сечі (IEF) та анкетою I-QоL. Було відзначено зменшення IEF при застосуванні дулоксетину порівняно із плацебо (50% проти 27%; р<0,001) та значне покращення якості життя (11,0 проти 6,8; р<0,001). Побічні ефекти мали місце у 4% жінок, які приймали плацебо, у 24% – дулоксетин (р< 0,001). Нудота була найбільш частим побічним симптомом, через який 6,4% жінок відмовились від лікування.
R. J. Millard et al. (2004) [34] здійснили дослідження дулоксетину у 458 жінок із СНС віком від 27 до 79 років із Аргентини, Австрії, Бразилії, Фінляндії, Польщі, Південної Африки та Іспанії: із них 227 осіб приймали дулоксетин 40 мг двічі на добу, 231 – плацебо впродовж 12 тиж. Автори відзначили зменшення IEF при застосуванні дулоксетину порівняно із плацебо (54% проти 40%; р=0,05) та покращення якості життя за анкетою I-QоL (10,3 проти 6,4; р<0,001). Побічні ефекти мали місце у 1,7% жінок, які приймали плацебо, у 17,2% – що приймали дулоксетин (р<0,001). Нудота була найбільш частим побічним симптомом, через який 3,1% жінок відмовились від лікування дулоксетином.
P. van Kerrebroeck et al. (2004) [42] провели дослідження дулоксетину у 46 медичних центрах Європи та Канади із залученням 494 жінок (стресове та змішане нетримання сечі із переважанням стресового компонента) віком 24‑83 роки, у яких показник IEF становив ≥7, кількість сечовипускань вдень і вночі була нормальною, ємність сечового міхура >400 мл, позитивні кашльовий та прокладковий тести. Медіана IEF при застосуванні дулоксетину зменшилась на 50% проти 29% при прийомі плацебо (р=0,002). Якість життя за анкетою I-QоL була також достовірно кращою через 4, 8 та 12 тиж від початку лікування дулоксетином. Відмова від лікування дулоксетином через побічні ефекти була відмічена у 22% хворих, які приймали дулоксетин, проти 5% осіб групи плацебо. Нудота була найбільш частим побічним симптомом, через який 5,3% жінок відмовились від терапії.
G.M. Ghoniem et al. (2005) [22] досліджували ефективність дулоксетину у поєднанні із вправами для зміцнення м’язів тазового дна (preoperative pelvic floor muscle training, PFMT) у 17 центрах Нідерландів, Великобританії та США із залученням 201 жінки віком від 18 до 75 років із понад двома епізодами нетримання сечі на день. Із них 52 особи приймали дулоксетин 80 мг/добу та виконували PFMT із фахівцем за спеціальною програмою, 50 – виконували лише PFMT, 52 – приймали лише дулоксетин 80 мг/добу, 47 жінок не отримували жодну зі схем терапії. Автори показали достовірне покращення результатів лікування окремо дулоксетином та PFMT по відношенню до хворих, яким не проводили лікування; при поєднанні дулоксетину із PFMT результати були кращими, ніж при лікуванні окремо дулоксетином та PFMT.
P. Mariappan et al. (2007) [30] представили огляд статей із лікування дулоксетином жінок, які страждали на СНС. Автори включили 9 досліджень за участю 3063 жінок, у яких дулоксетин порівнювали із плацебо, тривалість лікування становила 3‑36 тиж. Згідно з отриманими результатами, на фоні лікування зменшення IEF відмічено у близько 50% жінок; якість життя за анкетою I-QоL була достовірно кращою в осіб, які приймали дулоксетин (р<0,00001). Однак у кожної 8-ї жінки, яка приймала дулоксетин, було зафіксовано побічнні ефекти (у більшості випадків нудота), які змушували їх припинити лікування (17% проти 4% у плацебо).
D. Weinstein et al. (2006) [41] провели дослідження дулоксетину із залученням 2960 пацієнток різної расової приналежності: 2321 – європеоїдної раси, 271 та 368 – афроамериканського та латиноамериканського походження відповідно. Ефективність і добра переносимість препарату відмічені у представниць усіх рас.
Тривалому лікуванню дулоксетином (40 мг двічі на добу) була присвячена робота R. C. Bump et al. (2008) [14]. Автори виділили когорту А (n=1424), у якій пацієнтки отримували дулоксетин до 30 міс, та когорту В (n=2758) із тривалістю прийому до 72 тиж. У когорті А через рік терапії лише 42,5% жінок продовжили її, в обох когортах відзначено достовірне покращення показників IEF та PGI‑I.
Цікавим було питання, наскільки ефективно дулоксетин впливає на сфінктерний апарат уретри у жінок похилого віку. L. Viktrup та I. Yalcin (2007) [44], а також J.H.S. van Leeuwen et al. (2008) [43] дослідили ефективність дулоксетину у пацієнток похилого віку (після 65 років) із СНС і встановили його ефективність по відношенню до плацебо, хоча цей ефект був меншим, ніж у молодших жінок.
Ефективність дулоксетину була продемонстрована при лікуванні жінок із гіперактивним сечовим міхуром [26, 28, 46] та чоловіків із СНС після радикальної простатектомії та трансуретральної резекції простати [17, 20].
Ми також маємо досвід застосування препарату Yentreve (дулоксетин) виробництва Eli Lilly та Boehringer Ingelheim у комплексному лікуванні жінок із СНС (дослідження проводили у 2005‑2006 рр.) [1‑4]. Жінки (добровольці) знайомились з інструкцією до препарату та давали письмову згоду на його застосування у відповідності до міжнародних принципів Гельсінської декларації. Згідно з інструкцією для застосування препарату, його не призначали жінкам віком до 18 років, за наявності захворювань нирок та печінки, а також психічних патологій. Через побічні ефекти при прийомі 40 мг препарату двічі на добу (за даними літератури, у 10‑30% жінок) ми застосовували препарат у дозі 20 мг двічі на добу для зниження частоти можливих побічних ефектів та їх уникнення. З метою зміцнення м’язів тазового дна та зовнішнього поперечно-смугастого сфінктера уретри призначали вправи за Кегелем. Хворі зі змішаною та імперативною інконтиненцією (кількість сечовипускань >8 на день та 2 на ніч), а також із пролапсом тазових органів виключались із дослідження. Для виключення гіперактивності детрузора виконували цистометрію наповнення за допомогою уродинамічної системи Gynecare MoniTorr (Johnson and Johnson, США). Для оцінки ефективності комплексного лікування жінок із СНС при застосуванні дулоксетину використовували опитувальник ICIQ-SF до та після терапії із визначенням у балах індексу ICIQ, а також одногодинний прокладковий тест. До першої групи ввійшли 10 хворих віком від 35 до 68 років (середній вік – 56,5±3,86 року), які знаходились на амбулаторному лікуванні дулоксетином (20 мг двічі на добу) впродовж 2 тиж у поєднанні із вправами для зміцнення м’язів тазового дна. Другу групу склали 12 хворих віком від 34 до 59 років (середній вік – 51,6±2,68 року), які знаходились на стаціонарному лікуванні в урологічному відділенні Вінницької обласної клінічної лікарні з травня 2005 р. по серпень 2006 року й отримували впродовж 2 тиж дулоксетин 20 мг двічі на добу у поєднанні із вправами для зміцнення м’язів тазового дна та ендоуретральною електростимуляцією шийки сечового міхура апаратом «Інтратон». Одужанням вважали випадки повного утримання сечі жінками після лікування, які були підтверджені одногодинним прокладковим тестом. У хворих першої групи не було відмічено жодного випадку одужання, але покращення стану (якості життя) за опитувальником ICIQ-SF було статистично достовірним, за одногодинним прокладковим тестом – ні. Серед хворих другої групи 6 (50%) пацієнток виписались із відділення з повним утриманням сечі, що було підтверджено одногодинним прокладковим тестом. Ще у 6 хворих відмічалося значне покращення утримання сечі (ефект перевищував 50%). Результати лікування у хворих другої групи були статистично достовірними як за опитувальником ICIQ-SF, так і за одногодинним прокладковим тестом. Було зроблено висновок, що використання дулоксетину у поєднані з електростимуляцією шийки сечового міхура та вправами для зміцнення м’язів тазового дна покращує результати лікування у жінок із СНС. Отже, за відсутності протипоказань до електростимуляції зазначену комплексну терапію потрібно застосовувати з метою покращення якості життя пацієнток, уникнення хірургічного втручання та відбору хворих для операції.
Із реєстрацією дулоксетину в Європі у 2004 році для лікування жінок із СНС на нього покладалися великі сподівання стосовно зміни хірургічного способу лікування на користь консервативної терапії. Це було зумовлено високою частотою (до 10‑20%) рецидивів після залобкових слінгових операцій (операція TVT), а також інтра- та післяопераційних ускладнень (ушкодження сечового міхура, уретри, гематоми залобкового простору, ерозія піхви та ін.). На жаль, консервативна терапія СНС дулоксетином не стала провідним методом лікування цієї патології через відсутність одужання жінок та значний відсоток побічних ефектів. Крім того, у 2001 році у практику урологів та гінекологів був впроваджений трансобтураторний слінг (операція TVT-O), який дозволив значно знизити частоту інтра- та післяопераційних ускладнень. Середньоуретральні синтетичні слінги або субуретральні петльові пластики (операції TVT та TVT-O) стали стандартним ефективним методом лікування жінок із СНС. Середньоуретральні слінги дозволяють усунути це захворювання в більшості жінок (90‑95%) із безрецидивним перебігом захворювання впродовж 10‑17 років у 75‑85% прооперованих [8, 15, 19, 25, 29, 39, 40].
Кожна жінка прагне раз і назавжди позбавитися нетримання сечі, а тому зазвичай вибирає хірургічне малоінвазивне втручання (операцію TVT-O або TVT). Слід враховувати і витрати на тривале лікування дулоксетином, яке не гарантує одужання. Із жінками «молодого» для цього захворювання віку (30‑40 років) потрібно проводити бесіди стосовно операції із встановлення стороннього тіла (субуретральної поліпропіленової стрічки), яка потребуватиме кесаревого розтину при майбутніх пологах та супроводжується ризиком ерозії піхви в результаті статевих актів (в 1‑5% осіб). Згідно з рекомендаціями ICІ (2017), саме молодим жінкам із СНС доцільно спробувати консервативну терапію із застосуванням дулоксетину та вправ для зміцнення м’язів тазового дна при початковому зверненні до спеціаліста (див. схему).
Експерти EAU (2020) [19] підсумували місце дулоксетину в консервативному лікуванні СНС у жінок:
- застосування цього препарату в дозі 40 мг двічі на день покращує стан жінок із СНС;
- у перші тижні лікування дулоксетин викликає значні побічні ефекти з боку шлунково-кишкового тракту та центральної нервової системи, які призводять до відміни препарату (рівень доказовості 1а);
- слід пропонувати дулоксетин пацієнткам із СНС, коли хірургічне втручання не показане;
- через високий ризик побічних ефектів дулоксетин необхідно призначати та відміняти шляхом титрування дози (ступінь рекомендацій сильний).
На основі даних літератури та власного досвіду ми вважаємо доцільним використовувати дулоксетин у жінок із СНС у наступних випадках:
- якщо жінка відмовляється від операції або ж має протипоказання до хірургічного втручання;
- пацієнткам, які чекають на операцію й мають тяжкий ступінь СНС – для покращення стану на період очікування;
- жінкам, які хочуть народжувати природним шляхом, оскільки слінгова операція потребуватиме кесаревого розтину;
- для початкового лікування жінок із СНС, які не отримували до цього будь-якої терапії (бажано поєднати із вправами для зміцнення м’язів тазового дна);
- якщо жінка бажає лише покращити якість свого життя;
- якщо у пацієнтки є протипоказання до встановлення субуретральної поліпропіленової стрічки (декомпенсований інсулінозалежний цукровий діабет, імуносупресія та ін.).
Література
- Горовий В. І., Головенко В. П., Жук С. І. та ін. Шляхи підвищення ефективності лікування жінок із стресовим нетриманням сечі // Урологія. – 2006. – № 2. – С. 40‑49.
- Горовой В. И., Жук С. И., Головенко В. П., Кулаковская О. В. Использование препарата Yentreve (дулоксетин) в комплексном лечении женщин со стрессовым недержанием мочи // Здоровье женщины. – 2006. – № 4(28). – С. 234‑235.
- Горовий В. І., Головенко В. П., Жук С. І. та ін. Застосування препарату Yentreve (дулоксетин) у комплексному лікуванні жінок із стресовим нетриманням сечі // Тези доповідей 5-го Українсько-польського симпозіуму урологів. – Львів, 2007. – С. 66‑67.
- Горовий В. І., Жук С. І., Головенко В. П. та ін. Перший досвід застосування препарату Yentreve (дулоксетин) у комплексному лікуванні жінок із стресовим нетриманням сечі // Вісник Вінницького національного медичного університету. – 2007. – № 11(2/1) – C. 675‑677.
- Горовий В. І., Яцина О. І. Анатомія стресового нетримання сечі у жінок // Здоров’я України. – 2019. – № 2‑3 (16‑17). – С. 5‑14.
- Клінічна анатомія сечостатевих органів / За ред. Горового В. І., Шапринського В. О., Мазорчука Б. Ф. – Вінниця: Твори, 2016. – 640 с.
- Мазо Е. Б., Иремашвили В. В. Дулоксетин – новое в фармакотерапии недержания мочи у женщин // Урология. – 2004. – № 6. – С. 57‑5.
- Нетримання сечі у жінок: навч. посібник / За ред. Горового В.І., Яцини О.І. – Вінниця: ТОВ «ТВОРИ», 2020. – 472 с.
- Практична урогінекологія: курс лекцій / За ред. Горового В. І. – Вінниця: Вінницька обласна друкарня, 2015. – 728 с.
- Хиць А. Стресове нетримання сечі: сучасна фармакологічна терапія // Український медичний часопис. – 2020. – № 4 (138). – С. 1‑4.
- Abrams P., Artibani W. Understanding stress urinary incontinence. – Lier, Belgium: Ismar Healthcare, 2004. – 96 p.
- Alan C., Eren A. E., Ersay A. et al. Efficacy of duloxetine in early management of urinary continence after radical prostatectomy // Current Urology. – 2014. – Vol. 8. – P. 43‑48.
- Basu M., Duckett J. R.A. Update on duloxetine for the management of stress urinary incontinence // Clinical Interventions in Aging. – 2009. – Vol. 4. – P. 25‑30.
- Bump R. C., Voss S., Beardsworth A. et al. Long-term efficacy of duloxetine in women with stress urinary incontinence // BJU Int. – 2008. – Vol. 102. – P. 214‑218.
- Campbell-Walsh Urology / Wein A. J. et al. – 11th ed. – Philadelphia: Elsevier, 2016. – 4904 p.
- Cardozo L., Lange R., Voss S. et al. Short- and long-term efficacy and safety of duloxetine in women with predominant stress urinary incontinence // Curr. Med. Res. Opin. – 2010. – Vol. 26. – P. 253‑261.
- Chapple C. R. Duloxetine for male stress incontinence // European Urology. – 2004. – Vol. 49. – P. 958‑960.
- Dmochowski R. R., Miklos J. R., Norton P. A. et al. Duloxetine versus placebo for the treatment of North American women with stress urinary incontinence // J. Urol. – 2003. – Vol. 170. – P. 1259‑1263.
- EAU Guidelines on urine incontinence / Burkhard F. C. et al. – EAU, 2020. – 99 p.
- Fink K. G., Huber J., Wurnschhimmel E., Smeller N. T. The use of Duloxetine in the treatment of male stress urinary incontinence // Wien Med. Wochenschr. – 2008. – Vol. 158. – P. 116‑118.
- Freeman R. M. Initial management urinary incontinence: pelvic floor muscle training and duloxetine // BJOG, 2006. – Vol. 113. (suppl. 1). – P. 10‑16.
- Ghoniem G. M., Vanleeuwen J. S., Elser D. M. et al. A randomized, controlled trial of duloxetine alone, pelvic floor muscle training alone, combined treatment and no active treatment in women with stress urinary incontinence // J. Urol. – 2005. – Vol. 173. – P. 1647‑1653.
- Hagovska M., Svihra J. Evaluation of duloxetine and innovative pelvic floor muscle training in women with stress urinary incontinence (DULOXING) // Medicine. – 2020. – Vol. 99. – P. 1‑6.
- Haylen B. T., Ridder D., Freeman R. M. et al. An International Urogynecological Association (IUGA) / International Continence Society (ICS) join report on the terminology for female pelvic floor dysfunction // Neurourology and Urodynamics. – 2010. – Vol. 29. – P. 4‑20.
- Incontinence / Albrams P. et al. – 6th ed. – ICS – ICUD, 2017. – 2336 p.
- Juneau A. D., Gomelsky A. Pharmaceutical options for stress urinary incontinence // Current Bladder Dysfunction Reports. – 2019. – Vol. 14. – P. 357‑364.
- Lin A. T-L., Sun M-J., Tai A-L. et al. Duloxetine versus placebo for the treatment of women with stress predominant urinary incontinence in Taiwan: a double-blind, randomized, placebo-controlled trial // BMC Urology – 2008. – Vol. 8. – P. 2‑9.
- Li J., Yang L., Pu C. et al. The role of duloxetine in stress urinary incontinence: a systematic review and meta-analysis // Int. Urol. Nephrol. – 2013. – Vol. 45. – P. 679‑686.
- Lukacz E. S., Santiago-Lastra Y., Albo M. E., Brubaker L. Urinary incontinence in women. A review // JAMA. – 2017. – Vol. 318. – P. 1592‑1604.
- Mariappan P., Alhasso A., Ballantyne Z. et al. Duloxetine, a serotonin and noradrenaline reuptake inhibitor (SNRI) for treatment of stress urinary incontinence: a systematic review // Eur. Urol. – 2007. – Vol. 51. – P. 67‑74.
- Mariappan P., Alhasso A. A., Grant A., N’Dоw J.M.D. Serotonin and noradrenaline reuptake inhibitors (SNRI) for stress urinary incontinence in adults // Cochrane Library, Cohrane Database of Systematic Reviews. – 2010. – 3 p.
- Maund E., Guski L. S., Gotzsche P. C. Considering benefits and harms of duloxetine for treatment of stress urinary incontinence: a meta-analysis of clinical study reports // CMAJ. – 2017. – Vol. 189. – P. 194‑203.
- Mihaylova B., Pitman R., Tincello et al. Cost-effectiveness of duloxetine: the stress urinary incontinence treatment (SUIT) study // International Society for Pharmacoeconimics and Outcomes Research (ISPOR). – 2010. – Vol. 13. – P. 565‑572.
- Millard R. J., Moore K., Rencken R. et al. Duloxetine vs placebo in the treatment of stress urinary incontinence: a four-continent randomized clinical trials // BJU Int. – 2004. – Vol. 93. – P. 311‑318.
- Neff B., Guie A., Guralnick M. L. et al. Duloxetine for treatment of post-prostatectomy stress urinary incontinence // Can. Urol. Asoc. – 2013. – Vol. 7. – P. 260‑262.
- Nitti V. W. Duloxetine: a new pharmacologic therapy for stress urinary incontinence // Rev. Urol. – 2004. – Vol. 6 (suppl. 3). – P. 48‑55.
- Norton P. A., Zinner N. R., Yalcin I. et al. Duloxetine versus placebo in the treatment of stress urinary incontinence // American Journal of Obstetrics and Gynecology. – 2002. – Vol. 187. – P. 40‑48.
- Sweeney D. D., Chancellor M. B. Treatment of stress urinary incontinence with duloxetine hydrochloride // Reviews in Urology. – 2005. – Vol. 7. – P. 81‑86.
- Textbook of female urology and urogynaecology / Cardozo L., Staskin D. – 3rd ed. – Informa Healthcare. – 2010. – 1384 p.
- Urogynecology and reconstructive pelvic surgery / Walters M. D., Karram M. M. – 4th ed. – Philadelphia: Mosby Elsevier, 2015. – 686 р.
- Weinstein D., Cohen J. S., Liu S. et al. Duloxetine in the treatment of women with stress urinary incontinence: results from DESIRE (Duloxetine Efficacy and Safety for Incontinence in Racial and Ethnic population // Current Medical Research and Opinion. – 2006. – Vol. 22. – P. 2121‑2129.
- Van Kerrebroeck P., Abrams P., Lange R. et al. Duloxetine versus placebo in the treatment of European and Canadian women with stress urinary incontinence // BJOG. – 2004. – Vol. 111 – P. 249‑257.
- Van Leeuwen J. H.S., Lange R. R., Jonasson A. F. et al. Efficacy and safety of duloxetine in elderly women with stress urinary incontinence // Maturitas. – 2008. – Vol. 60. – P. 138‑147.
- Viktrup L., Yalcin I. Duloxetine treatment of stress urinary incontinence in women: effects of demographics, obesity, chronic lung disease, hypoestrogenism, diabetes mellitus, and depression on efficacy // European Journal of Obstetrics & Gynecology and Reproductive Biology. – 2007. – Vol. 133. – P. 105‑113.
- Zinner N. R. Stress urinary incontinence in women: effiency and safety of duloxetine // European Urology Supplements. – 2005. – Vol. 4, issue 1. – P. 29‑37.
- Steers W. D., Herschorn S., Kreder K. J. et al. Duloxetine compared with placebo for treatment women with symptoms of overactive bladder // BJU Int. – 2007. – Vol. 100. – P. 337‑345.
*«Медичні аспекти здоров'я жінки», № 3 (138), 2021.
Тематичний номер «Урологія. Нефрологія. Андрологія» № 2 (23), 2021 р.





