1 квітня, 2015
Хроническая послеоперационная боль: современные представления и пути решения проблемы
 Среди проблем послеоперационной аналгезии хроническая боль занимает особое место. Хронизация послеоперационной боли во многих случаях является следствием неадекватного лечения острой боли и может приводить к тяжелой инвалидизации, отягощаться формированием комплексных регионарных синдромов. Риск подобных осложнений лечения особенно высок среди онкологических больных, подвергающихся обширным хирургическим вмешательствам.
Среди проблем послеоперационной аналгезии хроническая боль занимает особое место. Хронизация послеоперационной боли во многих случаях является следствием неадекватного лечения острой боли и может приводить к тяжелой инвалидизации, отягощаться формированием комплексных регионарных синдромов. Риск подобных осложнений лечения особенно высок среди онкологических больных, подвергающихся обширным хирургическим вмешательствам.
В данном контексте развитие рациональных подходов к профилактике хронической послеоперационной боли, а также лечению уже развившихся болевых синдромов является актуальной проблемой, которой сегодня уделяется повышенное внимание.
Хронизация боли: распространенность, факторы риска
Для того чтобы боль была классифицирована как хроническая послеоперационная, она должна соответствовать следующим критериям:
- развиться после перенесенного хирургического вмешательства;
- длиться не менее 2 мес;
- должны быть исключены другие причины этой боли (новообразование, хроническое воспаление и т.д.).
В 2010 г. FDA была сформирована специальная группа ACTION (Analgetic Clinical Trial Innovations, Opportunities and Network), которая потребовала от исследователей и компаний выполнить базовые и клинические исследования по предотвращению развития хронической послеоперационной боли. Комитет ACTION разработал рекомендации по проведению подобных исследований с целью предотвращения возникновения хронической послеоперационной острой боли (ХПОБ).
Клинические исследования должны включать изучение предоперационных, интраоперационных, ранних и поздних послеоперационных факторов, а также оценку исхода терапии в определенные временные интервалы. Стоимость лечения ХПОБ и степень нарушений функций высоки, поэтому любые меры, которые предпринимаются по снижению риска ХПОБ, имеют большое значение.
При оценке датскими учеными результатов лечения 1135 женщин, перенесших гистерэктомии, показано, что у 32% из них через 1 год после операции развивалась ХПОБ. В исследовании установлены следующие факторы риска: тазовая боль, другие болевые синдромы, предшествующее кесарево сечение.
По данным зарубежных авторов, частота развития ХПОБ через 1 год после проведения косметических операций по поводу увеличения грудной железы достигает 9,5%. Согласно результатам шведского исследования хирургические вмешательства по поводу бедренной грыжи (n=1461) в 5,5% случаев сопровождались развитием ХПОБ, мешающей повседневной активности пациентов.
По данным британских авторов, у 1294 больных, перенесших эндопротезирование крупных суставов, частота средней и тяжелой ХПОБ составила соответственно 15 и 6% для тотального эндопротезирования коленного и тазобедренного сустава; у 6 и 1% из них соответственно была диагностирована нейропатическая боль.
В многоцентровом исследовании, проведенном в США, из 1030 больных, перенесших хирургические вмешательства на крупных суставах, 46% жаловались на постоянную боль через 1 год после операции (38% – при эндопротезировании тазобедренного и 53% – коленного сустава). Средняя выраженность боли у этих пациентов достигала 3 баллов по 10-балльной шкале, оценка наиболее интенсивного болевого синдрома составила 5 баллов.
Анализ баз данных с 1966 по 1998 г. позволил сделать вывод о высокой частоте развития хронического психогенного болевого синдрома (ХПБС) у пациентов, перенесших плановые и экстренные хирургические вмешательства, в том числе хирургическое лечение рака. Установлено, что частота постторакотомического ХПБС приближается к 45%, постмастэктомического – к 35-38%, после открытых холецистэктомий ХПБС развивается приблизительно в 25% случаев, а у пациентов, перенесших операции по поводу паховых грыж, так называемый генитофеморальный болевой синдром возникает в 10-12% случаев и т.д. (Perkins F., Kehlet H., 2000).
Развитие ХПБС является серьезной медико-социальной проблемой, которая имеет, кроме всего прочего, большое экономическое значение. Согласно данным зарубежных источников стоимость лечения ХПБС, развившегося у 30-летнего пациента, к концу его жизни достигает 1 млн долларов. В связи с этим ключевое значение для повышения эффективности послеоперационного обезболивания на современном этапе имеет профилактика хронизации острого послеоперационного болевого синдрома.
Для предотвращения развития послеоперационного болевого синдрома важна надлежащая оценка факторов риска, которая должна проводиться еще в предоперационном периоде (табл. 1).
По данным H. Kehlet и соавт. (2006), среди факторов риска развития длительной послеоперационной боли значимую роль играют психосоциальные факторы (психологическая уязвимость, депрессия, тревога, боязнь боли), возраст и пол (более подвержены молодые пациенты и лица женского пола), необходимость реабилитации для работающих лиц.
Частота развития длительного послеоперационного болевого синдрома после плановых хирургических вмешательств достигает 10-50%. В 2-10% случаев болевой синдром может быть интенсивным и вызывать психологические и физиологические расстройства. К сожалению, обсуждаемый синдром все еще недостаточно часто распознается в клинической практике и ему уделяется недостаточное внимание. Существенной проблемой является фактическое отсутствие справочной литературы. Кроме того, исследования, направленные на своевременное выявление и коррекцию возникших послеоперационных болевых синдромов, не проводятся на систематической основе, и все еще высока частота неправильного диагностирования и неадекватного последующего лечения.
В ряде случаев ошибки во время операции приводят к развитию длительной ятрогенной послеоперационной боли, требующей последующего хирургического лечения. В настоящее время выделяют следующие механизмы возникновения ятрогенной хронической боли:
- деафферентация (фантомные боли в конечностях);
- повреждение симпатических нервов (каузалгия, комплексный региональный болевой синдром);
- повреждения нервов;
- нейропатическая хроническая боль.
Для синдрома длительной послеоперационной боли характерно развитие боли после перенесенного хирургического вмешательства; в некоторых случаях болевой синдром возникает после безболевого периода. Определение болевого синдрома как длительной ХПОБ не производится в тех случаях, когда боль предшествовала оперативному вмешательству или связана с развитием заболевания.
Выделяют ряд механизмов поддержания послеоперационной боли, которые, собственно, способствуют переходу острого болевого синдрома в хроническую форму. К ним относят ряд факторов, связанных как с самим хирургическим вмешательством, так и с особенностями обезболивания.
1. Травматические повреждения нервов во время операции:
- прямая травма;
- раздавливание, рассечение, вытяжение;
- сокращение, компрессия;
- ретракция, раздражение.
2. Интенсивная и длительная гипералгезия:
- периферическая (воспаление);
- центральная («взвинчивание» + гипералгезия, вызванная опиоидами);
- нейрональная пластичность.
Патофизиология хронической боли
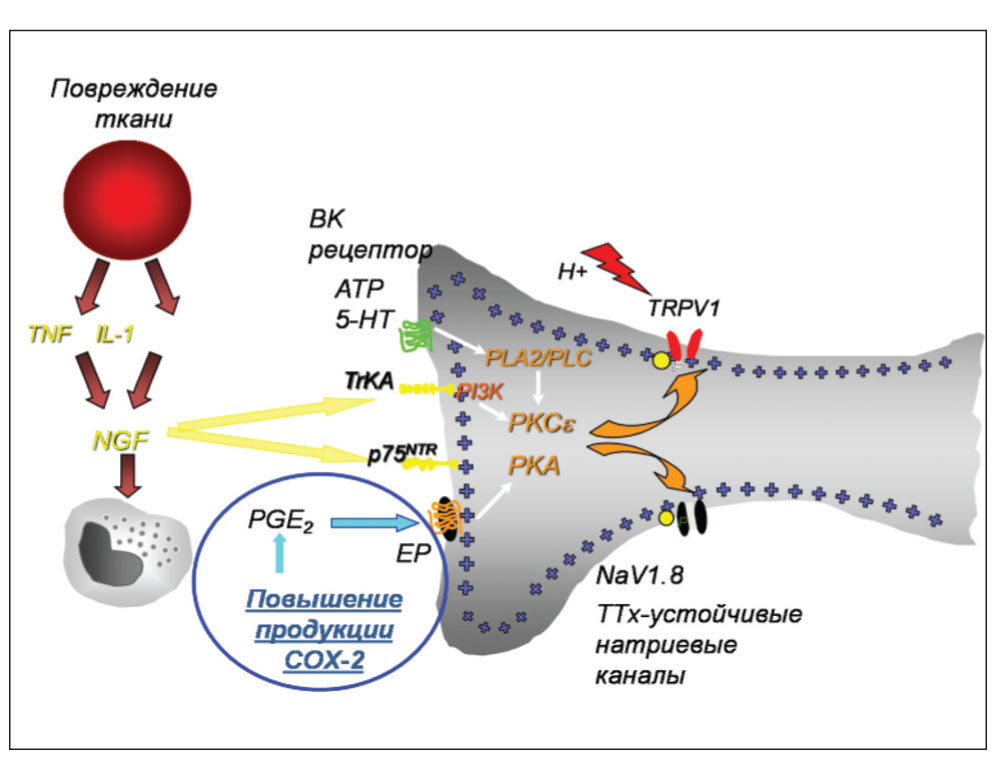
Как известно, травма и воспаление, вызванные разрезом и травмированием тканей при хирургическом вмешательстве, приводят к активизации ноцицепторов. Вследствие сенситизации периферических ноцицепторов воспалительными медиаторами (цитокины, брадикинин, простагландины), которые высвобождаются из поврежденных и воспалительных клеток в месте повреждения тканей, возникает воспалительная боль. Ноцицепторы демонстрируют обратимую пластичность в ответ на высвобождение медиаторов воспаления. При развитии патологической боли порог активации ноцицептора снижается, приводя к усиленной болевой чувствительности в месте травмы ткани (периферическая сенситизация) (рис. 1).
Рис. 1. Первичная гипералгезия (периферическая сенситизация)
Выраженность этого вида воспалительной боли обычно снижается, как только уменьшается выработка медиаторов, что наблюдается при заживлении раны или контроле течения заболевания. Повышенная болевая чувствительность может вносить свой вклад в заживление, помогая защитить поврежденную часть тела до репарации.
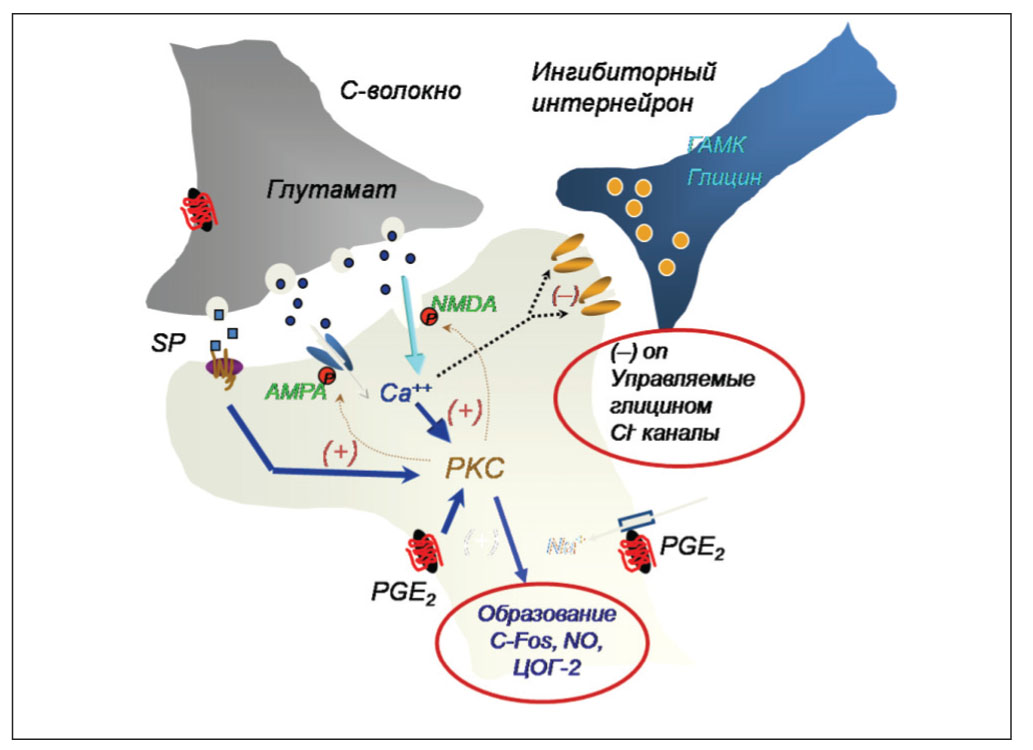
Центральная нервная система (ЦНС) также демонстрирует пластичность в ответ на боль, и болевые сигналы в спинном мозге могут быть усилены. При постоянном ноцицептивном входе зависимость «стимул-ответ» нарушается и может проявиться в виде повышенной возбудимости нейронов в ЦНС, известной как центральная сенситизация (рис. 2).
Клинически это проявляется повышенным ответом на болевые стимулы (гипералгезия) и боль в ответ на первично неболевые тактильные стимулы (аллодиния).
 С центральной сенситизацией связаны феномен «взвинчивания», длительная потенциация и вторичная гипералгезия. Феномен «взвинчивания» наблюдается при повторной активации C-волокон нейронов и является следствием действия глутамата на NMDA (N-methyl-D-aspartate) рецепторы. При нормальных условиях ион магния блокирует NMDA-рецептор, но в случае длительной болевой стимуляции блокировка устраняется и усиливается ответ нейронов второго порядка на болевые стимулы.
С центральной сенситизацией связаны феномен «взвинчивания», длительная потенциация и вторичная гипералгезия. Феномен «взвинчивания» наблюдается при повторной активации C-волокон нейронов и является следствием действия глутамата на NMDA (N-methyl-D-aspartate) рецепторы. При нормальных условиях ион магния блокирует NMDA-рецептор, но в случае длительной болевой стимуляции блокировка устраняется и усиливается ответ нейронов второго порядка на болевые стимулы.
Этим объясняется, почему антагонисты NMDA-рецепторов, такие как кетамин, полезны в уменьшении или блокировании феномена «взвинчивания». Феномен, известный как длительная потенциация, заключается в том, что ответ нейронов второго порядка превышает по длительности начальный стимул. Снижение болевого порога за пределами зоны воспаления (вторичная гипералгезия) отмечается при усилении активации нейронов второго порядка в дорзальном роге спинного мозга.
Травма нервов также играет важную роль в развитии хронической послеоперационной боли. После травмы нерва спонтанные эктопические разряды из поврежденных нервов и окружающих неповрежденных нервов приводят к возникновению спонтанной боли. Усиленный ноцицептивный вход в дорзальный рог спинного мозга вносит свой вклад в развитие центральной сенситизации. Утрата ингибиторных интернейронов в дорзальном роге спинного мозга ведет к разблокированию путей проведения боли и облегчению болевой трансмиссии.
Современные подходы к послеоперационному обезболиванию
 По мнению P.F. White, H. Kehlet (2010), для повышения эффективности послеоперационного обезболивания необходимо:
По мнению P.F. White, H. Kehlet (2010), для повышения эффективности послеоперационного обезболивания необходимо:
• внедрять существующие доказательные рекомендации в отношении индивидуального применения неопиоидных аналгетиков (НПВП, парацетамол, габапентиноиды, кетамин, местные и регионарные техники анестезии), которые при необходимости дополняются опиатами;
• практикующим врачам – применять рациональные комбинации препаратов для уменьшения количества вызванных опиоидными аналгетиками побочных эффектов, что будет способствовать улучшению ранних исходов и более быстрому возвращению к нормальной повседневной активности (в том числе мобилизации, восстановлению функции кишечника, возвращению пациента к работе).
Роль анестезиолога в предотвращении хронической послеоперационной боли является определяющей, так как в соответствии с современными позициями вид послеоперационной аналгезии должен быть неотъемлемой частью общего индивидуального плана периоперационного ведения при любом хирургическом вмешательстве и строго основываться на доказательных принципах аналгезии.
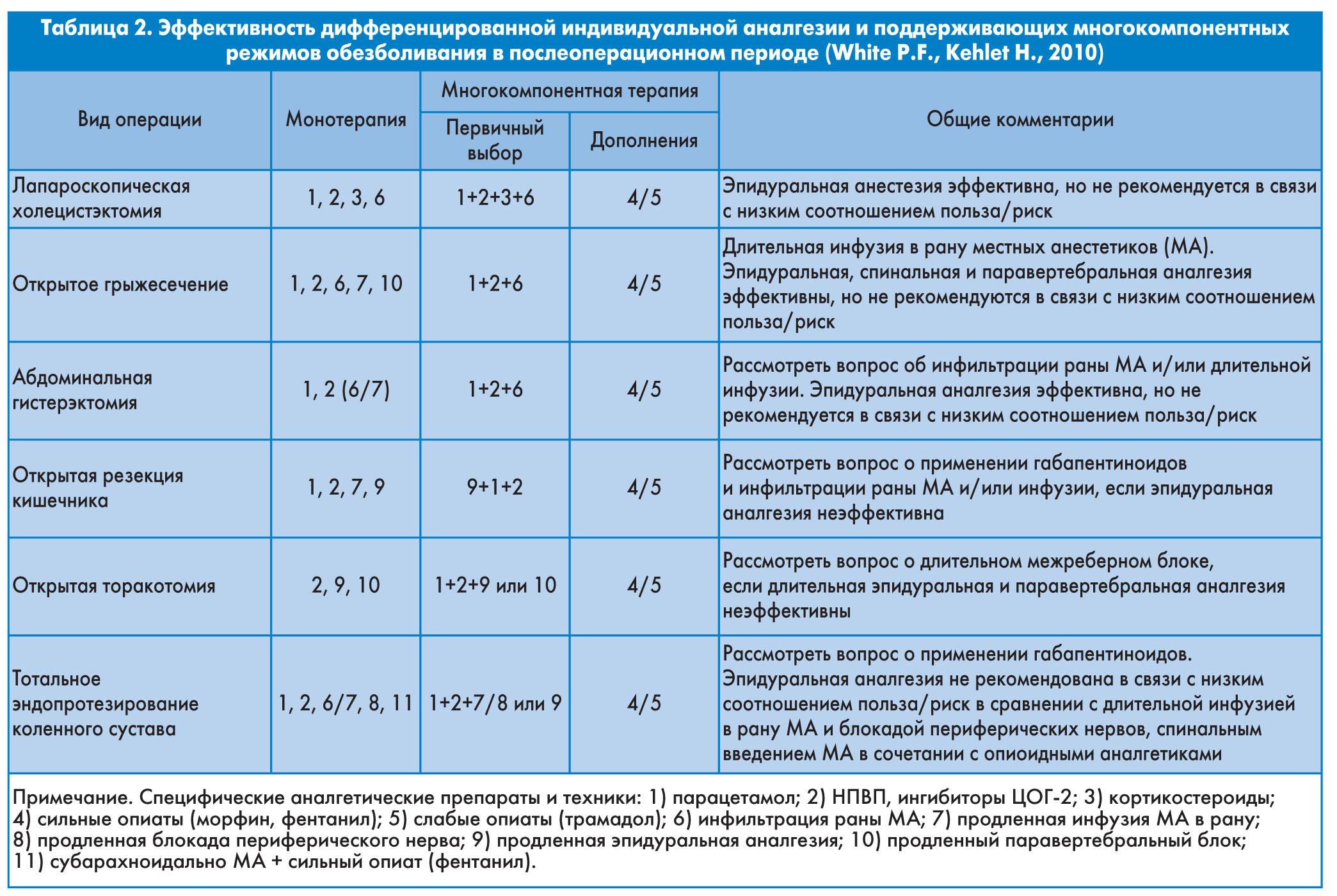
В последнее время много внимания уделяется соотношению польза/риск при выполнении аналгетических техник, что позволяет применять их максимально эффективно. В таблице 2 предложены возможные варианты моно- и сбалансированной аналгезии при наиболее частых оперативных вмешательствах с современных позиций. Краеугольным камнем является приоритет неопиоидной аналгезии, что связано с высокой частотой развития побочных эффектов опиоидных аналгетиков, а именно гипералгезии, острой толерантности, риска опухолевой прогрессии и других, которые определяют неэффективность аналгезии.
Регионарная анестезия
 При использовании региональных техник анестезии для блокады проведения импульсов по нервам применяют МА. Минимизация трансмиссии сигналов может предотвратить центральную сенситизацию. Спинальные и эпидуральные техники аналгезии действуют на корешки нервов, в то время как периферические блоки, плексусные блоки и инфильтрация раны с применением МА прерывают импульсы в периферических нервах. Недавний Кокрановский обзор показал, что эпидуральная аналгезия при торакотомии обеспечивает положительный эффект в отношении снижения риска развития хронической боли через 6 мес после операции, а паравертебральная аналгезия эффективна в уменьшении риска хронической боли после операции по поводу рака грудной железы. Спинальная анестезия имеет положительные эффекты в сравнении с общей в отношении снижения риска хронической боли после кесарева сечения. Ампутация конечности связана с высоким риском развития ХПОБ.
При использовании региональных техник анестезии для блокады проведения импульсов по нервам применяют МА. Минимизация трансмиссии сигналов может предотвратить центральную сенситизацию. Спинальные и эпидуральные техники аналгезии действуют на корешки нервов, в то время как периферические блоки, плексусные блоки и инфильтрация раны с применением МА прерывают импульсы в периферических нервах. Недавний Кокрановский обзор показал, что эпидуральная аналгезия при торакотомии обеспечивает положительный эффект в отношении снижения риска развития хронической боли через 6 мес после операции, а паравертебральная аналгезия эффективна в уменьшении риска хронической боли после операции по поводу рака грудной железы. Спинальная анестезия имеет положительные эффекты в сравнении с общей в отношении снижения риска хронической боли после кесарева сечения. Ампутация конечности связана с высоким риском развития ХПОБ.
Очевидно, что в этом случае травма нерва неизбежна, однако согласно современным данным периоперационная эпидуральная аналгезия снижает частоту развития тяжелой фантомной боли. Несмотря на то что существуют доказательства пользы региональных техник анестезии в снижении частоты ХПОБ, нет четких рекомендаций для всех видов операций.
Упреждающая и превентивная аналгезия
Оптимальное время и режим периоперационной региональной и системной аналгезии были предметом широкого обсуждения. Упреждающую аналгезию проводят до разреза. Упреждающая эпидуральная аналгезия оказывает значительный эффект на послеоперационную боль, но польза других видов аналгезии, которые выполняются аналогичным образом, не так ясна.
Превентивная аналгезия носит профилактический характер, ее длительность превышает ожидаемую продолжительность болевого синдрома, требующего обезболивания. Этот подход может играть важную роль в минимизации хронической боли после операции посредством уменьшения центральной сенситизации. Считается, что аналгетический режим в отношении предотвращения сенситизации нервной системы является эффективным и его необходимо применять в течение всего времени действия воспалительных стимулов – не просто при разрезе кожи, а на протяжении всего послеоперационного периода. Показано, что периоперационное использование блокаторов NMDA-рецептора обеспечивает превентивные аналгетические эффекты, и это считают следствием их действия в отношении предотвращения центральной сенситизации (уровень доказательств I).
Кетамин
Как блокатор NMDA-рецептора кетамин предупреждает возникновение опосредованного этим рецептором феномена «взвинчивания». Он также обладает болеутоляющим эффектом, воздействуя на нисходящие моноаминергические пути и предотвращая развитие вызванной опиоидами гипералгезии (парадоксальное увеличение чувствительности к болевым стимулам у больных, получающих опиоиды), а также острой толерантности к опиатам. Кетамин редко используется как единственное обезболивающее средство ввиду психомиметических побочных эффектов, но может быть очень полезным вспомогательным препаратом у тех больных, которые требуют высоких доз опиоидов. Он потенцирует опиоидную аналгезию, улучшает контроль боли и уменьшает количество связанных с применением опиата побочных эффектов.
Обычно вводится низкая доза кетамина болюсным путем (0,15-0,5 мг/кг) или низкодозовый болюс с последующей низкодозовой инфузией (2-4 мкг/кг/мин) у пациентов, получавших опиоиды в различных областях хирургии. В большинстве исследований показано, что под влиянием кетамина снижается потребность в опиоидах и интенсивность боли в первые 24 ч, хотя есть публикации и о более длительном положительном действии. Периоперационная эпидуральная аналгезия в сочетании с внутривенным введением кетамина более эффективно снижает гипералгезию и уменьшает интенсивность хронической боли после операций на кишечнике по сравнению с изолированной внутривенной аналгезией.
Внутривенный лидокаин
В ходе метаанализа, посвященного изучению интраоперационного введения внутривенного лидокаина, показано снижение острой боли. Наибольший эффект данного метода отмечен в абдоминальной хирургии. Системное введение МА сопровождается антигипераналгетическими эффектами, которые сохраняются в течение нескольких дней после оперативного вмешательства, то есть намного дольше непосредственного действия самих препаратов. Механизм действия МА при внутривенном введении не вполне понятен и не может быть объяснен только блокадой натриевых каналов. Однако эти находки позволяют предположить, что лидокаин может играть значимую роль в предотвращении центральной сенситизации и, следовательно, использоваться как превентивное болеутоляющее средство.
Габапентиноиды
Габапентин был изначально представлен как антиконвульсант в 1990-х гг. В последующих испытаниях продемонстрирована его эффективность в лечении нейропатической боли. Действие препарата опосредуется α2σ-субъединицами пресинаптических кальциевых каналов, препятствующими входу кальция и последующей продукции возбуждающих нейротрансмиттеров в болевых путях. Прегабалин по структуре подобен габапентину, но имеет большую аналгетическую силу и лучший фармакокинетический профиль.
В рандомизированных клинических исследованиях получены доказательства того, что опережающее использование габапентина снижает интенсивность острой послеоперационной боли. Недавно были опубликованы данные систематического обзора и метаанализа, в которых изучался вопрос развития ХПОБ после периоперационного применения габапентина и прегабалина. Положительный эффект габапентина отмечен в 4 из 8 исследований. В 6 исследованиях габапентина, которые вошли в метаанализ, габапентин вызывал средней или выраженной степени снижение частоты развития ХПОБ. Все три исследования включали системные обзоры эффектов прегабалина в отношении развития ХПОБ как препарата, имеющего значительное превентивное действие. В 4 из 6 исследований, в которых анализировались отдаленные клинические исходы, доказана польза от назначения габапентина и прегабалина. Это свидетельствует о том, что снижение частоты развития ХПОБ может быть связано с применением указанных препаратов в периоперационном периоде.
Однако ввиду ограниченного количества исследований, включенных в этот обзор, и предположения о том, что в публикациях может присутствовать систематическая ошибка, становится очевидным, что в будущем необходимы хорошо спланированные исследования для уточнения роли периоперационного использования габапентина и прегабалина в предотвращении возникновения ХПОБ.
Установлено, что габапентин блокирует позднюю, но не раннюю послеоперационную боль после тиреоидэктомии с поверхностной блокадой шейного сплетения (Brogly N. et al., 2008).
В исследовании 50 пациентов были разделены на группы габапентина 1200 мг или плацебо за 2 ч до операции. Данные о применении аналгетиков, боли в покое и во время глотания были сходными в обеих группах в первые 24 ч послеоперационного периода.
У 8 пациентов оценка боли по шкале DN4 составила более 3 баллов через 6 мес после операции. Жалобы на отсроченную боль отмечены у 7 пациентов с поверхностной блокадой шейного сплетения (ПБШС) против только 1 пациента с ПБШС при назначении габапентина (р=0,01).
Психосоциальные факторы
Болевой опыт – это нечто большее, чем просто определение повреждающих стимулов, которые передаются в ЦНС. На восприятие боли влияют как настроение, воспоминания, ожидания и социальная среда, так и психосоциальные факторы, что следует учитывать наряду с оценкой боли и ее лечением.
Модель избегания страха считают важной в возникновении и поддержании хронической боли, что демонстрирует роль психологического фактора. Страх в конечном счете приводит к невостребованности и инвалидности, при этом страх возникновения боли в действительности лучше прогнозирует инвалидность, чем сама боль. У лиц, подверженных панике, больше шансов попасть в цикл поведения с избеганием страха. Панику можно охарактеризовать как почти немедленную привычную негативную оценку ситуации.
Человек может, например, верить, что если он согнет спину, то сломает ее и станет инвалидом-колясочником. Связь между болевым опытом и поведенческой активностью опосредуется ожиданием боли и катастрофических последствий при выполнении определенных видов деятельности.
В целом ожидание боли должно быть полезным, поскольку адаптивные реакции ведут к изменению поведения для избегания боли. Однако оно может стать дезадаптирующим фактором у лиц с хронической болью. В исследованиях с нейровизуализацией, в которых оценивали, каким образом ожидание и тревога могут усилить восприятие боли, были выявлены определенные регионы, важные для усиления болевого опыта. Эти области включают энторинальный комплекс, миндалевидное тело, переднюю островковую и префронтальную кору.
Психологические факторы могут играть важную роль в трансформации острой послеоперационной боли в хроническую. Так, Katz и соавт. (2009) обнаружили корреляцию между предоперационной тревогой и острой послеоперационной болью у женщин, которые оперировались по поводу рака грудной железы. В литературе содержится меньше данных, касающихся роли психологических факторов в возникновении ХПОБ, хотя психологическая лабильность (паника), тревога, депрессия, невротизм и позднее возвращение к работе рассматривались как факторы риска. У больных со страхом последствий операции также повышен риск длительной боли и плохого восстановления.
Понимание сути боли имеет большое значение для достижения эффективного ее контроля. Опережающие когнитивные и поведенческие техники снижают уровень тревоги до и после операции, а также интенсивность боли и количество принимаемых аналгетиков. В исследовании Egbert и соавт., выполненном около 50 лет назад, показано уменьшение частоты применения морфина и длительности госпитализации в случаях, если больной был проинформирован до операции о возможных послеоперационных лечебных мероприятиях, дискомфорте и получал инструкции по релаксационным техникам. Когда пациентам в дополнение к информации по процедурам сообщают о том, какие ощущения им следует ожидать в дальнейшем, они испытывают меньшую боль и дистресс в сравнении с каким-либо одним видом информации. Полученная информация может обеспечить повторную оценку испытываемых ощущений после процедур, и это является нормальным. Например, после тотального эндопротезирования коленного сустава больных побуждают активизироваться в первые часы после операции. Это может доставлять дискомфорт, но является важным для того, чтобы пациенты не воспринимали боль как эквивалент повреждения и понимали, что некоторые неудобства – нормальное явление.
Благодаря активному вовлечению больных у последних повышается чувство самодостаточности в отношении лечения и связанного с болезнью поведения, и, скорее всего, лечебные цели будут достигнуты. У пациентов, которые пассивно реагируют на боль, регистрируется больший дистресс и показатели инвалидности по сравнению с теми, кто пытается решить эту проблему. Взятие под контроль причины боли или метода обезболивания обеспечивает положительный эффект.
Контроль ожиданий больных рассматривается как важный компонент программ ускоренной реабилитации. Предоставление пациентам со стороны хирургов, анестезиологов, сестер детальной информации о хирургических процедурах, ожидаемых ощущениях, обезболивании и восстановительном периоде будет способствовать уменьшению у них тревоги и выздоровлению.
Применение этих положений в периоперационном периоде, возможно, позволит снизить вероятность развития ХПОБ и инвалидности у больных высокого риска.
Будущие направления совершенствования послеоперационного обезболивания
- Сотрудничество между отделениями анестезиологии и хирургии с командой лечения острой боли и сестрами послеоперационных палат для достижения максимальной пользы от улучшенных аналгетических режимов.
- Возможность принятия наиболее неотложных решений по улучшению качества обезболивания на организационном уровне.
- Создание новых аналгетиков на основании открытия новых популяций рецепторов на сенсорных нервных окончаниях.
- Формирование понимания существенных индивидуальных различий в болевом ответе на одинаковые повреждающие хирургические стимулы.
- Фармакогенетика как важная область для будущих исследований, направленных на улучшение обезболивания.
- Исследование влияния метаболических факторов, возраста и пола на чувствительность пациента к обезболиванию.
- Переоценка концепции упреждающей аналгезии в связи с большим количеством несоответствий в данных рандомизированных исследований относительно временных аспектов начала аналгезии.
Профилактика развития длительной послеоперационной боли
Современные принципы профилактики развития длительной послеоперационной боли предполагают:
– внедрение менее инвазивных и агрессивных оперативных вмешательств;
– обеспечение профилактики гипералгезии с применением таких препаратов, как:
- МА;
- НПВП;
- агонисты α2-рецепторов: клонидин, дексмедетомидин;
- морфин;
- блокаторы NMDA-рецепторов – кетамин, декстрометорфан;
- блокаторы потенциалзависимых каналов – габапентин, прегабалин, зиконотид.
Новыми целями профилактики и лечения послеоперационной боли являются:
- воздействие на факторы роста, в частности нейротрофический фактор, полученный из линии глиальных клеток (GDNF);
- профилактика микроглиальной активации (миноциклин);
- блокада изоформ натриевых каналов;
- использование препаратов, облегчающих открытие калиевых каналов;
- профилактика развития длительной послеоперационной боли;
- разработка и внедрение менее инвазивных и агрессивных хирургических вмешательств;
- профилактика гипералгезии.
Таким образом, до настоящего времени существуют проблемы в области диагностики длительной послеоперационной боли. Послеоперационная нейропатическая боль может быть легко диагностирована в клинике благодаря использованию опросника DN4 и с помощью отслеживания анестезиологами отдаленных результатов лечения у пациентов. Механизмы длительной послеоперационной боли являются комплексными, включая изменение функции Ca2+-каналов, связанных с NMDA-рецепторами, изоформ Na+-потенциалзависимых каналов, а также генетическую предрасположенность. Необходимо помнить, что качественное устранение острой послеоперационной боли является залогом предотвращения хронической послеоперационной боли.
Понимание психологических процессов, влияющих на развитие длительной послеоперационной боли, позволяет использовать соответствующие терапевтические подходы, направленные на минимизацию вероятности трансформации острой боли, развивающейся после оперативных вмешательств, в хроническую ее форму. Осознание факторов риска развития ХПОБ может помочь распознавать больных с повышенным риском и выработать целевые индивидуальные лечебные программы. Необходимо рассматривать вопрос влияния психологических факторов на болевой опыт, при этом рекомендуется подход, основанный на сотрудничестве и активном вовлечении больных в принятие лечебных решений для обеспечения наилучшего исхода заболевания.
Список литературы находится в редакции.