6 січня, 2023
Рекомендації щодо серцево-судинного оцінювання та ведення пацієнтів, які потребують некардіологічних хірургічних втручань
До вашої уваги представлено огляд рекомендацій Європейського товариства кардіологів (ESС, 2022) щодо оцінювання серцево-судинної системи та ведення пацієнтів, які перенесли несерцеві хірургічні втручання (НКВ), схвалені Європейським товариством анестезіологів та інтенсивної терапії (ESAIC). Наведені настанови узагальнюють і оцінюють наявні доказові дані, щоб допомогти медичним працівникам запропонувати найкращі стратегії лікування для пацієнта з певним захворюванням, а також полегшити прийняття рішень у щоденній практиці.
За оцінками кількість великих хірургічних операцій у всьому світі становить понад 300 млн процедур на рік. Як відомо, 85% хірургічних втручань є НКВ, тобто виконуються на інших органах і системах. Так, за даними звіту Національної бази даних стаціонарних пацієнтів США (USA National Inpatient Sample databasе) 2012‑2013 рр. половина пацієнтів віком старше 45 років, які перенесли НКВ, мали принаймні два серцево-судинні (СС) чинники ризику, 18% осіб мали ішемічну хворобу серця (ІХС), 4,7% – інсульт в анамнезі, у 7,7% пацієнтів модифікований індекс серцевого ризику (RCRI) був ≥3 (діапазон 0‑6).
Ризик періопераційних ускладнень залежить від поширеності супутніх захворювань, клінічного стану пацієнтів перед операцією, а також терміновості, обсягу, типу і тривалості хірургічної процедури. У когортному дослідженні серед 40 тис. пацієнтів віком ≥45 років, які перебували на стаціонарному лікуванні після НКВ, в одного із семи через 30 днів після процедури спостерігали СС- або цереброваскулярне ускладнення. Особливо часто СС-ускладнення можуть виникати в осіб, які потребували хірургічного втручання, із підтвердженою або безсимптомною ІХС, дисфункцією лівого шлуночка (ДЛШ), захворюванням клапанів серця і аритмією в анамнезі. За оцінками, до 2030 р. кожна п’ята особа віком старше 75 років щорічно потребуватиме хірургічного втручання. Тобто дорослі віком ≥75 років мають більший ризик розвитку періопераційних серйозних СС-подій.
Ішемія міокарда, що розвивається в передопераційний період, може бути зумовлена трьома механізмами:
- Невідповідністю між потребою в кисні та його постачанням на тлі стенозу коронарної артерії, що може обмежувати кровотік внаслідок періопераційних гемодинамічних змін.
- Гострим коронарним синдромом (ГКС), спричиненим хірургічним стресом, із розривом атеросклеротичної бляшки; супроводжується із прозапальними і гіперкоагуляційними станами, гемодинамічним дистресом внаслідок змін рідинного гомеостазу й анестезії.
- Ризиком кровотечі, пов’язаної з хірургічним втручанням, внаслідок переривання антиагрегантної терапії, що може призвести до тромбозу в пацієнтів, що потребували НКВ після попереднього встановлення коронарного стента.
Оскільки поширеність патології серця зростає з віком, періопераційна СС-смертність і захворюваність є переважно проблемою старшого населення. Рекомендації ESC (2022) щодо оцінювання функції СС-системи (ССС) і лікування пацієнтів, які потребують НКВ, зосереджені на передопераційному оцінюванні СС-ризику та періопераційному веденні пацієнтів, у яких СС-захворювання (ССЗ) є потенційним джерелом ускладнень під час НКВ.
Поточні рекомендації спрямовані на запобігання періопераційній СС-захворюваності, зокрема періопераційному інфаркту міокарда (ІМ), тромбозу стента, гострій серцевій недостатності (СН), гемодинамічно значущій аритмії, тромбоемболії легеневої артерії (ТЕЛА), ішемічному інсульту і смерті. Також важливо запобігати ускладненням, пов’язаним з антитромботичним лікуванням, оскільки кровотеча асоційована з підвищеним ризиком ІМ та смерті.
Оцінювання клінічного ризику
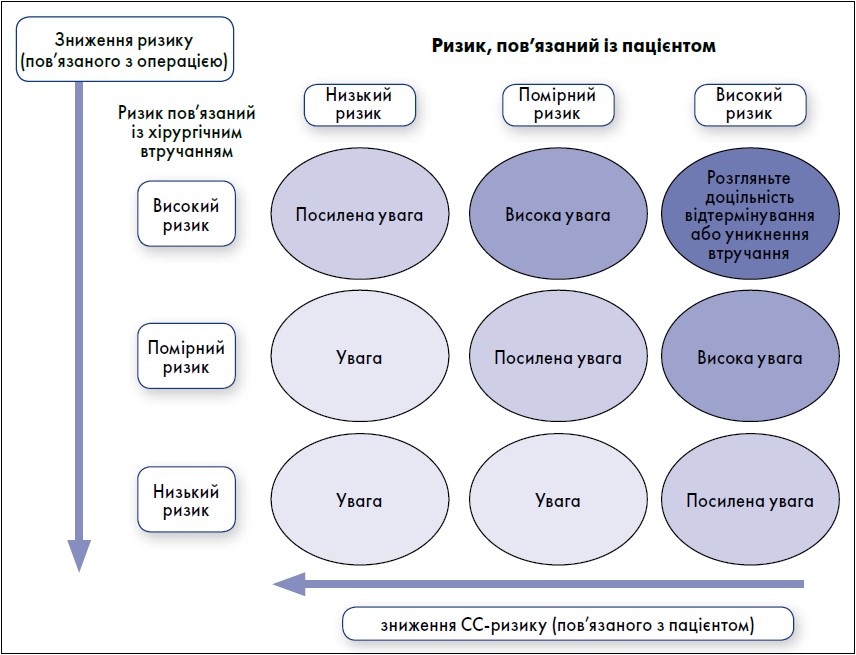
СС-захворюваність і смертність у пацієнтів при НКВ визначаються двома основними чинниками: ризиком, пов’язаним із пацієнтом, і ризиком, пов’язаним із хірургічним втручанням. Ризики можуть бути зменшені завдяки адекватному передопераційному оцінюванню і правильному вибору типу і часу хірургічної процедури (рис. 1).
Рис. 1. Оцінка ризиків при НКВ (ризик має бути якомога ближче до нижнього лівого кута)
Ризик, пов’язаний із хірургічним втручанням, визначається типом і тривалістю операції, а також терміновістю процедури чи втручання. Тип анестезії й анестетики також можуть мати вплив на ризик розвитку ускладнень у пацієнтів, що потребують НКВ, із середнім або високим СС-ризиком. Будь-яка хірургічна процедура може супроводжуватися підвищенням рівнів кортизолу і катехоламінів у відповідь на стрес внаслідок пошкодження тканин і запалення, а також нейроендокринного і симпатовагального дисбалансу. Зміни внутрішньої температури тіла, крововтрата і перерозподіл рідини можуть спричинити підвищення опору судин, а також гіпотензію, що призводить до дисбалансу між потребою міокарда в кисні та його доставкою.
Кровотеча, переливання продуктів крові, пошкодження тканин і запальна реакція, своєю чергою, можуть позначатися на системі згортання крові, спричинюючи протромботичний стан.
Ризик, пов’язаний із пацієнтом, визначається його віком, наявністю чинників ризику ССЗ (як-от куріння, гіпертонічна хвороба, цукровий діабет, дисліпідемія, сімейний анамнез) або встановлених ССЗ і супутньої патології. Виявлення пацієнтів із ризиком розвитку СС-ускладнень є надзвичайно важливим для вибору терапії, якщо доступні нехірургічні варіанти лікування або коли тип операції чи анестезії чинить вплив на ризик ускладнень. У разі екстреної оперативної допомоги оцінювання може бути обмеженим.
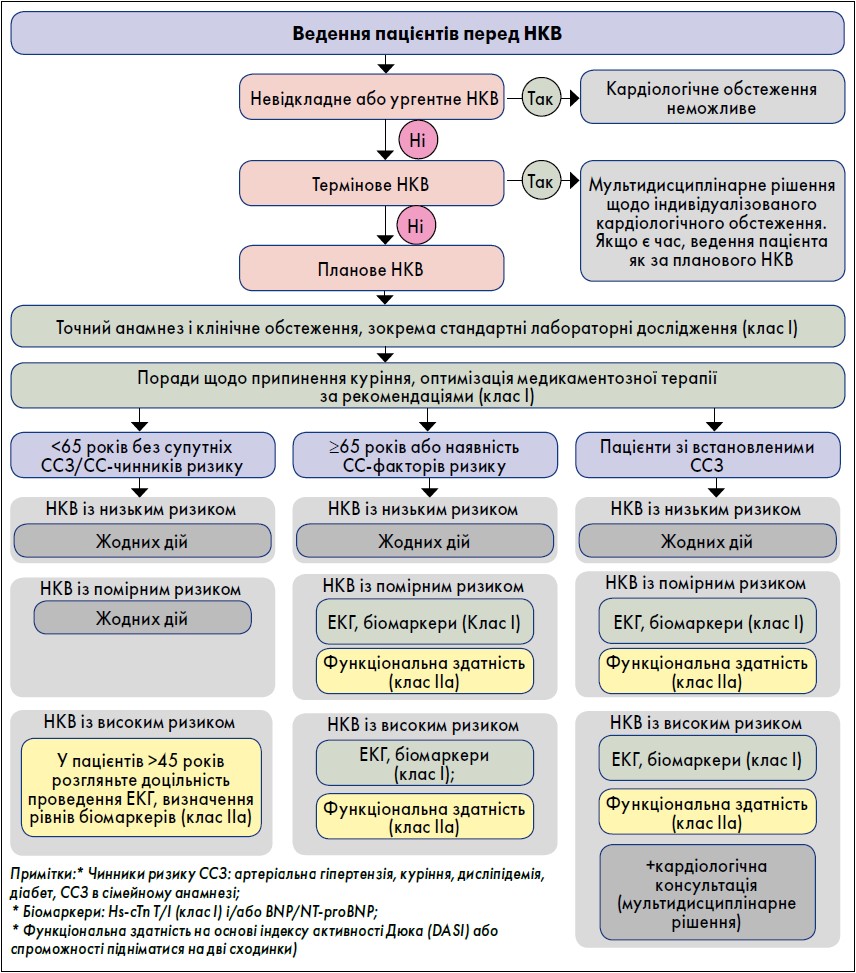
На початковому етапі рекомендовано в усіх пацієнтів ретельно збирати анамнез і проводити їх фізичний огляд, акцентуючи увагу на чинниках ризику ССЗ, наявних ССЗ і супутніх захворюваннях. Пацієнтам із середнім і високим хірургічним ризиком рекомендовано проводити стандартні лабораторні тести. За отриманою інформацією можна продовжити подальше оцінювання ризику. ЕКГ, функціональної здатності та/або визначення рівнів біомаркерів слід виконувати залежно від ступеня ризику, пов’язаного з хірургічним втручанням, і отриманих даних (рис. 2).
Рис. 2. Оцінювання ризику перед НКВ
Пацієнти віком менше 65 років без супутніх ССЗ або чинників СС-ризику в анамнезі вважаються групою низького ризику, їм можна проводити хірургічне втручання з низьким і помірним ризиком без додаткового передопераційного оцінювання ризику. Зокрема, пацієнтам без ознак чи симптомів ССЗ, але із сімейним анамнезом генетичної кардіоміопатії рекомендовано пройти дообстеження за допомогою ЕКГ та ехокардіографічного дослідження, щоб виключити наявність кардіоміопатії.
Так, пацієнти старше 65 років і з чинниками ризику ССЗ мають підвищений ризик виявлення недіагностованих ССЗ. Для оцінювання 10-річного ризику смерті від ССЗ поза проведенням НКВ можна використовувати SCORE2. Ця група пацієнтів також має підвищений ризик розвитку періопераційних ускладнень під час НКВ, тому вони потребують проведення додаткового оцінювання перед хірургічними операціями із середнім і високим ризиком, а також оптимального лікування чинників ризику. Це також стосується пацієнтів з іншими захворюваннями, які пов’язані з високим ризиком супутньої невиявленого або відомого ССЗ.
Термін проведення належного оцінювання ризику
Передопераційне оцінювання слід проводити перед оперативним втручанням, бажано одразу після прийняття рішення про НКВ. Точна оцінка ризиків і переваг хірургічного втручання є необхідною умовою для прийняття інформованого рішення щодо доцільності хірургічного втручання як лікарями, так і пацієнтами. Оцінювання має допомогти під час вибору способу хірургічного втручання (ендоскопічний або відкритий) і моніторингу. Тобто прогностична цінність передопераційної оцінки СС-ризику набагато вища в разі планової хірургії порівняно з ургентною.
Допуск чи недопуск до операції
У клінічних умовах може бути складно вирішити, чи є ССЗ протипоказанням до операції. Найкращий варіант – стабілізація стану кардіологічного пацієнта перед оперативним втручанням, але очікування може бути шкідливим за гострого хірургічного захворювання. Немає чіткого переліку захворювань серця, які є абсолютним протипоказанням до НКВ, але в пацієнтів із тяжкою СН (клас IV за класифікацією Нью-Йоркської кардіологічної асоціації [NYHA]), кардіогенним шоком, тяжкою легеневою гіпертензією або в пацієнтів із тяжкою слабкістю, можливо, слід уникати оперативних втручань із високим ризиком.
Слід враховувати час для подолання сумнівів пацієнтам і надання доказової інформації про співвідношення ризику і користі, а також варіанти лікування (зокрема, нехірургічного лікування або варіант «не робити нічого»), щоб забезпечити інформовану згоду і дати змогу брати участь у спільному прийнятті рішень для забезпечення найкращого рішення.
Методи передопераційного оцінювання
Оцінка ризику
Калькулятори загального ризику. На підставі багатофакторного аналізу даних спостережень розроблено калькулятори індексів ризику. Більшість калькуляторів враховують чинники ризику, пов’язані як із пацієнтом, так і з операцією, але в жодному серед змінних немає рівнів біомаркерів. Калькулятори ризику можна використовувати на додаток або як альтернативу до оцінювання чинників ризику, пов’язаних з операцією і пацієнтом.
Робоча група наголошує, що критеріями відбору пацієнтів для подальшого передопераційного тестування має бути клінічне оцінювання, а не певна кількість балів.
Слабкість
Слабкість – це пов’язаний із віком мультифакторний стан зниженого фізіологічного резерву, що призводить до зниження стійкості, втрати адаптаційної здатності та підвищеної вразливості до стресових чинників.
Передопераційне оцінювання пацієнтів старше 70 років має уміщувати скринінг слабкості, який є предиктором несприятливих результатів для здоров’я в зазначених групах хірургічних пацієнтів.
Електрокардіографія
ЕКГ у 12 відведеннях – це широкодоступний інструмент, що дає змогу оцінити серцевий ризик і виявити невідомі ССЗ, що потребують терапії (наприклад, фібриляцію передсердь або AV-блокаду). Передопераційну ЕКГ рекомендовано проводити у 12 відведеннях пацієнтам віком ≥65 років або з відомими ССЗ в анамнезі, чинниками ризику ССЗ або симптомами, що вказують на серцеві розлади, яким планується проміжне втручання або операція з високим ризиком.
Не рекомендовано регулярно проводити передопераційну ЕКГ у пацієнтів із низьким серцевим ризиком перед втручанням із низьким ризиком. У разі виявлення аномалій корисним є порівняння даних із попередніми записами ЕКГ. Передопераційна реєстрація ЕКГ також дає змогу виявити інтра- і післяопераційні зміни ЕКГ.
Біомаркери
Оскільки періопераційний ризик СС-ускладнень залежить від наявності та ступеня ССЗ, широкодоступні для визначення біомаркери можуть допомогти в оцінюванні СС-ризику.
Високочутливий серцевий тропонін T/I (Hs-cTn T/I) дає змогу кількісно оцінити пошкодження міокарда, а BNP і NT-proBNP – кількісно визначити гемодинамічний стрес серцевого м’яза. Кілька великих проспективних досліджень продемонстрували, що hs-cTn T/I і BNP/NT-proBNP мають високу та інкрементну прогностичну цінність щодо періопераційних серцевих ускладнень, зокрема СС-смерті, зупинки серця, гострої СН і тахіаритмії. Отже, визначення рівнів Hs-cTn T/I і BNP/NT-proBNP доповнює клінічну оцінку й ЕКГ у прогнозуванні ризику.
Неінвазивні й інвазивні процедури
Ретроспективні когортні дослідження не виявили більш значущого зниження ризику виникнення післяопераційної значної несприятливої СС-події чи надання більше інформації, ніж за домопогою клінічного оцінювання ризику в разі проведення перед НКВ із високим ризиком трансторакальної ехокардіографії (ТТЕ). Передопераційна ТТЕ надає інформацію про три основні маркери ризику післяопераційних серцевих подій: ДЛШ, ураження клапанів серця і кардіоміопатію. Систолічна ДЛШ є важливим предиктором післяопераційної СН.
Передопераційне ультразвукове обстеження FOCUS може мати вплив на ведення пацієнтів завдяки підвищенню діагностичної точності клінічної оцінки та допомогти спланувати спосіб хірургічного втручання, техніку анестезії, а також післяопераційний моніторинг. У багатоцентровому рандомізованому клінічному дослідженні попередні результати підтвердили, що передопераційне FOCUS-обстеження значно знизило смертність від усіх причин. Власне, через брак можливостей спектрального доплера, обстеження FOCUS є точним лише для оцінювання основних структурних і функціональних аномалій.
Навантажувальні тести
Тест із фізичним навантаженням. Фізичне навантаження з використанням бігової доріжки або велоергометра забезпечують визначення функціональної здатності, артеріального тиску (АТ) і частоти серцевих скорочень (ЧСС), а також допомагають виявити ішемію міокарда. Навантажувальний тест слід розглядати як цінну альтернативу для діагностики обструктивної ІХС лише, якщо неінвазивні візуалізаційні тести недоступні або для оцінювання функціональної здатності.
Візуалізаційні методи з навантаженням. Докази значення візуалізаційних методів під час навантаження для прогнозування періопераційного ризику значною мірою базуються на ішемії, індукованій за допомогою фармакологічного стрес-тесту. Хоча жодні докази не підтверджують перевагу фармакологічного впливу над фізичним навантаженням із візуалізацією в пацієнтів, які здатні виконувати фізичні вправи відповідного рівня.
У ретроспективному дослідженні за участю 4494 пацієнтів добутамінова стрес-ехокардіографія продемонструвала помірну додаткову прогностичну цінність щодо періопераційних ішемічних СС-ускладнень порівняно з клінічними показниками, і виявилася корисною як частина поетапного підходу до стратифікації ризику пацієнтів, яким планується НКВ із середнім і високим ризиком.
Ангіографія
КТ-коронарографія (КТК). КТК рекомендовано для початкової діагностики ІХС у стабільних пацієнтів із низькою клінічною імовірністю або відсутністю попереднього діагнозу ІХС. Крім того, КТК рекомендовано як альтернативу інвазивній коронарографії для виключення ГКС без підйому сегмента ST, у разі низької або середньої імовірності ІХС, а також, коли рівні серцевого тропоніну і/або дані ЕКГ відповідають нормі або непереконливі. Практична корисність КТК знижується в разі високого вмісту кальцію в коронарних судинах. Прогностична цінність КТК зростає, якщо її поєднувати з неінвазивними функціональними дослідженнями, як-от візуалізація перфузії міокарда.
Інвазивна коронарографія. Недостатньо інформації щодо користі інвазивної коронарографії в пацієнтів, яким заплановано НКВ. Крім того, це може спричинити непотрібну і непередбачувану затримку вже запланованого хірургічного втручання і додати до загального ризику, власне, ризик від процедури. Попри те, що на ІХС може хворіти значна кількість пацієнтів, які потребують НКВ, показання до передопераційної коронарографії та реваскуляризації подібні до таких у нехірургічних умовах.
Стратегії зі зниження ризику
Фармакологічні
Рекомендації щодо фармакологічного зниження ризику наведено в таблиці 1.
β-блокатори
β-блокатори зменшують споживання кисню міокардом, знижуючи силу і частоту серцевих скорочень, а також є ефективними антиаритмічними засобами. Крім того, деякі β-блокатори (метопролол) інгібують гіперактивацію нейтрофілів під час гострих запальних станів. Зважаючи на такі властивості, β-блокатори були одними з найчастіше досліджуваних кардіопротекторних засобів у пацієнтів перед проведенням НКВ.
У дослідженні передопераційного оцінювання ішемії POISE‑1 взяли участь 8351 пацієнт з атеросклеротичним захворюванням або з ризиком його розвитку, які не приймали β-блокатори перед НКВ. Пацієнти були рандомізовані для приймання метопрололу сукцинату із пролонгованим вивільненням (200 мг на добу) або плацебо. Лікування розпочинали за 2‑4 год до операції та продовжували протягом 30 днів. Первинний результат (сукупність СС-смерті, нелетального ІМ і нелетальної зупинки серця) був значно нижчим у групі застосування метопрололу (5,8% проти 6,9%; р = 0,04). Однак випадки смерті з усіх причин, інсульту та клінічно значущої гіпотензії або брадикардії в групі метопрололу були значно частішими. Загалом початок застосування β-блокаторів перед НКВ не був пов’язаний із клінічною користю, але може бути корисним для пацієнтів із високим СС-ризиком або в тих, хто очікує на НКВ із високим ризиком. Пацієнтам, які постійно приймають β-блокатори, рекомендовано продовжити їх застосування у передопераційному періоді.
Статини
Попри широке застосування статинів у пацієнтів, які зазнали хірургічного втручання, кількість досліджень, які оцінюють ефекти призначення статинів у передопераційний період, є нечисленною. Обмежені дані спостережень свідчать про потенційну користь статинів у передопераційному періоді. Довгострокове застосування статинів у пацієнтів із ССЗ або високим ризиком ССЗ загальновизнане. Зниження ризику операційних ускладнень за допомогою навантажувальної дози аторвастатину (LOAD) вивчали у 648 пацієнтів, які раніше не отримували статини, 24% із яких мали в анамнезі ССЗ, а 49% – діабет. У цьому рандомізованому контрольованому плацебо дослідженні пацієнти отримували аторвастатин у дозі 80 мг протягом 18 год до операції, а потім по 40 мг щодня впродовж 7 днів. Застосування аторвастатину не зменшувало ризик серйозних подій (смертність від усіх причин, нелетальний ІМ або інсульт через 30 днів). Тому рутинне періопераційне призначення статинів не рекомендовано. Однак пацієнтам, яким показане застосування статинів, слід розглянути можливість їх приймання в передопераційному періоді, особливо в разі запланованого хірургічного втручання із високим ризиком.
Інгібітори РААС
Дані про передопераційне застосування інгібіторів РААС непереконливі. Більшість досліджень демонструють, що продовження застосування інгібіторів РААС пов’язане з вищим ризиком розвитку гіпотензії в передопераційний період і, як наслідок, із більшим використанням вазопресорів й інотропів. Крім того, інтраопераційна артеріальна гіпотензія та її тривалість пов’язані з ішемічним ушкодженням органів, як-от ушкодження нирок, міокарда, а також інсульт.
У невеликому дослідженні за участю 275 пацієнтів, рандомізованих для продовження приймання інгібіторів ангіотензинперетворювального ферменту (іАПФ) або пропуску останньої перед операцією дози іАПФ, визначено, що в пацієнтів після відмови від останньої дози ІАПФ перед операцією рідше розвивалась інтраопераційна гіпотензія (55% проти 69%) і потреба в застосуванні вазопресорів була менш імовірною. З іншого боку, в групі з пропуском дози була частішою післяопераційна гіпертензія.
До того ж обсерваційне когортне дослідження за участю 4802 пацієнтів, яким проводили НКВ і які застосовували іАПФ і блокатори рецепторів ангіотензину (БРА), підтвердило, що припинення застосування цих препаратів за 24 год до операції асоціювалося з меншим ризиком розвитку інтраопераційної гіпотензії і пов’язане зі зниженням показників сукупної кінцевої точки, що охоплює смертність від усіх причин, інсульт і ІМ. За даними систематичного огляду дев’яти досліджень, відмова від іАПФ/БРА вранці перед операцією не була пов’язана зі смертністю або виникненням серйозної несприятливої СС-події, однак асоціювалося з меншим ризиком розвитку інтраопераційної гіпотензії.
Блокатори кальцієвих каналів
Вплив БКК на баланс між забезпеченням міокарда киснем і потребою в ньому робить ці препарати теоретично придатними для зниження періопераційного ризику. Вагомість рандомізованих досліджень, що оцінюють періопераційні ефекти блокаторів кальцієвих каналів (БКК) обмежується їх невеликим розміром, браком стратифікації ризику і систематичних звітів про серцеву смерть та ІМ.
Пацієнтам, які приймають БКК, особливо за наявності вазоспастичної стенокардії, рекомендовано продовжувати терапію БКК протягом передопераційного періоду, але пропустити приймання у день операції, щоб уникнути розвитку післяопераційної гіпотензії.
Агоністи α2-рецепторів
Агоністи α2-рецепторів зменшують постгангліонарний викид норадреналіну і в такий спосіб можуть зменшити сплеск рівнів катехоламінів під час операції. У міжнародному дослідженні POISE‑2 серед 10010 пацієнтів, які потребували НКВ, застосування агоністів α‑2-рецепторів (клонідину) не зменшило рівень смертності або нелетального ІМ, але збільшило ризик розвитку клінічно значущої гіпотензії та нелетальної зупинки серця.
Діуретики
Діуретики часто призначають пацієнтам з артеріальною гіпертензією (АГ) або СН. Загалом терапію АГ слід продовжувати до дня операції та відновлювати перорально якнайшвидше, коли це можливо. Ретроспективні дані свідчать про те, що інтраопераційне призначення діуретиків може збільшувати ризик гострого ураження нирок (ГНН) після НКВ. Переваги продовження приймання діуретиків як антигіпертензивних препаратів обмежені, тому можна розглянути альтернативні антигіпертензивні засоби.
У будь-якого пацієнта, який приймає діуретики, слід зважати на можливість розвитку електролітних порушень. При СН дозування діуретиків треба заздалегідь скоригувати, щоб забезпечити оптимальний баланс рідини перед операцією та уникнути затримки рідини або зневоднення. Як відомо, гіпокаліємія виникає у 36% пацієнтів, які перенесли хірургічне втручання. Тому будь-які електролітні порушення, особливо гіпокаліємію і гіпомагніємію, слід корегувати завчасно до операції. Особливу увагу варто приділяти пацієнтам, схильним до розвитку аритмій.
Інгібітори натрій-залежного котранспортера глюкози 2-го типу
Частота використання іНЗКТГ‑2 зростає через їх доведену користь у разі ССЗ у пацієнтів із ЦД 2-го типу і сприятливий вплив у пацієнтів із СН і нирковою недостатністю.
Еуглікемічний діабетичний кетоацидоз (ЕДКА) є рідкісним, але серйозним ускладненням. Хоча в РКД не підтверджено суттєвого збільшення частоти цього стану в разі застосування іНЗКТГ‑2, виявлено випадки ЕДКА, що виникали після НКВ у пацієнтів, які отримували зазначені препарати. Управління із санітарного нагляду за якістю харчових продуктів і медикаментів США (FDA) рекомендує переривати терапію іНЗКТГ‑2 принаймні за 3‑4 дні до запланованої операції та уважно стежити за симптомами, пов’язаними з ЕДКА.
Аміодарон
Аміодарон – засіб, який найчастіше застосовують для профілактики післяопераційної ФП. У метааналізі, що оцінював різні антиаритмічні препарати, застосування аміодарону знижувало ризик виникнення ФП після НКВ на 58%, але могло спричинювати несерцеві побічні ефекти. В іншому метааналізі аміодарон (перорально або внутрішньовенно) і β-блокатори були однаково ефективними для зниження ризику розвитку післяопераційної ФП. За даними проспективного рандомізованого клінічного дослідження, комбінація β-блокатора з аміодароном виявилась ефективнішою, ніж β-блокатор окремо в зменшенні ризику розвитку післяопераційної ФП.
Хоча профілактичне приймання аміодарону знижує частоту ФП, клінічні переваги, пов’язані з його регулярним застосуванням, неясні.
Періопераційне призначення антитромботичних засобів
При веденні пацієнтів, які приймають антитромботичні препарати і потребують хірургічного втручання або інвазивної процедури, слід зважати на ризик розвитку кровотечі або тромбозу, пов’язаний як із пацієнтом, так і з процедурою. Крім того, слід брати до уваги фармакокінетичні та фармакодинамічні властивості використовуваних антитромботичних препаратів.
Оцінювання ризику і прийняття рішень щодо пацієнтів, які потребують тривалої антитромботичної терапії (АТТ), є складним завданням, оскільки існує відповідний зв’язок між періопераційним антитромботичним лікуванням, кровотечею, тромботичними подіями і смертністю. Тобто міждисциплінарна оцінка ризику перед втручанням має вирішальне значення, щоб класифікувати пов’язані з пацієнтом ризики розвитку ішемії та кровотечі, а також хірургічний ризик.
Антитромботична терапія
Монотерапія. У пацієнтів, які приймають аспірин для первинної профілактики, ризик ішемічних подій є низьким; за рекомендаціями щодо первинної профілактики ССЗ ESC (2021) його приймання перед НКВ можна відмінити.
Як відомо, у пацієнтів зі встановленим ССЗ аспірин відіграє значну роль у довгостроковій профілактиці нових серцево-судинних подій завдяки кращому співвідношенню ризику й користі. У дослідженні POISE‑210010 пацієнтів зі встановленими ССЗ або з підвищеним СС-ризиком, які потребували НКВ, були розподілені відповідно до того, чи приймали вони аспірин до дослідження, чи ні. Встановлено, що аспірин не зменшував рівень смертності чи нефатального ІМ через 30 днів, проте в групі його застосування частіше, ніж у групі плацебо, спостерігали великі кровотечі (4,6 проти 3,8%).
Аналіз історій 470 пацієнтів, які перенесли черезшкірне коронарне втручання (ЧКВ), застосування аспірину було пов’язане зі значним зниженням смертності й ІМ, тоді як ризик виникнення великої або небезпечної для життя кровотечі суттєво не підвищувався. Цей аналіз підтверджує думку, що ішемічна користь періопераційного застосування аспірину переважує ризик розвитку кровотечі в пацієнтів із попереднім ЧКВ. Отже, зазначеній групі пацієнтів без дуже високого ризику розвитку кровотечі слід продовжувати приймання низьких доз аспірину протягом передопераційного періоду.
Пацієнтам, яким проводять транскатетерну імплантацію аортального клапана (ТІАК) і в яких немає інших показань для терапії пероральними антикоагулянтами, низькі дози аспірину рекомендовано як засіб стандартної терапії. На сьогодні немає доступних рандомізованих даних для оцінювання переваг відміни аспірину порівняно з продовженням його застосування в пацієнтів після ТІАК.
У разі, якщо ризик кровотечі перевищує потенційну користь щодо ССС, приймання аспірину слід припинити. Пацієнтам із високим періопераційним ризиком розвитку кровотечі (наприклад, під час операції на хребті або певних нейрохірургічних чи офтальмологічних операцій) застосування аспірину слід припинити щонайменше на 7 днів.
У рідкісних випадках пацієнти з хронічним коронарним синдромом (ХКС) можуть отримувати монотерапію клопідогрелем згідно з рекомендаціями ESC (2020) щодо лікування ГКС у пацієнтів без стійкої елевації сегмента ST. Робоча група досягла консенсусу щодо рекомендацій короткочасного скасування монотерапії інгібіторами P2Y12-рецепторів тромбоцитів у пацієнтів із високим ризиком розвитку кровотечі. Пацієнти, які отримували монотерапію інгібітором P2Y12-рецепторів як частину стратегії деескалації після ЧКВ/ГКС або через нещодавно перенесений інсульт, захворювання периферичних артерій або непереносимість аспірину, можуть потребувати періопераційного перегляду монотерапії.
Подвійна АТТ. Обсерваційні дослідження повідомляють про значну частоту виникнення значущих несприятливих СС-подій, зокрема СС-смерті, ІМ та тромбозу стента, у пацієнтів після ЧКВ, які потребували НКВ, порівняно з пацієнтами без стентів, що також супроводжувалося більш ніж удвічі вищим ризиком. Чинниками ризику виникнення значущих несприятливих СС-події після НКВ є час від ЧКВ до операції, із найвищим ризиком за перший місяць; первинне ЧКВ із приводу ІМ із підйомом сегмента ST; переривання або припинення подвійної АТТ і характеристики ураження. Ще одним чинником ризику є термінове хірургічне втручання. Класифікація НКВ, запропонована ESC і Європейською асоціацією анестезіологів (ESA), є підтвердженим інструментом, за допомогою якого можна передбачити вплив типу операції на виникнення значущої несприятливої СС-події.
Після ЧКВ пацієнтам на додаток до аспірину рекомендовано приймати інгібітори P2Y12-рецепторів. За даними метааналізу спостережень, припинення застосування клопідогрелю щонайменше на 5 днів знижує ризик повторної операції з приводу великої кровотечі на 50%, не збільшуючи ризик виникнення значущої несприятливої СС-події або смерті.
Слід зауважити, що прогноз тромбозу стента є гіршим, ніж при коронарній оклюзії de novo, і передчасне переривання подвійної АТТ у пацієнтів після нещодавньої імплантації коронарного стента є найвпливовішим предиктором тромбозу стента.
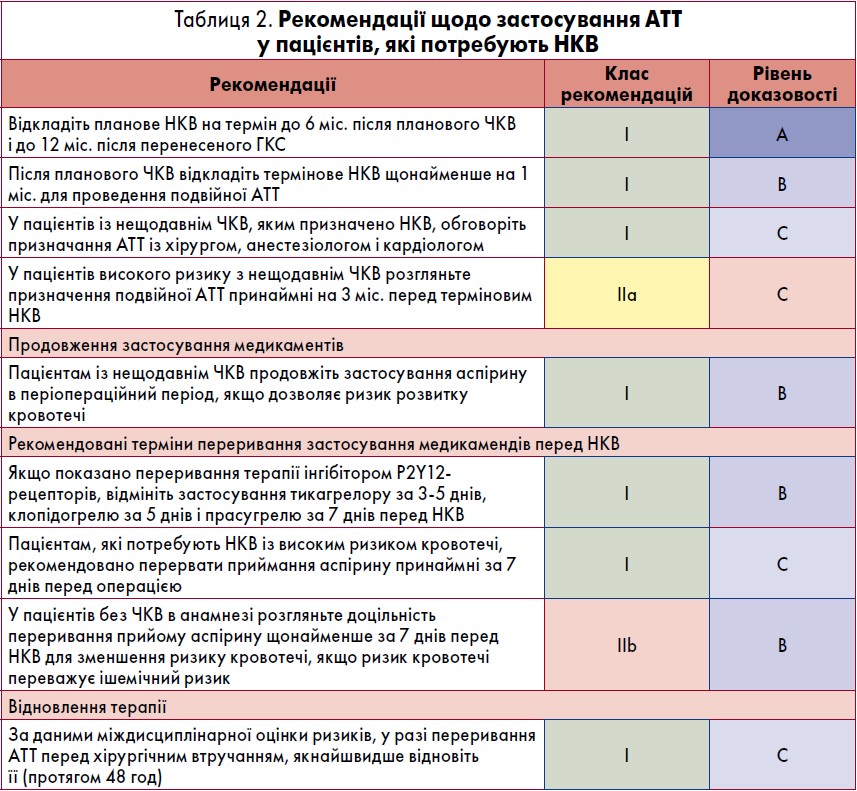
Переважною стратегією ведення пацієнтів, які отримують подвійну АТТ через нещодавній ЧКВ, є відкладення планового НКВ до завершення повного курсу АТТ (6 міс. після планового ЧКВ і 12 міс. після ГКС). Проте кілька досліджень підтвердили, що скорочення тривалості подвійної АТТ до 1‑3 міс. після імплантації сучасного стента з покриттям лікарським засобом асоціюється з прийнятною частотою виникнення важких несприятливих СС-подій і тромбозу стента в пацієнтів із низьким і помірним ризиком.
Зважаючи на ці дані, рекомендовано відкласти термінову НКВ до досягнення тривалості АТТ принаймні 1 міс. У пацієнтів із ССЗ високого ризику, наприклад через ГКС, слід розглянути призначення подвійної АТТ щонайменше упродовж 3 міс. перед терміновим НКВ. Після припинення застосування інгібітора P2Y12-рецепторів слід провести операцію, при цьому пацієнт продовжує приймати аспірин.
Доцільність довгострокового призначення подвійної АТТ (понад рік) за допомогою клопідогрелю, прасугрелю або тикагрелору на додаток до аспірину слід розглянути в пацієнтів із високим ризиком ішемії, а також в осіб із помірним ризиком ішемії, за відсутності підвищеного ризику кровотечі, що загрожуватиме життю.
Рекомендації щодо призначення АТТ пацієнтам, які потребують НКВ, наведено в таблиці 2.
Зменшення антиагрегантного ефекту. Призначення АТТ пацієнтам, які нещодавно перенесли ЧКВ і яким заплановано НКВ, має бути відбуватися за консультації хірурга і кардіолога, щоб підтримати баланс між ризиком розвитку небезпечної для життя хірургічної кровотечі під час приймання АТТ (компетенція хірурга) і ризиком тромбозу стента, що загрожує життю, через передчасне припинення подвійної АТТ (компетенція кардіолога). Підвищений ризик виникнення серйозної несприятливої СС-події як наслідок (значної) кровотечі також треба брати до уваги під час зіставлення ризиків.
Якщо термінову операцію неможливо відкласти, рекомендовано зменшити або скоротити подвійну АТТ. Це може полягати або в переході від сильніших інгібіторів P2Y12-рецепторів прасугрелю чи тикагрелору на клопідогрель, або в припиненні застосування аспірину і використанні прасугрелю чи тикагрелору як засобу монотерапії. Якщо жоден із цих варіантів не є достатнім, можна розглянути доцільність дострокового припинення терапії інгібітором P2Y12-рецепторів. У разі, якщо необхідно припинити АТТ, приймання тикагрелору слід завершити за 3‑5 днів, клопідогрелю – за 5 днів і прасугрелю – за 7 днів до операції.
Якщо це можливо, пацієнтам із показаннями до подвійної АТТ операцію слід проводити без припинення терапії аспірином. Лікування аспірином можна припинити як останній захід лише в разі дуже високого ризику кровотечі та відносно низького ризику ішемії. Однак такі хірургічні процедури рекомендовано проводити в медичних установах, де цілодобово працюють бригади для невідкладного лікування пацієнтів у разі розвитку періопераційних ішемічних явищ.
Пацієнтам, які отримують АТТ і у яких розвинулась сильна або небезпечна для життя періопераційна кровотеча, як стратегію порятунку рекомендовано переливання тромбоцитів. Однак тикагрелор і його активний метаболіт можуть пригнічувати агрегацію і перелитих тромбоцитів також. Експериментальні дані вказують на те, що введення альбуміну зв’язує тикагрелор і зменшує його інгібуючу дію на агрегацію тромбоцитів.
Призначення АТТ в періопераційний період з урахуванням функції тромбоцитів. Дослідження функції тромбоцитів у передопераційний період має кілька теоретичних переваг, серед них: виявлення пацієнтів, які отримують АТТ і мають підвищений ризик розвитку кровотечі, пов’язаної з хірургічним втручанням; визначення індивідуальних термінів планової операції після припинення АТТ; швидке призначення терапії в разі розвитку ускладнень у вигляді кровотеч.
Оральні антикоагулянти
Приблизно кожен четвертий пацієнт, який приймає антикоагулянтну терапію, упродовж 2 років потребуватиме хірургічного або інвазивного втручання. Періопераційне призначення оральних антикоагулянтів (ОАК) залежить від чинників, пов’язаних із хірургічним втручанням (терміновість операції і пов’язаний із процедурою ризик кровотечі), із пацієнтом (вік, індивідуальний тромботичний ризик, анамнез ускладнень у вигляді кровотечі, функція нирок, супутній прийом ліків, супутня патологія тощо), а також конкретного засобу антикоагулянтної терапії.
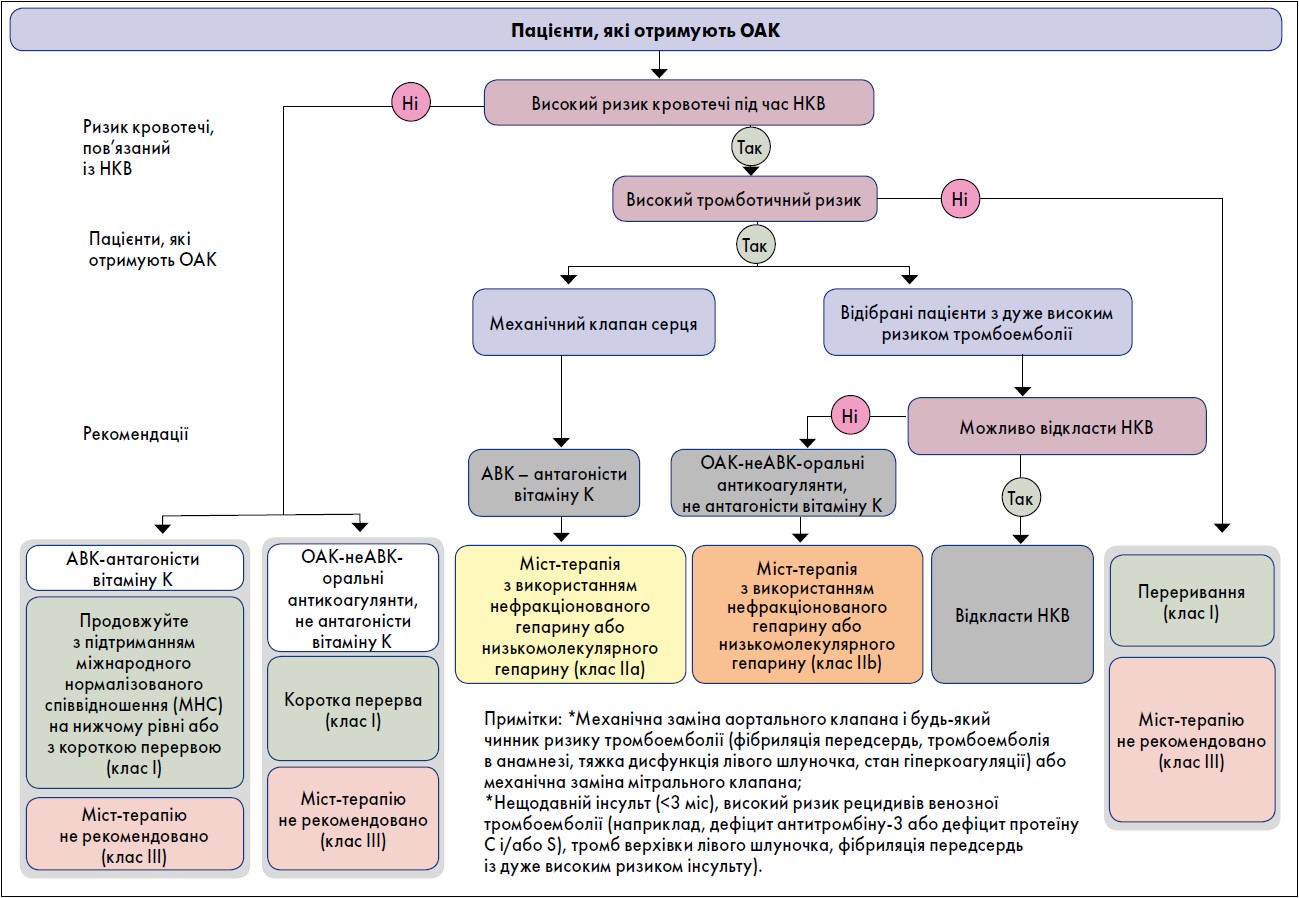
Рекомендації щодо призначення пероральної антикоагулянтної терапії пацієнтам, яким проводять НКВ, наведено на рисунку 3.
Рис. 3. Призначення пероральної антикоагулянтної терапії пацієнтам, яким заплановано НКВ
Із препаратів антагоністів вітаміну К (АВК) зараз використовують варфарин (період напіввиведення 36‑48 год), аценокумарол (період напіввиведення 12 год) і фенпрокумон (період напіввиведення 100 год).
Пацієнтам, які перервали лікування АВК перед операцією, слід відновити його через 12‑24 год після інвазивної процедури, якщо кровотеча добре контрольована і відновлена реабсорбція в шлунку і кишечнику.
На початку терапії слід призначати підтримувальну дозу плюс 50% бустерної дози протягом 2 днів. Пацієнтам, які отримують міст-терапію, слід призначати низькомолекулярний гепарин (НМГ) або нефракціонований гепарин (НФГ) разом із АВК через 24 год після операції, якщо кровотеча добре контрольована та підтримується, доки міжнародне нормалізоване відношення (МНВ) не досягне терапевтичного діапазону. У пацієнтів, яким проводять хірургічне втручання з високим ризиком кровотечі, застосування терапевтичної дози НМГ слід відкласти на 48‑72 год після досягнення гемостазу.
Серед оральних антикоагулянтів не антагоністів вітаміну К (ОАК-неАВК) використовують дабігатран (інгібітор фактора IIa), апіксабан, ривароксабан і едоксабан (інгібітор FXa).
Інвазивні хірургічні втручання можуть потребувати тимчасового припинення терапії ОАК-неАВК, тоді як багато менш інвазивних процедур із відносно низьким ризиком кровотечі можуть виконуватися з мінімальними перервами або безперервною терапією ОАК-неАВК. У разі потреби в терміновому хірургічному втручанні рекомендовано негайно припинити терапію ОАК-неАВК. За загрозливих для життя ситуацій, що потребують негайного втручання, можна розглянути можливість використання андексанету-альфа не за показаннями, пам’ятаючи, що він неспецифічно зв’язує всі інгібітори FXa, що можуть мати важливі наслідки для подальшого лікування, зокрема введення НФГ або НМГ. Якщо специфічні препарати зворотної дії недоступні, слід розглянути застосування концентрату протромбінового комплексу (КПК) або активований КПК, хоча сьогодні бракує доказів щодо ефективності та безпеки їх застосування за невідкладних процедур у пацієнтів, які приймають ОАК-неАВК.
Перед незапланованою операцією рекомендовано провести повну панель аналізів на згортання крові, щоб оцінити стан системи згортання крові пацієнта. Показання до призначення препаратів зворотної дії (і/або неспецифічних гемостатичних агентів) ґрунтуються на клінічній картині пацієнта, але початкова оцінка коагуляційного статусу може мати важливе значення для лікування в наступні кілька годин або днів.
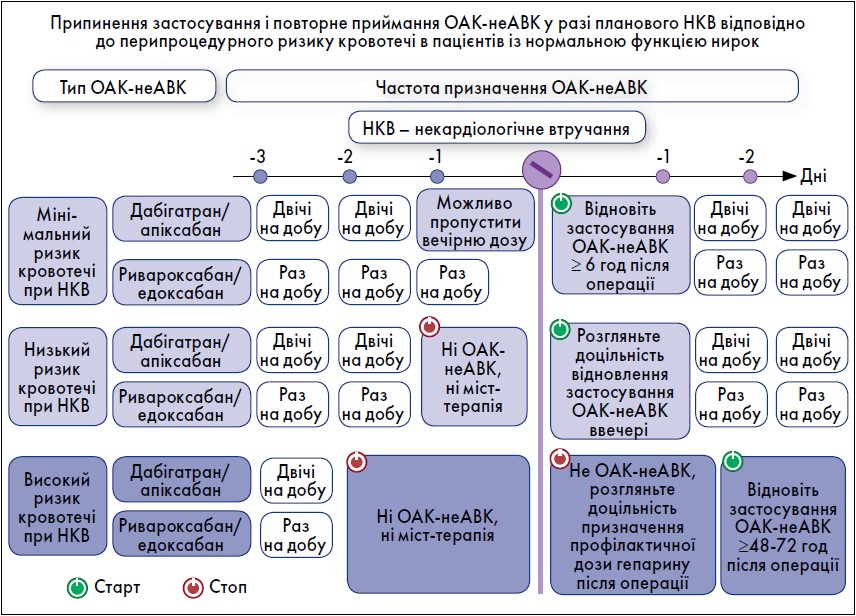
У пацієнтів, які приймали ОАК-неАВК, періопераційна міст-терапія з використанням гепарину або НМГ була пов’язана з підвищеним ризиком кровотечі без зменшення частоти тромбоемболічних подій. Тому, коли для операції необхідне переривання застосування ОАК-неАВК, міст-терапію не рекомендовано, за винятком кількох обставин із високим ризиком тромбоутворення (рис. 4). Відновити приймання ОАК-неАВК можна через 6‑8 год після втручання в разі швидкого і повного відновлення гемостазу. Коли ризик кровотечі у разі поновлення застосування повної дози антикоагулянтів перевищує ризик тромбоемболічних подій, терапію можна відкласти на термін до 48‑72 год після процедури, використовуючи профілактичну післяопераційну тромбопрофілактику, доки відновлення повної дози ОАК-неАВК не визнано безпечним. Післяопераційне введення гепарину також слід розглянути в пацієнтів, які не можуть приймати пероральну терапію. Не рекомендовано використовувати ОАК-неАВК у знижених дозах для зменшення ризику післяопераційної кровотечі, оскільки немає доказів, що підтверджують такий підхід.
Рис. 4. Періопераційне застосування ОАК-неАВГ відповідно до перипроцедурного ризику розвитку кровотечі
Комбінована терапія. Відповідно до рекомендацій ESC (2020) з діагностики і лікування ФП, розроблених у співпраці з Європейською асоціацією кардіоторакальної хірургії (EACTS, 2020), подвійна антитромботична терапія має застосовуватись у більшості пацієнтів із ФП і нещодавнім ЧКВ.
Планове хірургічне втручання слід відкласти до періоду, коли можна буде безпечно припинити АТТ (через 6 міс. після планового ЧКВ або через 12 міс. після ГКС). Щодо періопераційного застосування ОАК-неАВК, слід дотримуватися наведених вище рекомендацій.
Періопераційна тромбопрофілактика
Ретельне передопераційне оцінювання є важливою етапом для виявлення пацієнтів із підвищеним ризиком розвитку венозної тромбоемболії (ВТЕ), яким може бути корисна періопераційна тромбопрофілактика. Пацієнти із ССЗ (наприклад, із нещодавнім ІМ або СН) мають підвищений ризик розвитку періопераційної ВТЕ. Для стратифікації цього ризику в різних хірургічних умовах була розроблена і підтверджена шкала Капріні.
Можливість проведення тромбопрофілактики слід розглянути в пацієнтів із помірною (5‑8 балів) і високою (тобто ≥9 балів) оцінкою. Тромбопрофілактику слід розпочинати під час перебування в лікарні за 12 год до запланованого НКВ і продовжувати після операції на підставі індивідуальної оцінки ризику кровотечі. Здебільшого тромбопрофілактику слід продовжувати до повної мобілізації пацієнта або до виписки з лікарні (зазвичай до 10 днів). Розширену фармакологічну профілактику ВТЕ після виписки зазвичай не рекомендовано більшості неортопедичних хірургічних пацієнтів.
Хірургічне втручання може погіршувати перебіг захворювання і призводити до збільшення захворюваності й смертності в пацієнтів зі встановленим ССЗ. Цьому можна запобігти через впровадження перед НКВ відповідної стратифікації СС-ризику та індивідуального підбору передопераційної терапії для його зниження.
Якщо є час, також перед НКВ рекомендовано оптимізувати лікування захворювання відповідно до спеціальних рекомендацій.
Ключові повідомлення
Серед ключових повідомлень:
- Виникнення СС-ускладнень у передопераційний період НКВ погіршує прогноз.
- Ризик СС-ускладнень у пацієнтів, які перенесли НКВ, визначається чинниками, пов’язаними з пацієнтом, типом хірургічного втручання чи процедури й обставинами, за яких проводиться операція.
- Специфічні чинники ризику, пов’язані з пацієнтом, можна зменшити завдяки адекватному передопераційному оцінюванню ризику і запровадження ефективних стратегій його зниження.
- Кількісне визначення хірургічного ризику як низького, середнього і високого допомагає визначити групу пацієнтів, які матимуть найбільший ефект завдяки профілактичним, діагностичним і терапевтичним підходам до супутніх ССЗ.
- Правильний вибір типу і часу хірургічного втручання може знизити ризик розвитку ускладнень.
- Важливо зважати на прагнення пацієнтів, якість життя і зважувати переваги і ризики хірургічного втручання. Добре поінформовані пацієнти можуть брати участь у прийнятті остаточного рішення.
- Клінічне обстеження, оцінювання функціональної здатності та неінвазивні тести є основою передопераційного оцінювання роботи серця.
- Інструментальні й функціональні засоби обстеження серця слід обирати, зважаючи на хірургічний ризик, відносну діагностичну цінність, а також використання ресурсів охорони здоров’я та витрати.
- Передопераційне обстеження літніх пацієнтів, які потребують планового великого НКВ, має охоплювати оцінку слабкості, яка виявилася точним предиктором несприятливих наслідків для здоров’я в літній хірургічній популяції.
- Лікування наявних або нещодавно діагностованих ССЗ (наприклад, захворювань коронарних і периферичних судин, порушень ритму і СН) має бути індивідуальним відповідно до передопераційного ризику і з урахуванням спеціальних рекомендацій.
- Мультидисциплінарний підхід для оцінки того чи іншого лікування ССЗ перед запланованим НКВ покращує передопераційну безпеку.
- Ефективна передопераційна антитромботична терапія в пацієнтів, яким призначено НКВ, має на меті запропонувати потенційну користь для запобігання тромботичним подіям без підвищення ризику розвитку ускладнень у вигляді кровотечі.
- Важливо чітко й лаконічно повідомляти пацієнтам в усній і письмовій формі про зміни в лікуванні на до- і післяопераційному етапах.
- Лікування в передопераційний період НКВ має уникнути гемодинамічного дисбалансу, одночасно забезпечуючи достатню кардіопротекторну дію.
- Постачальникам медичних послуг слід бути добре обізнаними щодо періопераційних СС-ускладнень і нагляду за періопераційним ІМ, у пацієнтів високого ризику, які потребують НКВ із середнім або високим ризиком.
- Рутинне оцінювання якості лікування за допомогою встановлених показників є важливою для документування і визначення успіху профілактичних і терапевтичних стратегій у пацієнтів, які потребують НКВ.
Підготувала Ольга Загора
Оригінальний текст документа читайте на сайті www.escardio.org/Guidelines