21 лютого, 2021
Лікування пацієнтів із гострим коронарним синдромом без стійкого підйому сегмента ST
Частка пацієнтів з інфарктом міокарда без елевації сегмента ST (NSTEMI) серед усіх осіб з інфарктом міокарда (ІМ) останніми роками значно зросла. Переважно це пояснюється появою більш точної діагностики NSTEMI. Суттєвих змін у вихідних характеристиках щодо віку та куріння в популяції NSTEMI не спостерігається, тоді як частота розвитку цукрового діабету, артеріальної гіпертензії (АГ) та ожиріння підвищилася порівняно із хворими на ІМ з підйомом сегмента ST. За період 1995‑2015 рр. застосування ранньої ангіографії та черезшкірного коронарного втручання (ЧКВ) протягом перших годин після госпіталізації збільшилося з 9 до 60% та з 12,5 до 67% відповідно. Основними клінічними наслідками цих змін є зменшення 6-місячної смертності з 17,2 до 6,3%. Робоча група з лікування гострого коронарного синдрому в пацієнтів без стійкого підйому сегмента ST Європейського товариства кардіологів (ESC) розробила настанову, в якій узагальнено та оцінено наявні дані з метою впровадження найкращих стратегій терапії для кожного окремого хворого. Пропонуємо до вашої уваги стислий огляд рекомендацій щодо лікування осіб із гострим коронарним синдромом (ГКС) без стійкого підйому сегмента ST.
Спектр клінічних проявів ГКС широкий – від зупинки серця, електричної або гемодинамічної нестабільності з кардіогенним шоком (КШ) внаслідок тривалої ішемії міокарда або механічних ускладнень, таких як тяжка мітральна регургітація, до відсутності у пацієнтів навіть больового синдрому на момент поступлення до лікувального закладу. Провідним симптомом, що ініціює діагностичний та терапевтичний каскад у пацієнтів із підозрою на ГКС, є гострий дискомфорт у грудній клітці, що описується як біль, тиск, скутість і печіння. Симптоми, еквівалентні болю у грудях, можуть включати задишку, біль в епігастрії та лівій руці.
На основі даних електрокардіограми (ЕКГ) слід диференціювати дві групи пацієнтів:
- Пацієнти з гострим болем у грудях та постійним (>20 хв) підняттям сегмента ST. Цей стан має назву ГКС із підйомом сегмента ST і зазвичай відображає гостру загальну або проміжну коронарну оклюзію. В більшості хворих у кінцевому підсумку розвивається інфаркт міокарда з підйомом сегмента ST (STEMI). Основою лікування у таких пацієнтів є негайна реперфузія шляхом первинного ЧКВ або, якщо немає можливості провести його вчасно, – фібринолітична терапія.
- У пацієнтів із гострим дискомфортом у грудній клітці, але за відсутності стійкого підйому сегмента ST спостерігаються зміни на ЕКГ, які можуть включати тимчасове підняття сегмента ST, стійку або минущу депресію сегмента ST, інверсію зубця Т, плоский зубець Т чи псевдонормалізацію зубця Т, або ж ЕКГ може бути нормальною.
Патогенетичним корелятом на рівні міокарда є некроз кардіоміоцитів (NSTEMI) або, рідше, ішемія міокарда без пошкодження клітин (нестабільна стенокардія). У незначної частки пацієнтів може спостерігатися ішемія міокарда, що характеризується одним або кількома з наступного:
- періодичний або постійний біль у грудях;
- виразна депресія сегмента ST на ЕКГ у 12 відведеннях;
- серцева недостатність (СН) та гемодинамічна або електрична нестабільність.
Через ризик розвитку КШ та/або злоякісних шлуночкових аритмій вказано на необхідність проведення негайної коронарної ангіографії та, за потреби, реваскуляризації.
Універсальне визначення інфаркту міокарда
Гострий інфаркт міокарда (ГІМ) визначається як некроз кардіоміоцитів, що у клінічних умовах відповідає гострій ішемії міокарда, а саме виявленню збільшення та/або зменшення серцевого біомаркера, переважно серцевого тропоніну високої чутливості (hs-cTn) T або I, принаймні з одним значенням вище 99-го процентиля від верхньої контрольної межі та щонайменше з одним із наступного:
- симптоми ішемії міокарда;
- нові ішемічні зміни на ЕКГ;
- розвиток патологічних зубців Q на ЕКГ;
- візуалізація доказів втрати життєздатного міокарда або нової аномалії руху регіонарної стінки за схемою, що відповідає ішемічній етіології;
- внутрішньокоронарний тромб, виявлений під час ангіографії чи розтину.
ІМ 1-го типу
Даний тип ІМ характеризується розривом атеросклеротичної бляшки, виразками або ерозією з утворенням тромбу в одній чи декількох коронарних артеріях. Це призводить до зменшення кровотоку міокарда і/або дистальної емболізації та подальшого його некрозу. У пацієнтів може бути наявна основна тяжка ішемічна хвороба серця (ІХС), іноді (5‑10% випадків) – необструктивний коронарний атеросклероз, або ж ангіографічні дані щодо ІХС відсутні, особливо у жінок.
ІМ 2-го типу
ІМ 2-го типу – некроз міокарда, що за відсутності нестабільності коронарних бляшок спричиняє дисбаланс між постачанням та потребою міокарда в кисні. Наявні механізми включають гіпотонію, АГ, тахі-/брадиаритмії, анемію, гіпоксемію, спазм коронарних артерій, їхнє спонтанне розшарування (SCAD), коронарну емболію та дисфункцію коронарних мікросудин.
ІМ 3‑5-го типу
ІМ 3-го типу призводить до смерті, коли біомаркери недоступні, а ІМ 4-го і 5-го типів пов’язаний із ЧКВ та аортокоронарним шунтуванням (АКШ) відповідно.
Ведення пацієнтів із підозрою на ГКС без елевації сегмента ST
Діагностика та стратифікація ризику
Діагноз та початкову короткотермінову стратифікацію ризику рекомендовано встановлювати на основі клінічного анамнезу, симптомів, життєво важливих показників, інших фізичних даних, ЕКГ та лабораторних результатів, включно із hs-cTn (І, В). Вимірювати серцевий тропонін слід за допомогою високочутливих аналізів відразу після поступлення пацієнта до лікувального закладу та отримувати результати протягом 60 хв від забору крові (І, В). Також необхідно провести реєстрацію ЕКГ у 12 відведеннях протягом 10 хв після першого звернення хворого та негайно інтерпретувати результати у досвідченого лікаря (І, В). Рекомендовано виконати додаткову ЕКГ у 12 відведеннях у разі повторних симптомів або діагностичної невизначеності (І, С).
Доцільно застосувати спеціальний алгоритм ESC 0 год / 1 год, що передбачає забір крові одразу після звернення та через 1 год, включно із тестом на hs-cTn, якщо такий доступний (І, B). Далі потрібно провести додаткове тестування через 3 год, якщо перші два вимірювання серцевого тропоніну згідно із зазначеним алгоритмом не є остаточними, а клінічний стан все ще свідчить про наявність ГКС (I, B). Як альтернатива алгоритму ESC 0 год / 1 год рекомендовано діяти за алгоритмом ESC 0 год / 2 год із забором крові негайно після звернення та через 2 год з виконанням тесту на hs-cTn за його доступності (I, B).
У разі підозри на наявність ішемії, що триває, слід провести ЕКГ у додаткових відведеннях (V3R, V4R, V7 V9), якщо стандартні не дозволяють достовірно встановити діагноз (I, C).
Для досягнення початкових діагностичних цілей не рекомендовано регулярно вимірювати додаткові біомаркери, такі як серцевий білок, що зв’язує жирні кислоти (h-FABP), або копептин (III, В).
Візуалізація
Пацієнтам із зупинкою серця або гемодинамічною нестабільністю передбачуваного серцево-судинного походження рекомендовано проводити ехокардіографію (ЕхоКГ) кваліфікованим лікарем негайно після ЕКГ у 12 відведеннях (I, C). В осіб без рецидивів болю у грудях, за нормальних показників ЕКГ та рівня серцевого тропоніну (бажано високої чутливості), але із підозрою на ГКС доцільно провести неінвазивний стрес-тест (краще з візуалізацією) на індуцибельну ішемію або коронарну комп’ютерно-томографічну ангіографію (ККТА), перш ніж приймати рішення щодо застосування інвазивних методів лікування (I, B)
ЕхоКГ необхідна для оцінки регіональної та глобальної функції лівого шлуночка (ЛШ) та з метою диференційної діагностики (I, C). ККТА рекомендовано як альтернативу інвазивній коронарній ангіографії для виключення ГКС за низької/середньої імовірності розвитку ІХС, а також коли рівень серцевого тропоніну та/або ЕКГ нормальний або невизначений (I, A).
Моніторинг ритму
Рекомендований постійний моніторинг ритму до встановлення або виключення діагнозу NSTEMI в умовах спостережного (моніторингового) відділення (I, C). Моніторинг ритму до 24 год або перед ЧКВ слід проводити у пацієнтів із NSTEMI з низьким ризиком серцевих аритмій (I, C). Моніторинг ритму >24 год виконують в осіб із NSTEMI за підвищеного ризику серцевих аритмій (I, C).
Вимірювання біомаркерів для прогностичної стратифікації
Після встановлення діагнозу слід продовжувати послідовне вимірювання біомаркера hs-cTn для оцінки прогнозу (I, B). Визначення рівня додаткових біомаркерів, таких як натрійуретичний пептид, високочутливий С-реактивний білок, середньорегіонарний проадреномедулін, фактор росту і диференціації‑15, копептин та h-FABP, не рекомендоване для рутинної оцінки ризику чи прогнозу (III, В).
Лікування пацієнтів із ГКС без елевації сегмента ST, які перенесли ЧКВ
Антитромботична терапія
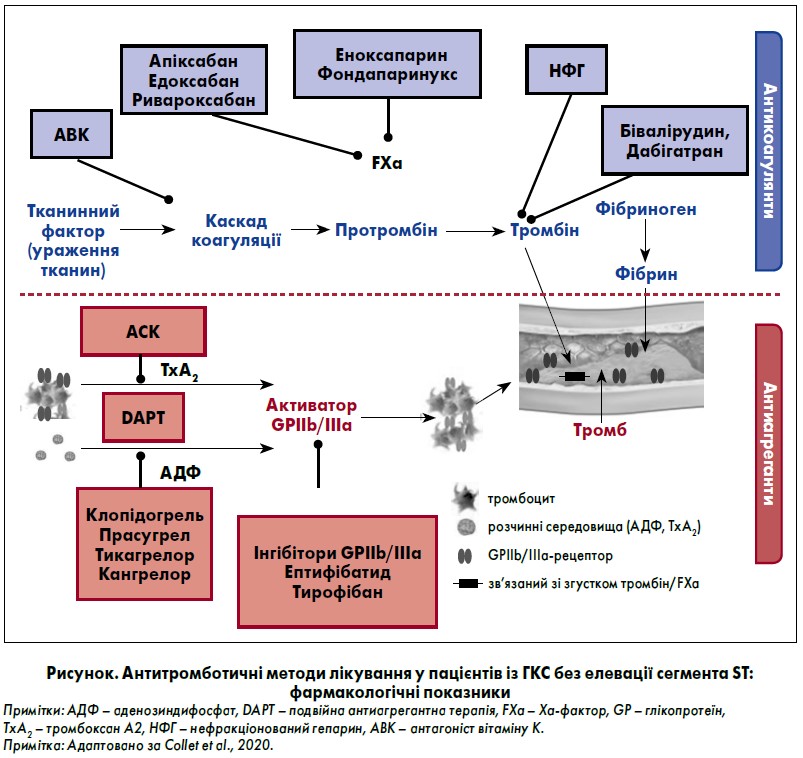
Активація тромбоцитів і каскад згортання крові відіграють ключову роль у початковій фазі та еволюції ГКС без елевації сегмента ST. Отже, достатнє інгібування тромбоцитів та (тимчасова) антикоагуляція є важливими для таких пацієнтів, особливо тих, хто переніс реваскуляризацію міокарда за допомогою ЧКВ. Ацетилсаліцилова кислота (АСК) вважається наріжним каменем інгібування генерації тромбоксану А2 (рисунок). Застосування АСК починають із навантажувальної дози (НД) 150‑300 мг із подальшою підтримувальною терапією у лікувальній дозі (ЛД) 75‑100 мг/добу. Отже, приймання АСК рекомендоване всім пацієнтам без протипоказань для тривалого лікування (I, A).
На додаток до АСК доцільно застосовувати інгібітор рецептора P2Y12 протягом 12 місяців, якщо немає протипоказань або надмірного ризику розвитку кровотечі (I, A).
Терапевтичні варіанти:
- прасугрел у пацієнтів, які не отримували інгібітори рецепторів P2Y12, переходили до ЧКВ: НД – 60 мг, ЛД – 10 мг/добу, для осіб віком ≥75 років або з масою тіла <60 кг – 5 мг/добу (I, B);
- тікагрелор незалежно від запланованої стратегії лікування – інвазивної або консервативної: НД – 180 мг, надалі по 90 мг два рази на добу (I, B);
- клопідогрель (НД – 300‑600 мг, надалі по 75 мг/добу), лише коли прасугрел або тікагрелор недоступні, погано переносяться або протипоказані (I, C).
Терапію антагоністами GP IIb/IIIa в пацієнтів, у яких коронарна анатомія невідома, не рекомендовано (III, А). Також не слід проводити рутинне попереднє лікування інгібітором рецептора P2Y12 пацієнтам, у котрих анатомія коронарних судин невідома, а також заплановане раннє інвазивне втручання (III, А).
Периопераційне антикоагулянтне лікування
Парентеральна антикоагуляція рекомендована усім пацієнтам на додаток до антиагрегантного лікування під час діагностики та, особливо, процедур реваскуляризації відповідно до співвідношення ризику ішемії/кровотечі (I, A).
Пацієнтам після перенесеного ЧКВ, необхідно призначати нефракціонований гепарин (НФГ): з урахуванням ваги внутрішньовенно болюсно під час ЧКВ – 70‑100 МО/кг або ж у поєднанні з інгібітором GP IIb/IIIa – 50‑70 МО/кг; при використанні інгібітора GP IIb/IIIa цільовий діапазон активованого часу згортання становить 250‑350 чи 200‑250 с (I, A). У випадках медикаментозного лікування або матеріально-технічних обмежень для переведення хворого на ЧКВ протягом визначеного періоду часу рекомендований фондапаринукс. За таких умов під час ЧКВ варто застосовувати одноразове болюсне введення НФГ (I, B)
Антикоагулянт необхідно підбирати відповідно до ішемічного ризику та ймовірності кровотечі, а також профілю ефективності/безпеки обраного препарату (I, C). Одночасне застосування НФГ та низькомолекулярного гепарину не рекомендоване (III, В).
Постінтервенційне та підтримувальне лікування
У пацієнтів із ГКС без елевації сегмента ST, яким проведено імплантацію коронарного стенту, слід застосовувати подвійну антиагрегантну терапію (DAPT) з інгібітором рецептора P2Y12 на додаток до АСК протягом 12 місяців. При цьому мають бути відсутні протипоказання, як-от надмірний ризик кровотечі (I, A).
Застосування антиішемічних препаратів у гострій фазі ГКС без елевації сегмента ST
Сублінгвальне або внутрішньовенне призначення нітратів та ранній початок лікування β-блокаторами доцільно застосовувати в осіб із постійними ішемічними симптомами та без протипоказань (I, C). Продовжувати терапію β-блокаторами рекомендовано, якщо у хворого відсутня СН (I, C). Внутрішньовенно нітрати призначають пацієнтам із неконтрольованою АГ або ознаками СН (I, C).
Комбінування антитромбоцитарних та антикоагулянтних засобів в осіб із ГКС без елевації сегмента ST за тривалої пероральної антикоагуляції
Профілактику інсульту слід проводити у хворих на фібриляцію передсердь (ФП) із ≥1 нестатевим фактором ризику інсульту за шкалою CHA2DS2-VASc (≥1 у чоловіків або ≥2 у жінок). Для пацієнтів із ≥2 чинниками ризику інсульту, що не є статевими, рекомендовані оральні антикоагулянти (ОАК) (I, A).
Ведення пацієнтів при виконанні коронарного стентування
Антикоагуляція
Під час ЧКВ рекомендована додаткова парентеральна антикоагуляція, незалежно від часу приймання останньої дози всіх вітамін К-незалежних преоральних антикоагулянтів (НОАК). При цьому міжнародне нормалізоване відношення становить <2,5 у пацієнтів, які отримували препарати групи антагоністів вітаміну К (АВК) (I, C).
Антитромбоцитарне лікування
В осіб із ФП та показниками за шкалою CHA2DS2-VASc ≥1 у чоловіків та ≥2 у жінок після короткого періоду потрійної антитромботичної терапії (до одного тижня від гострої події) слід проводити подвійне антитромботичне лікування як стратегію за замовчуванням. При цьому застосовують НОАК у рекомендованій дозі для профілактики інсульту й антитромбоцитарний засіб перорально (переважно клопідогрель) (I, A).
Доцільним є перипроцедурне (терміном до одного тижня) призначення подвійної антиагрегантної терапії, що складається з АСК та клопідогрелю (I, A). Через 12 місяців необхідно припинити антитромбоцитарне лікування у пацієнтів, які отримують ОАК (I, B).
Застосування тікагрелору або прасугрелу в складі потрійної антитромботичної терапії не рекомендоване (III, С).
Ведення хворих при виконанні коронарної реваскуляризації
Терміни застосування інвазивної стратегії
Негайне інвазивне втручання (<2 год) рекомендоване пацієнтам принаймні з одним із наступних критеріїв дуже високого ризику (I, C):
- гемодинамічна нестабільність або КШ;
- повторний чи рефрактерний біль у грудях незважаючи на медикаментозне лікування;
- аритмії, що загрожують життю;
- механічні ускладнення ІМ;
- СН, чітко пов’язана із ГКС без елевації сегмента ST;
- наявність депресії сегмента ST >1 мм у ≥6 відведеннях із підвищенням рівня сегмента ST у відведеннях aVR та/або V1.
Раннє інвазивне втручання протягом 24 год після події рекомендоване пацієнтам з будь-яким із наступних критеріїв високого ризику (I, A):
- діагностований NSTEMI;
- динамічні або нові суміжні зміни сегмента ST / зубця T, які свідчать про ішемію, що триває;
- перехідна висота сегмента ST;
- оцінка ризику за шкалою GRACE >140.
Вибіркова інвазивна стратегія після відповідного тестування на ішемію або виявлення обструктивної ІХС за допомогою ККTA рекомендовані хворим із низьким ризиком (I, A).
Технічні аспекти
Радіальний доступ використовують як стандартний підхід, за винятком випадків, коли є інші важливіші процедурні міркування (I, A). Стенти, що виділяють ліки, застосовувати доцільніше порівняно із металевими стентами для будь-якого ЧКВ, незалежно від клінічної картини, типу ураження, наявності планових некардіальних хірургічних втручань, передбачуваної тривалості DAPT, супутньої антикоагулянтної терапії (I, A).
Вибір стратегії реваскуляризації (ЧКВ ad hoc, багатосудинне ЧКВ/АКШ) слід базувати на клінічному статусі та супутніх захворюваннях пацієнта, а також тяжкості патології (тобто розподіл та характеристики ангіографічного ураження, як-то оцінка SYNTAX), відповідно до принципів стабільної ІХС. Однак рішення про негайну ЧКВ стенозу ураженої артерії не потребує консультації кардіологічної команди (I, B).
Ведення різних категорій пацієнтів із ГКС без підйому сегмента ST
Хворі на ІМ з необструктивними коронарними артеріями
В усіх пацієнтів із початковим робочим діагнозом ІМ та необструктивними коронарними артеріями (MINOCA) слід провести диференційну діагностику між істинним MINOCA та альтернативними діагнозами (I, C). Також у всіх осіб із MINOCA без очевидної основної причини необхідно виконати кардіо-магнітний резонанс (I, B). Пацієнтам із початковим діагнозом MINOCA та остаточно встановленою основною причиною доцільно призначити терапію відповідно до специфічних рекомендацій щодо захворювання (I, C).
Пацієнти із ГКС без підйому сегмента ST та СН або КШ
Необхідна екстрена коронарна ангіографія в осіб із ГКС, ускладненим КШ (I, B). Екстрена ЧКВ ураженої судини рекомендована пацієнтам із КШ внаслідок ГКС без елевації ST, незалежно від часу, що минув з початку виникнення симптомів, якщо коронарна анатомія піддається ЧКВ (I, B).
Екстрене АКШ доцільно проводити пацієнтам із КШ, якщо коронарна анатомія не піддається ЧКВ (I, B). Необхідно негайно виконати ЕхоКГ, щоб оцінити стан ЛШ та клапанну функцію і виключити механічні ускладнення (I, C). У випадках гемодинамічної нестабільності рекомендоване екстрене хірургічне або катетерне відновлення механічних ускладнень ГКС за рішенням кардіологічної команди (I, C).
Постійне застосування внутрішньо-аортального балонного насоса (внутрішньоаортальної контрапульсації) пацієнтам із КШ та відсутністю механічних ускладнень через ГКС не рекомендоване (III, В). Також не слід проводити рутинну негайну реваскуляризацію неуражених судин у хворих на ГКС без елевації сегмента ST із полісудинною ІХС (III, В).
Хворі на цукровий діабет із ГКС без елевації сегмента ST
У хворих на цукровий діабет із ГКС без елевації сегмента ST необхідний частий контроль рівня глюкози у крові (I, C). Також слід уникати розвитку гіпоглікемії (I, B).
Пацієнти із хронічною хворобою нирок та ГКС без елевації сегмента ST
Рекомендовано застосовувати ті самі діагностичні та терапевтичні стратегії для пацієнтів із хронічною хворобою нирок (ХХН), як для хворих із нормальною функцією нирок; може знадобитися коригування дози (I, C).
В усіх пацієнтів слід оцінювати функцію нирок за допомогою eGFR (I, C). В межах інвазивних стратегій рекомендовано використовувати низько- або ізоосмолярні контрастні речовини (у мінімально можливому обсязі) (I, A).
Популяція похилого віку із ГКС без елевації сегмента ST
Рекомендовано застосовувати ті самі діагностичні та інтервенційні стратегії у пацієнтів похилого віку, що й в інших вікових групах (I, B). Вибір антитромботичного засобу та дозування, а також вторинні методи профілактики повинні бути адаптовані до функції нирок та конкретних протипоказань (I, B).
Модифікація способу життя у пацієнтів після ГКС без елевації сегмента ST
Модифікація способу життя на додаток до відповідної фармакологічної стратегії необхідна для зменшення летальних випадків від усіх причин, серцево-судинної захворюваності/смертності та покращення якості життя пацієнтів, пов’язаної зі здоров’ям (I, A). Когнітивні поведінкові втручання рекомендовані, щоб допомогти хворим досягти здорового способу життя (I, A).
Багатопрофільна кардіологічна реабілітація на основі фізичних вправ рекомендована як ефективний підхід у хворих на ІХС для управління факторами ризику (I, A). Вітається залучення мультидисциплінарних медичних працівників (кардіологів, лікарів загальної практики, медсестер, дієтологів, фізіотерапевтів, психологів, фармацевтів) для зменшення загальної й серцево-судинної захворюваності та смертності, а також покращення якості життя пацієнтів, пов’язаної зі здоров’ям (I, A). Психологічні втручання є доцільними для усунення симптомів депресії в осіб з ІХС (I, B).
Щорічна вакцинація проти грипу рекомендована пацієнтам з ІХС, особливо особам похилого віку, з метою зниження захворюваності (I, B).
Довгострокова фармакотерапія після ГКС без елевації сегмента ST
Варіанти довгострокової медикаментозної терапії у пацієнтів після ГКС без елевації сегмента ST (за винятком антитромботичних методів лікування) наведені нижче.
Гіполіпідемічні засоби
Статини рекомендовані всім пацієнтам із ГКС без елевації сегмента ST. Метою є зниження рівня ліпопротеїнів низької щільності (ЛПНЩ) на >50% від вихідного рівня та/або досягнення рівня ЛПНЩ <1,4 ммоль/л (<55 мг/дл) (I, A).
Якщо цільових рівнів ЛПНЩ не досягнуто через 4‑6 тижнів при максимально переносимій дозі статину, необхідно призначити його комбінацію з езетимібом (I, B). Якщо цільових рівнів ЛПНЩ через 4‑6 тижнів також не досягнуто, незважаючи на терапію статинами та езетимібом у максимально переносимих дозах, слід додати інгібітор PCSK9 (I, B).
Інгібітори ангіотензинперетворювального ферменту або блокатори рецепторів ангіотензину ІІ
Інгібітори ангіотензинперетворювального ферменту (іАПФ) або блокатори рецепторів ангіотензину ІІ (БРА) за непереносимості іАПФ рекомендовані пацієнтам із СН зі зниженою фракцією викиду (ФВ) ЛШ (<40%), цукровим діабетом або ХХН, якщо це не протипоказано (наприклад, у разі тяжких порушень функції нирок, гіперкаліємії тощо), з метою зменшення загальної та серцево-судинної захворюваності/смертності (I, A).
Бета-блокатори, антагоністи мінералокортикоїдних рецепторів та інгібітори протонної помпи
Бета-блокатори призначають пацієнтам із систолічною дисфункцією ЛШ або СН зі зниженою ФВ ЛШ (<40%) (I, A).
Антагоністи мінералокортикоїдних рецепторів рекомендовані особам із СН зі зниженою ФВ ЛШ (<40%), щоб зменшити летальні випадки від усіх причин, а також серцево-судинну захворюваність і смертність (I, A).
Одночасне застосування інгібітора протонної помпи рекомендоване пацієнтам, які отримують монотерапію АСК, DAPT, подвійну, потрійну антитромботичну терапію або оральні антикоагулянти та мають високий ризик шлунково-кишкових кровотеч, із метою зниження ризику їхнього виникнення (I, A).
Підготувала Наталія Нечипорук
Оригінальний текст документа, включно зі списком літератури, читайте на сайті
www.escardio.org
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (73) 2020 р.