15 листопада, 2020
Модифікація кардіоваскулярних факторів ризику у світлі новітніх тенденцій
За матеріалами XXI Національного конгресу кардіологів України, 22-25 вересня
Серцево-судинні захворювання (ССЗ) залишаються значним тягарем охорони здоров’я як у світі, так і в Україні. Модифікація кардіоваскулярних факторів ризику (ФР) є оптимальним шляхом запобігання розвитку серцево-судинної патології та смертності. Найпоширенішими кардіоваскулярними ускладненнями є артеріальна гіпертензія (АГ) та дисліпідемії. Незважаючи на досягнення сучасної фармакології, проблеми щодо зменшення ФР ССЗ залишаються, особливо в групах пацієнтів із тяжкою супутньою патологією, резистентною АГ (РАГ) тощо. Водночас після оприлюднення нових європейських рекомендацій із менеджменту хворих на дисліпідемії досягнення цільових рівнів холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) стало неабияким викликом для лікарів-практиків.
 Завідувачка кафедри пропедевтики внутрішньої медицини ДЗ «Дніпропетровська медична академія МОЗ України», доктор медичних наук, професор Тетяна Володимирівна Колесник присвятила доповідь тактиці ведення АГ у жінок із раком молочної залози (РМЗ).
Завідувачка кафедри пропедевтики внутрішньої медицини ДЗ «Дніпропетровська медична академія МОЗ України», доктор медичних наук, професор Тетяна Володимирівна Колесник присвятила доповідь тактиці ведення АГ у жінок із раком молочної залози (РМЗ).
За даними Всесвітньої організації охорони здоров’я (2018), найпоширенішою онкологічною патологією у світі є РМЗ. Україна, на жаль, не є винятком: якщо за частотою захворюваності на 100 тис. населення вітчизняна статистика є дещо нижчою за світову, то за рівнем смертності ми несемо пальму першості. Відзначається невтішна тенденція: за останні 50 років рівень захворюваності на цю недугу в нашій країні зріс у 4 рази. Звісно, РМЗ насамперед уражає жінок, і серед цієї популяції онкологічних хворих його частка у структурі захворюваності на рак становить 29,7%. Для порівняння: частка раку шийки матки – 2,3%. Відповідно до статистичних даних Національного канцер-реєстру Національного інституту раку щороку реєструється 14,5 тис. нових випадків РМЗ, серед яких 40% діагностується в жінок працездатного віку. Більш як 5 тис. пацієнток щорічно помирають від РМЗ.
АГ є найпоширенішим коморбідним станом у онкохворих (38%) і напряму впливає на прогноз (Jain M., Townsend R., 2007).
 Одним із напрямів для визначення прогнозу виживаності онкохворих в аспекті серцево-судинної патології вважається оцінка 10-річного ризику летальних кардіоваскулярних подій за шкалою SCORE (Systematic COronary Risk Evaluation). Закономірно: що менше ФР, то кращий прогноз у хворого (Caro Codon J. et al., 2020) (рис. 1). Задача лікаря вже на первинному етапі діагностики – визначити та врахувати всі ФР, оскільки це напряму корелює з обсягом терапевтичного втручання.
Одним із напрямів для визначення прогнозу виживаності онкохворих в аспекті серцево-судинної патології вважається оцінка 10-річного ризику летальних кардіоваскулярних подій за шкалою SCORE (Systematic COronary Risk Evaluation). Закономірно: що менше ФР, то кращий прогноз у хворого (Caro Codon J. et al., 2020) (рис. 1). Задача лікаря вже на первинному етапі діагностики – визначити та врахувати всі ФР, оскільки це напряму корелює з обсягом терапевтичного втручання.
Основними кардіоваскулярними ФР, які впливають на прогноз онкологічних пацієнтів з АГ, є: неконтрольоване підвищення артеріального тиску (АТ); гіпертрофія лівого шлуночка (ЛШ); наявність ССЗ; хронічна хвороба нирок (ХХН) ≥III стадії; цукровий діабет; встановлення ≥3 серцево-судинних ФР; обструктивне апное сну; ожиріння; вік ≥60-65 років; недостатньо контрольована ішемічна хвороба серця, серцева недостатність, аритмія; подовження інтервалу QT; деякі види протипухлинної терапії (ППТ), зокрема інгібітори фактора росту ендотелію судин (іVEGF), mTOR-інгібітори (інгібітори мішені рапаміцину ссавців), понатиніб, цисплатин та ін.
Професор звернула увагу слухачів на взаємозв’язок кількості ФР і функції ЛШ у пацієнток після хіміотерапії. Так, ≥4 ФР можуть істотно вплинути на погіршення функції ЛШ, тоді як за наявності ≤2 ФР така залежність майже відсутня (Yamashita K. et al., 2020).
Співвідношення успіх/ризик лікування значною мірою залежить від ефективного контролю ФР, їх модифікації, термінів ініціації терапії й обсягу фармацевтичного втручання.
Варто зважати на те, що АГ має тісний патогенетичний зв’язок із захворюваннями нирок. Тому до алгоритму рутинного обстеження необхідно включити визначення швидкості клубочкової фільтрації, рівня альбумінурії/мікроальбумінурії.
У 2016 р. вийшли європейські рекомендації з профілактики ССЗ у клінічній практиці, в яких окремий розділ було присвячено запобіганню серцево-судинним ускладненням у хворих з АГ та онкологічною патологією. Як основна мета декларується зниження короткотермінових ризиків розвитку захворювань, пов’язаних з АГ, при збереженні ефективної антиангіогенної терапії для оптимального лікування раку.
Для досягнення цієї мети пропонуються такі кроки: виявити АГ і підтримувати систолічний АТ (САТ) <140 мм рт. ст. або нижче за вираженої протеїнурії; проводити оцінку серцево-судинних ФР до та під час проведення ППТ; за підозри на АГ «білого халата» ретельно контролювати АТ амбулаторно (в тому числі проводити добове моніторування АТ) та рекомендувати модифікацію способу життя; втілювати корекцію АГ до початку ППТ (Massimo F. et al., 2016).
Що стосується палітри антигіпертензивних засобів, то в разі коморбідності з РМЗ слід керуватися актуальними рекомендаціями та робити вибір на користь інгібіторів ангіотензинперетворювального ферменту, блокаторів рецепторів до ангіотензину ІІ, β-блокаторів, дигідропіридинових блокаторів кальцієвих каналів та ін. (ESH/ESC, 2018). Доповідачка зауважила, що призначення недигідропіридинових блокаторів кальцієвих каналів краще уникати через можливість небажаної взаємодії з ППТ.
Окрім того, за неконтрольованої АГ (АТ ≥180/110 мм рт. ст.) у хворих на РМЗ доцільно посилити антигіпертензивну терапію та знизити дозування чи взагалі тимчасово припинити застосування іVEGF. Щойно буде досягнуто цільових рівнів АТ (САТ <130 мм рт. ст.), ППТ необхідно відновити. У вказаної когорти пацієнтів украй важливими є ретельний моніторинг АТ і виконання призначень (Touyz R., Herrmann J., 2018).
Щоби пересвідчитися в ефективності та задовільній переносимості гіпотензивних засобів, актуальним є динамічне спостереження, включно з домашнім моніторуванням АТ.
На завершення доповіді Т. В. Колесник представила клінічний випадок із власної практики: пацієнтка Н. 59 років зі вперше діагностованою карциномою лівої молочної залози. З-поміж ФР наявний лише обтяжений сімейний анамнез щодо ССЗ. Хворіє на АГ 6 років. Нерегулярно приймала фіксовану подвійну комбінацію антигіпертензивних препаратів.
Об’єктивно: висока варіабельність підвищення АТ (від 1 до 3 ступеня) з найвищими показниками в денний час (max. САТ – до 200 мм рт. ст.). Гіпертрофії ЛШ та ураження магістральних артерій головного мозку не виявлено.
Хворій було проведено аналіз пружно-еластичних властивостей артеріальної стінки до початку ППТ. Рівень АТ під час вимірювання в положенні лежачи становив 168/90 мм рт. ст., а центральний аортальний тиск був вищий майже на 10 мм рт. ст. Швидкість поширення пульсової хвилі (ШППХ) дорівнювала 12,1 м/с, що свідчить про підвищення жорсткості й ураження судинної стінки як органа-мішені.
Зважаючи на анамнез хвороби й об’єктивні дані, було призначено потрійну фіксовану комбінацію (ПФК) амлодипіну, гідрохлоротіазиду (ГХТЗ) і валсартану (Тіара Тріо®). Через 4 міс після ППТ (хірургічне лікування та променева терапія) на тлі прийому Тіара Тріо® контроль АТ незіставний із вихідними показниками: денні показники АТ повністю нормалізувалися, зареєстровано лише поодиноке незначне підвищення тиску у вечірній і нічний час, що може бути пов’язано з променевою терапією. Нормалізувався центральний тиск, знизилася ШППХ до 10,3 м/с, що є верхньою межею норми в пацієнтів цієї вікової групи. Пацієнтка продовжує антигіпертензивне лікування та ППТ, що забезпечує контроль усіх наявних ФР.
 Наукова співробітниця відділу гіпертонічної хвороби ДУ «Національний науковий центр «Інститут кардіології ім. М. Д. Стражеска» НАМН України» (м. Київ), кандидат медичних наук Олена Олександрівна Матова представила доповідь на тему «Лікування пацієнтів із РАГ: на межі балансу між ефективністю та безпекою».
Наукова співробітниця відділу гіпертонічної хвороби ДУ «Національний науковий центр «Інститут кардіології ім. М. Д. Стражеска» НАМН України» (м. Київ), кандидат медичних наук Олена Олександрівна Матова представила доповідь на тему «Лікування пацієнтів із РАГ: на межі балансу між ефективністю та безпекою».
Тонкощі та нюанси ведення хворих на РАГ було розібрано на прикладі власного клінічного дослідження, проведеного на базі Інституту кардіології ім. М. Д. Стражеска. У випробуванні вивчався вплив терапії ПФК антигіпертензивних препаратів, а саме амлодипіну, ГХТЗ і валсартану (Тіара Тріо®), на контроль тиску у хворих із підозрою на РАГ (n=324). Термін спостереження – 3 роки.
Лікування препаратом Тіара Тріо® в максимально переносимих дозах дало змогу швидко нормалізувати тиск у 52% учасників, а отже, констатувати в них псевдорезистентну АГ. У решти хворих істинна РАГ підтверджена в 40% випадків, а у 8% пацієнтів діагностовано вторинну АГ.
Основними причинами псевдорезистентної АГ є: низька прихильність пацієнтів до призначеного лікування; ефект «білого халата»; неправильне вимірювання АТ; неоптимальне лікування (Carey R. et al., 2018).
Загальновідомо, що підвищений рівень АТ асоціюється з високим ризиком розвитку серцево-судинних ускладнень. У пацієнтів із РАГ, які взяли участь у дослідженні, вп’ятеро частіше спостерігалися ішемічна хвороба серця та цукровий діабет, удвічі частіше траплялися цереброваскулярні ускладнення, й у третини було діагностовано ХХН.
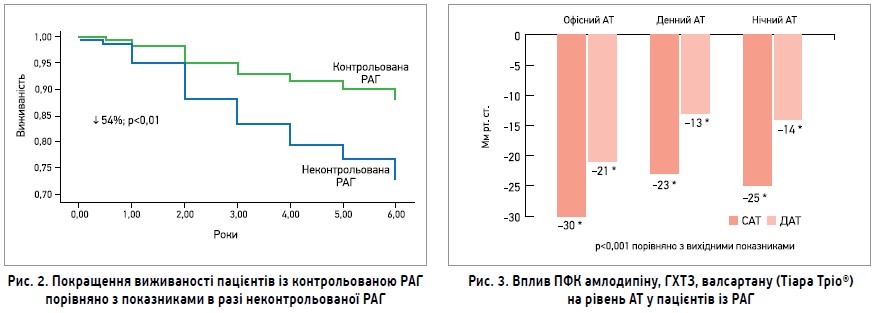
Було доведено, що за контролю АТ у хворих на істинну РАГ виживаність збільшується вдвічі порівняно з пацієнтами, в яких не вдалося досягти цільових рівнів АТ (рис. 2) (Fatemi O. et al., 2016).
Тим часом у хворих з істинною РАГ на тлі застосування Тіара Тріо® в максимально переносимих дозах відзначалося істотне зниження офісного, денного, нічного АТ (рис. 3).
О. О. Матова наголосила, що при оцінці ефективності антигіпертензивної терапії недостатньо офісного вимірювання АТ, оскільки чверть осіб із РАГ мають масковану форму хвороби, котра передбачає нормальний рівень офісного АТ, але підвищені показники за даними добового чи домашнього моніторування.
Ще одна важлива ремарка: в 15% хворих, які починають використовувати блокатори ренін-ангіотензин-альдостеронової системи (РААС), протягом перших тижнів можуть розвиватися транзиторне підвищення рівня креатиніну та зниження швидкості клубочкової фільтрації. Згодом цей показник повертається до норми. Слід пам’ятати, що в разі утримання високих рівнів креатиніну (більш як на 20%) на тлі прийому максимальних доз ПФК необхідно виключити реноваскулярну АГ. Але й хворі без ХХН із різким погіршенням ниркових показників на тлі прийому блокаторів РААС потребують ретельного спостереження, зокрема за функцією нирок, оскільки це пацієнти з дуже високим кардіоренальним ризиком (Edouord L. et al., 2019).
На жаль, контролю АТ у пацієнтів із РАГ досягти непросто. Якщо на тлі застосування ПФК не вдається досягти цільових рівнів АТ, доцільно додати четвертий препарат. У європейських настановах із ведення хворих на АГ (ESH/ESC, 2018) рекомендованим є спіронолактон. У дослідженні хворим до базової потрійної терапії почергово додавали спіронолактон, еплеренон, торасемід, небіволол і моксонідин. Найефективнішими були антагоністи мінералокортикоїдних рецепторів (АМР) спіронолактон і еплеренон, далі – торасемід. Найменш ефективними виявилися моксонідин і небіволол.
Проте слід пам’ятати, що на тлі прийому АМР може спостерігатися гіперкаліємія, котра асоціюється з удвічі вищим рівнем загальної смертності у хворих на АГ. Так, у метааналізі C. Wang і співавт. (2016) було показано, що у хворих на РАГ при застосуванні спіронолактону в дозі 25-50 мг спостерігалося підвищення рівня калію в середньому на 0,2 ммоль/л. Окрім того, АМР можуть зумовлювати антиандрогенні ефекти. Тому до тяжких хворих на РАГ слід застосовувати індивідуалізований підхід.
Результати 3-річного спостереження показали, що на тлі прийому ПФК Тіара Тріо® та четвертого препарату (одного з перелічених) цільових рівнів АТ було досягнуто в 35% хворих з істиною РАГ. Незважаючи на те що не всі учасники дослідження досягали цільових показників АТ, у середньому рівень офісного АТ становив 139/80 мм рт. ст., а добового – 135/78 мм рт. ст. (на початку випробування – 173/96 і 167/94 мм рт. ст. відповідно). Крім цього, відбувався регрес ураження органів-мішеней. У 25% учасників нормалізувався індекс маси міокарда, у 69% – достовірно знизився.
Отже, можна зробити такі висновки:
- призначення ПФК Тіара Тріо® в максимальній дозі за рахунок спрощення схеми лікування виключає феномен псевдорезистентності й дає змогу ідентифікувати осіб з істиною РАГ, які мають вищий ризик серцево-судинних ускладнень і потребують інтенсифікації терапії;
- ПФК є базовим стандартом терапії в когорті хворих на РАГ;
- найефективнішим четвертим препаратом для досягнення цільового рівня АТ у пацієнтів із РАГ є АМР спіронолактон або еплеренон. За їх непереносимості препаратом вибору може бути торасемід, ефективність якого вища, ніж моксонідину та небівололу;
- прийом АМР, особливо спіронолактону, має супроводжуватися моніторингом рівня калію та побічних явищ;
- зважаючи на складність досягнення цільового рівня АТ у пацієнтів із РАГ, вони потребують персоналізованих схем лікування та моніторування офісного й амбулаторного АТ;
- персоналізована антигіпертензивна терапія, включно з ПФК Тіара Тріо®, сприяє регресу ураження органів-мішеней.
.jpg) Завідувачка відділу дисліпідемії ДУ «Національний науковий центр «Інститут кардіології ім. М. Д. Стражеска» НАМН України», доктор медичних наук, професор Олена Іванівна Мітченко зупинилася на ще одному вагомому ФР ССЗ – гіперліпідемії.
Завідувачка відділу дисліпідемії ДУ «Національний науковий центр «Інститут кардіології ім. М. Д. Стражеска» НАМН України», доктор медичних наук, професор Олена Іванівна Мітченко зупинилася на ще одному вагомому ФР ССЗ – гіперліпідемії.
У нових настановах ESC/EAS щодо менеджменту пацієнтів із дисліпідеміями (2019) задекларовано «шалені» цільові показники ХС ЛПНЩ. Цільовий рівень для пацієнтів із дуже високим серцево-судинним ризиком було знижено до <1,4 ммоль/л (<55 мг/дл), високим – до <1,8 ммоль/л (<70 мг/дл), помірним – до 2,6 ммоль/л (<100 мг/дл). Для пацієнтів із низьким серцево-судинним ризиком цільовий рівень ХС ЛПНЩ залишився без змін – <3,0 ммоль/л (<115 мг/дл). У пацієнтів з атеросклеротичними ССЗ, які перенесли дві серцево-судинні події протягом 2 років на тлі статинотерапії, рекомендовано розглянути цільовий рівень <1,0 ммоль/л (<40 мг/дл). Такі низькі цільові показники ХС ЛПНЩ є дуже амбітними, і практичні лікарі зіткнулися з труднощами в реалізації цих настанов.
Можливості підвищення ефективності гіполіпідемічної терапії оцінено в дослідженні DA VINCI, в якому визначали, чи досягають пацієнти, котрі потребують первинної та вторинної профілактики ССЗ, цільових рівнів ХС ЛПНЩ, рекомендованих у попередніх настановах ESC/EAS (Ray K. et al., 2020). У випробуванні взяли участь 5888 пацієнтів із 18 країн Європи, в тому числі 484 – з України. Встановлено, що в середньому 54% хворих досягають цільових рівнів, рекомендованих ESC/EAS у 2016 р., та 33% – у 2019 р. В Україні лише 21% пацієнтів досягають цільових рівнів ХС ЛПНЩ, рекомендованих ESC/EAS у 2016 р. Аналіз впливу різних варіантів ліпідознижувальної терапії показав, що частка хворих, які досягають цільових рівнів ХС ЛПНЩ, зростає з інтенсифікацією лікування. Так, досягнення цільових рівнів, рекомендованих настановами ESC/EAS у 2016 та 2019 р., статинотерапія низької інтенсивності забезпечувала в 16 та 13% хворих, статинотерапія середньої інтенсивності – в 35 та 16%, статинотерапія високої інтенсивності – в 45 та 22% відповідно; комбінація статинів середньої чи високої інтенсивності з езетимібом – у 54 та 21% пацієнтів, комбінація статину з інгібітором PCSK9 – у 67 та 58%. Автори зазначають, що серед пацієнтів із дуже високим серцево-судинним ризиком лише 18% досягають цільового рівня ХС ЛПНЩ <1,4 ммоль/л, тому вкрай важливим є ширше застосування нестатинових ліпідознижувальних засобів. Для України на сьогодні це є нереалістичним з огляду на соціально-економічні аспекти. Тому в українських рекомендаціях для первинної та вторинної профілактики залишаються цільові рівні ХС ЛПНЩ, рекомендовані настановами ESC/EAS у 2016 р.: за дуже високого серцево-судинного ризику – <1,8 ммоль/л (70 мг/дл), високого – <2,6 ммоль/л (100 мг/дл), помірного чи низького – <3,0 ммоль/л (<115 мг/дл). Проте нові рекомендації ESC/EAS (2019) треба враховувати під час лікування та повідомляти про них пацієнта.
Головними компонентами лікування дисліпідемій були й залишаються статини. У сучасних реаліях оптимальним є вибір ефективних і доступних препаратів, таких як Превентор (розувастатин), який є біоеквівалентним оригінальному препарату Крестор (Кравчук Ж. і співавт., 2019).
Підсиленням статинотерапії може служити додавання езетимібу – інгібітора абсорбції холестерину в тонкому кишечнику. В Україні езетиміб доступний лише у вигляді комбінації з розувастатином.
За незадовільних результатів ліпідознижувальної терапії пропонується додавання інгібітора PCSK9. За рахунок безпосередньої участі в деградації рецепторів ЛПНЩ, рецепторів ліпопротеїнів дуже низької щільності та рецепторів до аполіпопротеїну Е2 PCSK9 є ключовою ланкою в регуляції обміну ліпідів крові.
У дослідженні FOURIER (Sabatine M. et al., 2017) інгібітор PCSK9 еволокумаб знижував рівень ХС ЛПНЩ у середньому на 59%, що відповідало 0,78 ммоль/л, порівняно з плацебо. Також було встановлено, що терапія еволокумабом протягом 3 років достовірно знижує ризик виникнення серцево-судинних подій і серцево-судинної смерті.
О. І. Мітченко розповіла, які нові ліпідознижувальні препарати нині виходять на світовий ринок. Зокрема, наприкінці минулого року Управління з контролю якості продуктів харчування та лікарських засобів США (FDA) затвердило бемпедоїдну кислоту, що блокує утворення холестерину в печінці шляхом пригнічення активності АТФ-цитратліази. Найближчим часом буде зареєстровано інклісиран, механізм дії котрого передбачає блокаду генів, які регулюють PCSK9 у печінці. За результатами програми ORION, інклісиран знижує рівень ХС ЛПНЩ більш ніж на 50% у 72,8% пацієнтів (Stoekenbroek R. et al., 2018). Ця молекула змінює парадигму лікування дисліпідемій: якщо статини пацієнт має приймати щодня, інгібітори PCSK9 – 1 раз на 2 тиж, то інклісиран – 1 раз на 6 міс. Причому вартість двох ін’єкцій інклісирану аналогічна ціні річного курсу статинів високої інтенсивності.
Підготувала Наталія Нечипорук
Медична газета «Здоров’я України 21 сторіччя» № 19 (488), 2020 р.