20 квітня, 2023
Перспективи застосування пробіотиків на основі спор бактерій роду Bacillus у дерматології та косметології
 Згідно з консенсусом, запропонованим Міжнародною науковою асоціацією пробіотиків і пребіотиків (International Scientific Association for Probiotics and Prebiotics, ISAPP), термін «пробіотики» слід використовувати для визначення живих мікроорганізмів, які при надходженні в адекватних кількостях позитивно впливають на здоров’я організму господаря [1]. Це визначення використовується також Всесвітньою гастроентерологічною організацією (World Gastroenterology Organization, WGO) [2].
Згідно з консенсусом, запропонованим Міжнародною науковою асоціацією пробіотиків і пребіотиків (International Scientific Association for Probiotics and Prebiotics, ISAPP), термін «пробіотики» слід використовувати для визначення живих мікроорганізмів, які при надходженні в адекватних кількостях позитивно впливають на здоров’я організму господаря [1]. Це визначення використовується також Всесвітньою гастроентерологічною організацією (World Gastroenterology Organization, WGO) [2].
Останніми роками поширюється застосування пробіотиків у дерматології та косметології як засобів, що забезпечують профілактичний і терапевтичний вплив на шкіру. Цьому, зокрема, присвячено низку сучасних оглядових публікацій [3-9]. Така дія досягається не лише в разі перорального надходження пробіотичних мікроорганізмів, а й за їх місцевого контакту зі шкірою. Показово, що не тільки ушкоджена шкіра, а й здорова позитивно реагує на пероральне надходження до організму пробіотичних бактерій [10].
Широкому застосуванню пробіотиків у дерматології та косметології сприяють результати фундаментальних досліджень, що встановили існування функціонально-метаболічних зв’язків між мікробіотою кишечнику і станом шкіри (вісь «кишечник – шкіра»), а також антиоксидантна, протизапальна, антипроліферативна та гістопротекторна функції нормальної кишкової / шкірної мікробіоти, її здатність забезпечувати захист біополімерів сполучної тканини й стримувати старіння шкіри.
Сучасні уявлення про взаємозв’язок між мікробіотою кишечнику та станом шкіри
Шлунково-кишковий тракт людини містить >100 трлн мікроорганізмів (більшість з них є бактеріями, але виявляються також віруси, гриби та найпростіші) [11, 12]. Щільність бактеріальних клітин у товстій кишці оцінюється від 1011 до 1012/мл, що робить цей відділ кишечнику одним із найгустонаселеніших середовищ існування мікробів на Землі [13]. Майже 10 млн генів уже ідентифіковано в мікробіомі кишечнику [14], тоді як геном людини складається з ≈23 000 генів [12].
Кишкова мікробіота виконує такі важливі функції, як ферментативне розщеплення клітковини, крохмалю, залишків харчових білків і жирів, органічних кислот, біосинтез вітамінів групи В, К, нікотинової кислоти, амінокислот та інших метаболітів, захист організму господаря від патогенних мікроорганізмів (через мікробний антагонізм, модифікацію pH, секрецію антимікробних сполук, клітинну сигналізацію), вплив на вроджений і адаптивний імунітет [15, 16].
Порушення видового та територіального складу кишкової мікробіоти (дисбіоз) спричиняє розлади бар’єрної функції товстої кишки [15, 17], бере участь у патогенезі низки захворювань, як-от псевдомембранозний (антибіотикоасоційований) коліт [18], виразковий коліт [19], колоректальний рак [20], ожиріння та цукровий діабет 2 типу [21], атеросклероз [22], стеатогепатит [23], автоімунні захворювання [24, 25], остеоартрит [26], патологія нервової системи (розсіяний склероз, нейродегенеративні захворювання, епілепсія, депресія, аутизм, шизофренія) [27-29].
Як відомо, мікроорганізми колонізують кишечник людини при народженні [30]. В ранньому віці склад його мікробіому змінюється із часом, доки він не стає відносно стабільним [31]. Кишечник містить ≈1000 різних видів бактерій, які належать до таких відділів, як Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria, Verrucomicrobia, Fusobacteria, Tenericutes, Spirochaetes, Cyanobacteria та Saccharibacteria [30-32]. Однією з найпомітніших змін у мікробіомі кишечнику є співвідношення між Firmicutes і Bacteroidetes, оскільки в разі ожиріння повідомляється про збільшення представників відділу Firmicutes [33].
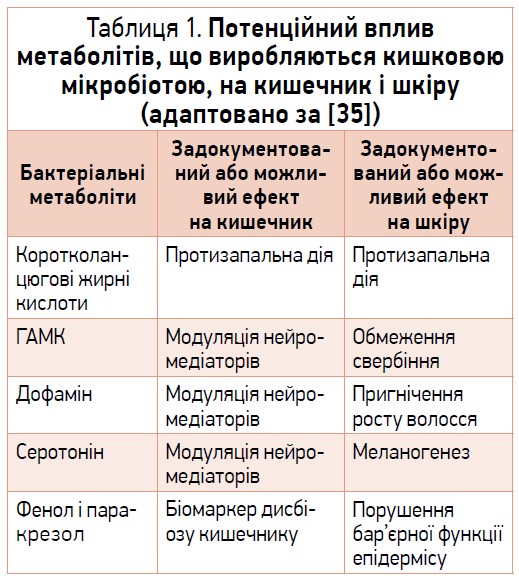
Нині відомо, що мікробіом кишечнику виробляє щонайменше 30 біорегуляторних сполук, як-от коротколанцюгові жирні кислоти, вторинні жовчні кислоти, триметиламін, кортизон, глюкагоноподібний пептид‑1, пептид YY, ґрелін, лептин, деякі нейромедіатори (гамма-аміномасляна кислота (ГАМК), серотонін, дофамін і норадреналін) [34]. Деякі представники кишкової мікробіоти здатні реагувати на гормони, що секретуються господарем. Біорегулятори, які продукуються мікробіотою кишечнику, вивільняються в кров і можуть діяти на віддалені органи та системи, в т. ч. на шкіру [35].
В таблиці 1 перераховано продукти метаболізму кишкової мікробіоти, що мають здатність долати кишковий бар’єр, надходити до системного кровотоку та впливати на шкіру [35].
За допомогою численних досліджень доведено існування взаємних зв’язків між мікробіотою товстої кишки та функціонально-метаболічним станом і структурою шкіри через вплив на імунну систему організму [36-38].
Коротколанцюгові жирні кислоти (монокарбонові кислоти з довжиною ланцюга до 6 атомів карбону) є продуктами бродіння неперетравлених полісахаридів кишковими бактеріями. Найпоширеніші з цих сполук у шлунково-кишковому тракті (≥95%) – ацетат, пропіонат і бутират, тоді як форміат, валерат, капроат та інші складають решту [39]. Ацетат і пропіонат продукуються здебільшого представниками відділу Bacteroidetes, тоді як бактерії відділу Firmicutes, у т. ч. представники рядів Bacillales і Lactobacillales, є основними джерелами бутирату [40]. Саме він найбільшою мірою посилює функцію епітеліального бар’єра [41, 42], при цьому надмірне споживання жиру та цукру за дефіциту в раціоні клітковини (дієта «західного типу») порушує нормальне співвідношення Firmicutes / Bacteroidetes. Це супроводжується підвищенням проникності кишкового бар’єра [43], що сприяє розвитку запальних та імунних захворювань [44]. Кількість коротколанцюгових жирних кислот зменшується також за розвитку кишкового дисбіозу, пов’язаного із застосуванням антибіотиків широкого спектра [45].
Нещодавно було показано, що харчові волокна і коротколанцюгові жирні кислоти здатні модулювати імунну відповідь при різних запальних станах не лише в кишечнику, а й дистантно в таких органах, як легені [46] та шкіра [47]. Протизапальну дію цих кислот пов’язують із пригніченням бутиратом, пропіонатом ферменту гістондеацетилази [48, 49] та / або активацією метаботропних G‑білок-зв’язувальних рецепторів GPR109A (ніацинового рецептора) бутиратом [50], а також GPR41 (відомого як рецептор вільних жирних кислот 3, FFAR3) і GPR43 (або FFAR2) ацетатом, пропіонатом, бутиратом [49, 51]. Наслідком пригнічення гістондеацетилази з одночасною активацією гістонацетилтрансферази є епігенетичні посттрансляційні модифікації, що супроводжується зниженням експресії прозапальних цитокінів та обмеженням системної запальної відповіді [52, 53].
Продемонстровано, що GPR109a здатний активувати макрофаги товстої кишки та дендритні клітини, індукувати диференціювання T‑регуляторних лімфоцитів – продуцентів протизапального цитокіну інтерлейкіну (IL)-10 [54]. Цей самий рецептор здатний блокувати ліпополісахарид (LPS)-індуковану активацію транскрипційного фактора каппа-B (NF‑κB) [55]. Пов’язаний з ним сигнальний шлях відіграє ключову роль не тільки в запаленні товстої кишки, а також у розвитку низки захворювань шкіри, включаючи псоріаз, запальні процеси, як-от синдром Блоха – Сульцбергера (лат. incontinentia pigmenti – нетримання пігменту), сонячні опіки, алергічний контактний дерматит, автоімунні захворювання, рак шкіри [56, 57]. Це надає підстави вважати, що GPR109A може бути потенційною терапевтичною мішенню для лікування захворювань шкіри.
Слід зазначити, що нещодавно отримані докази свідчать про те, що в дітей і немовлят, які страждають на атопічний дерматит або схильні до розвитку алергічної сенсибілізації, виявляється кишкова мікробіота зі зниженою здатністю виробляти коротколанцюгові жирні кислоти, зокрема бутират [58, 59]. Ці результати підтверджують думку про те, що низьке споживання клітковини, характерне для західного способу життя, може лежати в основі дисфункції шкірного бар’єра та подальшої схильності до ранньої алергенної сенсибілізації. Дійсно, A. Trompette та співавт. [60] із використанням експериментальної моделі атопічного дерматиту виявили, що дієта, збагачена ферментованими харчовими волокнами, зменшує системну алергенну сенсибілізацію та тяжкість захворювання. Автори пов’язують це явище саме із продукцією коротколанцюгових жирних кислот, зокрема бутирату, який посилює функцію не лише кишкового, а й шкірного бар’єра (шляхом індукування диференціювання епідермальних кератиноцитів і продукування ключових структурних компонентів епідермісу).
Нині підтверджено вплив інших метаболітів, що виробляються кишковою мікробіотою, на функціонування шкіри. Так, ГАМК (як і її ендогенний аналог, котрий виконує роль гальмівного нейромедіатора) виявляє здатність пригнічувати нейрони, які сигналізують про свербіж шкіри [61]. На мишачій моделі атопічного дерматиту було продемонстровано здатність ГАМК пом’якшувати ураження шкіри через урівноваження рівнів Т‑хелперних клітин 1 (Th1) та 2 (Th2) типів за переважання Th1 [62]. ГАМК також здатна пригнічувати матриксну металопротеїназу‑1 (MMP‑1), що руйнує колаген I типу, та збільшувати експресію колагену I типу людини (COL1A1 і COL1A2). Ці процеси є важливими для підтримки еластичності шкіри [63].
Своєю чергою, дофамін чинить прямий вплив на волосяні фолікули людини, обмежуючи ріст волосся шляхом індукції катагену (стадії відпочинку), що є важливим для попередження гірсутизму та гіпертрихозу [64]. Серотонін демонструє здатність посилювати меланогенез через активацію 5-HT2A‑рецепторів [65].
Розвиток кишечного дисбіозу змінює характер системної дії метаболітів мікробіоти кишечнику. За цих умов у плазмі крові зростає концентрація біоактивних токсинів, які є метаболітами ароматичних амінокислот, а саме фенолу та паракрезолу. Ці сполуки в наш час розглядаються як біомаркери дисбіозу кишечнику. Нещодавно встановлено їхню здатність зменшувати гідратацію шкіри та порушувати бар’єрну функцію епідермісу через розлади диференціації кератиноцитів [66].
Патогенетичне значення осі «кишечник – шкіра»
Регулювання взаємодії господаря з мікробіотою є фундаментальною функцією імунної системи, тому регіони, колонізовані коменсалами, як-от шкіра та кишечник, містять значний об’єм імунних клітин в організмі. Завдяки домінувальній активності імунної системи коменсальні мікробні спільноти відіграють важливу роль у функціонуванні мукозального імунітету. Обмеження контакту між мікроорганізмами та кишковою епітеліальною мембраною для мінімізації запальних реакцій і мікробної транслокації має вирішальне значення з метою збереження гомеостатичного балансу господаря. Щоб досягти цієї сегрегації, епітеліальний клітинний бар’єр кишечнику, шар слизу, Т‑клітини, секреторні імуноглобуліни A та дендритні клітини спільно створюють своєрідний екран під назвою «фаєрвол слизової оболонки». Ця структура обмежує переміщення коменсальних бактерій до лімфоїдних тканин, запобігаючи розвитку запального процесу [30]. Крім того, клітини кишечнику в нормальному стані характеризуються досить слабкою експресію Toll-подібних рецепторів 2 та 4 типів, із чим пов’язана нечутливість до дії бактеріальних LPS, яка посилюється виробленням слизовою оболонкою товстої кишки IL‑10 [67], TLR‑інгібувального пептиду [68].
Захисту організму господаря від запальної реакції на коменсальні мікроорганізми також сприяє здатність симбіотичної мікробіоти пригнічувати транслокацію NF‑κB до ядра й усувати в такий спосіб експресію генів низки прозапальних і прооксидантних білків, а також гістолітичних ферментів [69].
 Однак будь-яка зміна мікробного різноманіття кишечнику здатна підвищувати уразливість організму господаря та порушувати імунологічну толерантність слизової оболонки [70], що згодом може впливати на здоров’я шкіри [71].
Однак будь-яка зміна мікробного різноманіття кишечнику здатна підвищувати уразливість організму господаря та порушувати імунологічну толерантність слизової оболонки [70], що згодом може впливати на здоров’я шкіри [71].
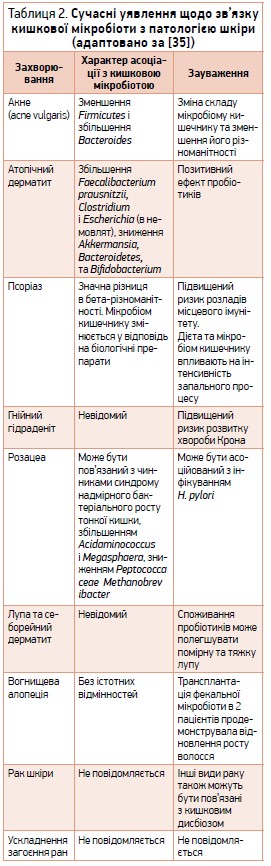
Наразі повідомляється про зв’язок запальних захворювань шкіри з розвитком дисбіозу кишечнику (табл. 2). Наявність останнього істотно зменшує протизапальні властивості нормальної мікробіоти та створює умови для надходження молекулярних структур, пов’язаних із мікроорганізмами (Microbe-Associated Molecular Patterns, MAMPs), як-от LPS, пептидоглікан, флагелін, бактеріальна ДНК тощо, через порушений епітеліальний клітинний бар’єр кишечнику до системного кровотоку з подальшим розвитком системної запальної відповіді [72]. Так, ДНК представників кишкової мікробіоти було ідентифіковано в зразках плазми пацієнтів із псоріазом. У дослідженні 54 пацієнтів і 27 здорових осіб контрольної групи бактеріальна ДНК була виявлена в 16 із 54 хворих на псоріаз і не спостерігалася в жодній контрольній групі. Крім того, в хворих на псоріаз також було виявлено збільшення маркерів системної запальної відповіді (інтерферону-γ, IL‑1β, IL‑6, IL‑12 і фактора некрозу пухлини) порівняно зі здоровим контролем. Секвенування бактеріальної ДНК ідентифікувало той самий тип мікроорганізмів, які зазвичай зустрічаються в кишковій мікробіоті [30].
Отже, наслідком надходження MAMPs до тканин шкіри є розвиток запалення, ушкодження її структур і порушення бар’єрної функції епідермісу [35].
За сучасними уявленнями, розвиток кишкового дисбіозу передбачає подальший комплекс патофізіологічних подій, що зумовлюють ушкодження шкіри [30, 73]:
1) збільшується проникність кишкового бар’єра, що спричиняє проходження через нього мікроорганізмів та їхніх продуктів, формується гіперчутливість В‑клітин, погіршується диференціювання Т‑клітин, зменшується секреція секреторних імуноглобулінів A;
2) дисбіотична кишкова мікробіота, токсичні продукти, нейротрансмітери та змінені імунні клітини через кровоносну систему досягають тканини шкіри, змінюють її стан зі здорового, що має збалансований склад мікроорганізмів і належну кількість антимікробних пептидів людського й бактеріального походження, на дисбіотичний;
3) MAMPs дисбіотичої кишкової та шкірної мікробіоти викликають через включення відповідних сигнальних каскадів (наприклад, NF‑κB‑залежного) деструкцію сполучної тканини шкіри, порушення бар’єрної функції епідермісу, запальне й імунне ураження шкіри, розвиток її захворювань та/або старіння.
Звертає на себе увагу двоспрямований характер функціонування осі «кишечник – шкіра». Виявлено, що дія на шкіру ультрафіолетового випромінювання В (UVB) збільшує різноманіття мікробіому кишечнику, що, на думку дослідників, опосередкується виробленням вітаміну D [74]. Так, концентрація вітаміну D у сироватці крові людей корелювала з відносною кількістю родів Lachnospira та Fusicatenibacter.
Окрім того, порушення шкірного бар’єра може також сприяти розвитку патологічних процесів у кишечнику, безпосередньо не пов’язаних з його дисбіозом. Наприклад, сенсибілізація організму за епікутанного впливу протеїну арахісу призводить до опосередкованої імуноглобуліном Е інфільтрації кишечнику мастоцитами [75].
Застосування пробіотиків у дерматології та косметології
Найчастіше в дерматології та косметології як пробіотики використовуються деякі види лактобацил (Lactobacillus), біфідобактерій (Bifidobacterium), ентерококів (Enterococcus), а також окремі представники роду бацил (Bacillus). Повідомляється, що системний курс пробіотиків може вважатися новим підходом щодо підтримки структури та функції шкіри.
Останніми роками було опубліковано результати низки рандомізованих плацебо-контрольованих клінічних досліджень, що виявили ефективність застосування пероральних пробіотиків у разі атопічного дерматиту [76-81] та псоріазу [82, 83]. Повідомляється, що введення пробіотичних мікроорганізмів значно покращує якість життя пацієнтів і перебіг захворювань, зменшує їхню тяжкість та ризик рецидивів, коригує концентрації біомаркерів запалення. Одне дослідження підтверджує ефективність місцевого терапевтичного впливу препарату, що містить продукти бродіння Enterococcus faecalis, на мікробіом шкіри та перебіг acne vulgaris [84].
Італійський дерматолог C. Diehl проаналізував механізми протизапальної та антиоксидантної дії пробіотиків на організм людини і ссавців [5], головними з яких виявилися такі:
- продукція пробіотичними мікроорганізмами (Bifidobacteria, Lactobacillus fermentum) різних метаболітів із протизапальною та антиоксидантною активністю, як-от бутират, фолат і глутатіон;
- пригнічення NF‑κB‑залежної продукції прозапальних цитокінів, матриксних металопротеїназ, активних форм оксигену та нітрогену (Bacillus spp.);
- індукція сигнального шляху Nrf2 – Keap1 – антиоксидант-респонсивний елемент (Bacillus sp. strain LBP32);
- гістопротекторна дія – інгібування експресії матриксних металопротеїназ (L. acidophilus, L. plantarum), антиеластазна та антиколагеназна активність (L. casei, L. diolivorans, L. rhamnosus, L. exopolysaccharides);
- гальмування ферментів, що продукують активні форми оксигену, наприклад, NADPH‑оксидази, циклооксигенази‑2 (L. fermentum CECT5716, L. coryniformis CECT5711, L. gasseri CECT5714);
- хелатування іонів металів, зокрема катіонів Fe2+ і Cu2+ (Streptococcus thermophilus 821, L. casei KCTC3260, L. helveticus CD6);
- експресія ферментативних антиоксидантів – супероксиддисмутази, каталази, глутатіонпероксидази (L. fermentum, L. lactis).
В експериментах на тваринах доведено здатність пробіотичних бактерій при їхньому нанесенні на шкіру забезпечувати фотопротекторну дію (Bifidobacterium breve, L. johnsonii, L. plantarum HY7714, L. acidophilus) та прискорювати загоєння ран шкіри (L. plantarum), покращувати функціонування шкірного бар’єра (Streptococcus thermophiles, L. plantarum, Bifidobacterium breve), поліпшувати гідратацію шкіри (Bifidobacterium) [5]. Здатність пробіотиків покращувати зволоження шкіри та запобігати фотостарінню було підтверджено в рандомізованому подвійному сліпому плацебо-контрольованому клінічному дослідженні з пероральним вживанням L. plantarum HY7714 добровольцями, які мають суху шкіру, а також зморшки [85].
У лабораторії Theofilos Poutahidis було встановлено омолоджувальний ефект пробіотичних бактерій на шкіру та хутро літніх мишей [86]. Вживання пробіотичного йогурту, за даними дослідників, викликає зсув фази анагену (активної фази росту волосся) із себоцитогенезом, що спричиняє формування густого блискучого хутра через індукцію бактеріями протизапального IL‑10 та нейрогормона окситоцину [86, 87]. Старі самці, що вживали пробіотики, демонструють посилений субкутикулярний фолікулогенез порівняно з відповідними контрольними тваринами [86]. Дослідники розглядають наявність більш блискучого волосся в дослідній групі самок як ознаку, що корелює з їхньою фертильністю.
Водночас пробіотичні бактерії при пероральному вживанні можуть мати побічну дію – аж до виникнення септичних станів (за дисфункції кишкового бар’єра й імунодефіциту), імунних і метаболічних розладів, наслідків горизонтального перенесення генів [88, 89]. Описано випадки бактеріємії та сепсису, пов’язаних із надходженням до крові L. acidophilus, L. casei, S. boulardii, L. rhamnosus, Bifidobacterium breve та Bacillus subtilis [88].
Певний ризик у разі застосування пробіотиків при запальних захворюваннях шкіри можуть мати лактобацили внаслідок їхньої властивості активувати вироблення Т‑хелперами 1 типу прозапальних цитокінів [90]. Окрім того, виявлено здатність L. reuteri стимулювати автоімунні реакції при моделюванні в експерименті на мишах червоного вовчака [91].
Сучасні літературні джерела критикують думку щодо можливості пробіотичних мікроорганізмів прищеплюватися до стабільної біоплівки, яку утворює резидентна мікробіота. Крім того, представники родів Lactobacillus і Bifidobacterium за перорального вживання характеризуються дуже повільним ростом та значною чутливістю до шлункового соку, що суттєво порушує їхній транзит шлунково-кишковим трактом [92]. Вважається, що ефекти пробіотичних бактерій пов’язані насамперед із безпосереднім впливом на епітеліальні й імунні клітини, підтримкою проблемної мікробіоти через обмін генами та метаболітами [93].
Отже, сучасна наукова література обґрунтовує необхідність розширення пошуку ефективних пробіотичних засобів для перорального та місцевого застосування в дерматології та косметології, що відрізняються високим профілем безпечного вживання. Перспективним шляхом у цьому напрямі може бути застосування як пробіотиків представників транзиторної мікробіоти, зокрема спороутворювальних бактерій роду Bacillus. Ці мікроорганізми, незважаючи на обмежений час перебування в кишечнику та неможливість входження до біоплівки, здатні позитивно впливати на функціонування останньої, посилювати епітеліальні бар’єри, протидіяти імунним, запальним і метаболічним розладам, пов’язаним із дисбіозом кишечнику та шкіри, основним захворюванням, а також віковим змінам.
Бактерії роду Bacillus як пробіотики і перспективи їхнього застосування в дерматології та косметології
Рід Bacillus налічує 77 видів і поєднує велику групу аеробних або факультативно анаеробних грампозитивних мікроорганізмів паличкоподібної форми, що утворюють термостійкі ендоспори [94]. Бактерії цього роду разом із лактобацилами є головними складовими мікробіоценозу товстої кишки [95, 96], при цьому завдяки виробленню каталази та субтилізину бацили можуть посилювати ріст і життєздатність культури Lactobacillus [97]. Показово, що деякі з бацил (наприклад, B. subtilis natto) споконвіку використовуються у ферментованих продуктах азійської кухні [95]. Більшість з комерційних пробіотиків містить B. subtilis, B. polyfermenticus, B. clausii, деякі – B. cereus, B. coagulans, B. pumilus, B. licheniformis [98], спори яких є стабільними при зберіганні та резистентними до температурного чинника, кислотності шлункового соку, жовчі [94, 95].
На слизових оболонках ротової порожнини, глотки, а потім і шлунка спори активуються та зазнають вегетативного росту. Аналіз фекалій показав, що пробіотичні штами B. cereus, B. clausii та B. pumilus можуть зберігатися в шлунково-кишковому тракті мишей до 16 діб [99].
Низка оглядових і оригінальних публікацій висвітлює переваги пробіотичних штамів Bacillus, головними з яких є їхня нешкідливість навіть у високих концентраціях, антагонізм щодо широкого спектра патогенних та умовно-патогенних мікроорганізмів, здатність синтезувати корисні біологічно активні сполуки, позитивний вплив на імунологічний статус організму господаря, антимутагенні, антиоксидантні, протизапальні, гістопротекторні, антипроліферативні властивості, стійкість до літичних ферментів та обумовлена цим висока життєздатність під час перебування в шлунково-кишковому тракті, екологічна безпека [94-96, 98, 100].
За даними дослідників, ≈800 речовин, що можуть генеруватися бацилами, виявляють антибактеріальну активність. До таких сполук належать бактеріоцини – рибосомальні пептиди чи білки, що зазнають посттрансляційної модифікації (субтилін, ерицин S, коагулін, мегацин), або антибіотики (бацилізин, сурфактин) [101].
Перспективи використання в дерматології та косметології бактерій роду Bacillus як пробіотиків значно зростають через їхню антиоксидантну, протизапальну, імуномодулювальну, гістопротекторну та антипроліферативну дію. Така активність значною мірою пов’язана із продукуванням бацилами екзополісахаридів (EPS) – високомолекулярних екзогенних продуктів метаболізму бактерій [102-104]. Так, EPS B. subtilis модулюють вироблення цитокінів T‑хелперами 1 і 2 типів [105], поляризують макрофаги в напрямку М2 фенотипу [106], зменшують експресію компонентів прозапальних сигнальних шляхів – транскрипційних факторів NF‑κB і STAT6, а також янус-кінази 1 (JAK1) [107]. Ці транскрипційні фактори беруть провідну участь у патогенезі псоріазу та запальних захворювань шкіри [108, 109], а також вікових розладів [110].
При внесенні B. subtilis до культури ентероцитів було виявлено суттєве зменшення продукції прозапального IL‑8 та індуцибельної ізоформи NO‑синтази на різні стимули (IL‑1β, дезоксиніваленол і флагелін) унаслідок пригнічення активації NF‑κB шляхом порушення деградації інгібіторного білка IκB [111]. Автори показали, що деякі штами B. subtilis можуть значно покращувати цілісність кишкового бар’єра, посилюючи експресію білків щільного з’єднання. Водночас пробіотичні штами цього виду виявляють здатність обмежувати деструкцію сполучнотканинних компонентів екстрацелюлярного матриксу [112].
Цікавою особливістю B. subtilis є потенційна здатність уповільнювати старіння та подовжувати тривалість життя, що було виявлено під час дослідження модельного організму – нематоди Caenorhabditis elegans [113]. Важливо відзначити, що цей ефект B. subtilis насамперед викликається негативною регуляцією сигнальної системи, пов’язаної з інсуліноподібним фактором росту, характерною для здорового довголіття людей, що досягають столітнього віку.
EPS B. amyloliquefaciens також знижують експресію прозапальних цитокінів, фагоцитарну активність та окисний стрес, що пов’язують з гальмуванням NF‑κB‑сигналінгу і позаклітинних сигналорегульованих протеїнкіназ 1/2 [114]. Крім того, EPS активує антагоністичну щодо NF‑κB сигнальну систему – Nrf2 (Nuclear Factor Erythroid 2-related Factor 2) / антиоксидант-респонсивний елемент. Разом усі ці механізми істотно зменшують ознаки окисного стресу та тяжкість запалення.
Нещодавно виявлено здатність Bacillus spp. блокувати сигнальну систему колоній патогенних мікроорганізмів, що реалізується через механізм підтримки «соціальної поведінки бактерій», відомий як quorum sensing (відчуття кворуму) [115]. Така дія бацил виявляється вкрай важливою з метою корекції дисбіозу шкіри та створює передумови для включення певних штамів представників роду Bacillus до складу пробіотиків для місцевого застосування й засобів особистої гігієни (спреї для тіла, мило для рук, креми для шкіри, пасти, засоби для чищення зубних щіток тощо). Нині для цих цілей уже застосовуються такі види, як B. subtilis, B. licheniformis і B. pumilus [101].
Одним із найперспективніших шляхів оптимізації позитивної дії бацил та уникнення, пов’язаних з їхнім надходженням, побічних ефектів (ризик утворення ентеротоксину, формування антибіотикорезистентності, вироблення біогенних амінів) є створення і використання багатокомпонентних композицій пробіотиків. Збалансованим складом пробіотичних штамів бацил, що забезпечують антиоксидантну, протизапальну, імуномодулювальну, гістопротекторну та антипроліферативну дію за достатнього профілю безпеки, характеризується дієтична добавка Ремедіум (сировина Chrisal NV, Бельгія), який містить 5 видів полірезистентних до антибіотиків штамів бактерій роду Bacillus (B. subtilis, B. amyloliquefaciens, B. licheniformis, B. pumilus і B. megaterium) [116]. Безпечність пробіотичної композиції підтверджено висновками Управління з контролю за якістю продуктів харчування та лікарських засобів США (Food and Drug Administration, FDA). 1 доза препарату містить 1,7×109 КУО/флакон живих пробіотичних бактерій.
Показово, що Ремедіум містить два види бацил (B. subtilis, B. amyloliquefaciens) із доведеним механізмом фармакологічної дії, пов’язаним зі впливом на сигнальні системи NF‑κB, STAT і Nrf2 [107, 111, 114]. Іншим важливим ефектом дієтичної добавки Ремедіум є її антибактеріальні властивості, пов’язані з антагонізмом пробіотичних штамів щодо широкого спектра умовно-патогенних мікроорганізмів, зокрема до бактерій роду Staphylococcus, Proteus і грибів роду Candida [117].
Висновки
- Коменсальна мікробіота товстої кишки постійно знаходиться у функціональному зв’язку із клітинами шкіри, складовими її мікробіоценозу (вісь «кишечник – шкіра»), що відбувається через продукцію бактеріями біорегуляторних сполук (коротколанцюгових жирних кислот, ГАМК, серотоніну, дофаміну тощо), метаболітів і за участю ефекторів природного та адаптивного імунітету.
- Розвиток кишечного дисбіозу змінює характер системної дії метаболітів мікробіоти кишечнику, збільшує проникність кишкового бар’єра, що спричиняє надходження до внутрішнього середовища мікроорганізмів, токсичних продуктів, нейротрансмітерів і змінених імунних клітини, які через кровоносну систему досягають тканини шкіри, порушуючи її мікробіоценоз, структуру сполучної тканини, бар’єрну функцію епідермісу, що є чинниками патогенезу захворювань шкіри та її прискореного старіння.
- Сучасні літературні джерела підтверджують доцільність перорального й місцевого застосування пробіотиків у дерматології та косметології, результатом чого є покращення якості життя пацієнтів і перебігу запальних, імунних, гіперпроліферативних захворювань шкіри (акне, атопічний дерматит, псоріаз, гнійний гідраденіт, розацеа, себорейний дерматит, вогнищева алопеція, рак шкіри), зменшення їхньої тяжкості, ризику рецидивів, забезпечення захисту від дії чинників навколишнього середовища, прискорення загоєння ран шкіри.
- Сучасні літературні джерела обґрунтовують доцільність застосування пробіотичних штамів спороутворювальних бактерій роду Bacillus у дерматології та косметології на підставі їхніх властивостей відновлювати нормальне функціонування осі «кишечник – шкіра», пригнічувати ріст патогенних мікроорганізмів, уповільнювати старіння, забезпечувати суттєву антиоксидантну, протизапальну, імуномодулювальну, гістопротекторну та антипроліферативну дію, пов’язану зі впливом на системи внутрішньоклітинної сигналізації.
- Використання багатокомпонентних пробіотиків на основі композицій найперспективніших штамів бактерій роду Bacillus є далекосяжним шляхом оптимізації позитивної дії цих мікроорганізмів у дерматологічній і косметологічній практиці та уникнення їхніх небажаних ефектів.
Список використаної літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 7 (543), 2023 р.