26 жовтня, 2020
Трудные аспекты «простых» резекций печени
В статье представлены клинические случаи хирургического лечения объемных образований печени, расположенных вблизи ее кавальных и/или портальных ворот и в связи с этим представляющих значительную сложность для выполнения оперативного вмешательства.
Ключевые слова: гепатопанкреатобилиарная зона, кистозное образование печени, объемное образование печени, резекция печени.
 Хирургия гепатопанкреатобилиарной зоны в настоящее время является одной из наиболее развивающихся областей хирургической науки. Этому в значительной мере способствовали расширение знаний анатомии и физиологии данной зоны, совершенствование оперативной техники, развитие трансплантационных технологий, улучшение хирургического оборудования и развитие анестезиологического обеспечения, а также интенсивной терапии в послеоперационном периоде. Все это обеспечило возможность выполнения значительных по объему резекций печени при различных хирургических, паразитарных и онкологических ее поражениях, а также при травме, что, в свою очередь, значительно улучшило прогноз для жизни у данных пациентов. Подобные вмешательства должны выполняться в специализированных крупных центрах хирургами со значительным опытом гепатопанкреатобилиарной, а в ряде случаев – трансплантационной хирургии печени. В то же время выполнение малых резекций печени в объеме сегмент- и даже секционэктомии в настоящий момент относят к категории «простых» операций, проведение которых возможно в общехирургическом стационаре без специальной подготовки хирурга, особенно если речь идет о небольших по размеру доброкачественных поражениях печени.
Хирургия гепатопанкреатобилиарной зоны в настоящее время является одной из наиболее развивающихся областей хирургической науки. Этому в значительной мере способствовали расширение знаний анатомии и физиологии данной зоны, совершенствование оперативной техники, развитие трансплантационных технологий, улучшение хирургического оборудования и развитие анестезиологического обеспечения, а также интенсивной терапии в послеоперационном периоде. Все это обеспечило возможность выполнения значительных по объему резекций печени при различных хирургических, паразитарных и онкологических ее поражениях, а также при травме, что, в свою очередь, значительно улучшило прогноз для жизни у данных пациентов. Подобные вмешательства должны выполняться в специализированных крупных центрах хирургами со значительным опытом гепатопанкреатобилиарной, а в ряде случаев – трансплантационной хирургии печени. В то же время выполнение малых резекций печени в объеме сегмент- и даже секционэктомии в настоящий момент относят к категории «простых» операций, проведение которых возможно в общехирургическом стационаре без специальной подготовки хирурга, особенно если речь идет о небольших по размеру доброкачественных поражениях печени.
Однако близость некоторых сегментов печени к ее портальным или кавальным воротам, сложность и вариантность сосудистой и билиарной анатомии обуславливают значительную сложность выполнения хирургического вмешательства, что прежде всего справедливо по отношению к I и IVа сегментам печени (S1, S4a). Наличие злокачественных опухолей в области данных сегментов как первичного, так и вторичного характера зачастую обуславливает их нерезектабельность ввиду инвазии в воротную вену и ее ветви и/или печеночные вены и нижнюю полую вену. Выполнение радикальных операций в данном случае возможно только при использовании трансплантационных технологий, которые позволяют не только удалить пораженную часть печени, но и провести резекцию/реконструкцию магистральных сосудов, что позволяет рассчитывать на приемлемые отдаленные результаты. В случае доброкачественных опухолей с локализацией в сегментах S1 и S4a только тщательное предоперационное обследование и планирование, прецизионная хирургическая техника с тщательной идентификацией и протекцией портальных и кавальных сосудов печени и ее билиарных структур позволяют безопасно выполнить резекцию пораженного сегмента печени с опухолью без риска тяжелых интра- и послеоперационных осложнений, что обуславливает значительную техническую сложность подобных вмешательств. В связи с этим интересными представляются следующие клинические случаи.
Обсуждение
Хирургическое лечение небольших по размеру доброкачественных опухолевых и паразитарных образований печени в большинстве случаев не является технически сложным и предполагает выполнение как анатомических, так и неанатомических резекций в пределах 1‑2 сегментов органа. Однако при локализации опухоли вблизи портальных или кавальных ворот печени резекция представляет собой достаточно сложную проблему для оперирующего хирурга ввиду необходимости сохранения адекватного как афферентного, так и эфферентного кровотока органа и его билиарных структур. Еще более усложняет эту задачу значительная вариантная анатомия как сосудистых структур печени, так и ее желчных протоков.
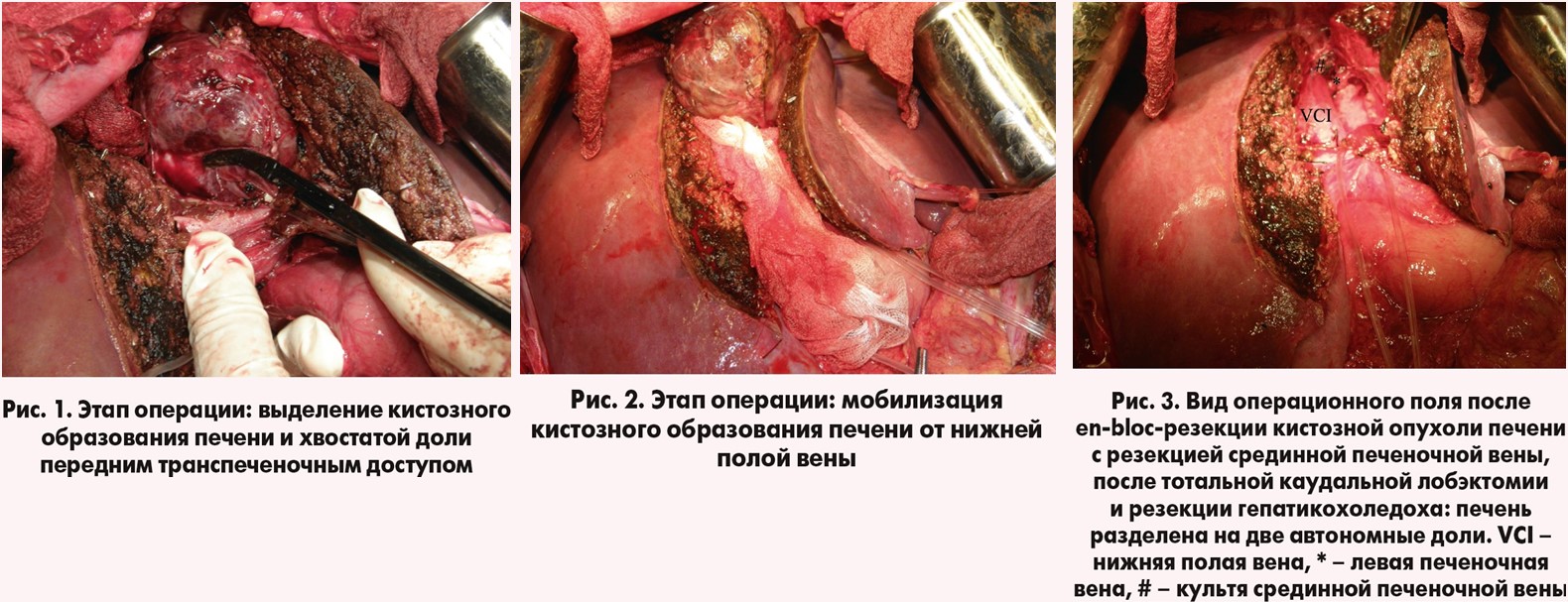
Так, по мнению Д. И. Скорого и соавт. (2016‑2018), хвостатая доля является частой зоной локализации как доброкачественных, так и злокачественных опухолей печени, а ее уникальная анатомия обуславливает технические особенности и специфические подходы к ее удалению. При этом хвостатая доля (I сегмент по C. Couinaud) является относительно автономной анатомической структурой печени, которая по мере дальнейшего совершенствования знаний анатомии печени в дальнейшем была разделена на два субсегмента: спигелиева доля (I сегмент) и паракавальная порция (IХ сегмент). При этом хвостатая доля печени может быть удалена как изолированно – тотальная каудальная лобэктомия, так и в комбинации с другими сегментами печени – зачастую с правой или левой долей печени при хирургическом лечении ее злокачественных опухолей. В соответствии с этим возможно использование четырех принципиальных доступов к хвостатой доле печени: правого, левого, билатерального и переднего. В соответствии с данными Д. И. Скорого и соавт., использование переднего транспеченочного доступа целесообразно при опухолях, тесно прилежащих к основным стволам печеночных вен, когда опухоль имеет большие размеры и находится в непосредственной близости к воротным структурам и нижней полой вене. Данный доступ обеспечивает необходимые условия для обработки афферентных трубчатых структур хвостатой доли печени и безопасное отхождение ее от кавальных и портальных структур.
Локализация злокачественных опухолей вблизи кавальных ворот печени, в частности в сегменте S4а печени, в большинстве случаев требует резекции печеночных вен или гепатокавального сегмента нижней полой вены, что в течение длительного времени определяло эти опухоли в категорию нерезектабельных. Однако современное развитие хирургической науки, и особенно трансплантологии, позволяет успешно оперировать подобные опухоли с достижением тотальной сосудистой изоляции печени. Варианты такой изоляции отличаются состоянием кровотока в нижней полой вене (полное прерывание или сохранение кровотока), а также числом и уровнем пересекаемых магистральных сосудов печени, что определяет топографическое положение органа во время резекции по отношению к изначальной ортотопической позиции органа (in situ, ex situ) и организму пациента в целом (in vivo, ex vivo). При этом наиболее оправданным в настоящее время при необходимости резекции кавальных ворот печени считается технология in vivo, ex situ или ante-situm, предложенная L. Hannoun (1991), поскольку подобные операции сопровождаются наиболее благоприятными исходами (Ефанов М.Г. и соавт., 2018). Вместе с тем доброкачественные образования печени в большинстве случаев не предполагают резекции сосудистых структур органа, однако при выполнении резекционных вмешательств на печени требуется тщательное и прецизионное разделение ее паренхимы с целью идентификации и предотвращения повреждений как афферентных, так и эфферентных сосудистых структур органа, нижней полой вены.
Выводы
Таким образом, локализация доброкачественных образований печени вблизи ее кавальных и/или портальных ворот представляет сложную задачу для хирурга. Выполнение резекции органа в таком случае должно выполняться только в специализированном учреждении хирургом со значительным опытом в области гепатопанкреатобилиарной хирургии. В случае выполнения резекционных вмешательств по поводу доброкачественных образований печени необходимо стремиться к сохранению магистральных сосудистых и билиарных структур печени, что достигается с помощью тщательной техники оперирования, а их резекция может быть выполнена только по строгим показаниям. При этом оперирующий хирург должен обладать навыком реконструкции сосудистых структур печени, если в этом возникает необходимость.
Клинический случай № 1
Пациентка, 46 лет, обратилась в клинику Института 07.03.2016 г. с жалобами на периодические боли в правом подреберье, повышение температуры тела до 38 °C. Указанные жалобы беспокоят около 1 года. Из анамнеза известно, что пациентка болеет несколько лет. Ранее была дважды оперирована по поводу желчнокаменной болезни и кист холедоха, в связи с чем ей были выполнены холецистэктомия и резекция кист холедоха.
В клинике Института пациентка была обследована. В лабораторных показателях – без существенных отклонений от нормы, за исключением гипербилирубинемии до 27 мкмоль/л с преобладанием непрямой фракции билирубина, а также повышением аланинаминотрансферазы (АЛТ) до 50,37 Ед/л. По данным компьютерной томографии (КТ) в медиальных сегментах S1, S4a, S8 печени, распространяясь в область портальных ворот печени на холедох до уровня его интрапанкреатической части, определяется мультикистозное образование размерами 52×54×65 мм с наличием множественных перегородок, усиливающихся при внутривенном контрастировании. По периферии кистозного образования на уровне позадипеченочной части нижней полой вены видны металлические швы. Основной ствол воротной вены, ее правая и левая ветви проходят по периферии образования, деформированы, контрастирование их сохранено. Печеночные артерии также проходят по периферии образования, контрастированы достаточно. Внутрипеченочные ходы неравномерно расширены. Печень не увеличена в размерах: переднезадний размер правой доли – 146 мм, контур печени местами неровный. В субкапсулярных отделах S8 печени определяется кистозный очаг размерами до 12 мм, без признаков контрастного усиления (киста?). В паренхиме S6, S7 печени видны два портовенозных шунта. Портальная вена расширена до 18 мм. В области ворот печени видны немногочисленные лимфоузлы размерами до 14 мм.
Заключение: КТ-признаки мультикистозного образования медиальных сегментов S1, S4а, S8 печени с распространением на холедох (билиарная цистаденома? билиарная цистаденокарцинома?).
Установлен диагноз: Цистаденома? Цистаденокарцинома внутрипеченочных желчных протоков?
Лечение: После краткой предоперационной подготовки пациентка прооперирована в плановом порядке. 18.03.2016 г. выполнено: лапаротомия; удаление образования внутрипеченочных желчных протоков в едином блоке с тотальной каудальной лобэктомией передним транспеченочным доступом, экстирпация гепатикохоледоха, лимфодиссекция гепатодуоденальной связки, бигепатикоеюностомия по Ру, дренирование брюшной полости.
Из протокола операции: «…Лапаротомия типа «мерседес». В брюшной полости – выраженный спаечный процесс – разъединение сращений. С существенными техническими трудностями выделены элементы гепатодуоденальной связки. Гепатикохоледох расширен неравномерно до 10‑20 мм. В области конфлюэнса долевых протоков в последний «впадает» кистозное образование, которое по бокам плотно сращено с долевыми портальными структурами, снизу – с нижней полой веной, сзади – с устьевыми отделами правой, левой и срединной печеночных вен. Образование полностью выполняет хвостатую долю печени. Попытки мобилизации и удаления образования с выполнением каудальной лобэктомии из правого, левого и воротного доступов – технически безуспешны. В связи с этим принято решение о выполнении переднего транспеченочного доступа. Выполнена транссекция паренхимы печени по линии Rex-Cantlie. Во время вмешательства тщательно идентифицировались сосудистые и билиарные структуры, а также выявлено, что срединная печеночная вена проходит в структуре кистозного образования, в связи с чем выполнена en-bloc-резекция кистозного образования со срединной печеночной веной, тотальной каудальной лобэктомией, экстирпацией гепатикохоледоха и лимфодиссекцией гепатодуоденальной связки. После операции сформировались две полностью автономные доли печени (рис. 1‑3).
Сформирован бигепатикоеюноанастомоз по Ру. Операция завершена дренированием брюшной полости тремя трубочными дренажами. Продолжительность операции – 575 мин, интраоперационная кровопотеря – 721 мл.
Послеоперационный период осложнился развитием острой печеночной недостаточности, которая проявилась нарушением коагуляции (ПТИ – 60%), гипо-, диспротеинемией (альбумин – 27%), транзиторной гипербилирубинемией и повышением активности аспартатаминотрансферазы (АСТ), АЛТ. На фоне проводимой интенсивной терапии явления печеночной недостаточности регрессировали. На 7-е послеоперационные сутки по данным ультразвукового исследования (УЗИ) отмечено скопление жидкости в зоне транссекции печеночной паренхимы, в связи с чем понадобилось ее чрескожное дренирование под ультразвуковой навигацией. Также с 8-х послеоперационных суток отмечены признаки рецидивного правостороннего гидроторакса, что потребовало его повторных пункций (2 раза).
Гистологическое заключение: Изменения более всего соответствуют папиллярной цистаденоме желчных протоков. Киста гепатикохоледоха.
Диагноз после операции: Билиарная цистаденома внутрипеченочных желчных протоков. Кистозная трансформация гепатикохоледоха. Хронический рецидивирующий холангит. Острая транзиторная послеоперационная печеночная(?) недостаточность. Острое поддиафрагмальное жидкостное скопление справа. Правосторонний рецидивный гидроторакс.
На фоне общего и местного лечения состояние пациентки с постепенной положительной динамикой. Раны зажили первичным натяжением. По данным УЗИ в динамике жидкостное скопление в правом поддиафрагмальном пространстве регрессировало. Выписана в удовлетворительном состоянии на амбулаторное лечение под наблюдением хирурга.
Пациентка осмотрена через 3 года после операции. Жалоб не предъявляет. Вернулась к прежней физической активности. Признаков рецидива заболевания по данным КТ не выявлено.
Клинический случай № 2
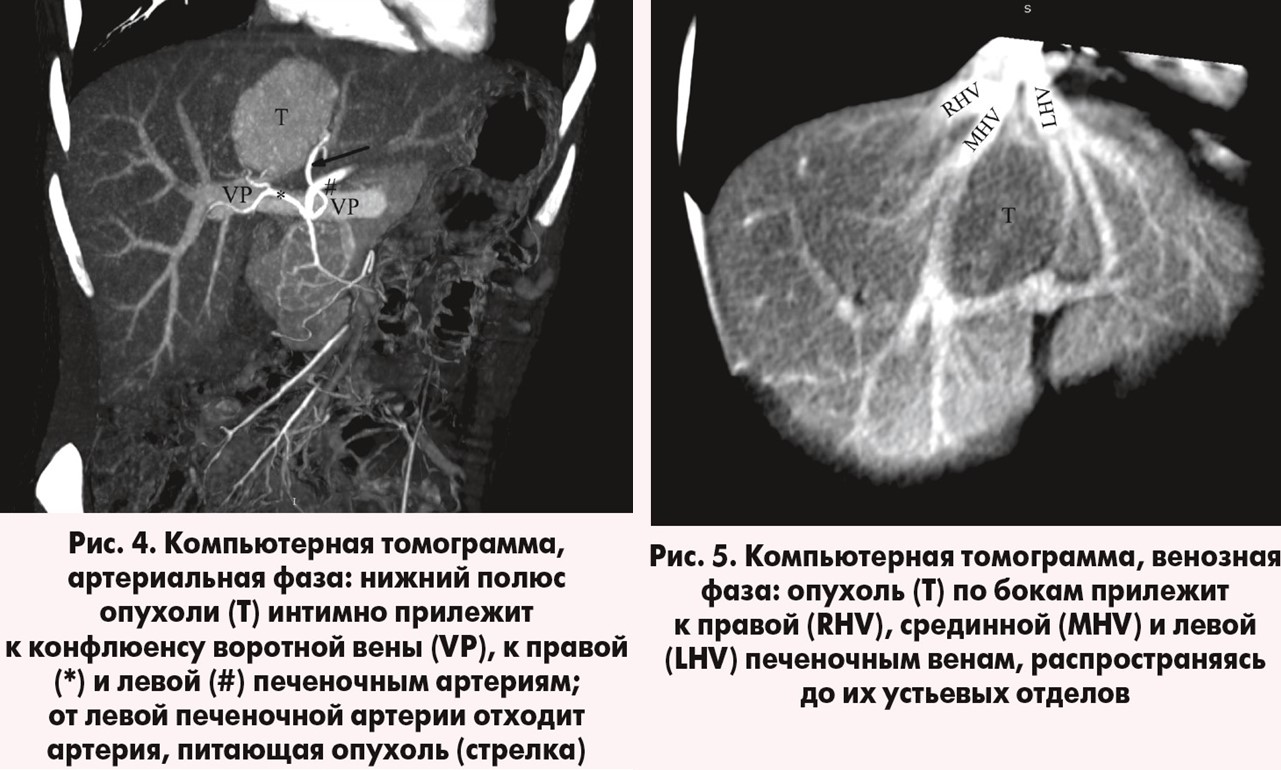
Пациентка, 28 лет, поступила планово с жалобами на дискомфорт в правой поясничной области, слабость. Из анамнеза: болеет около 1 месяца. При УЗИ было выявлено объемное образование в нижнем полюсе правой почки и в печени, в связи с чем пациентке была выполнена КТ: печень в размерах не увеличена, контуры четкие. В сегменте S4а определяется образование размерами 50×42×52 мм, интенсивно накапливающее контрастное вещество в артериальную фазу с последующим быстрым вымыванием. Нижний полюс образования прилежит к конфлюенсу воротной вены, окутан правой и левой печеночными артериями. По бокам образования определяются печеночные вены, верхний край образования прилежит к устьевым отделам печеночных вен, сзади – к позадипеченочному сегменту нижней полой вены. Контрастирование сосудов печени, нижней полой и воротной вен сохранено, контуры сосудов не изменены. Диаметр воротной вены – 10 мм. Внутри-, внепеченочные желчные протоки не расширены. Других патологических изменений в печени не выявлено.
Правая почка имеет нормальную форму, размерами 90×42 мм, с наличием участков локального истощения до 2 мм, на уровне которых визуализируются единичные кальцинаты размерами до 3×2 мм, плотностью до 660 HU. Полостная система не расширена, конкременты не определяются. Выделительная функция не нарушена. Субкапсулярно в нижнем полюсе определяется кистозное образование размерами 25×20×21 мм, неоднородной структуры за счет наличия септ, накапливающих контрастное вещество. Паранефральная жировая клетчатка не изменена. Левая почка – без особенностей. Лимфоузлы брюшной полости, забрюшинного пространства и тазовой локализации не определяются.
Заключение: КТ-признаки кистозного образования правой почки (III тип по Bosniak), объемное образование в сегменте S4а печени (фиброзно-нодулярная гиперплазия? аденома?) (рис. 4, 5).
В клинике Института пациентка дообследована. Лабораторные данные без отклонения от возрастной нормы.
Установлен диагноз: Рак правой почки T1N0M0, I стадия, II клиническая группа. Объемное образование (очаговая фиброзно-нодулярная гиперплазия) в сегменте S4а печени.
Лечение: Пациентка прооперирована в плановом порядке. 15.05.2019 г. выполнено: лапаротомия; резекция сегмента S4а печени с опухолью; удаление объемного образования нижнего полюса правой почки; дренирование брюшной полости.
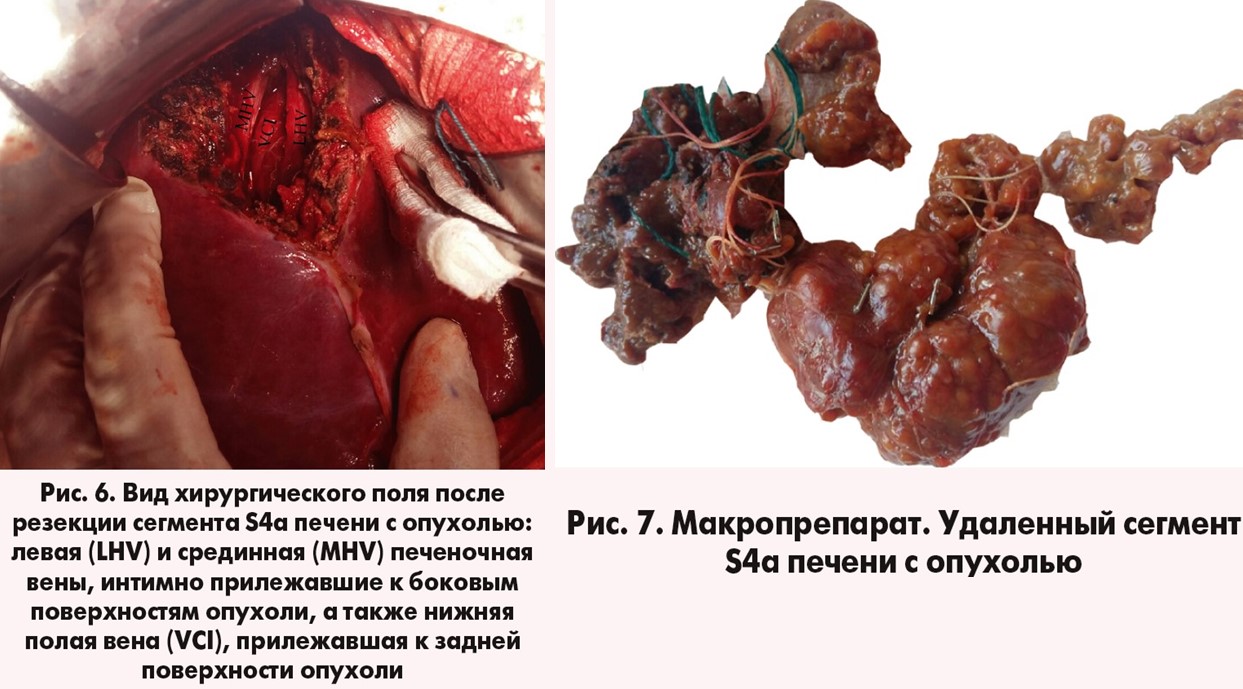
Из протокола операции: «…Выполнена J-лапаротомия. При ревизии: в толще паренхимы сегмента S4а печени определяется образование округлой формы до 5 см в диаметре. В нижнем полюсе левой почки определяется округлое тестоватой плотности образование, не связанное с окружающими тканями. Признаков локального и отдаленного метастазирования не выявлено. Произведена мобилизация обеих долей печени путем рассечения фиксирующих ее связок, печень вывихнута в операционную рану. По диафрагмальной поверхности проекционно, в соответствии с определяемыми в толще органа границами опухоли, рассечена паренхима сегмента S4а печени. Дальнейшее рассечение паренхимы выполнялось малыми порциями с помощью методики «clamp crushing» с прецизионной перевязкой мелких трубчатых структур. Идентифицированы и отделены от опухоли последовательно левая, срединная и правая печеночные вены вплоть до устьевых отделов. Опухоль мобилизована от нижней полой вены, являвшейся ее нижней границей, удалена. Мобилизован нижний полюс правой почки с опухолевидным образованием белесого цвета. Выполнено удаление опухоли правой почки по типу энуклеорезекции на расстоянии 2 см от видимого края опухоли. Брюшная полость дренирована тремя трубочными дренажами» (рис. 6, 7).
Продолжительность операции – 260 мин, интраоперационная кровопотеря – 215 мл.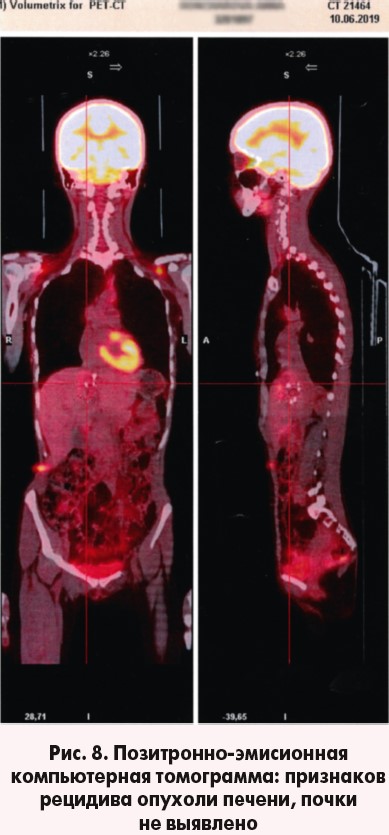
Течение послеоперационного периода без осложнений, дренажи удалены на 4‑5-е послеоперационные сутки. Раны зажили первичным натяжением.
Гистологическое заключение: объемное образование в печени соответствует фиброзно-нодулярной гиперплазии, в почке – аденокарцинома G1.
Диагноз после операции: Рак правой почки pT1N0M0G1, I стадия, II клиническая группа. Очаговая фиброзно-нодулярная гиперплазия S4а печени.
Пациентка выписана 25.05.2019 г. в удовлетворительном состоянии под наблюдение онколога, хирурга, уролога по месту жительства. Через 1 месяц обследована в Турции (Medical Park Hospital, Анталия), выполнена позитронно-эмиссионная томография, совмещенная с КТ (ПЭТ-КТ) – данных в пользу рецидива заболевания не выявлено (рис. 8).
Осмотрена в клинике Института через 1 год: состояние удовлетворительное, жалоб не предъявляет, вернулась к прежней физической активности. По результатам контрольной КТ данных в пользу рецидива заболевания не выявлено, в печени объемные образования не определяются.
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 3 (41), 2020 р.