23 січня, 2024
Азитроміцин як антибіотик деескалації і відновлення чутливості до деяких антибіотиків у грамнегативних збудників антибіотикорезистентних інфекцій
Україна стає антилідером із розповсюдження грамнегативних мультирезистентних мікроорганізмів в умовах стаціонару,
що становить серйозну загрозу здоров’ю людини. Інфікування мультирезистентними штамами значно ускладнює лікування пацієнтів стаціонарів, особливо реанімаційних і травматологічних відділень. На жаль, усе частіше такі інфекції мають профіль повної антибіотикорезистентності, що унеможливлює використання навіть антибіотиків резерву. У таких випадках ефективним рішенням може бути комбінована антибіотикотерапія.
 У листопаді відбувся VI міжнародний конгрес «Antibiotic resistance STOP!», присвячений питанням подолання антибіотикорезистентності. Старший науковий співробітник Інституту молекулярної біології і генетики НАН України (м. Київ), керівник групи з дослідження біоплівок, кандидат біологічних наук Олена Володимирівна Мошинець розповіла про роль біоплівок у перебігу інфекційного процесу і можливості комбінованої терапії мультирезистентних грамнегативних інфекцій азитроміцином і меропенемом.
У листопаді відбувся VI міжнародний конгрес «Antibiotic resistance STOP!», присвячений питанням подолання антибіотикорезистентності. Старший науковий співробітник Інституту молекулярної біології і генетики НАН України (м. Київ), керівник групи з дослідження біоплівок, кандидат біологічних наук Олена Володимирівна Мошинець розповіла про роль біоплівок у перебігу інфекційного процесу і можливості комбінованої терапії мультирезистентних грамнегативних інфекцій азитроміцином і меропенемом.
Невід’ємними компонентами інфекційного процесу є біоплівка (може бути як монокультурною, так і мультикультурною) (рис. 1), бактеріальні клітини (які відокремлюються від біоплівки та рухаються в напрямку інших (ще неколонізованих) ніш із метою формування нових вогнищ інфекційного процесу, тобто ще вільні від біоплівок еконіші, а також реакції імунної системи пацієнта на інфекцію (участь лейкоцитів) (рис. 2). Клінічна практика показує, що різні біоплівки проявляють різну чутливість до антибіотикотерапії. Це пов’язано зі структурою самої біоплівки, яка навіть у межах одного виду мікроорганізму може бути дуже різноманітною залежно від штаму.
Рис. 1. Біоплівка як форма інфекційного процесу
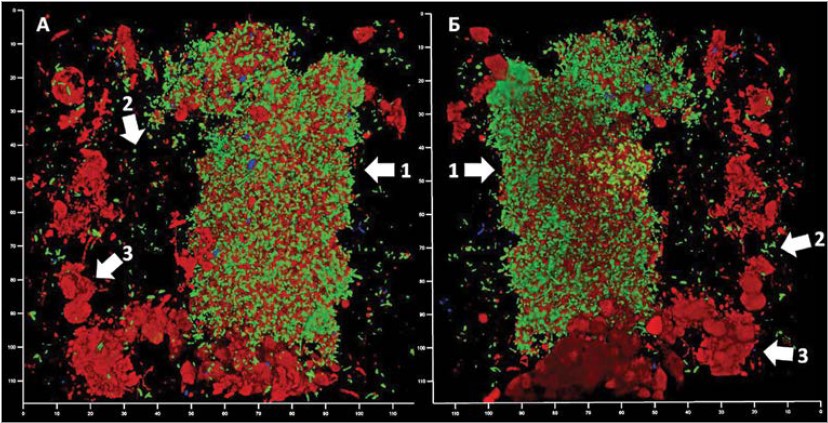
Рис. 2. Цитологічний ландшафт інфекційного осередку на прикладі підгострого пародонтиту, конфокальна лазерна скануюча мікроскопія, вітальний зразок, забарвлення позаклітинної ДНК і метаболічно неактивних клітин пропідієм бромідом (червоний сигнал) і метаболічно активних клітин SYBR green (зелений сигнал)
Примітки: А і Б – ландшафт препарату з двох боків. Стрілками відмічені складові компоненти інфекційного процесу, зокрема 1 – біоплівка, 2 – окремі планктонні бактеріальні клітини, 3 – лейкоцити.
Практичний досвід використання антибіотиків і лабораторні дослідження, зокрема дослідження 2017 року, продемонструвало, що на додаток до загального профілю нечутливості бактерій до антибіотиків, тобто до класичної генетичної антибіотикорезистентності, бактерії здатні до розвитку так званої фенотипової резистентності за рахунок розвитку біоплівки. Цей опосередкований утворенням біоплівки профіль стійкості є дуже специфічним для кожного ізоляту. Такий індивідуальний профіль резистентності залежить від структурних властивостей біоплівок. Більш того, антибактеріальна стійкість біоплівки не пов’язана із профілем стійкості культури в умовах планктонного росту, мукоїдною морфологією або морфологією невеликих колоній ізолятів. Натомість окремі структури біоплівок розвиваються під час розвитку інфекційного процесу, формуються під впливом специфічних сигналів навколишнього середовища. Профіль стійкості біоплівок є специфічним для ізолятів і не може бути передбачений із загальнодосліджених фенотипів. Отже, біоплівка є джерелом фенотипової резистентності. Індивідуалізована діагностика резистентності біоплівок може покращити дотримання раціональніших рекомендацій щодо антимікробної терапії та підвищення ефективності лікування хронічно інфікованих пацієнтів (Müsken M., Klimmek K., Sauer-Heilborn A. et al., 2017).
В іншому дослідженні було проаналізовано велику та різноманітну колекцію із 352 клінічних ізолятів Pseudomonas aeruginosa щодо їхньої антимікробної чутливості в умовах росту біоплівки до ципрофлоксацину, тобраміцину та колістину. Було виявлено, що різні клінічні ізоляти демонструють дуже широкий розподіл чутливості до трьох антибіотиків при вирощуванні в умовах біоплівки, навіть якщо вони демонструють однаково високу чутливість до протимікробних препаратів у планктонних умовах. Деякі клінічні ізоляти P. aeruginosa виявилися надзвичайно чутливими до антибіотиків; низькі концентрації антибіотиків зумовили значне зменшення кількості клітин, вирощених у біоплівці. Однак інші ізоляти значною мірою не реагували, а кількість клітин, вирощених у біоплівках, що вижили, знижувалася тільки за дуже високих концентрацій антибіотиків. Наприклад, дослідники порівняли біоплівкову чутливість до тобраміцину двох штамів P. aeruginosa, які мали однаковий МІК до тобраміцину, який дорівнював 1 мг/л. З’ясувалося, що два штами мали принципово різну біоплівкову чутливість до тобраміцину.
Таким чином, обидва клінічні ізоляти були чутливими до тобраміцину за результатами класичного мікробіологічного тесту, вони демонстрували однакове значення мінімальної інгібуючої концентрації (МІК) (МІК = 1 мкг/мл). Біоплівка штаму M70563004 реагувала на тобраміцин, утім, у більш високій концентрації (A), тоді як біоплівка штаму MHH0426 виявилася взагалі нечутливою до тобраміцину (Б) (Thöming J.G., Häussler S., 2022).
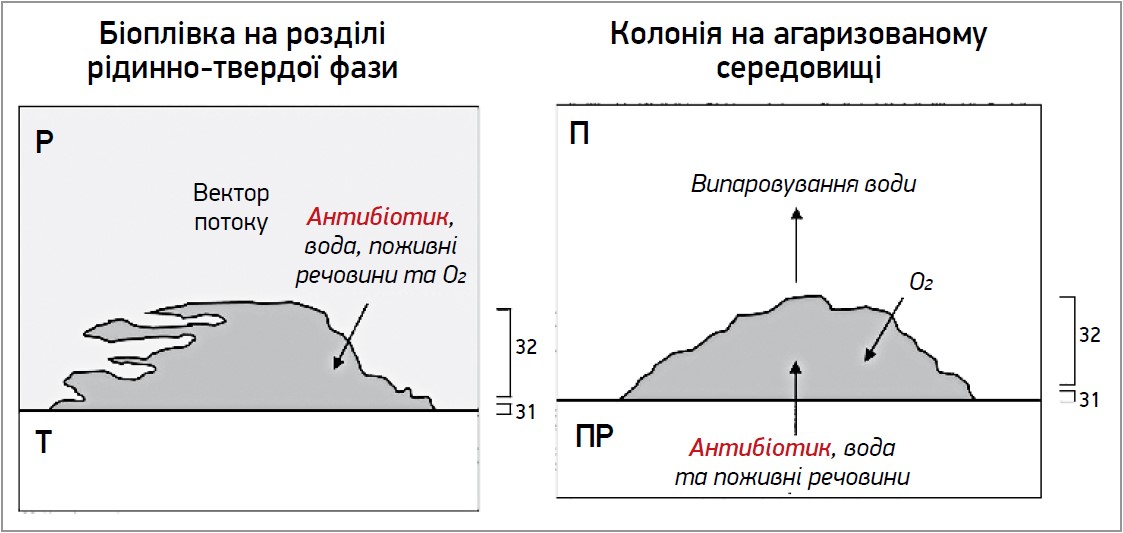
На відміну від біоплівки, яка є природним бактерійним агрегатом, агаризована колонія бактерій – це штучний тип агрегації мікробних клітин. Те, як біоплівка функціонує в організмі пацієнта (вектори проникнення кисню, поживних речовин і метаболітів), значно відрізняється від того, як це відбувається в агаризованих колоніях. У кожному типі агрегації шар клітин прикріплюється до твердої поверхні, а дистальні ділянки утримуються на місці взаємодією клітини та компонентів матриксу. В біоплівках з інтерфейсом «повітря – рідина» клітини та компоненти матриці також можуть прориватися через інтерфейс. Однак поживні речовини постачаються капілярним потоком (масовий транспорт) знизу колоній, тоді як у біоплівках розділу «повітря – рідина» і «рідина – тверда поверхня» вони транспортуються чи дифундують з навколишньої рідини (рис. 3). Саме тому дослідження антибіотикочутливості з використанням агаризованих колоній не дозволяє спрогнозувати чутливість біоплівок відповідних штамів (Moshynets O.V., Spiers A.J., 2016).
Рис. 3. Різниця векторів дифузії в біоплівці та колонії (адаптовано з Moshynets & Spiers, 2016)
Примітки: П – повітря; Р – рідина; ПР – пористе середовище; Т – тверде середовище.
В іншому дослідженні порівнювали дані метатранскрипотомів (сукупну транскрипційну активність геному, тобто які гени «працювали») бактерій, які спричиняли різні інфекції людини, що культивувались in vitro. Зокрема, для аналізу використовувалися результати секвенування РНК P. aeruginosa із трьох типів зразків: інфекції людини (включали зразки мокротиння пацієнта з муковісцидозом із Данії, інфекції м’яких тканин із Данії та США), інфекції мишей, культури in vitro. В результаті виявлено важливі відмінності в експресії генів, що беруть участь у стійкості до антибіотиків, міжклітинної комунікації та метаболізму. Виявилося, що P. aeruginosa в зразках людини та зразках in vitro має різні транскриптоми. Аналіз показав, що транскриптом P. aeruginosa під час зараження людини кластеризується окремо від транскриптомів in vitro, незважаючи на відмінності в місці зараження, терапевтичному режимі, географічних регіонах. Отже, фізіологічний стан бактерій в інфекційному середовищі та агаризованих колоніях різний. Розуміння закономірностей експресії бактерій у пацієнтів – необхідний крок на шляху поліпшення терапії та розробки точніших лабораторних моделей (Cornforth D.M., Dees J.L. et al., 2018).
Співробітниками інституту молекулярної біології і генетики НАН України в рамках виконання науково-технічної роботи за проєктом 2020.02/0246 «Розробка комбінованої терапії важких Klebsiella pneumoniae-асоційованих нозокоміальних інфекцій для подолання їхньої антибіотикорезистентності» за підтримки НФДУ за програмою «Підтримка досліджень провідних та молодих учених» (0120U104850) проводилася робота щодо дослідження можливої синергічної дії антибактеріальних препаратів метансульфонату колістину й азитроміцину. Використовуючи модельний штам Klebsiella pneumoniae ATCC10031, було встановлено, що серед восьми макролідних антибіотиків найбільший антибіоплівковий ефект щодо клебсієли мав азитроміцин. Також досліджувався синергізм азитроміцину і колістину в класичній моделі – на колоніях на агарі та в біоплівках. Зокрема, досліджувалося те, як змінюються зони затримки росту до дисків із поліміксином на агарі з азитроміцином і без нього для 11 штамів K. pneumoniae (5 мультирезистентні, 6 немультирезистентні) та як комбінація азитроміцину і колістину впливає на біоплівки цих самих штамів. Дослідження продемонструвало, що, по-перше, азитроміцин підвищував ефективність колістину для багатьох штамів, а по-друге, немає кореляції між ефектами обох антибіотиків у колоніях на агарі та в біоплівках. Тобто дослідження синергії антибіотиків, що зроблені в класичному мікробіологічному посіві, не відображають реальні фізіологічні процеси, що відбуваються в біоплівках і в осередку запалення. Отже, існує необхідність тестування антибіотиків на моделях біоплівок, де потенційний синергізм може відкрити нові терапевтичні можливості, що не спостерігаються в рідинних культурах, або в дослідженнях на колоніях бактерії (Moshynets O.V. et al., 2022).
Азитроміцин (на прикладі препарату Азимед®, таблетки, вкриті плівковою оболонкою, по 500 мг, виробництва АТ «Київмедпрепарат» (фармацевтична корпорація «Артеріум», лідер* роздрібного ринку антибактеріальних препаратів))** – це напівсинтетичний антибіотик широкого спектра дії, азалід, ефективний при лікуванні грампозитивних інфекцій, анаеробів, деяких грамнегативних збудників. Він посилює фагоцитоз, тропний до макрофагів, знижує експресію цитокінів, блокує експресію QS-залежних метаболітів (розвиток біоплівки, синтез токсинів, рамноліпідів, сидерофорів, факторів вірулентності) (Pollock J., 2021). Азитроміцин застосовується для лікування інфекційних респіраторних захворювань, урогенітальних інфекцій, інфекцій шкіри та м’яких тканин, кишкових інфекцій тощо. Азитроміцин належить до найменш токсичних антибіотиків (макроліди менш токсичні, ніж інші антибіотики, а азитроміцин – за інші макроліди), однаково безпечний і для дорослих, і для дітей (Jelić D., 2016). Крім того, серед макролідів азитроміцин має найкращий комплаєнс. Останніми роками в літературі все частіше наголошується на тому, що азитроміцин недооцінений для лікування грамнегативної флори (Powers J., 1996).
Деякі дані in vitro та обмежені дані, отримані на моделях тварин, підтверджують активність макролідів проти P. aeruginosa та інших резистентних грамнегативних патогенів. Переваги макролідів також були продемонстровані при муковісцидозі, бронхоектазі, не пов’язаних із муковісцидозом, а також у пацієнтів із хронічною обструктивною хворобою легень та хронічною інфекцією P. aeruginosa. Однак для оцінки макролідів як антибіотиків для лікування інфекцій, спричинених P. aeruginosa та широко стійкими грамнегативними мікроорганізмами, необхідні додаткові клінічні дані (наразі обмежені незначною серією випадків). Якщо буде доведено їхню активність, макроліди (потенційно в поєднанні з іншими антибіотиками) можуть виявитися корисним варіантом лікування інфекцій, спричинених патогенами, з обмеженими або відсутніми іншими можливостями лікування (Karakonstantis S., 2022).
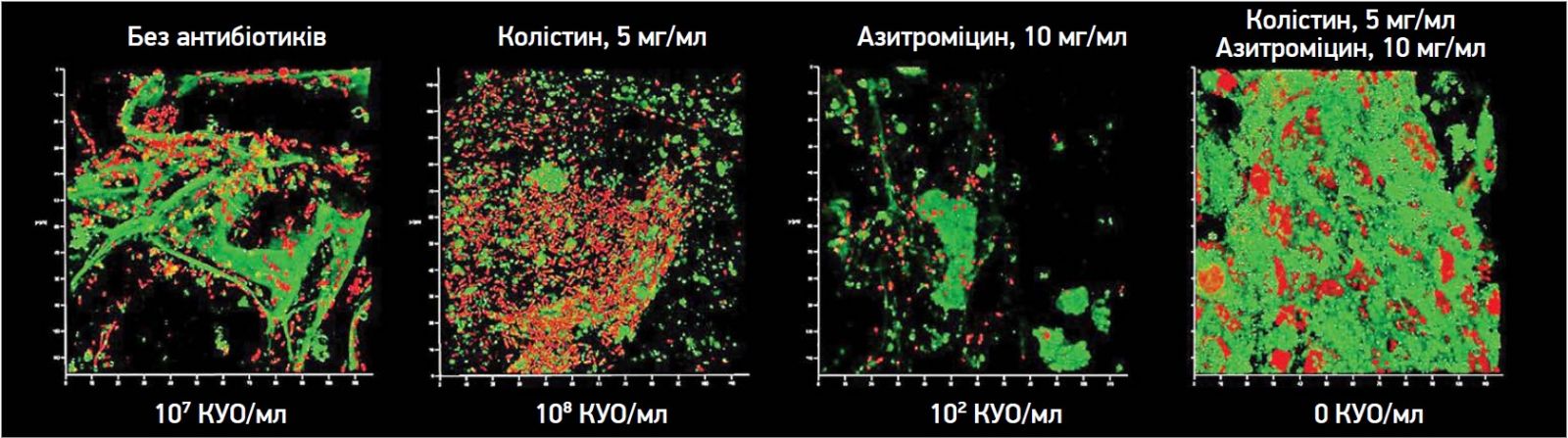
Наші власні дослідження підтвердили, що за умов, наближених до умов in vivo, азитроміцин сам по собі стає високоефективним антибіотиком для пригнічення утворення біоплівки в моделі тканини людини. Додавання колістину повністю пригнічувало інфекційний процес у таких умовах (рис. 4).
Рис. 4. Модель ранової поверхні, клітинна лінія HEK923 була використана як епітелізовані клітини, забарвлення етидієм бромідом (червоні ядра), колагеновий 3D матриксовий носій відтворював матрикс шкіри, забарвлення Amy Green (зелене забарвлення), багате поживне середовище відтворювало рановий ексудат. Полірезистентний штам KP UHI 1090 (бактеріальні клітини забарвлено червоним) вносився до моделі як інфекція за різних антибіотиків, інкубація відбувалася протягом 2 діб (адаптовано з Moshynets et al., 2023)
Подальші дослідження впливу азитроміцину на загальний профіль стійкості до антибіотиків на прикладі 4 мультирезистентних штамів K. pneumoniae (KP UHI 329, KP UHI 1633, KP UHI 1090, KP UHI 1667) показали, що азитроміцин здатен відновити чутливість до деяких бета-лактамних антибіотиків, зокрема до меропенему (на прикладі препарату Мепенам, порошок для розчину для ін’єкцій, виробництва АТ «Київмедпрепарат» (фармацевтична корпорація «Артеріум», лідер* роздрібного ринку антибактеріальних препаратів))**.
Базуючись на цих дослідженнях, азитроміцин було запропоновано включити у схему лікування пацієнтів із тяжкими панстійкими грамнегативними інфекціями. Один із таких випадків було описано у Kryzhevsky та співавт. (2023). У цьому клінічному випадку, зокрема, продемонстровано ефективність включення до схеми лікування комбінованої терапії азитроміцином і меропенемом, що зумовила покращення стану пацієнта й ерадикацію резистентних штамів. У хворого (травми, пов’язані з бойовими діями) діагностовано сепсис, спричинений панрезистентною мультиінфекцією. Протягом перших 8 днів виявлялися лише грамнегативні ізоляти, чутливі до тайгецикліну. Незважаючи на рекомендовану комбіновану антимікробну терапію колістином і тайгецикліном, стан хворого погіршився, а це свідчило про те, що фенотипова стійкість як до колістину, так і до тайгецикліну розвивалася після утворення біоплівок під час інфекційного процесу. Альтернативна комбінована терапія азитроміцином (500 мг кожні 8 год з 10-го по 37-й день лікування) і меропенемом (2 г кожні 8 год внутрішньовенно з 17-го до 37-го дня лікування) продемонструвала сильний синергічний ефект in vivo. Це спричинило швидку нормалізацію прокальцитоніну (від 0,8 до <0,25 нг/мл), лейкоцитів, паличкоядерних гранулоцитів, стабілізацію співвідношення нейтрофілів і лімфоцитів. Автори наголошують, що цей синергізм не може спостерігатися для окремих ізолятів у стандартних мікробіологічних тестах in vitro, оскільки залежить від біоплівки та є специфічним in vivo через підвищену бактерицидну ефективність азитроміцину у фізіологічному середовищі. Інакше кажучи, коли інфекція спричинена грамнегативними бактеріями із фенотипом XDR/PDR, азитроміцин/меропенем можна застосовувати без додаткового тестування синергізму.
Висновки
- Інфекційний процес розвивається через утворення локальних біоплівок інфекційними штамами.
- Біоплівка – джерело спонтанної фенотипової резистентності in vivo, що завжди має бути враховано під час призначення терапії та впродовж лікування, для чого обов’язковою є оцінка ефективності терапії на 3-й день лікування.
- Біоплівка може бути новою терапевтичною мішенню.
- Нові комбінації антибіотиків можуть діяти синергічно, щоб пригнічувати ріст бактеріальних патогенів, стійких до лікарських засобів, але передбачити, яка комбінація буде успішною, складно; стандартне тестування чутливості до антибіотиків може не виявити важливих фізіологічних відмінностей між планктонними бактеріальними клітинами, що вільно існують, та прикріпленими бактеріальними клітинами, що захищені біоплівками.
- Азитроміцин може бути використаний як антивірулентна терапія при сепсисі.
- Комбінована терапія азитроміцином та меропенемом може бути терапевтичним рішенням для лікування грамнегативних інфекцій із високою резистентністю.
* Роздрібний аудит Sale out Системи дослідження фармацевтичного ринку Pharmxplorer, «Проксіма Рісерч Інтернешнл», березень 2023 р.
** Примітка редакції.
Підготував Олександр Соловйов
Медична газета «Здоров’я України 21 сторіччя» № 23-24 (560-561), 2023 р