13 вересня, 2024
Напад мігрені: що обрати для ефективного знеболення?
Мігрень – хронічна неврологічна хвороба, якій притаманні напади пульсувального (зазвичай однобічного) головного болю, що посилюється під час фізичного навантаження; асоціюється з фото- і фонофобією, нудотою, блюванням та (нерідко) алодинією шкіри (International Headache Society, 2018).
Відповідно до ІІІ перегляду Міжнародної класифікації розладів, що супроводжуються головним болем, істинна мігрень має відповідати таким критеріям:
а. щонайменше 5 нападів, які відповідають критеріям б-г;
б. тривалість нападу головного болю – 4-72 год (за відсутності лікування чи в разі невдалого лікування);
в. головному болю притаманні щонайменше 2 з 4 таких характеристик:
1 – однобічна локалізація;
2 – пульсувальний характер;
3 – помірна чи значна інтенсивність болю;
4 – посилення болю при рутинній фізичній активності (ходьба, підйом сходами) або потреба в уникненні цих активностей через посилення болю;
г. під час нападу головного болю спостерігається щонайменше 1 з нижчезазначених ознак:
1 – нудота та/або блювання;
2 – фото- і фонофобія;
ґ. відповідніший діагноз відсутній (International Headache Society, 2018).
Мігрень є дуже поширеною і характеризується значним тягарем, який накладається на життя пацієнта. Підраховано, що в світі на мігренозні напади страждають майже 1 млрд людей (Global Burden of Disease Collaboration, 2019). Загалом розповсюдженість мігрені (хоча б 1 нападу на рік) становить 18% у жінок і 6% у чоловіків; її пік припадає на вікову категорію 25-55 років. До пубертату поширеність мігрені в хлопців і дівчат є приблизно однаковою й становить 3-7%, однак у віці ≈30 років міжстатева розбіжність є найбільшою: жінки утричі частіше страждають на мігренозні атаки. Напади мігрені значно порушують функціональні здатності людини під час навчання чи роботи, а також при соціальних взаємодіях (Ailani J. et al., 2021; Deiner H.C. et al., 2019).
Мігрень також асоціюється зі значними фінансовими витратами: лише в США на лікування цього захворювання щороку витрачають 27 млрд дол. (Raval A.D., Shah A., 2017; Munakata J. et al., 2009). Окрім самих нападів головного болю, мігрень супроводжується підвищеним ризиком інших патологічних станів, включаючи тривожність, депресію, бронхіальну астму, епілепсію, інсульти (Buse D.C. et al., 2020).
Консенсусний документ Американського товариства головного болю (2021) чітко розподіляє лікування мігрені на гостре та профілактичне. Цілями гострого лікування є швидке і стійке усунення болю й асоційованої з ним симптоматики та відновлення нормального функціонування організму людини. Із цією метою застосовуються неспецифічні фармакологічні препарати (нестероїдні протизапальні препарати (НПЗП), неопіоїдні аналгетики, парацетамол, комбіновані кофеїновмісні аналгетики) та мігрень-специфічні засоби (триптани, дигідроерготамін, гепанти, селективні агоністи серотонінових рецепторів). Своєю чергою, цілями профілактичного лікування є зниження частоти, тяжкості, тривалості нападів; покращення відповіді на лікування; досягнення самоконтролю хвороби, покращення якості життя. Профілактичне лікування слід розглянути особам, у яких напади мігрені виникають часто та/або значно порушують щоденне життя, незважаючи на лікування, а також пацієнтам, у котрих препарати для гострого лікування неефективні чи протипоказані. Пропонуючи хворому індивідуальний план лікування, слід повідомити йому про важливість правильного харчування, регулярних фізичних навантажень, належної гідратації організму, достатньої кількості сну та контролю стресу. Доцільно також виявити власні тригери нападів за допомогою щоденника мігрені та уникати їх у майбутньому. Критерії успішного профілактичного лікування: зниження кількості днів із мігренню на 50%, достовірне зниження тривалості та тяжкості нападу (за суб’єктивною оцінкою пацієнта), поліпшення відповіді на гостре лікування, зменшення обмеження функціональних можливостей під час нападу, покращення якості життя та зменшення асоційованого з мігренню психологічного стресу.
Незважаючи на наявність широкого спектра фармакотерапевтичних засобів для лікування мігрені, низка потреб пацієнтів залишається незадоволеною. Одна із причин – недостатня обізнаність лікарів первинної ланки щодо лікування цієї хвороби (насамперед у профілактичному режимі). Ця недостатня обізнаність нерідко обумовлює зловживання і неправильне застосування препаратів невідкладної допомоги за мігренозних нападів (Bentivegna E. et al., 2024).
Хоча мігрені притаманний типовий больовий синдром, значній частці пацієнтів правильний діагноз установлюється лише через 10 років після початку хвороби, а належна фармакотерапія призначається при відвідуванні щонайменше четвертого за рахунком медичного закладу (Kim B.K. et al., 2021). Згодом лікування нерідко виявляється неефективним через питання безпеки, переносимості та доступності призначених препаратів. Для оптимізації терапії лікарі повинні підібрати найкращий препарат для конкретного пацієнта, орієнтуючись водночас не лише на ефективність, а й на типові для цієї активної речовини побічні ефекти. Так, β-блокатори можуть спричиняти гіпотензію, брадикардію, імпотенцію та явища летаргії; протиепілептичні препарати – нудоту, парестезії, утруднення концентрації; антидепресанти – подовження інтервалу QT, нудоту, запаморочення. Опіоїди сприяють хронізації процесу, чинять проноцицептивний ефект і погіршують ефективність триптанів. Побічними ефектами моноклональних антитіл до пептиду, зв’язаного з геном кальцитоніну, є закрепи та локальні реакції у ділянці ін’єкції. Іще одна група препаратів – дитани, котрі активно проникають через гематоенцефалічний бар’єр, що обумовлює їхню здатність зумовлювати запаморочення, сонливість, втомлюваність. Усі ці побічні ефекти можуть погіршувати прихильність до лікування, спричиняти зловживання препаратами для гострого лікування, провокувати поліпрагмазію, опосередковано сприяючи хронізації патологічного процесу, ускладненню лікування (Bentivegna E. et al., 2024; Ferrari M.D. et al., 2019).
Класичні засоби для усунення гострих нападів мігрені – НПЗП і триптани. Як відомо, НПЗП притаманна значна кількість побічних ефектів (нефротоксичність, підвищення імовірності кровотеч, несприятливий вплив на шлунково-кишковий тракт) (Bindu S. et al., 2020). Своєю чергою, триптани через вазоконстрикторну дію не рекомендовані пацієнтам з анамнезом цереброваскулярної хвороби та встановленим діагнозом серцево-судинного захворювання (Bigal M.E. et al., 2010).
Триптани були впроваджені в медицину на початку 1990-х рр. і досі залишаються золотим стандартом лікування мігрені (Bentivegna E. et al., 2024). Аналіз лікування понад 3 млн мігренозних нападів у реальній клінічній практиці Великої Британії, США та Канади виявив, що найвищу оцінку хворі надають саме триптанам (Wilcha R.-J. et al., 2024). Цій групі препаратів притаманний найвищий ступінь ефективності в усуненні гострого нападу мігрені. Триптани слід застосовувати при тяжких мігренозних болях або у випадку мігреней, які не відповідають на аналгетики, їхні комбінації з кофеїном та/або НПЗП. Лікування триптанами є ефективним для мігреней з аурою та без неї. Якщо після первинного покращення стану біль рецидивує, слід застосувати повторну дозу триптану (щонайменше через 2 год після першої) (Diener H.C. et al., 2022).
Механізм дії триптанів полягає у звуженні краніальних артерій (здебільшого базилярної артерії, артерій твердої мозкової оболонки) та інгібуванні вивільнення нейропептидів, які опосередковують больові відчуття. Найпершим і найкраще вивченим триптаном є суматриптан (Pellesi L. et al., 2024). Цьому препарату властива висока ефективність в усуненні мігренозного болю, яка перевищує показники інших препаратів (табл.) (Diener H.C. et al., 2022).
|
Таблиця. Порівняльна ефективність триптанів та інших аналгетиків у лікуванні нападів мігрені |
|
|
Препарат |
Відносна ймовірність відсутності болю через 2 год порівняно із плацебо |
|
Суматриптан, 100 мг |
3,85 |
|
Елетриптан, 40 мг |
3,35 |
|
Наратриптан, 2,5 мг |
2,52 |
|
Ризатриптан, 10 мг |
2,43 |
|
Ацетилсаліцилова кислота + парацетамол + кофеїн |
2,2 |
|
Ацетилсаліцилова кислота |
2,08 |
|
Золмітриптан, 2,5 мг |
2,06 |
|
Ібупрофен, 400 мг |
1,91 |
|
Парацетамол |
1,89 |
|
Алмотриптан, 12,5 мг |
1,68 |
Суматриптану притаманні також відмінні показники безпеки. Хоча всім триптанам властивий класовий ефект у формі підвищення кардіо- та цереброваскулярного ризику, на тлі вживання суматриптану частота побічних явищ, які загрожують життю (інфаркт міокарда, інсульт, тяжка аритмія), є надзвичайно низькою – в межах 1 випадку на 1 млн застосувань препарату, причому практично в усіх випадках серйозних побічних явищ пацієнти мали протипоказання до застосування суматриптану або діагноз мігрені було встановлено помилково (Ghanshani S. et al., 2020; Welch K.M.A. et al., 2000). Слід зауважити, що суматриптан, як і всі триптани, слід вживати після закінчення аури (рис.) (Bates D. et al., 1994; Olesen J. et al., 2004).
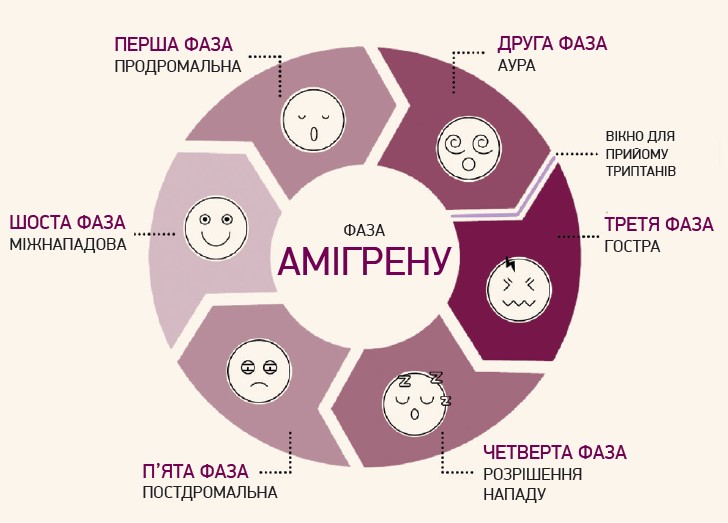
Рис. Фази мігрені та оптимальне часове вікно для вживання триптанів
Окрім мігренозного головного болю, суматриптан зменшує вираженість асоційованих із ним супутніх симптомів: фотофобії, нудоти, порушення щоденного функціонування (Brar Y. et al., 2023). У рекомендаціях Американського товариства головного болю (Diener H.C. et al., 2019) надано пораду застосовувати суматриптан для гострого лікування мігреней помірної та значної тяжкості. Суматриптан також застосовується off-label для лікування мігренозних болів у дітей та підлітків (Barbanti P. et al., 2019). Найбільша доказова база суматриптану (порівняно з іншими засобами цієї групи) та дані реєстрів відстеження наслідків вагітності дозволяють вважати його препаратом вибору для усунення мігренозних нападів у вагітних. Аналогічно суматриптан може застосовуватися в жінок, які годують грудьми, без потреби у зціджуванні порції молока після вживання препарату (Diener H.C. et al., 2022).
Суматриптан може застосовуватися і для профілактики мігрені, наприклад, у форматі т. зв. мініпрофілактики. Так, у дослідженні L.C. Newman і співавт. (1998) профілактика суматриптаном (25 мг 3 р/добу за 2-3 дні до очікуваного початку нападу протягом 5 днів) дозволила уникнути нападу асоційованої з менструацією мігрені в 52,4% випадків і зменшити інтенсивність болю на ≥50% у 42% випадків.
Висновки
Мігрень – поширена неврологічна патологія, яка посідає одне із провідних місць серед причин головного болю в усьому світі.
Лікування мігрені передбачає застосування загальних аналгетичних та мігрень-специфічних засобів, а також гостру (невідкладну) терапію і профілактичне лікування.
Золотим стандартом невідкладної терапії мігренозних нападів є триптани, найпотужнішу доказову базу серед яких має суматриптан.
Висока ефективність (порівняно з іншими засобами) та відмінні показники безпеки дозволяють застосовувати суматриптан для лікування помірно тяжких і тяжких нападів мігрені в різних категоріях пацієнтів (у т. ч. у вагітних й у жінок, які годують грудьми). Можливе також застосування суматриптану в режимі мініпрофілактики.
Довідка «ЗУ»
Амігрен (ТОВ «АСТРАФАРМ», Україна) – вітчизняний препарат суматриптану, представлений у двох найчастіше використовуваних дозах – 50 та 100 мг. Відповідно до інструкції для медичного застосування препарату, Амігрен показаний для швидкого полегшення стану при нападах мігрені (з аурою чи без неї). Після перорального застосування суматриптан швидко всмоктується, досягаючи 70% максимальної концентрації уже через 45 хв. Застосування Амігрену є хорошим вибором для пацієнтів, які не реагують на НПЗП та/або аналгетики на основі парацетамолу чи ацетилсаліцилової кислоти.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 15 (576), 2024 р



