23 травня, 2021
Місце JAK-інгібіторів у сучасній стратегії лікування ревматоїдного артриту
У лікуванні автоімунних захворювань, таких як ревматоїдний артрит (РА), за останнє десятиліття вдалося досягти значних успіхів завдяки розробці біологічних засобів, спрямованих на запальні цитокіни. Нещодавній прогрес у терапії РА був пов’язаний з інгібіторами янус-кінази (JAK) – доступних та ефективних пероральних хворобомодифікувальних препаратів (ХМП) нового покоління. Ефективність та безпеку окремих представників зазначеної групи ліків було всебічно розглянуто під час науково-практичної конференції у форматі онлайн «Коморбідність у ревматології: особливості діагностики та лікування» (17‑19 березня 2021 року).
Стратегія лікування РА
Про особливості стратегії терапії хворих на РА розповів завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця (м. Київ), д. мед. н., професор Олег Борисович Яременко. Як зауважив доповідач, протягом останніх десятирічь стратегії лікування РА змінювалися. Якщо у 80-х рр. минулого століття ключовою метою терапії була боротьба з болем та скутістю, а основним її принципом – зменшення симптомів, то у 90-х рр. на перший план вийшли зменшення структурних пошкоджень та уповільнення інвалідизації.
Як зауважив доповідач, протягом останніх десятирічь стратегії лікування РА змінювалися. Якщо у 80-х рр. минулого століття ключовою метою терапії була боротьба з болем та скутістю, а основним її принципом – зменшення симптомів, то у 90-х рр. на перший план вийшли зменшення структурних пошкоджень та уповільнення інвалідизації.
Початок 2000-х рр. ознаменувався впровадженням у практику інгібіторів фактора некрозу пухлин (ФНП), які зробили реальністю досягнення стійкої ремісії / низької активності захворювання. Вже з 2010 р. предметом активного обговорення стали проблеми коморбідності, попереджання наслідків хвороби та зменшення смертності, а цільовою терапією РА – стратегія «лікувати до цілі» (treat to target, Т2Т), основною метою якої є досягнення ремісії (Smolen et al., 2010). При цьому розглядаються певні часові обмеження – 3‑6 місяців після встановленого діагнозу, оскільки далі відбуваються незворотні зміни, які суттєво зменшують ефективність лікування та погіршують прогноз. Якщо ремісії досягти не вдається, альтернативною метою є низька активність захворювання на мінімальних компонентах медикаментозного лікування та збереження таких умов протягом тривалого часу.
! Разом із досягненням клінічної ремісії або низької активності захворювання поліпшення якості життя є ключовим принципом цільового лікування РА.
Лікувальну стратегію Т2Т без суттєвих змін було переглянуто 2016 р. (Smolen et al., 2016). Рекомендовано кожні 1‑3 місяці переглядати терапію з метою якнайшвидшого досягнення ремісії / стійкої низької активності РА та підтримки прийнятного клінічного профілю захворювання. При цьому необхідним є регулярний моніторинг активності хвороби та прогнозу РА.
З цією метою слід проводити комплексну оцінку активності за індексами ACR20, ACR50, ACR70, DAS28, CDAI, JADAS, аналіз прогнозу за ревматоїдним фактором, ерозіями на рентгенограмі, а також порушення функції та позасуглобових проявів. В Україні, відповідно до Універсального протоколу ведення пацієнтів із РА (2014), критерії активності захворювання визначають за індексами SDAI, CDAI та DAS28, при цьому сьогодні найбільш доказово обґрунтованим та уніфікованим для використання у клінічній практиці залишається DAS28.
Зазначена стратегія активно впроваджувалася протягом останнього десятиріччя та впевнено продемонструвала свою результативність. Пацієнти з РА мають підвищений рівень смертності порівняно із загальною популяцією, переважно через серцево-судинні (СС) та інші супутні захворювання, а також інфекції. Натомість своєчасне застосування сучасних ХМП сприяє підвищенню ефективності лікування та покращує прогноз (Jacobsson et al., 2007).
Янус-кінази та їх інгібітори
Засоби фармакотерапії РА еволюціонували від препаратів для симптоматичного лікування, комбінованої та біологічної терапії ХМП до інгібіторів JAK (Roder et al., 2015). Останні отримали свою назву на честь Януса із двома обличчями, оскільки JAK мають два майже ідентичних домени, що переносять фосфат. Один із них характеризується кіназною активністю, а другий негативно регулює кіназну активність першого.
Наразі відомо чотири представники цього класу ферментів – JAK1, JAK2, JAK3, ТYK2 (тирозинкіназа‑2), що функціонують разом для передачі сигналів із поверхні клітини до ядра (Fragoulis et al., 2019). Вони є внутрішньоклітинними нерецепторними тирозинкіназами, що регулюють сигнальні шляхи. При цьому для кожного цитокіну існує власна комбінація JAK, яка має біологічне значення щодо множинних патофізіологічних мішеней (як-то Т-клітинний гомеостаз, запалення, гранулоцитопоез, антивірусні властивості, вроджений імунітет тощо).
Загалом JAK-кінази залучені до широкого спектра імунних і клітинних функцій, таких як проліферація та диференціювання клітин, їхня міграція й апоптоз, проти-/прозапальні ефекти, гематопоез, вроджений і набутий імунітет. Багато цитокінів та факторів росту перетинаються на сигнальному шляху JAK, при цьому кіназ усього чотири, що дає можливість препаратам із селективним впливом на одну чи декілька кіназ зумовлювати однаковий клінічний результат.
На даний час розроблено низку JAK-інгібіторів, деякі з яких вже зареєстровані та використовуються у клінічні практиці, а деякі ще перебувають у тій чи іншій фазі клінічних випробувань. В Україні для лікування РА затверджений перший пероральний JAK-інгібітор тофацитиніб (Ксельянз, Pfizer).
JAK-інгібітори мають унікальний механізм дії, спрямований на сигналювання багатьма цитокінами одночасно в межах шляху JAK-STAT, тоді як біологічні антиревматичні ХМП (бХМАРП) впливають на окремий запальний цитокін / клітинну функцію (Fragoulis et al., 2019). JAK-інгібітори ефективні при невдалому лікуванні іншими ХМП, зокрема бХМАРП, до того ж серед їхніх переваг варто відзначити простоту застосування (пероральна форма), швидкий початок дії (вже через два тижні від початку терапії) та сприятливу переносимість, зіставну із бХМАРП (Taylor, 2019).
Щодо пріоритетів у формуванні медикаментозної стратегії лікування хворих на РА, доцільним варіантом ініціації терапії є метотрексат (МТ) (EULAR, 2019). Якщо мети не досягнуто, додають бХМАРП чи таргетний синтетичний ХМАРП (сХМАРП). Коли ж мети все одно не вдалося досягти, варто перевести пацієнта на інший клас препаратів (ACR, 2020). Доцільно зауважити, що JAK-інгібітори не є бХМАРП, тому вони не викликають продукцію антитіл до препарату. Монотерапія JAK-інгібіторами ефективна, але не настільки, як комбіноване лікування. У пацієнтів, що добре переносять МТ, комбіноване застосування JAK-інгібітора та МТ – краще рішення, ніж перехід на монотерапію. Натомість у пацієнтів, що погано переносять МТ, монотерапія JAK-інгібіторами є доцільною (Choy et al., 2019).
Тофацитиніб: перший та найбільш вивчений JAK-інгібітор
Тофацитиніб є першим та найбільш вивченим пероральним JAK-інгібітором. За кількістю досліджень, що були проведені із залученням хворих на різні форми РА, зокрема, резистентних до МТ та біологічних засобів, тофацитиніб (Ксельянз) є безумовним лідером серед інших JAK-інгібіторів.
! Щодо JAK-інгібітора тофацитинібу, доступно до 9,5 років довгострокових даних з ефективності та безпеки при лікуванні РА.
Тофацитиніб – пан-JAK-інгібітор (JAK1/3-інгібітор із незначною активністю щодо JAK2 та ТYK2, затверджений Управлінням із контролю за якістю харчових продуктів та медикаментів США (FDA) та Європейським агентством із лікарських засобів (EMA). Тофацитиніб затверджений у більш ніж 90 країнах за показанням РА, – його застосовують 208 тис. пацієнтів (Winthrop et al., 2016).
! JAK-інгібітори, зокрема тофацитиніб, рекомендовано міжнародними асоціаціями ревматологів для лікування РА – Американською колегією ревматологів (ACR, 2015) та Європейською антиревматичною лігою (EULAR, 2019).
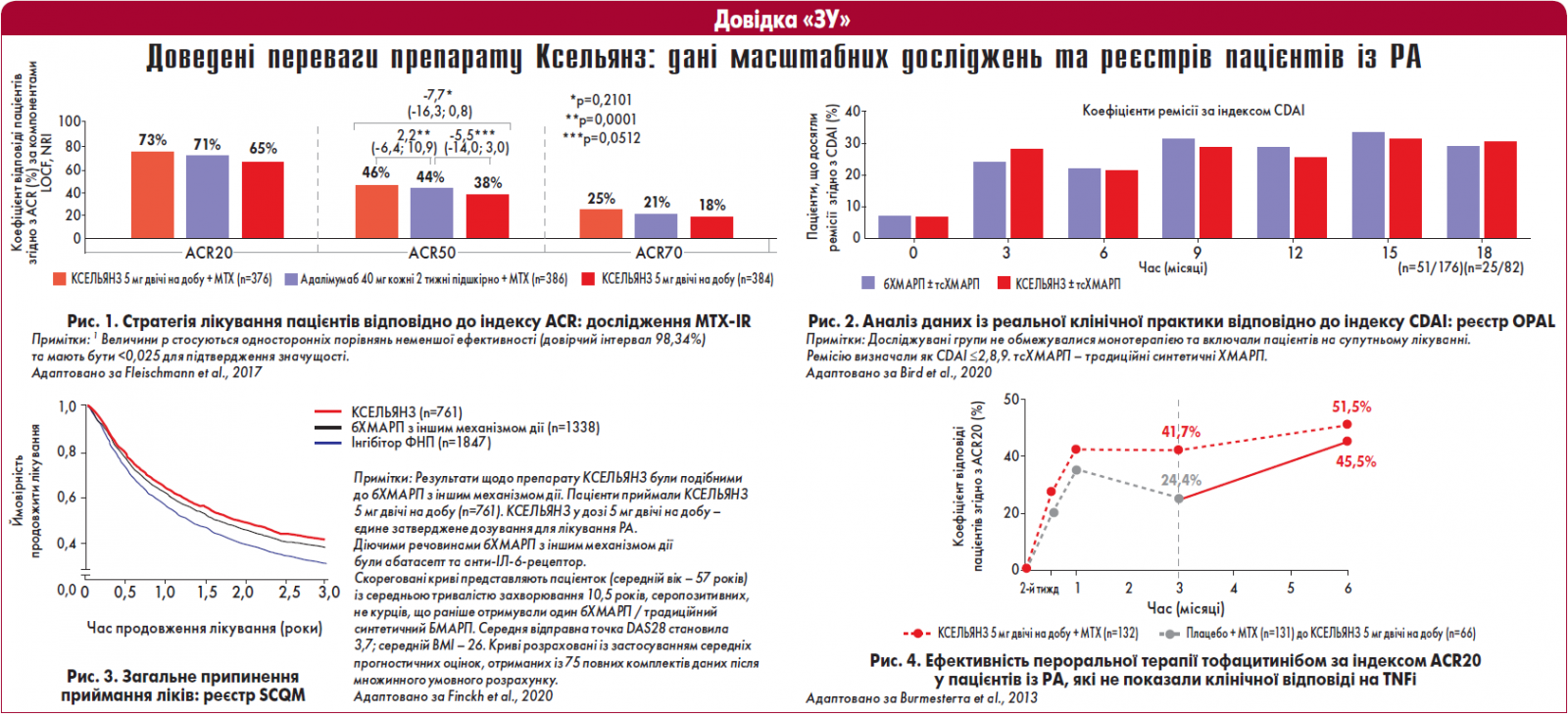
У реальній клінічній практиці встановлено, що ефективність тофацитинібу стосовно досягнення частоти ремісії за DAS28 та CDAI є такою самою, як при застосуванні біологічних препаратів протягом 16 місяців спостереження (Bird et al., 2020). Частка пацієнтів, які отримували монотерапію тофацитинібом, була вищою як на початкових етапах лікування, так і через 19‑26 місяців, ніж при використанні бХМАРП (Bird et al., 2020).
Було проведене обсерваційне когортне дослідження за участю хворих на РА, які застосовували терапію тофацитинібом, інгібіторами ФНП (n=1862), бХМАРП (n=1355) та JAK-інгібіторами (n=806). За отриманими даними, ризик припинення лікування інгібіторами ФНП внаслідок неефективності, побічних явищ тощо підвищувався за відсутності супутньої терапії традиційними синтетичними базисними препаратами, на відміну від використання інших біологічних агентів та тофацитинібу (Finckh et al., 2020).
У 2020 р. було опубліковано декілька досліджень, за результатами яких тофацитиніб у вигляді монотерапії або в комбінації з МТ є менш витратним лікуванням порівняно з бХМАРП. Лікування тофацитинібом у межах терапії 2-ї або 3-ї лінії після МТ може бути дешевшим, ніж приймання тофацитинібу як 4-ї лінії після невдалого застосування двох інгібіторів ФНП (Angelini et al., 2020).
Проблеми відповіді на терапію РА
Завідувачка кафедри внутрішньої медицини № 2 Тернопільського національного медичного університету імені І.Я. Горбачевського, д. мед. н. професорка Світлана Іванівна Сміян висвітлила проблеми відповіді на терапію РА та вплив тофацитинібу за даними клінічних досліджень. За словами спікерки, ефективність терапії оцінюють через три місяці, оскільки зниження активності РА на тлі лікування протягом перших трьох місяців асоційоване з розвитком ремісії через 12‑24 місяці.
 Аналізуючи результати досліджень щодо ефективності імунобіологічної терапії (ІБТ), можна зробити висновок, що наявні схеми лікування не є дієвими для всіх пацієнтів, а бХМАРП, що потребують парентерального введення, не завжди доступні. Лише 20‑30% осіб досягають поліпшення за ACR20 протягом 1-го року лікування. Незважаючи на доступні таргетні бХМАРП (наприклад, інгібітори ФНП, інтерлейкіну та Т-/В-клітин), деякі пацієнти з активним, неконтрольованим захворюванням не можуть отримувати ці методи терапії, втрачають клінічну відповідь, інші схильні також до неприйнятних ризиків.
Аналізуючи результати досліджень щодо ефективності імунобіологічної терапії (ІБТ), можна зробити висновок, що наявні схеми лікування не є дієвими для всіх пацієнтів, а бХМАРП, що потребують парентерального введення, не завжди доступні. Лише 20‑30% осіб досягають поліпшення за ACR20 протягом 1-го року лікування. Незважаючи на доступні таргетні бХМАРП (наприклад, інгібітори ФНП, інтерлейкіну та Т-/В-клітин), деякі пацієнти з активним, неконтрольованим захворюванням не можуть отримувати ці методи терапії, втрачають клінічну відповідь, інші схильні також до неприйнятних ризиків.
За рекомендацією EULAR, РА вважається таким, що важко піддається лікуванню у разі неефективності ≥2 біологічних або синтетичних ХМАРП. Своєю чергою до ознак, що свідчать про активне/прогресувальне захворювання (визначаються як ≥1), відносять щонайменше помірну активність патології (відповідно до затверджених показників, зокрема >3,2 за DAS28-ESR або >10 за CDAI), ознаки/симптоми (включно з гострофазовими показниками та візуалізацією), які вказують на активну фазу хвороби, неможливість зменшити лікування глюкокортикостероїдами (ГК) (˂7,5 мг/добу), швидке рентгенографічне прогресування, наявність симптомів РА, що знижують якість життя навіть за умов добре контрольованого захворювання відповідно до зазначених стандартів. Нарешті, РА вважається таким, що важко піддається терапії, якщо контроль ознак/симптомів сприймається ревматологом та/або пацієнтом як проблематичний (Gyоrgy et al., 2021).
Серед пацієнтів із РА близько 10% все ще важко піддаються лікуванню (через стійкість до декількох препаратів, наявність супутньої патології, соціально-економічні причини), що свідчить про необхідність персоніфікованого підходу (Takanashi et al., 2021). Своєю чергою до проблем визначення таргетної ІБТ можна віднести меншу ефективність у реальній клінічній практиці порівняно із клінічними дослідженнями, низький ефект монотерапії, розвиток вторинної неефективності внаслідок імуногенності (синтез антитіл до препарату), можливість нестабільності складу при зміні умов виробництва, особливі вимоги до зберігання та транспортування, високу вартість виробництва, парентеральний шлях введення – постін’єкційні й постінфузійні реакції, незручність для деяких пацієнтів тощо (Kay et al., 2011).
Отже, існує необхідність у терапії РА з альтернативними механізмами дії та формою випуску препаратів, щоб забезпечити хворим додаткові терапевтичні можливості та підвищити прихильність до лікування.
Ефективність тофацитинібу за даними клінічних досліджень
Тофацитиніб використовується як препарат другої лінії з 2015 р. та включений до рекомендацій EULAR як таргетний синтетичний біологічний препарат, що показав свою ефективність в осіб із РА (EULAR, 2019). Якщо порівняти перелік необхідних обстежень перед призначенням ІБТ та тофацитинібу, слід зазначити, що для пацієнтів, які отримують тофацитиніб, додатково потрібне виконання ліпідограми, тоді як у разі призначення ІБТ слід постійно контролювати виникнення туберкульозу.
Тофацитиніб призначають перорально у дозі 5 мг двічі на добу; він швидко поглинається із Тmax 0,5‑1,0 год та має період напіввиведення 3,2 год. В умовах ex vivo було показано, що тофацитиніб знижує експресію гена інтерлейкіну (IЛ)-6 у період 12‑24 тижнів, здійснюючи змінний вплив на гени IЛ‑8, ФНП-α та IЛ‑10. Тофацитиніб знижує всі прозапальні цитокіни, in vitro зменшує експресію костимулювальних молекул CD80 та CD86 та запобігає вивільненню інтерферону І типу (Tanaka et al., 2012). Лікування тофацитинібом строком до шести місяців асоційоване з дозозалежним ефектом щодо зменшення природних клітин-кілерів та збільшенням кількості В-клітин.
Окрім того, тофацитиніб продемонстрував високу ефективність у межах клінічних досліджень у пацієнтів із РА (n=23613) тривалістю від 6 місяців до 9,5 років, зокрема осіб із високою активністю РА та таких, що погано відповідали на попередню терапію; переважно це були жінки віком 50‑55 років із перебігом хвороби від 3 до 8 років, які приймали значну кількість супутніх нестероїдних протизапальних препаратів (НПЗП) та системних ГК.
Ефективність тофацитинібу було також підтверджено за показником ACR50, який був супутньою первинною кінцевою точкою у дослідженні ORAL Strategy (Fleischmann et al., 2017). Тофацитиніб у дозі 5 мг двічі на добу був набагато дієвішим, ніж МТ у МТ-наївних пацієнтів, а також тих, хто не відповідав на МТ. До того ж тофацитиніб продемонстрував еквівалентну ефективність з адалімумабом, зокрема у хворих, які не показали клінічної відповіді на ІБТ.
Частка пацієнтів, які відповідали критерію ACR70 у дослідженні ORAL Srart, була також вищою у групі тофацитинібу порівняно із застосуванням МТ та ІБТ, зокрема із групою адалімумабу (Lee et al., 2014). Окрім того, на користь ефективності тофацитинібу у дозі 5 мг двічі на добу свідчить той факт, що кількість хворих із ремісією за DAS28 була удвічі більшою на тлі використання тофацитинібу порівняно із МТ, а також однакова у групах тофацтинібу та адалімумабу + МТ (Lee et al., 2012; Cohen et al., 2019).
Щодо досягнення відповіді за DAS28 у пацієнтів із низькою активністю РА, за цим показником тофацитиніб майже удвічі випереджав МТ та був еквівалентний з адалімумабом. Близько 50% пацієнтів, які приймали тофацитиніб у дозі 5 мг два рази на добу, досягли відповіді за DAS28(CRP)-ремісією, що була вищою, ніж на тлі бХМАРП та ІБТ, а частка осіб, що досягли відповіді за DAS28(CRP)-низькою активністю, становила 41% (Cohen et al., 2019).
На додаток, клінічну ефективність тофацитинібу в зазначених дослідженнях було підтверджено за шкалою оцінки якості життя (HAQ-DI).
Певний інтерес також представляють порівняльні плацебо-контрольовані випробування тофацитинібу та адалімумабу. Зокрема, було показано, що тофацитиніб + МТ за часткою відповіді згідно з ACR20 продемонстрував кращі результати, ніж адалімумаб + МТ (van Vollenhoven et al., 2012). До того ж прогресування РА за рентгенологічними ознаками в пацієнтів, які отримували тофацитиніб у дозі 5 мг двічі на добу, було майже у сім разів меншим, ніж у тих, що лікувалися МТ упродовж шести місяців (зазначена тенденція спостерігалася протягом року).
Таким чином, у міжнародних дослідженнях було підтверджено клінічну та рентгенографічну ефективність тофацитинібу в дозі 5 мг два рази на добу в осіб із РА (Angelini et al., 2020).
Безпека тофацитинібу: на що звернути увагу?
Старший науковий співробітник відділу некоронарогенних хвороб серця та клінічної ревматології ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України (м. Київ), к. мед. н. Олена Олексіївна Гарміш детальніше зупинилася на профілі безпеки тофацитинібу. Лекторка зазначила, що, відповідно до даних Американського реєстру Corona RA 2012‑2017 рр., який оцінював частоту виникнення серйозних інфекцій, туберкульозу, СС-подій, онкологічних захворювань, гастроінтестинальних перфорацій та Herpes Zoster серед пацієнтів, що отримували тофацитиніб й інші сХМАРП або бХМАРП, тофацитиніб вірогідно відрізнявся лише за частотою розвитку інфекції Herpes Zoster (ACR/ARHP, 2018).
 Довгострокові (9,5 років спостереження) дані всіх клінічних досліджень тофацитинібу свідчать про те, що препарат не підвищує ризик шлунково-кишкових перфорацій, венозних/артеріальних тромбозів і тромбоемболій, інфаркту міокарда (ІМ), інсульту, СС-смерті, загальної летальності, туберкульозу й опортуністичних інфекцій, натомість підвищує імовірність серйозних побічних реакцій та інфекцій, а також H. zoster (Cohen et al., 2020). Варто зауважити, що серйозна побічна реакція – це та подія, що призводить до госпіталізації, необхідності застосування внутрішньовенних противірусних чи антибактеріальних препаратів або закінчується незворотними, несприятливими наслідками.
Довгострокові (9,5 років спостереження) дані всіх клінічних досліджень тофацитинібу свідчать про те, що препарат не підвищує ризик шлунково-кишкових перфорацій, венозних/артеріальних тромбозів і тромбоемболій, інфаркту міокарда (ІМ), інсульту, СС-смерті, загальної летальності, туберкульозу й опортуністичних інфекцій, натомість підвищує імовірність серйозних побічних реакцій та інфекцій, а також H. zoster (Cohen et al., 2020). Варто зауважити, що серйозна побічна реакція – це та подія, що призводить до госпіталізації, необхідності застосування внутрішньовенних противірусних чи антибактеріальних препаратів або закінчується незворотними, несприятливими наслідками.
Під час аналізу довгострокової безпеки тофацитинібу у спектрі серйозних наслідків було зазначено пневмонії (n=124), H. zoster (n=43), сечові інфекції (n=31), целюліт (n=31). При цьому розвиток тяжких інфекцій корелював із рівнем лімфоцитів: якщо він становив <500 клітин/мкл, ймовірність побічних реакцій збільшувалася у 7,1 раза, якщо коливався у межах ≥500<2000 клітин/мкл, ризик знижувався удвічі (2,5‑3,5). Останнє зумовлює необхідність моніторування рівня лімфоцитів у пацієнтів, що приймають тофацитиніб, як перед початком, так і під час терапії. До позитивних аспектів слід віднести відсутність кумулятивного наростання ризику інфекції.
Стосовно H. zoster, серед факторів ризику розвитку інфекції слід відзначити літній вік, регіон проживання (Азія), куріння, приймання ГК тощо. Також варто зауважити, що H. zoster є найчастішою інфекцією, на яку щорічно хворіє 1 млн осіб (50% віком ≥60 років). H. zoster становить 44% опортуністичних інфекцій серед осіб, що приймають ХМАРП, МТ та інгібітори ФНП. Ризик повторного епізоду складає близько 5% (Pinchinat, 2013). Також відомо, що ймовірність розвитку H. zoster є значно більшою при використанні ГК та залежить від віку пацієнта, – в осіб після 50‑60 років вона зростає у 10‑20 разів відповідно.
Кардіоваскулярні події
У метааналізі шести рандомізованих клінічних досліджень (n=4076) оцінювали основні СС-ускладнення (МАСЕ): ІМ, інсульт та СС-смерть (Charles-Schoeman et al., 2019). Загалом у когорті було зафіксовано 52 події, або 0,4 пацієнта / 100 пацієнто-років. Базовими предикторами були традиційні фактори ризику: вік, ожиріння, діабет, артеріальна гіпертензія, при цьому найбільш значущим – співвідношення холестерин (ХС) / ХС ліпопротеїнів високої щільності (ЛПВЩ) та Апопротеїн (Apo)-А / Apo-В. Натомість активність захворювання, кількість залучених суглобів та приймання ГК у дозі 3,5‑6,4 мг/добу жодним чином не впливали на МАСЕ.
За даними інших досліджень показано, що підвищення ХС становить близько 20% від вихідного рівня за 24 тижні від початку застосування JAK-інгібіторів.
Під час тривалого лікування тофацитинібом зросла кількість пацієнтів, що приймали статини. Так, у дослідженні LTE вона збільшилася через два роки з 10 до 15%, а через вісім років від початку терапії – до 25% (Cohen et al., 2020).
Тромбоз глибоких вен і тромбоемболію легеневої артерії при застосуванні JAK-інгібіторів (тофацитинібу та ін.) вивчали в 2020 р. у метааналізі 17 рандомізованих контрольованих досліджень (n=24 128). Частота венозної тромбоемболії (ВТЕ) становила 0,31 на 100 пацієнто-років. Ризик розвитку ВТЕ аналізували у хворих на РА, які перебували на лікуванні інгібіторами ФНП або сХМАРП. До проспективного спостереження у період 2009‑2019 рр. було включено 11 094 пацієнти, кількість ВТЕ становила 116 випадків (0,26 на 100 пацієнто-років). При цьому венозні тромби розвивались у хворих віком ≥65 років та при рівні С-реактивного протеїну ≥5 мг/л. Тобто вік і запальні захворювання підвищують ризик венозної тромбоемболії, тоді як збережена функція суглобів та приймання інгібіторів ФНП порівняно із сХМАРП – знижують (Schaefer et al., 2020).
При цьому згідно з даними шведського реєстру (n=46316) за період 2006‑2017 рр. встановлено, що ВТЕ протягом одного року асоціювалася з активністю РА. Отже, чим вища активність захворювання, тим більшою є частота ВТЕ (Molander et al., 2020).
Таким чином, з огляду на вищезазначене, запорукою безпеки терапії тофацитинібом є скринінг на латентні вогнища інфекції, моніторування рівня лімфоцитів протягом терапії, оцінка наявності факторів СС-ризику, спостереження за динамікою ліпідного профілю та контроль своєчасного призначення статинів за показаннями, скринінг на наявність венозних тромбозів і корекція терапії.