6 лютого, 2024
Що відомо про інгібітори янус-кінази: перспективи застосування тофацитинібу
За матеріалами Науково-практичної конференції «Всеукраїнський ревматологічний форум–2023 з міжнародною участю» (25‑27 жовтня 2023 р., м. Київ)
За останні десятиліття підходи до лікування пацієнтів з аутоімунними захворюваннями досягли значного прогресу завдяки розробці сучасних біологічних засобів. Так, ефективними хворобомодифікуючими антиревматичними препаратами (ХМАРП) нового покоління сьогодні визнано інгібітори янус-кінази (JAK). Власне, про клінічне значення, безпеку та перспективи застосування окремих представників зазначеної групи ліків йшлося під час науково-практичної конференції «Всеукраїнський ревматологічний форум‑2023», який відбувся наприкінці жовтня.
Із доповіддю щодо еволюції лікування аксіального спондилоартриту та місця JAK-інгібіторів у терапії виступив д.мед.н., професор кафедри внутрішніх хвороб № 3 Запорізького державного медико-фармацевтичного університету Дмитро Геннадійович Рекалов.
— Аксіальний спондилоартрит (АС) – це хронічне запальне ревматичне захворювання опорно-рухового апарату з переважним ураженням осьового скелета. Група Міжнародного товариства спондилоартриту (ASAS, 2009) розробила критерії класифікації АС, які охоплюють два компоненти:
- Перший – для пацієнтів із даними візуалізації сакроілеїту на рентгенограмі або магнітно-резонансній томографії (МРТ) та щонайменше однією клінічною ознакою СпА, тобто рентгенографічний АС (р-АС, також відомий як анкілозуючий спондиліт).
- Другий – потребує наявності HLA B27 та щонайменше двох клінічних ознак СпА, окрім даних візуалізації – нерентгенографічний АС (нр-АС).
За ці роки було описано, що р-АС і нр-АС є захворюваннями одного спектра і пацієнти із цими діагнозами значною мірою мають подібну клінічну картину за ознаками, отримуваним лікуванням та відповіддю на нього (Ramiro et al., 2022).
Низька чутливість і специфічність цих критеріїв (83 і 84% відповідно) під час оцінювання в когорті пацієнтів, скерованих до лікаря-ревматолога з недіагностованим хронічним болем у спині та підозрою на СпА, стали вагомим аргументом для пошуку нових підходів до клінічної діагностики. Для перегляду попередньої класифікації керівний комітет ASAS (2023) скликав міжнародну робочу групу для експертного оцінювання відповідності діагностичних критеріїв раннього АС.
Зокрема, було визначено, що діагноз раннього АС може встановлюватися в разі тривалості аксіальних симптомів ≤2 років. Аксіальними симптомами можуть бути біль у хребті / сідницях або ранкова скутість, незалежно від рентгенологічного підтвердження. Ревматолог має розглядати ці скарги як такі, що пов’язані з АС, це сприятиме максимально ранньому початку ефективного лікування.
Основною метою лікування пацієнтів з АС є поліпшення довгострокової якості життя завдяки контролю симптомів і запалення, запобіганню прогресуючому структурному ушкодженню та збереженню / нормалізації функції та соціальної активності (Ramiro et al., 2022).
Власне, одним зі способів досягти цього є таргетна терапія, спрямована на основні сигнальні шляхи захворювання, які в кінцевому результаті впливають на якість життя пацієнта, а саме активність захворювання, структурне ушкодження та функцію. Блокування передачі сигналів цитокінів є оптимальною фармакологічною мішенню у лікуванні СпА та інших аутоімунних захворювань.
Аксіальний спондилоартрит – це потенційно тяжке захворювання з різноманітними симптомами, які потребують мультидисциплінарного лікування, координованого лікарем-ревматологом (Ramiro et al., 2022). Оскільки симптоми АС є гетерогенними, під час персоналізованого підходу до лікування необхідно брати до уваги індивідуальні особливості захворювання та потреби пацієнтів.
Нещодавні докази того, що вищий індекс активності анкілозуючого спондилоартриту (ASDAS) свідчить про більше утворення синдесмофітів, робить контроль ASDAS однією з терапевтичних цілей. Зокрема, ASDAS <2,1 відповідає низькому ступеню активності захворювання, а ASDAS <1,3 свідчить про неактивну хворобу (Ramiro, 2014; Poddubnyy, 2016).
В оновлених рекомендаціях ASAS-EULAR (2022) також зазначено, що якщо неможливо застосувати ASDAS, краще використовувати Батський індекс активності анкілозуючого спондилоартриту (BASDAI), ніж взагалі не використовувати жоден інструмент, але бажано докладати всіх зусиль для впровадження у щоденну клінічну практику ASDAS.
Зростаюча доступність більшої кількості ліків із різними механізмами дії призводить до порушення питання щодо їхнього позиціонування у менеджменті захворювання.
Уперше в оновлених рекомендаціях представлено дані про препарати групи JAK (Ramiro et al., 2022). Як зазначають автори, після першої невдачі в лікуванні АС ХМАРП слід розглянути можливість переходу на інший ХМАРП біологічного походження або призначити JAK-інгібітори.
Інгібітори JAK прямо та опосередковано блокують патогенетичні цитокінові шляхи при АС: прямо інгібують інтерлейкін‑23 (IL‑23) та IL‑22, і опосередковано – IL‑17 та фактор некрозу пухлини-α (TNF-α) (Veale, 2019; Hammitzsch, 2020).
Активне обговорення препаратів групи інгібіторів JAK зумовлене тим, що сьогодні лікарі мають усе більше даних про ефективність застосування тофацитинібу. Так, результати аналізу даних другої фази дослідження М. Шstergaard et al. (2023) щодо оцінювання ефективності застосування тофацитинібу в лікуванні запалення хребта у пацієнтів з активним анкілозуючим СпА підтвердили, що, за даними МРТ, тофацитиніб сприяє зменшенню запалення в тілах хребців через 12 тиж. порівняно з плацебо. Крім того, тофацитиніб опосередковано зменшує втому, зумовлену ранковою скутістю і болем, що є клінічно значущим ефектом, адже зменшення больового синдрому є ключовою метою лікування СпА (Kristenses et al., 2023).
Продовжила тему старший науковий співробітник Національного наукового центру «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України» к.мед.н. Олена Олексіївна Гарміш.
 — Спондилоартропатії охоплюють багато різних форм запального артриту, що можуть уражати хребет (АС) або периферичні суглоби (периферичний СпА) та поєднуватись з іншими патологіями, як-от увеїт, псоріаз, ентезит або запальні захворювання кишківнику (ЗЗК). Сьогодні наявність позасуглобових симптомів є складовою частиною класифікаційних критеріїв СпА. Шкіра (як зовнішній бар’єр тіла), і кишківник, і суглоби (як внутрішні бар’єри) особливо схильні до розвитку запальних процесів, оскільки зазнають найбільшого мікробного, хімічного і механічного впливу (Schett et al., 2021).
— Спондилоартропатії охоплюють багато різних форм запального артриту, що можуть уражати хребет (АС) або периферичні суглоби (периферичний СпА) та поєднуватись з іншими патологіями, як-от увеїт, псоріаз, ентезит або запальні захворювання кишківнику (ЗЗК). Сьогодні наявність позасуглобових симптомів є складовою частиною класифікаційних критеріїв СпА. Шкіра (як зовнішній бар’єр тіла), і кишківник, і суглоби (як внутрішні бар’єри) особливо схильні до розвитку запальних процесів, оскільки зазнають найбільшого мікробного, хімічного і механічного впливу (Schett et al., 2021).
Високий рівень навантаження може постійно спричиняти імунну активацію, відповідно, ці бар’єри оснащені складними регуляторними системами, які контролюють, пригнічують і усувають запалення за допомогою протизапальних цитокінів та імунних регуляторних клітин (Serhan, 2018; Alivernini, 2020).
Найчастішим є поєднання ураження суглобів і кишківнику. Як зазначають Е. Gracey et al. (2020), близько 60% когорти пацієнтів зі СпА мають ЗЗК, серед них 50% – це пацієнти із субклінічним перебігом захворювання.
За даними дослідження, клінічно виразне ЗЗК фіксують у 6‑14% пацієнтів з анкілозуючим СпА (Fragoulis et al., 2019). Це може бути зумовлено тим, що ЗЗК та СпА мають кілька спільних патогенетичних механізмів.
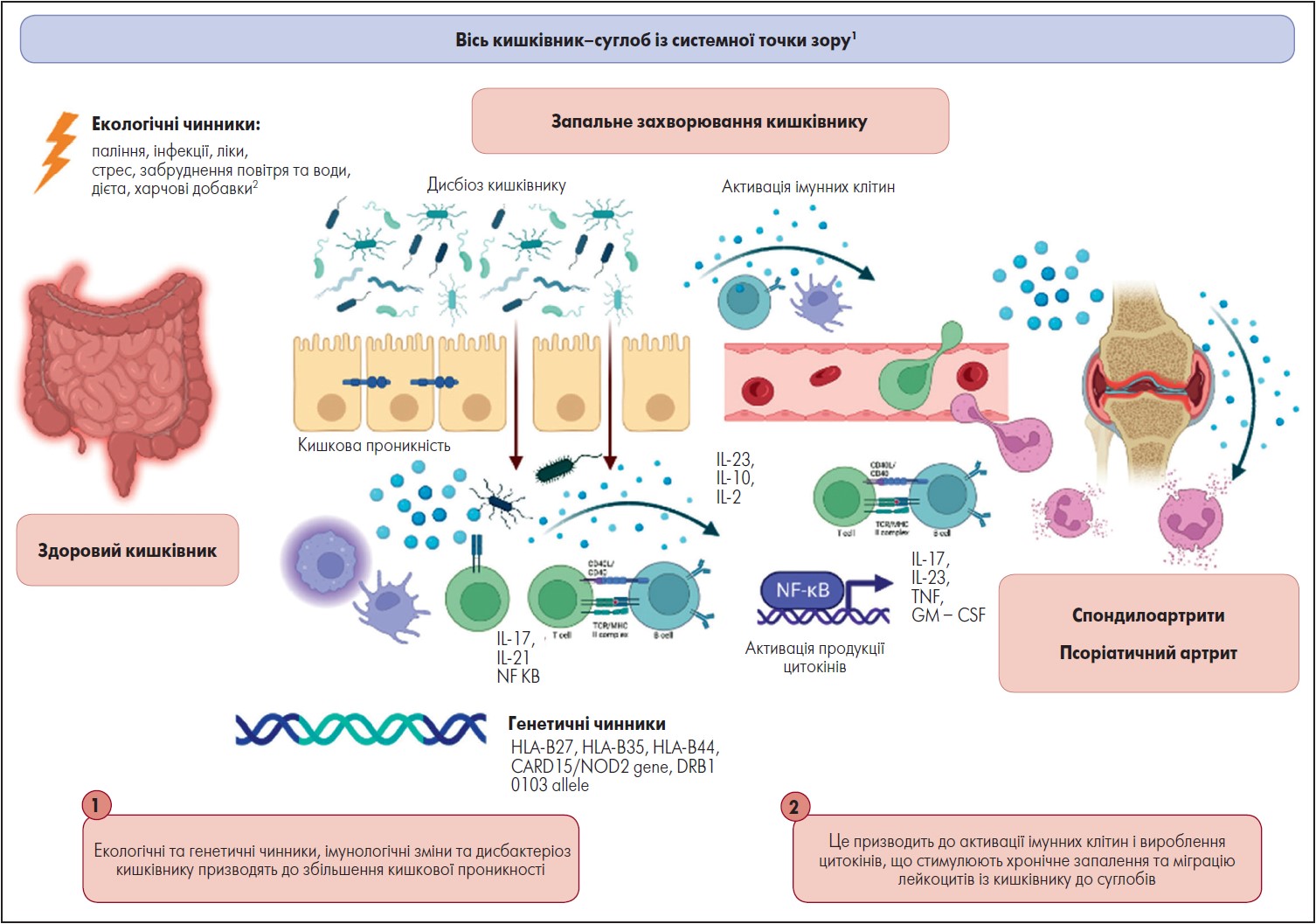
Основна гіпотеза, яка підтверджує існування кишково-суглобової осі, полягає в тому, що запальний процес починається саме в кишківнику, де дисбактеріоз призводить до підвищення кишкової проникності, і як наслідок, до імунної активації з утворенням великої кількості цитокінів (рисунок) (Felice et al., 2023).
Рис. Імунологічні зміни кишково-суглобової системи
Адаптовано за C. Felice et al., 2023.
Кишкова мікробіота разом із генетичними, імунологічними та екологічними чинниками відіграє ключову роль у патогенезі ЗЗК і виступає прозапальним тригером в імунних захворюваннях суглобів (Pavel et al., 2021).
М.-С. Radu et al. (2021) описали декілька цікавих механізмів, намагаючись пояснити зв’язок дисбактеріозу і суглобового запалення, проте підтверджувальних даних поки бракує, щоб розглядати це як терапевтичний підхід.
Центральна роль у патогенезі імунного суглобового та кишкового запалення сьогодні належить цитокінам (Schett et al., 2021). Більшість доступних видів терапії, націленої на імунологічні мішені у разі ЗЗК або СпА, були розроблені на основі специфічної участі цитокінів у кожній клінічній ситуації.
На відміну від селективних цитокінових мішеней, інгібітори JAK є ефективними для лікування кількох імуноопосередкованих запальних захворювань, отже, застосування цієї групи препаратів можна розглядати як додатковий ефективний терапевтичний варіант для пацієнтів із поєднанням ЗЗК і СпА (Schwartz et al., 2017).
Головними клінічними маркерами, що підтверджують патофізіологічний взаємозв’язок ЗЗК і СпА, є підвищені рівні С-реактивного протеїну (СРП) і фекального кальпротектину під час обох захворювань. Тому важливо вчасно діагностувати ЗЗК у пацієнтів зі СпА та скаргами на кишкові розлади, оскільки це може мати вплив на вибір лікування.
З погляду гастроентерології, СпА – це найчастіший позаінтестинальний клінічний симптом ЗЗК, який розвивається, за різними даними, у 18,1–47,5% пацієнтів (Felice et al., 2018).
Так, за даними метааналізу, 10% випадків хвороби Крона, виразкового коліту та недиференційованого коліту супроводжуються сакроілеїтом, 3% – аксіальним СпА (АСпА), 13% – периферичним Сп А. Також у метааналізі оцінювали поширеність ентезитів (діапазон поширеності від 1 до 54%) і дактиліту (діапазон поширеності від 0 до 6%) (Karreman et al., 2017).
Кумулятивна захворюваність на СпА доведено зростає з тривалістю спостереження за пацієнтами із ЗЗК (Shrestha et al., 2022).
Поєднання кишкових і суглобових симптомів зумовлює необхідність тандемної роботи гастроентеролога й ревматолога щодо визначення терапевтичної стратегії, яка була б ефективною для обох захворювань. Оскільки ЗЗК є хронічним станом, підтримуюча терапія має бути ефективною протягом тривалого періоду часу; в ідеалі лікування не має супроводжуватися підвищеним ризиком розвитку небезпечних подій.
Дані аналізу W.J. Sandborn (2022) продемонстрували, що тофацитиніб (5 мг двічі на добу) у пацієнтів із помірно-тяжким або тяжким активним виразковим колітом мав прийнятний профіль безпеки за тривалої терапії.
В іншому дослідженні зазначено, що перші позитивні ефекти застосування препарату, як-от значне зменшення частоти дефекації та вмісту крові в калі, фіксували вже через 3 дні лікування. У разі довгострокового спостереження було відмічено, що застосування тофацитинібу для лікування виразкового коліту сприяло розвитку швидкої (8-й тиждень) і тривалої (52-й тиждень) ремісії (Sandborn et al., 2022).
Про основні показання до призначення тофацитинібу, профіль безпеки та перспективи його застосування розповів у своїй доповіді д.мед.н., завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця, професор Олег Борисович Яременко.
 — Інгібітори JAK належать до нового класу пероральних лікарських засобів із характерним механізмом дії, що відрізняється від інших препаратів. Він полягає у внутрішньоклітинному перериванні шляху JAK-STAT, який має вирішальне значення для імунної відповіді. Завдяки їхній центральній ролі в імунній відповіді та зв’язку з рецепторами одразу до декількох цитокінів (тоді як біологічні ХМАРП впливають на окремий запальний цитокін і/або клітинну функцію) інгібування JAK виявилося перспективною стратегією (Bellinvia et al., 2018).
— Інгібітори JAK належать до нового класу пероральних лікарських засобів із характерним механізмом дії, що відрізняється від інших препаратів. Він полягає у внутрішньоклітинному перериванні шляху JAK-STAT, який має вирішальне значення для імунної відповіді. Завдяки їхній центральній ролі в імунній відповіді та зв’язку з рецепторами одразу до декількох цитокінів (тоді як біологічні ХМАРП впливають на окремий запальний цитокін і/або клітинну функцію) інгібування JAK виявилося перспективною стратегією (Bellinvia et al., 2018).
Тофацитиніб – перший пероральний JAK-інгібітор, затверджений Управлінням із контролю за якістю харчових продуктів та медикаментів США (FDA) та Європейським агентством із лікарських засобів (EMA) для лікування ревматоїдного артриту (РА), псоріатичного артриту, анкілозуючого СпА, ювенільного ідіопатичного артриту (ЮІА) та виразкового коліту.
Тофацитиніб внесено до рекомендацій із лікування РА та ЮІ (АEULAR, 2022). В Україні зареєстровано показання щодо менеджменту пацієнтів із РА та ЮІА.
Результати кількох рандомізованих контрольованих досліджень за участю дорослих пацієнтів із РА достовірно засвідчили, що тофацитиніб є ефективним як засіб монотерапії, у комбінації із ХМАРП, а також у пацієнтів, які раніше не отримували лікування (Fleischmann et al., 2016, 2012; Kremer et al., 2013; Fleischmann et al., 2017).
Під час дослідження ефективності тофацитинібу у пацієнтів із РА спостерігали статистично та клінічно значуще поліпшення перебігу захворювання, яке оцінювали за категоріальними критеріями відповіді на терапію Американського коледжу ревматології (ACR 20, 50 і 70) та за допомогою інших інструментів. Зокрема, було підтверджено, що тофацитиніб впливає на перебіг захворювання та запобігає прогресуванню структурного ушкодження суглобів (Strand et al., 2016).
Важливо, що лікування тофацитинібом забезпечує швидке покращення стану, про яке повідомляють пацієнти. Це підтверджено результатами 6-місячного дослідження ORAL Solo, у якому застосування тофацитинібу було пов’язане зі статистично значущим поліпшенням критеріїв відповіді ACR 20 через 3 міс. та клінічно значущим поліпшенням загальної оцінки пацієнта активності захворювання (PtGA), оцінки болю та втоми за функціональною оцінкою хронічної хвороби (FACIT-F) (Fleischmann et al., 2012).
Швидкість настання ефекту була вражаючою: покращення показника PtGA і оцінки болю проти вихідного рівня фіксували вже через 3 дні після початку лікування (Strand, 2015).
За даними проведеного 12-місячного дослідження ORAL Sync, у якому вивчали ефективність і безпеку застосування тофацитинібу в комбінації з небіологічними ХМАРП, тофацитиніб продемонстрував швидкий початок дії зі значною різницею показників відповіді на терапію ACR 20 і ACR 50 уже на 2-му тижні та ACR 70 – на 4-му тижні (Kremer et al., 2013).
Результати кількох клінічних досліджень тривалістю ≤24 міс. засвідчили, що монотерапія тофацитинібом (як лікування першої або другої лінії) і комбінована терапія із синтетичним ХМАРП (як лікування другої або третьої лінії) була ефективною стратегією для зменшення виразності ознак і симптомів захворювання та поліпшення якості життя, пов’язаної зі здоров’ям (HR-QOL). Зокрема, переваги такої комбінації зберігаються за тривалої терапії (≤96 міс.) (Burmester et al., 2013).
Монотерапія тофацитинібом протягом ≤24 міс. пригнічувала прогресування структурних ушкоджень у пацієнтів, які раніше не отримували метотрексат. Причому сприятливий ефект також спостерігали в пацієнтів, які застосовували тофацитиніб і метотрексат як терапію другої лінії протягом 12 міс. (van der Heijde et al., 2013).
У когорті пацієнтів з ЮІА було виконано дослідження за участю осіб із поліартикулярним перебігом захворювання віком від 2 до 18 років (Ruperto et al., 2021). Під час першої частини дослідження учасники отримували пероральний тофацитиніб протягом 18 тиж. Пацієнти, у яких спостерігали відповідь згідно з показниками JIA/ACR30, у випадковий спосіб були розподілені для продовження терапії тофацитинібом або переходу на плацебо в другій частині дослідження (упродовж 26 тиж.).
За результатами дослідження, частота загострень захворювання на 44-му тижні була значно нижчою в разі застосування тофацитинібу – 21 (29%) із 72 пацієнтів, ніж за приймання плацебо – 37 (53%) із 70 пацієнтів. Отримані дані підтверджують, що тофацитиніб є ефективним засобом лікування пацієнтів із поліартикулярним перебігом ЮІА, що особливо важливо, він є препаратом із високим комплаєнсом серед дітей і підлітків, які бажають уникати ін’єкцій (Ruperto et al., 2021).
Побічні ефекти у другій частині дослідження виникали у 68 (77%) із 88 пацієнтів, які отримували тофацитиніб, і у 63 (74%) із 85 – у тих, хто приймав плацебо. Загалом тофацитиніб добре переносився протягом ≤114 міс. лікування, більшість побічних явищ були легкого або середнього ступеня тяжкості. Профіль переносимості тофацитинібу був подібним до біологічних ХМАРП (Bellinvia, 2018; Taylor, 2019).
Відповідно до даних Американського реєстру Corona RA (20122017), який оцінював частоту виникнення серйозних інфекцій, туберкульозу, СС-подій, онкологічних захворювань, гастроінтестинальних перфорацій та оперізуючого герпесу в пацієнтів, які отримували тофацитиніб та інші синтетичні або біологічні ХМАРП, тофацитиніб вирізнявся лише за частотою розвитку інфекції, спричиненої Herpes zoster (ACR/ARHP, 2018).
Отже, тофацитиніб – це це високоефективна сучасна терапія РА і ЮІА та перспективний засіб у лікуванні АС, ПсА та ВК, що підтверджують останні міжнародні рекомендації.
Підготувала Ольга Загора