26 січня, 2022
Коморбідність при акромегалії: пацієнторієнтована терапевтична тактика
Незважаючи на наявність доволі чітких рекомендацій із ведення пацієнтів з акромегалією (АМ), на практиці лікарі часто стикаються з неефективністю обраного лікування.  Про особливості терапії АМ з урахуванням коморбідної патології йшлося в доповіді провідного наукового співробітника відділу орфанних захворювань ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), кандидата медичних наук Лариси Андріївни Луценко в рамках чергового засідання науково-освітнього проєкту «Школа ендокринолога» яке відбулося на початку листопада 2021 року.
Про особливості терапії АМ з урахуванням коморбідної патології йшлося в доповіді провідного наукового співробітника відділу орфанних захворювань ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), кандидата медичних наук Лариси Андріївни Луценко в рамках чергового засідання науково-освітнього проєкту «Школа ендокринолога» яке відбулося на початку листопада 2021 року.
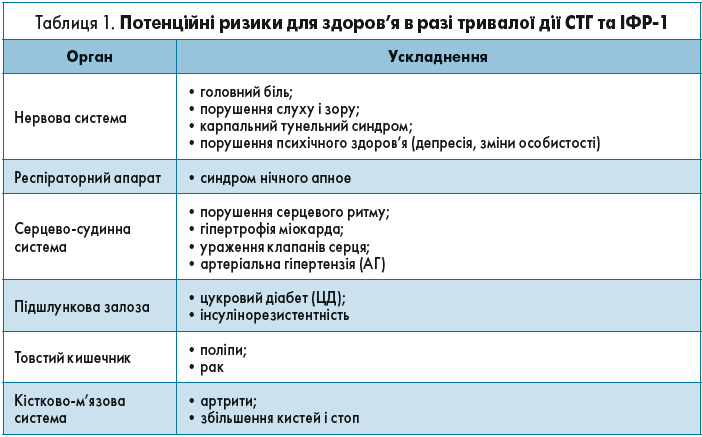
У разі недостатнього контролю над перебігом АМ організм людини впродовж тривалого часу зазнає впливу високих рівнів соматотропного гормону (СТГ) й інсуліноподібного фактора росту‑1 (ІФР-1).
Це супроводжується низкою потенційних ризиків для здоров’я, що відображено в таблиці 1.
Безумовно, транссфеноїдальна операція є першою лінією лікування АМ в більшості пацієнтів (Katznelson et al., 2014). У разі ремісії потреби в подальшому лікуванні немає, однак лікар має проводити моніторинг біохімічних показників (ІФР‑1 щороку i спорадичний рівень СТГ) для раннього виявлення рецидиву. На жаль, хвороба може повернутися навіть через 20 років після успішного оперативного втручання, що обов’язково треба враховувати в клінічній практиці.
Мета лікування АМ (ААСЕ 2011/ ААСЕ 2014/АСЕ 2018):
- видалення пухлини гіпофіза (резекція або стабiлiзацiя розмiрiв);
- нормалiзацiя рiвнiв СТГ та ІФР‑1;
- збереження функціональної активності гіпофіза;
- зменшення вираженості клінічних симптомів захворювання (стабiлiзацiя або зворотний розвиток);
- запобігання розвитку рецидивів.
Все зазначене вище спрямоване не лише на підвищення якості життя пацієнтів, але й на збільшення його тривалості.
Для контролю ефективності лікування необхідно використовувати критерії активності АМ (табл. 2). Мети лікування можна досягти тільки на стадії контролю.
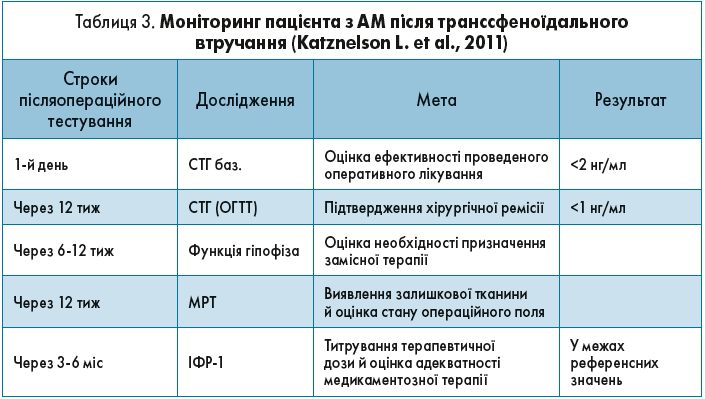
Якщо пацієнтові була проведена транссфеноїдальна операція, задачею практикуючого ендокринолога є післяопераційний моніторинг, який проводиться з метою оцінки стану післяопераційного поля і функції гіпофіза. Це дає можливість оцінити ефективність проведеного лікування і, за потреби, вчасно розпочати медикаментозну чи променеву терапію. Детальні рекомендації щодо частоти і параметрів післяопераційного супроводу пацієнта на амбулаторному етапі відображені в таблиці 3.
На жаль, ефективність хірургічного лікування в середньому становить 65%. Відповідно, у третини пацієнтів відбувається рецидив АМ і виникає потреба в медикаментозному чи променевому лікуванні майже відразу після операції.
Варто пам’ятати, що променева терапія часто супроводжується низкою ускладнень, які можуть виникати в різні строки після її початку. Найпоширенішими з них є:
- пошкодження навколишніх тканин мозку (післяпроменевий набряк ділянки гіпофіза, крововиливи в гіпофiз, скронева епілепсія);
- зорові порушення (парез окорухового нерва, транзиторний птоз, часткова або повна атрофiя зорових нервів);
- післяпроменева гiперпролактинемія;
- ураження судин головного мозку (не залежить від рівнів СТГ й ІФР‑1, розмiру пухлини, поширення її за межi турецького сідла або наявності гіпопітуїтаризму);
- нейропсихологічні зміни, порушення когнітивних функцій центральної нервової системи (погіршення пам’яті, вербальної функції, депресія);
- розвиток гіпопітуїтаризму.
Ступiнь гiпопiтуїтаризму позитивно корелює з тривалістю післяпроменевого періоду. Так, через 2-5 років після променевої терапії зниження функції гіпофіза спостерігають у 10-29% пацієнтів, тоді як через 16 років гіпопітуїтаризм виникає в 60% хворих.
Крім того, навіть після променевого лікування пацієнт певний час потребує медикаментозної корекції. Саме тому променеве лікування є терапією третьої лінії та застосовується після оцінки всіх можливих ризиків.
Таким чином, медикаментозне лікування відіграє важливу роль у лікуванні АМ. Показанням для медикаментозної терапії є (Paragliola R.M. et al., 2018):
- нерадикальність проведеної транссфеноїдальної аденомектомії;
- очікування ефекту променевої терапії;
- наявність протипоказань до оперативного лікування у зв’язку із соматичним статусом пацієнта;
- особливості росту пухлини;
- відмова хворого вiд хірургічного втручання.
За реальних умов ми не можемо призначати пацієнтові то один препарат, то інший або підбирати ефективну терапію суто емпірично. Треба пам’ятати про ризики, пов’язані з тривалим впливом високих доз СТГ й ІФР‑1, і використовувати всі доступні на сьогодні дані для максимально швидкої оптимізації лікування.
Саме неконтрольовано високий рівень ІФР-1 є чинником розвитку супутніх захворювань у пацієнта з АМ. Пегвісомант контролює ІФР-1 у 97% (Van der Lely A.J. et al., 2001). Так, відповідно до оновлених у 2021 р. рекомендацій Товариства з вивчення гіпофіза (The Pituitary Society) щодо лікування АМ, застосування пегвісоманту в 73% випадків демонструє біохімічний контроль із дуже низькими показниками короткочасного підвищення рівня трансаміназ і 6,8% росту пухлини (за даними МРТ). У пацієнтів із ЦД використання пегвісоманту покращує метаболізм глюкози незалежно від контролю ІФР-1, але не впливає на кінцеві глікемічні показники в пацієнтів без ЦД. Хворим на ЦД і особам із вищим ІМТ потребуються вищі дози пегвісоманту і швидше титрування для досягнення нормалізації ІФР-1 (Fleseriu М. et al., 2021).
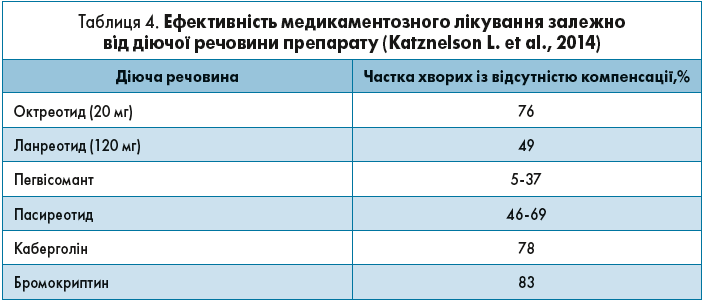
Отже, передусім необхідно враховувати залежність ефективності медикаментозного лікування від діючої речовини препарату, що відображено в таблиці 4 (Katznelson L. et al., 2014).
Таким чином, 3/4 пацієнтів на октреотиді і половина хворих, які отримують ланреотид, потребуватимуть посилення медикаментозної терапії, при виборі якої потрібно обов’язково враховувати можливі ускладнення, а також коморбiдні стани, які є частими у хворих з АМ. Найпоширенішими з них є:
- ЦД;
- АГ;
- ураження клапанного апарату серця;
- аритмії та порушення серцевої провідності;
- синдром обструктивного апное сну;
- головний біль;
- новоутворення (поліпи товстого кишечнику, доброякісні утворення;
- зміни в скелетно-м’язовому апараті (артропатії, остеопороз, компресiйнi переломи хребців, карпальний тунельний синдром);
- дисліпідемія.
Щодо частоти онкологічних захворювань при АМ, то інформацію про це можна знайти вкрай суперечливу (Ara M. et al., 2012). Так, за даними різних авторів, злоякісні новоутворення є причиною смерті в 9-50% хворих з АМ (у середньому 24%). Незважаючи на такий широкий діапазон, єдине, що можна стверджувати напевно, це те, що зв’язок, безумовно, є: ризик розвитку злоякісних пухлин різних органів у хворого з АМ у 1,5-4 рази вищий, ніж у загальній популяції. Відповідно, швидке досягнення контролю захворювання необхідне ще й для зниження ризику розвитку онкопатології.
Якщо говорити про патологію серцево-судинної системи, то найперше варто згадати про АГ. Вона виникає в 40-50% хворих і є одним із найсильніших негативних прогностичних факторів смертності при АМ (Ковалева Ю.А. та співавт., 2016). Вибір антигіпертинзивного препарату для корекції артеріального тиску при АМ не відрізняється від загальних підходів до лікування АГ. Проте необхідно зазначити, що в разі досягнення біохімічного контролю АМ ми впливаємо на патогенетичні складові АГ, і тиск починає знижуватися. Відповідно, таким пацієнтам потрібно зменшувати дозу гіпотензивних препаратів, але в жодному разі не відміняти терапію АМ через виникнення епізодів гіпотензії.
Ще одним частим серцево-судинним ускладненням є акромегалічна кардіоміопатія, поширеність якої і 3,3-14,2 раза вища, ніж у загальній популяції. Клапанні порушення спостерігають у 86% пацієнтів з АМ в активнiй стадії, тоді як у разі контролю захворювання їх частота становить 73%.
Зазначимо, що лікування АМ дає можливість скорегувати згадані стани і зменшити прояви гiпертрофії міокарда і серцевої дисфункції на початковому і проміжному етапах розвитку серцево-судинної патології, але не в разі формування декомпенсованого стану. Саме тому рання діагностика й адекватна терапія є запорукою запобігання кардіоваскулярним ускладненням.
Не менш поширеними в пацієнтів з АМ є зміни з боку кістково-м’язової системи. Під впливом СТГ й ІФР‑1 виникає гiпертрофiя хрящів, слабкість сухожиль, збільшуються верхня і нижня щелепи, розвиваються остеофіти з подальшим руйнуванням суглобів, виникає остеопороз/остеопенія.
У пацієнтів із такими факторами ризику, як жiноча стать, похилий вік, супутнє ожиріння і висока активність захворювання, нерідко спостерігають ураження суглобів, переважно – колiнний і кульшовий суглоби. Своєю чергою, у чоловіків, особливо з гіпогонадизмом, частіше виникають компресійні переломи хребців.
Одним із важливих симптомів АМ є м’язова слабкість. Буває на прийом звертаються кремезні чоловіки з вираженою м’язовою гіпертрофією, які через слабкість не спроможні пройти навіть мінімальну відстань, а витримувати серйозніші фізичні навантаження й поготів.
Лікування таких станів також неможливе без адекватного патогенетичного лікування АМ. На стадії контролю (не раніше ніж через 6 міс) можна призначити додаткове лікування, наприклад фізіотерапію, системну і/або внутрішньосуглобову протизапальну і знеболювальну терапію, ендопротезування.
Окремо хотілося б зупинитися на ЦД, який виникає в 16-56% хворих з АМ (Pivonello R. et al., 2017; Brit C. et al., 2019). Такі розлади вуглеводного обміну, як порушення толерантності до глюкози і гіперглікемія натще, виникають у 6-45% і 7-22% пацієнтів відповідно. В основі цих розладів лежить інсулінорезистентність, яка розвивається під впливом високих доз ІФР‑1.
Частота ЦД залежить і від тривалості АМ: при стажі захворювання менш ніж 8 років ЦД розивається в 40,6% хворих, тоді як через ≥15 років – у 60,5%.
Фактори ризику розвитку ЦД при АМ:
- загальнопопуляцiйнi – вiк, жiноча стать, обтяжений анамнез за ЦД 2 типу, АГ, порушення ліпідного обмiну;
- специфічні для АМ – тривалість і активність захворювання, призначене лікування.
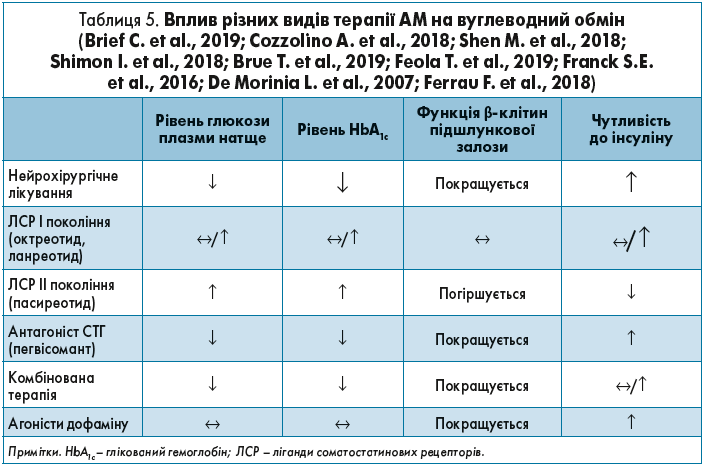
Аби вберегти пацієнтів від розвитку ЦД та пов’язаних із ним ускладнень, необхідно враховувати вплив різних препаратів для лікування АМ на вуглеводний обмін (табл. 5).
Таким чином, призначення ЛСР ІІ покоління (пасиреотид) в пацієнтів з АМ і порушеннями вуглеводного обміну, особливо декомпенсованим ЦД, призведе до ще глибших метаболічних порушень. Відповідно, перевагу потрібно віддавати препаратам, які позитивно впливатимуть як на функцію β-клітин підшлункової залози, так і на чутливість до інсуліну, наприклад пегвісоманту.
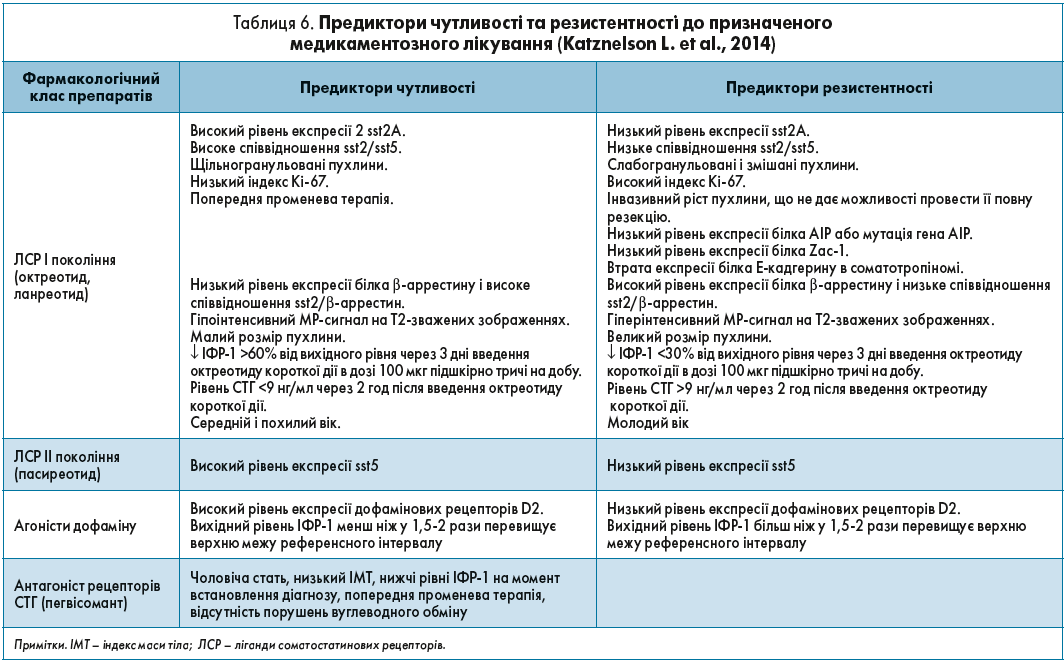
Ще одним фактором, який варто враховувати при персоніфікованому підході до лікування АМ, є наявність або відсутність предикторів чутливості та резистентності до медикаментозного лікування, детально відображених в таблиці 6 (Katznelson L. et al., 2014).
Звичайно, деякі з цих параметрів, зокрема експресія білка Zac‑1, рівень експресії sst 2А, співвідношення sst2/sst5, не завжди можливо і зручно використовувати в реальній клінічній практиці. Проте, такі показники, як розмір пухлини, інтенсивність МР-сигналу, рівень ІФР‑1, а також характеристики і дані анамнезу пацієнта, обов’язково треба враховувати під час вибору оптимального препарату.
Таким чином, підхід до лікування АМ має враховувати як патогенетичну основу захворювання, так і коректувати, або принаймні не погіршувати, наявні ускладнення і коморбідні стани. Лише клініко-метаболічний контроль дасть можливість досягти мети лікування – знизити ризик смертності і підвищити якість і тривалість життя пацієнтів. Незважаючи на обраний підхід до терапії, ведення пацієнта має охоплювати моніторинг як основних клінічних показників, що характеризують перебіг АМ, так і ризиків, пов’язаних із лікуванням.
Список літератури – у редакції.
Підготувала Ганна Кирпач
За підтримки представництва компанії «Пфайзер Експорт Бі. Ві.» в Україні.
PP-SOM-UKR-0034
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 4 (56) 2021 р.