26 лютого, 2023
Шлунково- та кишковорозчинна форми ацетилсаліцилової кислоти: порівняння ефективності, біодоступності та впливу на слизову оболонку шлунково-кишкового тракту
Ацетилсаліцилова кислота (АСК) є одним із найстаріших і найпоширеніших препаратів. До 70-х років минулого сторіччя АСК використовувалася здебільшого як протизапальний і знеболювальний засіб, але завдяки своїм антиагрегантним властивостям вона перетворилася на препарат, який широко призначається в клінічній практиці для первинної та вторинної профілактики серцево-судинних і тромботичних цереброваскулярних подій.
Згідно з рекомендаціями Американської колегії кардіологів (ACC) і Американської асоціації серця (AHA) щодо первинної профілактики серцево-судинних захворювань (2019) низькі дози АСК можуть розглядатися для профілактики атеросклеротичних серцево-судинних порушень у дорослих віком 40-70 років, які не мають підвищеного ризику кровотечі.
Як засіб вторинної профілактики атеросклеротичних серцево-судинних порушень АСК є широко рекомендованим препаратом. Фахівці ACC/AHA в настанові щодо терапії гострих коронарних синдромів без підйому сегмента ST (2014) рекомендують розпочинати прийом АСК якомога раніше перед черезшкірним коронарним втручанням (ЧКВ), а після ЧКВ продовжувати прийом АСК необмежений час у дозі від 81 до 325 мг/день.
Спеціалісти з Американської діабетичної асоціації (ADA) в Стандартах медичної допомоги при цукровому діабеті (2020) відзначають, що терапію низькими дозами АСК (75-162 мг/день) можна розглядати як основну стратегію первинної та вторинної профілактики у хворих на цукровий діабет 2 типу, які мають підвищений ризик розвитку серцево-судинних порушень.
Відповідно до рекомендацій Незалежної групи експертів у галузі охорони здоров’я США (USPSTF) для первинної профілактики серцево-судинних захворювань особливо доцільно (рівень доказовості В) призначати низькі дози АСК дорослим віком від 50 до 59 років із 10-річним ризиком серцево-судинних захворювань, які не мають підвищеного ризику кровотечі, мають очікувану тривалість життя принаймні 10 років і готові приймати низькі дози АСК принаймні 10 років.
Вплив низьких доз АСК на розвиток ентеропатій
Добре відомо, що використання низьких доз АСК пов’язане з підвищеним ризиком виникнення різноманітних ентеропатій, включаючи появу численних петехій, втрату ворсинок слизової кишечнику, формування ерозій і виразок. Поширеність таких уражень тонкої кишки серед пацієнтів, які довгий час приймали низькі дози АСК, становить 88,5-100% (Endo H., 2011). Ідеальною терапією цих ускладнень було би скасування препарату, однак АСК використовується в більшості випадків як антитромбоцитарний засіб і його скасування може збільшити ризик серцево-судинної/цереброваскулярної захворюваності та смертності. Зі старінням суспільства поширення використання низьких доз АСК продовжує зростати, і схильність препарату призводити до розвитку шлунково-кишкових патологій стала клінічною проблемою, що потребує уваги.
Патогенез АСК/НПЗП-ентеропатії є багатофакторним і складним. У пацієнтів, які приймають нестероїдні протизапальні препарати (НПЗП), слизова оболонка тонкої кишки піддається багаторазовому впливу: спочатку місцевий вплив до та під час всмоктування препарату, потім вплив під час його системного розподілу. Така циклічна дія відіграє важливу роль у патогенезі ентеропатії, індукованої НПЗП/АСК (Davies N.M., 2000). НПЗП чинять пряму токсичну дію на ентероцити, що описується так званою гіпотезою трьох ударів (Bjarnason I., 1993):
- по-перше, препарати розчиняють ліпідний компонент фосфоліпідів на поверхні слизової оболонки, що спричиняє пряме пошкодження мітохондрій епітеліальних клітин (Somasundaram S., 2000);
- по-друге, пошкодження мітохондрій зумовлює порушення міжклітинних з’єднань зі збільшенням проникності слизової оболонки тонкої кишки;
- по-третє, слизовий бар’єр послаблюється й долається внутрішньопросвітним умістом (як-от жовчні кислоти, просвітні бактерії та продукти їхнього розпаду, харчові макромолекули й інші токсини), що призводить до запалення (Reuter B.K., 1997).
Другим важливим патогенетичним механізмом ентеропатії, спричиненої НПЗП, є системний ефект, пов’язаний із виснаженням простагландинів. Хоча спочатку вважалося, що патогенез ентеропатії пов’язаний лише з інгібуванням циклооксигенази-1 (ЦОГ-1), проведені на мишах експерименти показали, що дефіцит або інгібування ЦОГ-1 й інгібування ЦОГ-2 не є шкідливими для цілісності тонкої кишки (Sigthorsson G., 2002).
Морфологічна картина ентеропатій, спричинених прийомом низьких доз АСК
Донедавна більшість досліджень стосовно пошкоджень, спричинених АСК, були зосереджені на ураженнях шлунка та дванадцятипалої кишки, а потенціал низьких доз АСК зумовлювати пошкодження тонкої кишки залишався предметом дебатів. Однією з причин цього були труднощі в оцінці тонкої кишки, а спричинену АСК ентеропатію ще залишалося докладно охарактеризувати. Останні досягнення в діагностичній ендоскопії, як-от капсульна ендоскопія (КЕ) та подвійна балонна ендоскопія (Iddan G., 2000), дають змогу безпосередньо візуалізувати тонку кишку та пролили світло на її пошкодження, спричинені АСК й іншими НПЗП. Численні клінічні дослідження показали, що хронічне застосування низьких доз АСК потенційно може зумовити різноманітні тяжкі ураження тонкої кишки, включаючи ерозії, виразки та колоподібні стриктури (Endo H., 2009). Своєю чергою, ці ураження можуть бути пов’язані з такими ускладненнями, як гостра кровотеча, обструкція та прихована шлунково-кишкова кровотеча (Manetas M., 2004).
Хронічна постгеморагічна анемія та прихована кровотеча не є рідкісними ускладненнями прийому низьких доз АСК, хоча ураження слизової оболонки гастродуоденальної або товстої кишки в таких випадках часто відсутнє (Manetas M., 2004). У деяких пацієнтів у разі прийому низьких доз АСК розвиваються серйозна кровотеча без ідентифікованого джерела, залізодефіцитна анемія або навіть абдомінальні симптоми. Ці дані свідчать про те, що така терапія може призводити до пошкодження слизової оболонки тонкої кишки.
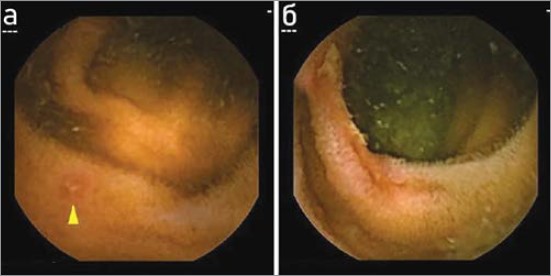
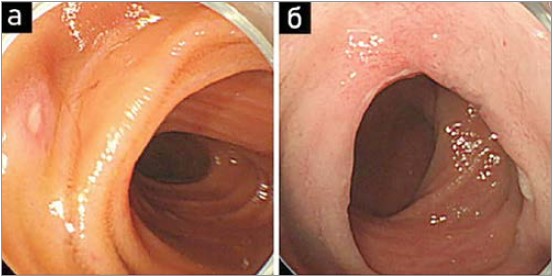
На сьогодні вже добре відомо про характеристики ураження тонкої кишки, які спостерігаються при довгостроковому використанні низьких доз АСК (Endo H., 2009; Watanabe T., 2008). Типові ендоскопічні картини в пацієнтів, які приймали низькі дози АСК, показані на рисунках 1 і 2.
Рис. 1. Капсульна ендоскопія – візуалізація пошкоджень слизової оболонки тонкої кишки в пацієнтів, які приймають низькі дози АСК: а) мале пошкодження слизової; б) циркулярне пошкодження слизової
Рис. 2. Балонна ендоскопія – візуалізація пошкоджень слизової оболонки тонкої кишки в пацієнтів, які приймають низькі дози АСК: а) ерозія тонкої кишки; б) циркулярна виразка
Попередні звіти, в яких обговорювалися характеристики ураження тонкої кишки при довготривалому прийомі АСК, здебільшого припускали, що виразки спостерігаються переважно в дистальній частині тонкої кишки (Watari I., 2014; Endo H., 2011). Використовуючи систему оцінки Льюїса, яка може кількісно оцінити зміни слизової оболонки тонкої кишки, пов’язані з будь-яким запальним процесом (Gralnek I.M., 2008), було доведено, що пошкодження слизової оболонки мають тенденцію бути серйознішими в дистальній частині тонкої кишки (Endo H., 2011). Проте в інших дослідженнях не вдалося виявити жодної такої тенденції в анатомічному розподілі розривів слизової оболонки тонкої кишки при довготривалому прийомі АСК (Watari I., 2014). Можливо, у зв’язку з результатами КЕ в ході деяких із цих досліджень учені не відрізняли розриви слизової оболонки від інших морфологічних порушень, як-от ерозії чи виразки, щоби спростити оцінку спричиненого АСК пошкодження слизової оболонки тонкої кишки.
Можливості профілактики розвитку ентеропатій
Для профілактики уражень тонкої кишки в пацієнтів, які отримують низькі дози АСК, важливо визначити чинники ризику їх розвитку. Стосовно ускладнень верхніх відділів шлунково-кишкового тракту (ШКТ), пов’язаних із застосуванням АСК, добре відомо, що не всі пацієнти, котрі отримують низькі дози, мають еквівалентний ризик, і кілька факторів, як-от похилий вік, наявність пептичної або кровоточивої виразки в анамнезі, одночасне застосування НПЗП / інших антиагрегантів чи антикоагулянтів, наявність або відсутність тяжких супутніх захворювань і застосування високих доз АСК, впливають на ризик (Lanas A., 2007).
Було запропоновано деякі ключові стратегії для мінімізації несприятливих ефектів низьких доз АСК на верхні відділи ШКТ, як-от зменшення впливу модифікованих чинників ризику, зниження дози АСК й одночасне застосування гастропротекторних агентів, переважно інгібіторів протонної помпи (ІПП). У ході проспективного дослідження (Endo H., 2014) вчені за допомогою КЕ проаналізували стан слизової оболонки тонкої кишки в 198 пацієнтів, які постійно приймали низькі дози АСК. Одночасно з АСК для первинної або вторинної профілактики виразки шлунка чи дванадцятипалої кишки учасники приймали препарати з групи ІПП або антагоністи рецепторів гістаміну-2. Виявилося, що використання ІПП (відносний ризик (ВР) 2,04; 95% довірчий інтервал (ДІ) 1,05-3,97) й АСК із кишковорозчинною оболонкою (ВР 4,05; 95% ДІ 1,49-11,0) є незалежними чинниками ризику ентеропатій у разі довготривалого прийому АСК. Причому ураження тонкої кишки в пацієнтів, які приймали ІПП, не були дозозалежними. Під час аналізу з використанням індексу Льюїса застосування ІПП й АСК, вкритої кишковорозчинною оболонкою, було визначено як значущі чинники ризику «помірних» змін слизової оболонки з ВР 5,81 та 3,28 відповідно. Стало відомо, що супутнє застосування ІПП було пов’язане з вищим ризиком розривів слизової оболонки тонкої кишки в пацієнтів, які тривалий час приймали низькі дози АСК.
Дві форми АСК: шлунково- та кишковорозчинна
Для уникнення пошкодження слизової оболонки шлунка, спричиненого місцевим подразненням АСК, були розроблені та широко використовуються два типи препаратів – буферизована, або шлунковорозчинна, АСК та кишковорозчинна. Буферизовані форми містять такі речовини, як карбонат кальцію, оксид магнію та карбонат магнію, котрі знижують концентрацію іонів водню в частинках АСК. Низька концентрація іонів водню збільшує розчинність препарату в шлунку, тим самим зменшуючи час контакту між АСК і слизовою оболонкою шлунка (Banoob D.W., 2002).
Кишковорозчинні форми АСК призначені для припинення розпаду препарату в кислому середовищі та проходження через шлунок без розчинення. Вважалося, що такі форми також можуть зменшити ризик розвитку пошкоджень шлунка. Сьогодні відомо, що з погляду частоти й тяжкості ушкоджень кишковорозчинна форма не надає жодних переваг перед буферизованою АСК і не мінімізує ймовірність пептичної виразки та шлунково-кишкової кровотечі (Törüner M., 2007), оскільки вплив на ризик кровотечі з верхніх відділів ШКТ є системним (de Abajo F.J., 2001).
Майже в усіх дослідженнях учені дійшли висновку, що використання АСК із кишковорозчинною оболонкою не дає додаткової користі для захисту ШКТ. Зокрема, вчені вивчали різницю в тяжкості пошкодження слизової оболонки тонкої кишки залежно від типу препарату в пацієнтів із підозрою на кровотечу з тонкої кишки (Endo H., 2012). Із 70 пацієнтів, які приймали участь у дослідженні, 15 призначили буферизовану АСК, а 55 – кишковорозчинну. Середня тривалість прийому препаратів становила 72 та 60 міс відповідно. Кількість пацієнтів із принаймні однією виразкою була значно вищою в групі учасників, які приймали АСК із кишковорозчинною оболонкою, ніж у тих, хто приймав буферизовану АСК (38,2 проти 6,7%; p=0,026). Оцінка Льюїса показала, що пошкодження слизової оболонки, спричинене АСК, було значно серйознішим у групі кишковорозчинної АСК, ніж у групі буферизованої АСК, особливо в дистальній частині тонкої кишки.
Було припущено, що пошкодження тонкої кишки зумовлено подразнювальною дією препарату. Зважаючи на цей механізм, можна пояснити, чому кишковорозчинна форма є токсичнішою для слизової оболонки тонкої кишки, ніж інші типи АСК (Endo H., 2012). У дослідженнях доктора Y. Hirata з Японії (2011) частка пацієнтів із клінічно значущою анемією, причиною якої могла бути крововтрата в тонкій кишці, зазвичай була вищою серед тих, хто приймав кишковорозчинні форми АСК (2%), а не буферизовані (0,3%). У цьому дослідженні передбачувана тонкокишкова кровотеча була діагнозом, встановленим шляхом виключення, а не прямого підтвердження джерела крововтрати.
Група американських учених відзначила, що найпоширенішою причиною припинення участі в їхньому дослідженні пацієнтами, які приймали комбінацію АСК й омепразолу, були шлунково-кишкові ускладнення (Goldstein J.L., 2016). Інші дослідження, проведені у 2008 та 2010 роках в Японії, показали, що прийом низьких доз кишковорозчинної АСК був значно пов’язаний з ураженням тонкої кишки (Shiotani A., 2010; Watanabe T., 2008).
Порівняння ефективності та біодоступності двох форм АСК
Важливим залишається питання терапевтичної ефективності обох препаратів, їхньої біодоступності та гастропротекції. Вирішальну роль у біодоступності АСК відіграє її всмоктування. АСК – це слабка кислота, яка незначно дисоційована при рН шлунка, а отже, швидко всмоктується крізь різні його клітинні мембрани. У фізіологічних умовах ЦОГ-1 ацетилюється вже в портальній системі кровообігу, де тромбоцити дезактивуються. АСК дуже швидко (період напіврозпаду – 15-20 хв) гідролізується до саліцилової кислоти, 70-90% якої зв’язується з білками плазми. Підвищення рН кишкової рідини призводить до посилення дисоціації АСК, що сповільнює швидкість її всмоктування. Ступінь всмоктування АСК під час її розпаду в кишечнику є непередбачуваною, а її рівні в портальній системі кровообігу, ймовірно, нижчі за межу ефективності (Bultas J., 2013). Із цією концепцією узгоджуються висновки дослідження D.L. Bhatt (2017), яке задокументувало в пацієнтів із цукровим діабетом 2 типу пізнє підвищення рівня саліцилової кислоти в крові та її значно нижчі (p<0,0001) рівні в плазмі після прийому кишковорозчинної АСК.
Уповільнене та знижене всмоктування кишковорозчинної АСК призводить до того, що називається псевдорезистентністю до АСК (Grosser T., 2013). Було виявлено, що в осіб із псевдорезистентністю вплив АСК на агрегацію тромбоцитів нормалізується після введення препарату без кишковорозчинної оболонки. Автори вищезазначеного дослідження припустили, що феномен псевдорезистентності або резистентності з клінічних причин часто був «прихований» в інших публікаціях під пунктом резистентності до АСК, який трапляється в 5-20% досліджень. Справжня резистентність до АСК, здається, буває нечасто й пов’язана зі специфічним фенотипом унаслідок поліморфізму гена PL A1/A2 глікопротеїну IIIa.
Висновки
- АСК широко використовується для профілактики та лікування серцево-судинних і тромботичних цереброваскулярних подій. Але вона завдає шкоди слизовій оболонці ШКТ своїм місцевим і системним впливом, що призводить до розвитку ерозій, виразок і кровотеч.
- АСК із кишковорозчинною капсулою відрізняється зниженою біодоступністю, тому її не слід застосовувати при станах, що потребують швидкого початку дії та пов’язаних із підвищенням активності тромбоцитів, зокрема при гострих коронарних синдромах і цукровому діабеті 2 типу.
- Лікування кишковорозчинною АСК не є ефективним механізмом захисту ШКТ і значно пов’язане з пошкодженням слизової оболонки тонкої кишки.
- Наявні дані свідчать про переваги буферизованої (шлунковорозчинної) форми АСК для профілактики кардіоваскулярних патологій.
Підготувала Юлія Котикович
Медична газета «Здоров’я України 21 сторіччя» № 18-19 (535-536), 2022 р.