31 грудня, 2018
Влияние эверолимуса на клиническое течение почечных ангиомиолипом у детей с комплексом туберозного склероза, получавших лечение по поводу субэпендимальных гигантоклеточных астроцитом

Комплекс туберозного склероза (КТС) – аутосомно-доминантное наследственное заболевание, встречающееся с частотой 1 случай на 5800 новорожденных. Согласно экспертным оценкам, КТС имеет место примерно у 1 млн человек в мире [1, 2]. Это генетическое заболевание вызвано мутациями гена TSC1 либо TSC2, которые приводят к аберрантной активации сигнального пути комплекса 1 мишени рапамицина в клетках млекопитающих (mammalian target of the rapamycin complex 1 – mTORC1) [3]. Результатом усиления передачи сигналов по пути mTORC1 становится рост гамартом в ряде органов (почках, коже, головном мозге, печени, легких и сердце). При этом данные доброкачественные опухолевидные образования могут начинать формироваться еще в период внутриутробного развития [4, 5].
Хотя КТС-ассоциированные опухоли классифицируются как доброкачественные, они могут оказывать значимое отрицательное влияние на функцию тех органов, в которых они локализуются. У многих пациентов с КТС еще в пренатальный период или в раннем детском возрасте формируются кортикальные туберсы и субэпендимальные узлы в головном мозге, которые в дальнейшем могут продолжать медленно расти как нейроглиальные опухоли, известные под названием «субэпендимальные гигантоклеточные астроцитомы» (СЭГА). Рост СЭГА может сопровождаться развитием таких серьезных осложнений, как острая гидроцефалия и смертельный исход [6-8]. К частым клиническим проявлениям КТС также относится развитие почечных ангиомиолипом (АМЛ), которые встречаются примерно у 80% пациентов с этим заболеванием [9]. В типичных случаях эти поражения билатеральны: как правило, в обеих почках выявляют множественные опухоли, которые состоят из гладкомышечных клеток, аномальных кровеносных сосудов и клеток, подобных адипоцитам [10]. Почечные АМЛ, часто диагностируемые уже в подростковом возрасте, имеют тенденцию к росту по мере взросления пациента [11, 12]. Размер АМЛ (>3 см в максимальном диаметре) и их последовательный рост рассматриваются как факторы риска развития осложнений, таких как формирование аневризм с последующим их разрывом, приводящим к кровотечению [13, 14]. Растущие АМЛ также могут медленно сдавливать или инфильтрировать здоровую почечную паренхиму, нарушая функцию органа и повышая риск развития почечной недостаточности [15]. Таким образом, они являются значимым фактором, влияющим на показатели заболеваемости и смертности у пациентов с КТС, что подчеркивает необходимость их раннего выявления и лечения [9, 16, 17].
Применение эверолимуса (ингибитор mTORC1 для перорального приема) в качестве средства лечения пациентов с почечными АМЛ оценивалось в ходе двойного слепого плацебо-контролируемого исследования III фазы EXIST‑2 (EXamining everolimus In a Study of Tuberous sclerosis complex; NCT00790400). На основании полученных данных о более высокой частоте достижения ответа на фоне терапии эверолимусом по сравнению с плацебо (42% в сравнении с 0%; p <0,0001; после лечения, медиана длительности которого составляла 38 недель в группе эверолимуса и 34 недели – в группе плацебо [18]) эверолимус был одобрен к применению для лечения КТС-ассоциированных АМЛ у взрослых пациентов. Совсем недавно более долгосрочный промежуточный анализ данных продленной фазы исследования EXIST‑2 продемонстрировал дальнейшее повышение частоты достижения терапевтического ответа до 54% спустя примерно 2,5 года [19]. В ходе предшествующего исследования EXIST‑1 (NCT00789828), представлявшего собой двойное слепое плацебо-контролируемое исследование III фазы с участием пациентов с КТС-ассоциированными СЭГА, было показано, что лечение эверолимусом обеспечивало более высокую частоту достижения ответа со стороны СЭГА по сравнению с плацебо во время двойной слепой основной фазы (35% в сравнении с 0%; p <0,0001; после лечения, медиана длительности которого составляла 42 недели в группе эверолимуса и 36 недель – в группе плацебо [20]). Эти результаты послужили основанием для одобрения использования эверолимуса при СЭГА у взрослых и педиатрических пациентов, что стало первым показанием к применению этого препарата при КТС. Однако в настоящее время эверолимус пока не одобрен для лечения КТС-ассоциированных АМЛ у детей ввиду недостаточного количества данных о его применении в этой субпопуляции больных [21].
Многие пациенты с КТС, включенные в исследование EXIST‑1, также имели почечные АМЛ, что дало возможность оценить влияние эверолимуса на клиническое течение этих доброкачественных опухолей у педиатрических пациентов. Медиана возраста пациентов, которые получили как минимум одну дозу эверолимуса в ходе исследования EXIST‑1, составляла 9,5 года (диапазон 1,1-27,4 года [22]). Недавно была завершена продленная фаза исследования EXIST‑1, и результаты окончательного анализа его данных подтвердили стойкую эффективность препарата в уменьшении размеров КТС-ассоциированных СЭГА на протяжении примерно 4 лет лечения как у взрослых, так и у детей. При этом у 57,7% пациентов отмечался ответ со стороны опухоли в любой момент лечения [23]. В исследовании EXIST‑1 частота ответа со стороны почечных АМЛ являлась заранее определенной поисковой конечной точкой в подгруппе пациентов с исходным наличием ≥1 целевой АМЛ (максимальный диаметр опухолевого поражения ≥1 см [20, 24]). Во время двойной слепой основной фазы исследования у пациентов, возраст которых первоначально составлял <18 лет, в группе эверолимуса ответ со стороны почечных АМЛ наблюдался в 53% случаев, в группе плацебо – 0% [20, 24]. В данной публикации представлены результаты апостериорного (post hoc) анализа долгосрочного ответа со стороны почечных АМЛ и данные по переносимости эверолимуса у этих педиатрических пациентов на момент завершения исследования EXIST‑1.
Материалы и методы
В исследовании EXIST‑1 [20, 22-24] пациенты любого возраста с установленным диагнозом КТС и последовательным ростом СЭГА были рандомизированы в соотношении 2:1 для получения эверолимуса или плацебо в первичной основной фазе исследования. Эверолимус применяли перорально; терапию начинали с дозы 4,5 мг/м2 площади поверхности тела в сутки, а в дальнейшем дозу титровали до достижения остаточных уровней препарата в крови 5-15 нг/мл (с учетом переносимости). Первичной конечной точкой в данном исследовании являлась частота ответа со стороны СЭГА, определяемая как количество пациентов с уменьшением суммарных объемов СЭГА на ≥50% от исходных при отсутствии развития новых опухолей (≥1 см в наибольшем диаметре) и впервые возникшей гидроцефалии (либо усугубления течения уже имеющейся).
После получения положительных результатов во время основной фазы исследования (от начала исследования до того времени, когда последнему пациенту было проведено изучаемое лечение в течение 6 мес) оно было продолжено в форме заранее запланированной открытой продленной фазы, в ходе которой все пациенты, по-прежнему принимающие участие в исследовании, могли получать эверолимус. Продленная фаза продолжалась до 4 лет с момента рандомизации последнего пациента.
Конечные точки и критерии оценки
В этом апостериорном (post hoc) анализе оценивали частоту ответа со стороны почечных АМЛ у пациентов с наличием одной или большего количества целевых опухолей (максимальный диаметр поражения ≥1 см). Данный показатель представлял собой заранее запланированную поисковую конечную точку исследования EXIST‑1. Как и в исследовании EXIST‑2, частота ответа со стороны почечных АМЛ определялась как количество пациентов, у которых по данным независимой централизованной радиологической экспертизы отмечалось уменьшение суммарного объема целевой почечной АМЛ на ≥50% в сравнении с исходным при отсутствии образования новых целевых АМЛ, отсутствии увеличения размера почки на >20% от минимального и связанных с АМЛ кровотечений II или более высокой степени (установленной на основании Общих терминологических критериев нежелательных явлений Национального института рака – NCICTCAE, версия 3.0 [25]).
Объем опухоли измеряли при помощи компьютерной томографии или магнитно-резонансной томографии почек, которые выполняли через 12, 24 и 48 недель лечения и затем ежегодно. В течение всего исследования у каждого пациента следовало использовать один и тот же метод визуализации. Рассчитывали средний показатель уменьшения объема опухоли, а также количество пациентов с уменьшением суммарного объема целевых АМЛ на ≥30 или ≥50%.
Рассчитанная скорость клубочковой фильтрации (СКФ) оценивалась с использованием формулы Шварца [26] исходно, на 2-й, 4-й, 6-й, 8-й, 12-й и 18-й неделе, а затем каждые 12 недель. Кроме того, проводилась оценка наличия белка в моче с использованием тест-полосок – исходно, на 4-й, 8-й, 12-й, 18-й и 24-й неделе исследования, а затем каждые 12 недель.
В течение всего исследования осуществлялся мониторинг нежелательных явлений (НЯ), которые классифицировались по степени тяжести в соответствии с классификацией NCICTCAE (версия 3.0) [25].
Результаты
 Из 117 пациентов, первоначально рандомизированных в ходе двойной слепой фазы исследования, 111 получили ≥1 дозу эверолимуса в соответствии с условиями рандомизации или в ходе открытой фазы лечения (33 пациента первоначально были рандомизированы в группу плацебо и затем переведены на терапию эверолимусом). Среди получавших эверолимус больных было 33 пациента, возраст которых на момент начала лечения составлял <18 лет и которые исходно имели ≥1 целевой почечной АМЛ. Эта педиатрическая подгруппа пациентов была включена в данный анализ, 23 (69,7%) пациента из нее завершили участие в исследовании в соответствии с протоколом. Причины досрочного прекращения участия в исследовании включали развитие НЯ (n=3; 9,1%), отзыв пациентом информированного согласия (n=3; 9,1%), административные проблемы (n=3; 9,1%) и выбывание из последующего наблюдения (n=1; 3,0%).
Из 117 пациентов, первоначально рандомизированных в ходе двойной слепой фазы исследования, 111 получили ≥1 дозу эверолимуса в соответствии с условиями рандомизации или в ходе открытой фазы лечения (33 пациента первоначально были рандомизированы в группу плацебо и затем переведены на терапию эверолимусом). Среди получавших эверолимус больных было 33 пациента, возраст которых на момент начала лечения составлял <18 лет и которые исходно имели ≥1 целевой почечной АМЛ. Эта педиатрическая подгруппа пациентов была включена в данный анализ, 23 (69,7%) пациента из нее завершили участие в исследовании в соответствии с протоколом. Причины досрочного прекращения участия в исследовании включали развитие НЯ (n=3; 9,1%), отзыв пациентом информированного согласия (n=3; 9,1%), административные проблемы (n=3; 9,1%) и выбывание из последующего наблюдения (n=1; 3,0%).
Более чем половину (54,5%) пациентов этой подгруппы составляли лица мужского пола и европеоидной расы (90,9%; табл.). Медиана (диапазон) возраста этих пациентов составляла 11,5 (5,4-17,5) года, при этом 39,4% пациентов находились в возрасте от 3 и до <10 лет (табл.).
У большинства (81,8%) пациентов исходный размер опухолевого поражения составлял <3 см. На момент завершения исследования (2 октября 2014 г.) медиана длительности воздействия эверолимуса у этих пациентов составляла 44,8 мес (диапазон 1,9-57,9). Средняя остаточная концентрация эверолимуса (Cmin) в течение первых 6 недель увеличивалась с 4,40 нг/мл на 2-й неделе до 5,09 нг/мл на 4-й неделе и 5,76 нг/мл на 6-й неделе, а затем до окончания исследования оставалась в пределах между 6 и 8 нг/мл. 32 из 33 пациентов во время исследования принимали противоэпилептические препараты.
Эффективность
Из 33 пациентов с исходным наличием АМЛ об ответе со стороны данной опухоли сообщалось у 25 (75,8%; 95% доверительный интервал 57,7-88,9) пациентов, а о стабильном течении заболевания как о наилучшем ответе – у 4 (12,1%) пациентов. Наибольшее изменение (выраженное в процентах) объема опухоли по сравнению с исходным было установлено у 30 пациентов (рис. 1).
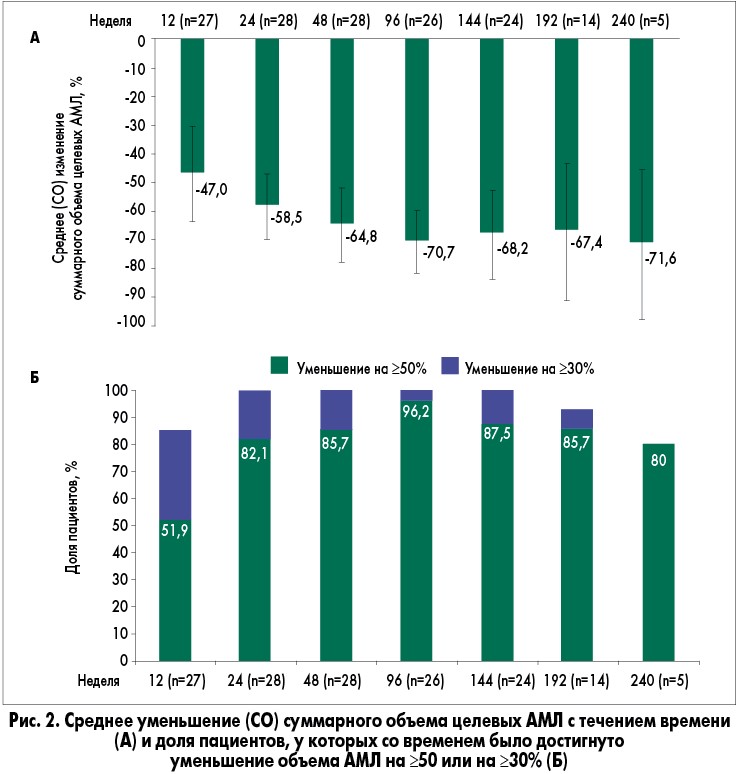 Из них у 29 (96,7%) пациентов регистрировалось уменьшение объема почечной АМЛ в сравнении с исходным в качестве наилучшего ответа. Средняя доля уменьшения объема почечной АМЛ увеличилась с 47% на 12-й неделе до 70,7% на 96-й неделе и затем стабилизировалась на протяжении оставшегося периода исследования (рис. 2A), превышая 67% к 240-й неделе.
Из них у 29 (96,7%) пациентов регистрировалось уменьшение объема почечной АМЛ в сравнении с исходным в качестве наилучшего ответа. Средняя доля уменьшения объема почечной АМЛ увеличилась с 47% на 12-й неделе до 70,7% на 96-й неделе и затем стабилизировалась на протяжении оставшегося периода исследования (рис. 2A), превышая 67% к 240-й неделе.
У большинства (≥80%) пациентов отмечалось клинически значимое уменьшение объема АМЛ (≥50%) с 24-й недели до окончания исследования (рис. 2Б). На 192-й неделе (n=14) у 92,9% пациентов отмечалось уменьшение объема почечной АМЛ на ≥30%, а у 85,7% – на ≥50%. Это демонстрирует, что клинически значимое уменьшение опухоли оставалось стойким с течением времени.
Девять пациентов в этой подгруппе были рандомизированы для получения плацебо в ходе двойной слепой первичной основной фазы исследования и продолжили получать эверолимус в ходе открытой продленной фазы исследования. Во время фазы плацебо у этих пациентов не наблюдалось четкой тенденции к изменению объема АМЛ по сравнению с исходным, однако после начала применения эверолимуса объем АМЛ уменьшился у всех 9 пациентов (рис. 3).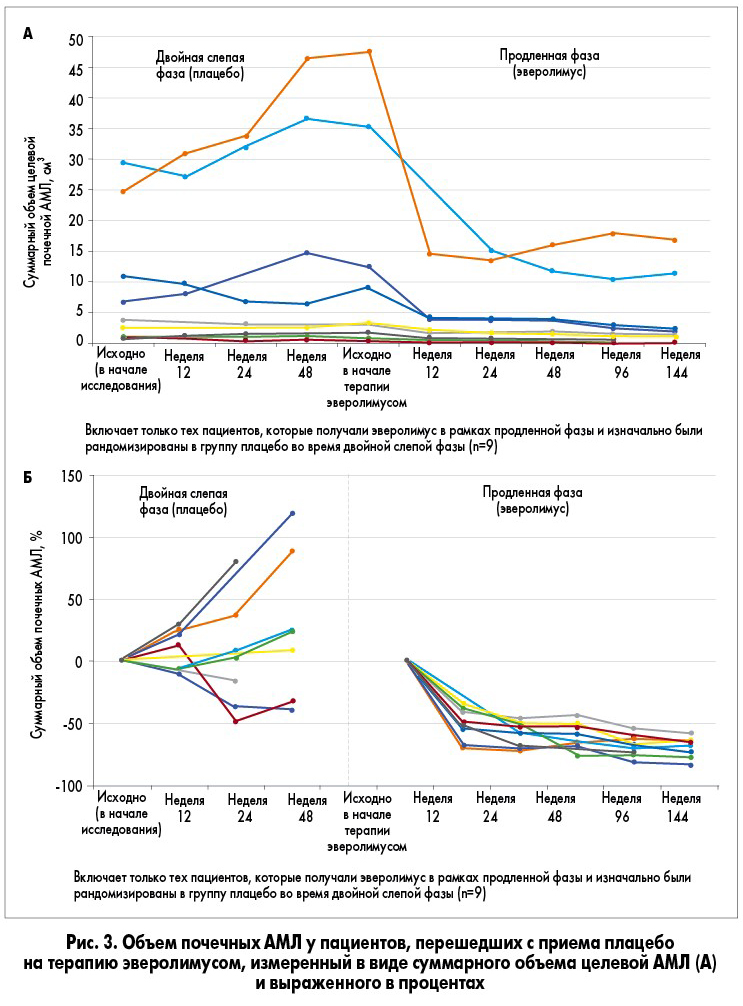
Безопасность
У всех пациентов отмечалось возникновение ≥1 НЯ во время исследования, при этом у большинства (n=30; 90,9%) пациентов отмечались НЯ, которые предположительно были связаны с приемом эверолимуса. Большинство часто указываемых НЯ любой степени, возникавших более чем у 25% пациентов, включали судороги и изъязвление слизистой оболочки полости рта (по 45,5% на каждое НЯ), стоматит (42,4%) и кашель (27,3%).
Четыре (12,1%) пациента сообщали о наличии гипертензии. Примерно у половины (n=18; 54,5%) пациентов возникало ≥1 НЯ III или IV степени; у 30,3% пациентов фиксировали НЯ III или IV степени, которые предположительно были связаны с приемом эверолимуса. Наиболее частые НЯ III степени (независимо от наличия связи с приемом исследуемого препарата) включали пневмонию, судороги, стоматит (n=3 для каждого; 9,1%) и аменорею (n=2 из 10 пациенток в возрасте от 10 до <18 лет; 20%). Из 2 случаев аменореи III степени в 1 случае отмечено разрешение спустя 296 дней на фоне лечения, а в 1 – сохранение НЯ на момент прекращения сбора данных. НЯ IV степени включали лихорадку, пневмонию, гастроэнтерит и гиперкалиемию (n=1 для каждого; 3%). Всем пациентам требовалась дополнительная терапия (медикаментозная и немедикаментозная) для лечения НЯ в определенный момент времени в ходе исследования.
Три (9,1%) пациента прекратили прием эверолимуса по причине НЯ. Так, девочка в возрасте 8,5 года прекратила лечение ввиду нейтропении III степени, которая по предположению исследователей была связана с приемом эверолимуса. Мальчику в возрасте 13,8 года было проведено нейрохирургическое вмешательство (НЯ III степени) по поводу эпилепсии, наличие которой не связывалось исследователями с применением эверолимуса. Мальчик в возрасте 5,9 года прекратил лечение из-за агрессии (НЯ II степени), появившейся после возникновения судорог (расцененных как НЯ III степени).
Функция почек
В целом эверолимус не оказывал значимого влияния на почечный клиренс. Исследуемая субпопуляция пациентов имела первично нормальные показатели СКФ. Средняя СКФ оставалась стабильной в течение всего исследования. Ни у одного пациента не возникло эпизода почечного кровотечения на фоне терапии эверолимусом. У большинства (n=26; 78,8%) пациентов также исходно были зафиксированы отрицательные результаты анализа мочи на наличие белка. О наличии протеинурии как о НЯ сообщалось лишь у 2 пациентов. Не сообщалось ни об одном случае возникновения почечных аневризм.
Обсуждение
Исследование EXIST‑1 продемонстрировало эффективность эверолимуса в уменьшении объема СЭГА с сохранением стойкого ответа в течение приблизительно 4 лет лечения [23]. Заранее спланированный вторичный анализ был проведен с целью оценки долгосрочной эффективности и безопасности эверолимуса в подгруппе педиатрических пациентов с почечными АМЛ. Результаты этого исследования подтвердили эффективность эверолимуса в уменьшении объема почечных АМЛ у детей и подростков – ответ со стороны опухоли был достигнут примерно у 76% пациентов. У большинства (>80%) пациентов в течение исследования было достигнуто уменьшение объема почечных АМЛ как минимум на 30%. Более того, эверолимус четко модифицировал траекторию роста почечных АМЛ у всех педиатрических пациентов, которые изначально получали плацебо в ходе двойной слепой фазы исследования EXIST‑1: было констатировано уменьшение размеров опухоли после начала открытой фазы исследования с назначением эверолимуса.
Хотя эверолимус в настоящее время пока не показан к применению с целью лечения детей с почечными АМЛ, результаты анализа полученных в этой популяции данных согласуются с таковыми у взрослых пациентов. Промежуточный анализ результатов исследования EXIST‑2, проведенный спустя примерно 2,5 года лечения, выявил, что терапия эверолимусом ассоциировалась с частотой ответа со стороны почечных АМЛ, равной примерно 54% у пациентов с КТС-ассоциированными АМЛ либо со спорадическим лимфангиолейомиоматозом [18, 19]. Хотя в текущем анализе сообщалось о более высокой частоте ответа со стороны АМЛ (76% в сравнении с 54%), следует отметить, что включенные в исследование EXIST‑2 пациенты имели более тяжелое течение заболевания (т.е. объем целевой АМЛ составлял >3 см в наибольшем диаметре в исследовании EXIST‑2 в сравнении с >1 см в исследовании EXIST‑1), а значения, приведенные в этой статье, были получены после менее длительного времени (медиана 28,9 в сравнении с 44,8 мес). Кроме того, возможно, что в исследовании EXIST‑1 измерения могли быть не столь точными ввиду относительно меньшего размера целевого опухолевого поражения, который мог сложнее поддаваться оценке с учетом толщины среза при использовании метода визуализации. Следует также рассмотреть дозирование эверолимуса. В то время как в исследовании EXIST‑1 дозирование фокусировалось на целевом остаточном уровне препарата в крови (5-15 нг/мл), в исследовании EXIST‑2 использовали начальную дозу 10 мг, которую впоследствии можно было скорректировать в случае проявления токсичности без мониторинга остаточного уровня препарата в крови [18-23].
Контроль роста АМЛ представляет собой важную цель лечения, достижение которой позволяет избежать развития будущих осложнений. Рост АМЛ может приводить к утрате нормальной почечной паренхимы и последующему развитию хронической болезни почек и почечной недостаточности [14, 15]. Сосудистая система АМЛ зачастую имеет аномальную структуру, что приводит к развитию аневризм и повышению риска спонтанного кровотечения [14]. Факторы риска АМЛ-ассоциированного кровотечения включают размер опухоли (>3 см), размер аневризмы (>0,5 см) и последовательный опухолевый рост [13, 14, 27]. Связанные с наличием почечных АМЛ кровотечения реже встречаются в педиатрической популяции, но ранее сообщалось о них даже у детей с маленькими опухолями [28-30]. Необходим тщательный мониторинг течения почечных АМЛ на протяжении всей жизни, наряду с ранним лечением с целью контроля роста этих опухолей и потенциального снижения риска развития спонтанных почечных кровотечений. В этом анализе эверолимус эффективно уменьшал размер АМЛ, данный эффект оставался стойким на протяжении примерно 4 лет. Таким образом, лечение эверолимусом с целью предотвращения развития крупных поражений (т.е. >3 см) у лиц с последовательным ростом опухоли или размером аневризмы >0,5 см может рассматриваться в качестве средства снижения риска развития кровотечения и/или хронической болезни почек у детей группы высокого риска.
Профиль НЯ в этой подгруппе педиатрических пациентов в целом согласовывался с таковым в предыдущих исследованиях по изучению применения эверолимуса при КТС [18-20, 22, 31, 32]. Хотя все пациенты имели ≥1 НЯ (а наиболее часто упоминаемыми НЯ были судороги, изъязвление слизистой оболочки полости рта, стоматит и кашель), отдельные НЯ III или IV степени возникли не более чем у 4 (12,1%) пациентов для каждого НЯ; о прекращении лечения из-за развития связанных с применением эверолимуса НЯ сообщалось лишь у 2 (6%) пациентов.
Как и ожидалось, о развитии НЯ, ассоциированных с терапией эверолимусом, сообщалось чаще, что согласуется с полученными во время первичной основной фазы исследования EXIST‑1 результатами о более высокой частоте изъязвления слизистой оболочки полости рта (32% в сравнении с 5%) и стоматита (31 против 21%) при приеме эверолимуса в сравнении с плацебо [20]. Хотя о возникновении судорог чаще сообщалось в этой подгруппе (45,5%), не наблюдалось каких-либо различий между группами эверолимуса и плацебо во время первичной основной фазы EXIST‑1 (23% в сравнении с 26%). Об аналогично высокой частоте (30%) сообщалось в общей популяции пациентов во время продленной фазы исследования [20, 22]. Однако частота судорог как впервые возникшего НЯ со временем существенно снижалась – она составляла 21,6% в течение 1-го года лечения и 7% в течение 5-го года [23]. Другие НЯ, которые возникали с аналогичной частотой в группах эверолимуса и плацебо в исследовании EXIST‑1, включали рвоту (17% в сравнении с 13%), кашель (13% в сравнении с 10%) и назофарингит (18% в сравнении с 23%) [20]. Что же касается инфекций, то частота развития отдельных инфекций у детей с АМЛ в исследовании EXIST‑1 имела некоторые вариации в сравнении с таковой у взрослых пациентов при проведении долгосрочного промежуточного анализа результатов исследования EXIST‑2. Назофарингит развивался у небольшого количества пациентов в подгруппе исследования EXIST‑1 в сравнении с таковым в EXIST‑2 (24,2 против с 42,9%); однако инфекции верхних дыхательных путей (21,2% в сравнении с 14,3%) и синусит (21,2% в сравнении с 12,5%) возникали у несколько большего количества детей – участников исследования EXIST‑1 [33]. Следует также отметить, что почти всем (99%) пациентам требовалась дополнительная терапия (медикаментозная либо немедикаментозная) для лечения НЯ в определенный момент исследования. Это необходимо принимать во внимание, поскольку добавление большего количества видов терапии может оказывать влияние на качество жизни пациента.
В этой педиатрической подгруппе не отмечалось существенного изменения функции почек согласно оценке средней рассчитанной СКФ. У большинства пациентов в текущем анализе данных исследования EXIST‑1 результат общего теста на наличие белка в моче был преимущественно отрицательный либо у них обнаруживались лишь следовые его количества. О протеинурии как о НЯ сообщалось лишь у 2 пациентов, а постоянно повышенный уровень белка в моче отмечался у 1 пациента.
Анализ данных исследования EXIST‑1 ассоциирован с рядом ограничений, которые следует принимать во внимание. Во-первых, открытый дизайн продленной фазы и отсутствие группы сравнения могут приводить к ограничению возможности сделать общие выводы о долгосрочном использовании эверолимуса. Кроме того, анализ не имел достаточной мощности для оценки данных подгруппы эверолимуса ввиду небольшого размера выборки педиатрических пациентов с АМЛ. Более того, хотя анализ мочи с использованием тест-полосок является приемлемым методом определения повышенного содержания белка в моче, наличие протеинурии должно быть подтверждено данными количественного измерения, такими как соотношение белок/креатинин в моче. Наконец, существует риск ошибок измерения при поражениях маленького размера.
Выводы
Хотя эверолимус в настоящее время пока не показан к применению у детей с почечными АМЛ, в этой популяции педиатрических пациентов, получавших лечение по поводу КТС-ассоциированных СЭГА, было продемонстрировано уменьшение объема АМЛ почек, которое сохранялось в течение приблизительно 4 лет исследования. При этом профиль зарегистрированных НЯ согласовывался с известным профилем безопасности эверолимуса при КТС, и не наблюдалось заметного влияния препарата на функцию почек. Таким образом, эти результаты подтверждают эффективность и безопасность эверолимуса в лечении педиатрических пациентов с почечными АМЛ и СЭГА, при которых требуется терапия этим препаратом.
Статья печатается в сокращении.
Список литературы находится в редакции.
Pediatr. Nephrol. 2018; 33: 101-109.
Перевела с англ. Елена Терещенко
Тематичний номер «Педіатрія» № 4 (47) грудень 2018 р.




