26 січня, 2021
Місце алергенспецифічної імунотерапії серед сучасних світових тенденцій лікування алергії
27-28 листопада 2020 р., у рамках проекту «Життя без алергії», пройшла науково-практична конференція МОЗ України «Сучасні світові тенденції лікування алергії». Подія відбулася завдяки зусиллям Асоціації алергологів України (ААУ). Онлайн-формат заходу не лише не знизив його значущості й масштабу, а, навпаки, дав можливість долучитися до нього більш як 2 тис учасників. Спікерами виступили провідні українські та зарубіжні експерти в галузі алергології, пульмонології, отоларингології і дерматології з Ізраїлю, Італії, Іспанії та Польщі.
Темою низки доповідей стали сучасні підходи до алергенспецифічної імунотерапії (АСІТ), зокрема виступ члена Європейської асоціації клінічної алергології та імунології (European Academy of Allergy and Clinical Immunology, ЕААСІ), професора Енріке Фернандеса-Кальдаса (Іспанія).
 Імунотерапія (ІТ) – це комплекс методів лікування із застосуванням імунологічних механізмів для боротьби із захворюваннями. Крім усього іншого такий комплекс включає імуносупресію при трансплантації органів або аутоімунних захворюваннях, лікування інтерферонами, методи клітинної терапії раку та гіпосенсибілізуючі засоби для лікування алергічних захворювань (АЗ).
Імунотерапія (ІТ) – це комплекс методів лікування із застосуванням імунологічних механізмів для боротьби із захворюваннями. Крім усього іншого такий комплекс включає імуносупресію при трансплантації органів або аутоімунних захворюваннях, лікування інтерферонами, методи клітинної терапії раку та гіпосенсибілізуючі засоби для лікування алергічних захворювань (АЗ).
Всесвітня організація охорони здоров’я (ВООЗ) визнала АСІТ єдиним етіологічним способом лікування, яке разом з уникненням контакту з алергенами може змінити природний перебіг АЗ і запобігти розвитку астми в пацієнтів з алергічним ринітом (АР) (ВООЗ, 1998).
На сьогодні чітко встановлено, що АСІТ, поряд із контролем довкілля, фармакотерапією та санітарно-просвітницькою роботою, є одним із 4 основних методів подолання такої поширеної у світовій популяції проблеми, як АЗ.
Механізм впливу високодозованої АСІТ, відображений на рисунку 1, полягає в стимуляції продукції Т-хелперів 1 і 2 типу та регуляторних клітин, які блокують дію Т-хелперів 2 типу (Robinson et al., 2004).
Рис. 1. Імунологічні зміни, які лежать в основі терапевтичного впливу високодозованої ІТ (Robinson et al., 2004)
Крім того, посилюється продукція IgG та IgG4, які в подальшому блокуватимуть алергічну реакцію в разі природного впливу алергену. Необхідно зазначити, що хоча симптоми алергії виникають при дуже низьких концентраціях (нг) більшості алергенів, для успішного лікування потрібні набагато вищі дози (мкг).
Незважаючи на те що поняття імунотерапії відомо вже більш як 100 років, цей метод лікування є надзвичайно перспективним. Основними аспектами, які розглядаються в якості майбутнього ІТ, є використання (Burks et al., 2013):
- альтернативних способів вакцинації (бронхіальний, нашкірний, назальний, оральний та сублінгвальний);
- ІТ в поєднанні з біологічними агентами (омалізумабом або агоністом TLR‑9);
- вакцин зі зменшеною алергенністю.
Реалізацію останнього пункту забезпечує застосовування модифікованих алергенів, розроблених для проведення АСІТ з метою підвищення ефективності (скорочення часу досягнення ефекту) та зменшення побічних ефектів. Для цього застосовують:
- Т-клітинні епітопні вакцини;
- рекомбінантні алергенні вакцини;
- вакцини на основі комбінації ад’юванта та алергену;
- наночастинні вакцини;
- комбіноване лікування імуномодуляторами;
- алергоїдну вакцинацію.
Алергоїди закріпили свою роль в якості важливого методу алерготерапії. Отримують ці речовини шляхом полімеризації природних алергенів із глютеральдегідом (GA). У результаті інкубації утворюються полімери з високою молекулярною масою. GA-модифіковані алергени містять меншу кількість епітопів до IgE проти нативних екстрактів. Це робить їх менш алергенними, а значить – безпечнішими.
Різна молекулярна маса супроводжується різницею в презентації антигена між нативними та модифікованими алергенами, що відображено на рисунку 2 (Akdis, 2000).
Рис. 2. Різниця в презентації антигена між нативними та модифікованими алергенами (Akdis, 2000)
У разі потрапляння в організм природних алергенів відбувається дегрануляція тучних клітин і базофілів. Презентація антигена, опосередкована IgE, веде до збільшення виробництва Th2 та IgE. Модифіковані алергени використовують фагоцитарну/піноцитарну систему презентації антигена (поглинання антигена) дендритними клітинами та моноцитами/макрофагами. Це забезпечує генерацію збалансованої структури цитокінів Th0/Th1 типу та виробництво IgG В-клітинами пам’яті.
Таким чином, фармакодинамічні властивості алергоїдів включають меншу, якщо порівняти з нативними алергенами, зв’язувальну здатність з IgE та ферментативну активність при однаковому зв’язуванні IgG та здатністю розпізнавати клітини. Ці характеристики забезпечують меншу алергенність при збереженій імуногенності, що дає можливість використовувати вищі дози, прискорені схеми вакцинації та змішувати різні види алергоїдів в одній комбінації.
Перше клінічне дослідження, яке підтвердило, що полімеризований антиген амброзії пришвидшує імунізацію пацієнтів з атопією з меншими побічними ефектами, ніж стандартні мономерні препарати, датується 1976 роком (Metzeg W.J. et al., 1976). З того часу інтерес до цього методу зростає, що відображається у світових тенденціях практичного застосування алергоїдів для АСІТ. Так, за останні 10 років в Іспанії частка вакцин на основі алергоїдів збільшилася більш як удвічі: з 34,6 до 71,9% (AIMFA, 2020).
Безпека та ефективність препаратів алергенів із використанням алергоїдів для проведення АСІТ компанії Inmunotek (Іспанія) (сублінгвальної форми – Oraltek та підшкірної – Alxoid) доведені в ході численних контрольованих клінічних досліджень.
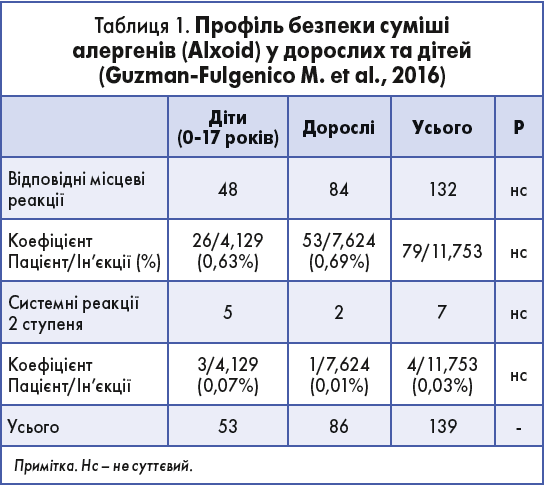
Так, M. Guzman-Fulgenico та співавт. оцінювали профіль безпеки АСІТ модифікованими за допомогою глутаральдегіду екстрактами алергенів у дітей та дорослих. Ретроспективне дослідження оцінило дані 1855 пацієнтів, які отримували для АСІТ сумішшю алергенів (Alxoid) у різних режимах: традиційний, терміновий, надтерміновий (Guzman-Fulgenico М. et al., 2016). У результаті препарат показав відмінний профіль безпеки (табл. 1).
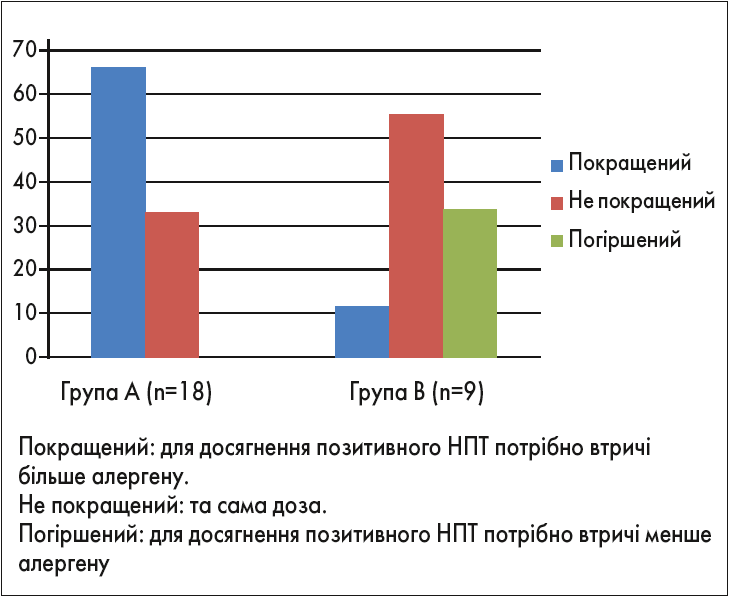
Subiza та співавт. оцінювали ефективність кластерної ІТ модифікованою глутаральдегідом сумішшю трав шляхом проведення специфічних назальних провокаційних тестів (НПТ) до лікування та менш ніж через 2,5 міс після нього (Subiza et al., 2008). Пацієнтів було розподілено на 2 групи, перша (група А) отримувала АСІТ препаратом Alxoid, учасники контрольної групи (група В) АСІТ не отримували. Результати дослідження відображені на рисунку 3.
Рис. 3. Профіль відповіді на специфічні НПТ в пацієнтів, які отримували (група А) та не отримували (група В) АСІТ препаратом Alxoid (Subiza et al., 2008)
Як можна побачити на графіку, майже в 70% пацієнтів, які отримували АСІТ, стан покращувався, тоді як у контрольній групі позитивна динаміка спостерігалася лише в 10% пацієнтів. У більш як 50% пацієнтів симптоматика не змінилася, а у більш як 30% стан взагалі погіршився. У групі А погіршення стану в жодного з учасників не відбулося. Ці результати показують, що, попри те що АСІТ полегшує перебіг захворювання не в 100% випадків, вона все ж таки перешкоджає погіршенню стану пацієнта.
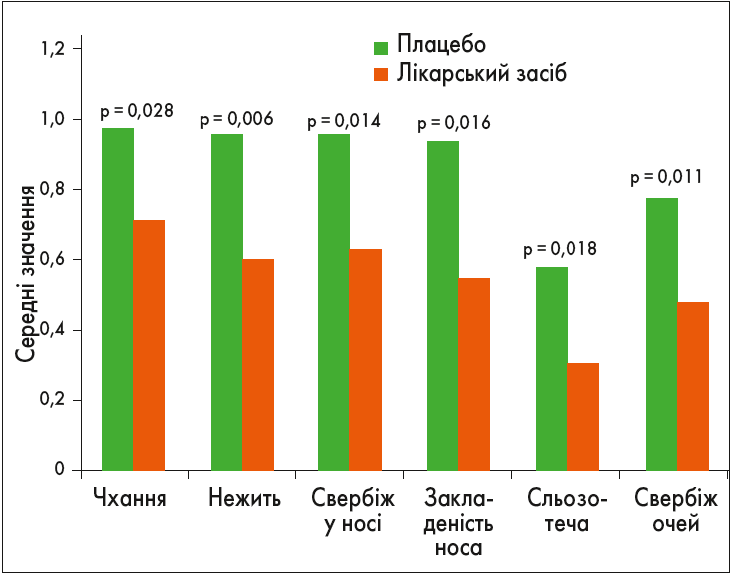
У ще одному подвійному сліпому плацебо-контрольованому дослідженні оцінювали профіль безпека / ефективність високополімеризованого екстракту трав’яного пилку з використанням нового кластерного 1-річного протоколу дозування Alxoid. У дослідження було включено 121 пацієнта віком від 18 до 75 років з АР, кон’юнктивітом та/чи алергічною бронхіальною астмою (БА). До складу досліджуваного препарату входило 60% трави в рівних пропорціях: Holcus lantus, Dactylis glomerata, Lolium perenne, Phleum pretense, Poa ratensis, Festuca elatior; 40% Secale cereal. Первинна кінцева точка включала оцінку потреби у фармакотерапії та інтенсивність симптомів (Klimek et al., 2014). У результаті було встановлено, що використання нового кластерного протоколу дозування Alxoid протягом року супроводжувалося достовірним зменшенням симптоматики проти групи плацебо. Показники ефективності, отримані в дослідженні, відображені на рисунку 4.
Рис. 4. Ефективність суміші трав Alxoid у пацієнтів з АР, кон’юнктивітом та/чи алергічною БА (Klimek et al., 2014)
Безпека оцінювалась у 120 пацієнтів, які за період дослідження отримали загалом 1778 ін’єкцій. Спостерігалися такі побічні явища:
- негайні місцеві реакції ≥1 ступеня трапилися після 0,7% ін’єкцій препарату на етапі збільшення дози;
- системні реакції 1 ступеня виникли після 0,6% ін’єкцій препарату;
- системні реакції >2 ступеня за класифікацією меморандуму ЕААСІ не спостерігалися.
Отримані результати підтвердили високу безпеку та ефективність препарату Alxoid у пацієнтів з алергією на трав’яний та/або житній пилок.
Uhlight та співавт. також оцінювали ефективність і безпеку кластерної ІТ високополімеризованими алерген-екстрактами кліща домашнього пилу (КДП) в проспективному багатоцентровому дослідженні за участю 53 пацієнтів віком 7-79 років з АР, кон’юнктивітом
та/чи алергічною БА в анамнезі (Uhlight et al., 2009).
Через рік терапії спостерігалося статистично значуще зменшення активності симптомів риніту, кон’юнктивіту та БА на 60,2; 61,9 та 47,5% відповідно. Профіль безпеки препарату виявився відмінним: системні реакції 1 та 2 ступеня зазначалися лише при 0,5% ін’єкцій.
Одне з нещодавніх досліджень з оцінки ефективності та безпеки ІТ Alxoid було проведено Cardona та співавторами. Проспективне паралельне плацебо-контрольоване дослідження за участю 250 пацієнтів із ринокон’юнктивітом (із них у 107 була ще й БА) тривало 12 місяців. Для оцінки інтенсивності симптомів (первинна кінцева точка) кожні 3 міс застосовували Комбіновану оцінку симптомів та ефективності лікування CSMS (риніт) та Тест контролю над астмою (АСТ) та покрокове лікування астми згідно з GINA (Cardona R. et al., 2019).
Через 3; 6 та 12 міс лікування спостерігалося достовірне зменшення інтенсивності симптомів, оцінених за шкалами CSMS та АСТ.
Крім того, через 12 міс АСІТ зменшилася потреба у фармакотерапії згідно з відповідними кроками лікування БА за GINA.
Таким чином, висока клінічна ефективність і безпека продуктів Inmunotek як для сублінгвальної (Oraltek), так і для підшкірної (Alxoid) АСІТ підтверджені в контрольованих клінічних дослідженнях із використанням стандартизованих міжнародних шкал, зокрема CSMS, АСТ та препаратів, рекомендованих GINA для покрокового лікування.
У доповіді завідувача кафедри клінічної імунології та алергології із секцією медичної генетики Національного медичного університету ім. О.О. Богомольця (м. Київ), доктора медичних наук, професора Андрія Ігоровича Курченка йшлося про імунобіологію КДП.
Кліщі домашнього пилу належать до сімейства Pyroglyphidae та в основному представлені Dermatophagoides pteronyssinus, Dermatophagoides farinea та Eroglyphus maynei. Вони поширені в усіх регіонах та на всіх континентах земної кулі, у тому числі на антарктичній дослідній станції. За оцінками, у 84% будинків США виявляють алергени КДП.
Клінічно вагомі характеристики КДП
Приблизно 75% ваги КДП складає вода. Кліщі не можуть пити воду самостійно, тому дуже залежать від вологості навколишнього середовища, поглинаючи воду кінцівками. Ця здатність зберігається при відносній вологості повітря, яка становить не менш ніж 65%. Кліщі починають втрачати воду при 55% вологості, а критичне зниження виживання спостерігається при вологості 50%, що має важливе значення для елімінаційної терапії.
Однією з найважливіших, з точки зору алергенного потенціалу, характеристик КДП є їхня травна система. Кліщ домашнього пилу щодня виділяє фекальні частинки, оточені перитрофічною мембраною (приблизно 20 на добу). Ферменти перитрофічної мембрани дають можливість додатково розщеплювати їжу.
Першим ідентифікованим у 1980 р. алергеном КДП був алерген І цистеїнової протеази Dermatophagoides pteronyssinus або Der p1, за яким слідують Der p2 і гомологічні алергени, отримані від Dermatophagoides farinea 1 та 2. 97% пацієнтів з алергією на КДП сенсибілізовані до алергену Der p1. На сьогодні відомо про 24 різноманітні типи алергенів пилового кліща.
Сконцентровані у фекаліях КДП головні алергени Der p2 та Def p2 здатні активувати вроджені імунні реакції завдяки унікальному механізму. За допомогою специфічної молекули MD2 вони напряму взаємодіють із Toll-like рецептором (TLR)-4. Ця властивість робить Der p2 та Def p2 спільними алергенами для шкіри і дихальних шляхів.
Діагностика сенсибілізації до КДП
Сучасним та найбільш чутливим методом, який дає можливість визначити сенсибілізацію як до мажорних, так і до мінорних компонентів КДП, є ALEX2.
Багатокомпонентний, розроблений на основі унікальних нанотехнологій тест ALEX² дає можливість одночасно визначити рівень антитіл до алергенних молекул і екстрактів алергенів у крові та отримати практично повну картину сенсибілізації кожного пацієнта.
В ALEX² інтегрований потужний інгібітор перехресно-реактивних карбогідратних детермінант (ССDs), які взаємодіють із сироваткою крові під час інкубації і допомогають отримати максимально точні кількісні результати рівня специфічних IgE в крові пацієнта. Ця особливість тесту ALEX² дає можливість правильно й точно інтерпретувати результати аналізу в пацієнтів із сенсибілізацією до CCD-перехресно-реактивної карбогідратної детермінанти і підвищує специфічність методу.
Терапевтична стратегія при алергії на КДП
Специфічна ІТ алергенами кліщів Dermatophagoides – ефективний засіб лікування IgE-опосередкованих АЗ дихальних шляхів, який сприяє розвитку імунологічної толерантності й довготривалому клінічному ефекту.
У пацієнтів з АР клінічний ефект АСІТ корелює з імунологічними змінами на гуморальному та клітинному рівнях. Перші полягають у зниженні співвідношення специфічних IgE/ IgG4 і підвищенні slgG4. Зміни на клітинному рівні представлені зниженням відповіді ефекторних клітин, зокрема Th2, Th9 та Th17, і підвищенням активності Th1.
Високоякісний препарат для сублінгвальної АСІТ при алергії на КДП представлений на ринку України компанією Іnmunotek під торговою назвою Oraltek. Це сублінгвальний спрей, який показаний для лікування АР, кон’юнктивіту та астми. Клінічні дослідження продемонстрували достовірне зменшення інтенсивності алергічних симптомів через 12 міс після застосування препарату Oraltek (Kohlmoos et al., 2009).
Роль мультикомпонентної діагностики алергії при виборі АСІТ стала темою виступу професора кафедри професійних хвороб та клінічної імунології Дніпропетровської медичної академії МОЗ України (м. Дніпро), завідувачки Регіонального алергологічного центру, доктора медичних наук, професора Євгенії Михайлівни Дитятківської. 
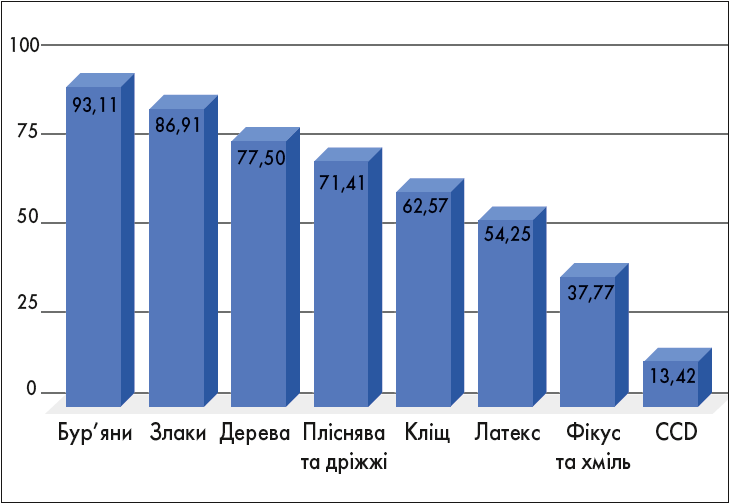
Нещодавно за результатами мультикомпонентного алерготесту ALEX проводилася оцінка профілю сенсибілізації 1742 пацієнтів, мешканців Дніпра. Було виявлено, що майже 96% пацієнтів сенсибілізовані до пилкових алергенів. Із них частота сенсибілізації до пилку бур’янів становить 93%, злаків – 86,9%, а дерев – 77,5%. Більш детальна структура сенсибілізації населення до інгаляційних алергенів представлена на рисунку 5.
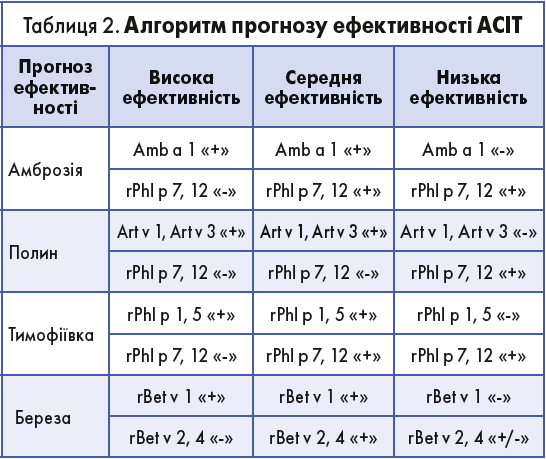
З метою прогнозу ефективності АСІТ були оцінені мажорні та мінорні алергени трав, дерев і бур’янів. Алгоритм прогнозування клінічної відповіді на АСІТ представлений в таблиці 2.
Використовуючи даний підхід, можна спрогнозувати ефективність АСІТ ще до початку терапії.
Якщо передбачається висока або середня ефективність АСІТ, треба обрати препарат з оптимальним співвідношенням ефективність/безпека, яким є Alxoid виробництва компанії Inmunotek. До складу препарату входять модифіковані екстракти алергенів для підшкірної ІТ, чиї висока молекулярна маса та низька алергогенність дає можливість використовувати прискорені режими введення та досягти максимальної дози за короткий час. Це, своєю чергою, забезпечує ранню клінічну відповідь, що покращує не тільки якість життя пацієнтів, але й їхню прихильність до лікування.
Суміші модифікованих екстрактів алергенів та їхній профіль безпеки вивчався в дослідженні Caballero та співавт.за участю 1216 пацієнтів, які отримували суміші модифікованих алергенів: 284 – з кліщами та пилком, 29 – з алергенами лупи котів і кліщами та/або пилком, 903 – із сумішшю пилку. Концентраційний екстракт алергену в суміші становив 10 000 [терапевтичні одиниці] Tо/мл. Профіль безпеки оцінювався за частотою небажаних реакцій. Усі виявлені побічні явища були І ступеня тяжкості. Місцеві реакції включили 17 негайних та 22 відтермінованих випадки, системні (кропив’янка та бронхоспазм): 34 негайних та 19 відтермінованих.
Рис. 5. Розподіл частоти сенсибілізації по групах інгаляційних алергенів у м. Дніпро (n=1742)
Таким чином, прискорені схеми введення сумішей модифікованих алергенів мають високий профіль безпеки і дають можливість проводити лікування хворих на полісенсибілізацію без збільшення кількості ін’єкцій.
На аспектах хворобо-модифікуючої терапії АЗ зосередила увагу у своєму виступі доцент кафедри педіатрії № 1 НМАПО ім. П.Л. Шупика, кандидат медичних наук Олена Вікторівна Шарікадзе. 
Урбанізація, індустріалізація, забруднення довкілля і зміни клімату зумовлюють і зміну діапазону алергенів. При цьому єдиний напрям подальших дій полягає в зміцненні та оптимізації профілактичних і лікувальних стратегій.
На жаль, препарати для симптоматичного лікування алергії, які сьогодні доступні на фармацевтичному ринку, недостатньо ефективні. Навіть після оптимізації лікування у значної частини пацієнтів (іноді до >50%) симптоми алергії не зникають.
Іншою проблемою є короткочасність медикаментозної терапії. Так, в одному з досліджень при лікуванні дітей інгаляційними кортикостероїдами симптоми алергії були практично відсутні. Через рік після відміни стероїдів симптоми з’явилися знову і не відрізнялися за інтенсивністю від тих, що були в дітей, які ніколи не отримували лікування (Guilbert T.W. et al., 2006). Таким чином, якщо пацієнти припиняють приймати ліки, симптоми захворювання повертаються.
Ще одним мінусом тривалої медикаментозної терапії є зростання вірогідності побічних ефектів. Це напряму впливає на комплаєнс та потребує призначення більш сучасних і дороговартістних препаратів, що є економічно недоцільним.
У найближчі роки метою вчених і керівництва охорони здоров’я має стати повне лікування захворювання. Єдиною терапевтичною опцією, яка може потенційно впливати на перебіг захворювання та має хворобо-модифікуючий ефект, є АСІТ.
Основні переваги АСІТ:
- зниження чутливості до конкретного алергену;
- зменшення або зникнення клінічної симптоматики в період природного впливу алергену;
- зниження потреби в протиалергійних лікарських препаратах;
- висока ефективність при інсектній алергії, алергічних сезонних і цілорічних ринітах і алергічній БА;
- тривале збереження позитивного ефекту (протягом кількох років);
- висока ефективність у молодих пацієнтів та на ранніх стадіях захворювання.
Згідно з рекомендаціями ЕААСІ необхідно інтегрувати АСІТ у загальну систему лікування алергічної БА для зменшення симптомів, покращення якості життя та контролю астми (ЕААСІ, 2019). Так, АСІТ потрібно призначити всім пацієнтам із частково контрольованою та контрольованою БА. У разі поганого контролю АСІТ показана після досягнення контролю.
З огляду на те що алергічний компонент астми більш виражений у дітей та підлітків і випадки найбільш тяжкого перебігу астми частіше виникають у ранньому дитячому віці, АСІТ варто призначати якомога раніше. АСІТ у дітей знижує ризик розвитку астми, розширення спектру сенсибілізації та зменшує загрозу формування хронічного обструктивного захворювання легень.
Важливим моментом, на який необхідно звернути увагу при АСІТ, є різна ефективність різних препаратів. Екстракти для АСІТ мають відповідати сучасним методологічним стандартам щодо якості, ефективності й безпеки.
Препаратом для проведення АСІТ, ефективність і безпека якого доведені в контрольованих клінічних дослідженнях, є Alxoid від іспанської компанії Inmunotek.
Так, оцінка клінічного результату АСІТ із використанням екстракту алергоїду в дітей з алергічним ринокон’юнктивітом проводилася в дослідженні Leong та співавт. (Leong et al., 2019). Проспективне обсерваційне дослідження включило дітей у віці 5-15 років, які розпочали АСІТ пилком трави, модифікованим глютаральдегідом у березні-червні 2017 року. Загальний показник ринокон’юнктивіту, використання ліків та побічні явища були оцінені до початку АСІТ та через 12 і 24 міс лікування.
У результаті в усіх учасників спостерігалося зниження оцінки інтенсивності симптомів за Візуальною аналоговою шкалою більш як на 30% за перші 12 місяців. Стійке поліпшення симптомів зберігалося 24 міс після лікування. Не повідомлялося про розвиток помірних і тяжких побічних явищ.
Крім того, зменшилася частка учасників, які застосовували протиалергічне лікування (на 89 та 50% через 12 та 24 міс відповідно).
Для цього можна використовувати сублінгвальні вакцини. Препаратом із доведеними якістю, ефективністю і безпечністю використання є сублінгвальний спрей Oraltek. Гліцерин, який входить до складу Oraltek, чинить протимікробний та противірусний ефект, подовжує контакт антигена зі слизовою, збільшуючи захоплення антигенпрезентуючими клітинами, та інгібує протеолітичну активність і агрегацію білка (Lockey R., 2014; Nelson H., 1999; Vogenende V., 2009).
Переваги вакцини Oraltek:
- Відсутність ініціального етапу, тобто пацієнт знаходиться на максимальній дозі з першого дня захворювання.
- Відмінний профіль безпеки: протягом 60 тис курсів терапії спостерігалося всього 27 побічних реакцій (Traina G. et al.).
- Хороший комплаєнс завдяки відсутності періоду наростання.
Доцент кафедри клінічної, лабораторної імунології та алергології НМАПО ім. П.Л. Шупика, завідувачка лабораторії клінічної імунології клінічної лікарні «Феофанія» Людмила Станіславівна Осіпова у своїй доповіді розкрила дуже актуальну тему мультикомпонентної підтримки імунної системи в умовах СOVID‑19.
Пандемія СOVID‑19 є особливо небезпечною для пацієнтів із супутніми хронічними захворюваннями. Астма може погіршити перебіг СOVID‑19 у разі виникнення інфекції, насамперед при використанні системних стероїдів (Morais-Almeidaa M. et al., 2020).
Небезпека СOVID‑19 полягає в розвитку так званого цитокінового шторму. Це потенційно летальна для імунної системи реакція, і зводиться вона до неконтрольованої активації, яка не несе захисного впливу, цитокінами імунних клітин у вогнищі запалення і вивільнення останніми нової порції цитокінів унаслідок наявності прямого зв’язку між цими процесами. Хибне коло призводить до руйнування тканин вогнища запалення. Одночасно реакція поширюється на сусідні тканини і по мірі розвитку набуває системного характеру, охоплюючи весь організм у цілому.
На сьогодні не було проведено контрольованих клінічних досліджень, які б підтвердили ефективність будь-якого противірусного препарату проти СOVID‑19. Однак деякі речовини є достатньо перспективними та використовуються off-label. Одним із таких лікарських засобів є Віусид – багатокомпонентний препарат, дія якого зумовлена синергічним впливом компонентів, що входять до його складу.
Гліциризинова кислота (ГК) підвищує ригідність мембран клітини і вібріона, вбудовуючись у них. У результаті підвищується енергетичний поріг, необхідний у разі утворення зон негативної кривизни при злитті (Vega et al., 2019).
Гліциризин пригнічує індукцію оксидативного стресу в разі грипозної інфекції, виявляючи антиоксидантні властивості, що сприяє зниженню вірус-індукованої продукції цитокінів/хемокінів, не впливаючи на реплікацію самого вірусу.
У дослідженні J. Cinatl та співавт. була продемонстрована вірус-інгібуюча дія гліциризину на SARS-асоційований коронавірус у клітинній культурі. Ефект гліцину виявився сильнішим за препарати порівняння – рибавірин, 6-азаурідін, піразофурін, мікофенолову кислоту (Cinatl J. et al., 2003).
Також у дослідженні Michaelis та співавт. було показано, що в клітинах легеневого походження лінії А549 гліциризин пригнічує реплікацію високопатогенного вірусу грипу А (Н5N1), вірус-індукований апоптоз і експресію прозапальних цитокінів.
Аргінін, ще один компонент Віусиду, є принципово важливим для проліферації та функціонування Т-лімфоцитів. Дефіцит аргініну супроводжується зниженням опору до вірусних та бактеріальних патогенів, пригніченням протипухлинного імунітету та злоякісною трансформацією (Cohen W.D. et al., 2013).
У систематичному огляді та метааналізі J.W. Drover та співавт. оцінювався вплив аргініну на інфекційні ускладнення в пацієнтів з елективними оперативними втручаннями. Було виявлено, що застосування аргініну супроводжувалося зниженням ризику інфекцій в 1,7 раза і тривалості перебування в стаціонарі більш як на 2 дні (Drover J.W. et al., 2011).
Гліцин має протизапальну та цитопротекторну дію (Zhong Z. et al., 2003).
В основі протизапальних ефектів гліцину лежить його здатність знижувати вироблення активних форм кисню і зменшувати вираженість оксидативного стресу (Mauriz J.L., 2001).
Цинк має широкий спектр імунорегуляторних ефектів. Його внутрішньоклітинний рівень є критичним фактором активації CD4+T-лімфоцитів при їх взаємодії з лПС-активованими дендритними клітинами (Kitamura H., 2006).
Дефіцит цинку призводить до порушення фагоцитозу, внутрішньоклітинного кіллінгу, за рахунок дисрегуляції ядерного транскрипційного фактору κВ активується синтез фактору некрозу пухлини, ІL‑6, ІL‑8 та деяких інших прозапальних цитокінів (Murakami M. et al., 1998).
У майже 35% літніх людей в країнах із високим рівнем доходу спостерігається недостатність цинку (Prasad, 2014). Те, що дана категорія пацієнтів є однією з найуразливіших в умовах СOVID‑19, може бути пов’язане з дефіцитом саме цього мікроелементу.
Яблучна кислота має антивірусні властивості і значний антиоксидантний ефект, нормалізує компенсаторно-метаболічні процеси в тканинах, активізує окислювальні функції мітохондрій, бере участь у синтезі [аденозинтрифосфату] АТФ.
Перші дані щодо застосування Віусиду в умовах СOVID‑19 були опубліковані в Еквадорі. 12 пацієнтів у віці 35-65 років із середньотяжким перебігом захворювання пройшли амбулаторний 10-денний курс лікування:
- Віусид – 1 саше 3 р./добу.
- Кларитроміцин 500 мг – 2 р./добу.
- Ацетилцистеїн 600 мг – 1 р./добу.
- Парацетамол – 1 г кожні 8 годин.
Поліпшення в кінці курсу лікування зазначалося в 95% пацієнтів.
Крім самоізоляції контактним особам було призначено 1 саше Віусиду. У результаті жоден із досліджуваних не захворів (Crespo A. et al., 2020).
Згідно з протоколом лікування критичних станів СOVID‑19 EVMS (Eastern Virginia Medical School) для профілактики та лікування рекомендується цинк, аскорбінова кислота та кверцетин, які входять до складу Віусиду (Marik P. et al., 2020).
Проводиться клінічне дослідження ефективності й безпеки Віусиду в пацієнтів із СOVID‑19.
Отже, застосування Віусиду навіть за відсутності прямого показання при коронавірусній інфекції СOVID‑19 не суперечить нормативним документам і стандартам; згідно з рекомендаціями ВООЗ можливе призначення препаратів із передбачуваною етіотропною ефективністю off-label.
Високий науковий рівень заходу, доповіді на дуже актуальні теми, насичена цікавою інформацією робоча програма, представлені спікерами результати численних клінічних досліджень з алергології, дружня та невимушена атмосфера подарували учасникам науково-практичної конференції можливість не лише отримати нові знання та перейняти досвід своїх авторитетних колег, але й відчути позитивні емоції від спілкування. У такий складний час це вкрай важливо.
Підготувала Ганна Кирпач
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 4 (53), 2020 р.