23 липня, 2022
Оптимізація вибору антигістамінних препаратів при лікуванні кропив’янки та алергічного риніту
 Висока поширеність алергічних захворювань (АЗ) із року в рік продовжує неухильно зростати. Останніми десятиліттями ця проблема – одна з основних для національних систем охорони здоров’я. Через свою високу актуальність АЗ все частіше стають темою багатьох конференцій, спрямованих на покращення обізнаності лікарів різних спеціальностей щодо алергопатології. Одним із таких заходів стала науково-практична конференція, організована за ініціативи МОЗ України, «Життя Без Алергії. International‑3», яка відбулася в першій декаді вересня 2021 року в онлайн-форматі. Доповідачами виступили провідні вітчизняні та світові експерти, зокрема професор алергології Віденського медичного університету Рудольф Валента (Австрія), доктор медичних наук Антонелла Мураро (Італія), професор Торстен Зубербір (Німеччина), професор Ірусен М. Елвіс (Південно-Африканська Республіка) та інші.
Висока поширеність алергічних захворювань (АЗ) із року в рік продовжує неухильно зростати. Останніми десятиліттями ця проблема – одна з основних для національних систем охорони здоров’я. Через свою високу актуальність АЗ все частіше стають темою багатьох конференцій, спрямованих на покращення обізнаності лікарів різних спеціальностей щодо алергопатології. Одним із таких заходів стала науково-практична конференція, організована за ініціативи МОЗ України, «Життя Без Алергії. International‑3», яка відбулася в першій декаді вересня 2021 року в онлайн-форматі. Доповідачами виступили провідні вітчизняні та світові експерти, зокрема професор алергології Віденського медичного університету Рудольф Валента (Австрія), доктор медичних наук Антонелла Мураро (Італія), професор Торстен Зубербір (Німеччина), професор Ірусен М. Елвіс (Південно-Африканська Республіка) та інші.
У структурі АЗ на особливу увагу заслуговують хронічна кропив’янка (ХК) і алергічний риніт (АР). Ці стани мають спільну патогенетичну основу і підходи до лікування і значуще погіршують якість життя і працездатність хворих. Для ефективнішого лікування пацієнтів із ХК і АР варто розуміти спільні для цих захворювань механізми розвитку і правильно на них впливати. Саме на цих двох питаннях зосередив увагу у своїй доповіді директор Фонду Європейського центру досліджень алергії (ECARF), генеральний секретар Всесвітньої європейської мережі з алергії та астми (GA2LEN), президент Німецької академії алергології та медицини довкілля (DAAU), доктор медицини, професор Торстен Зубербір.
Ключові слова: алергічний риніт, хронічна кропив’янка, антигістамінні препарати ІІ покоління, біластин, якість життя, ARIA, GA2LEN, мінімальне персистуюче запалення, дослідження BUCUM.
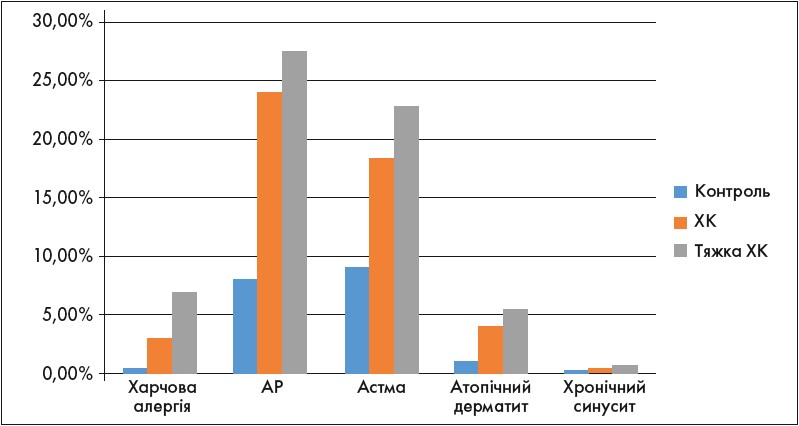
Насамперед нагадаємо, що кропив’янка – це не ізольоване ураження шкіри, а системне захворювання, яке характеризується значною варіативністю симптомів, на тяжкість яких впливає коморбідна патологія (Darlenski R. еt al.,2014). Спектр і частота захворювань, асоційованих із ХК, відображені на рисунку 1 (Rosman et al., 2015).
Рис. 1. Коморбідна патологія, асоційована з ХК (Rosman et al., 2015)
Отже, АР і ХК дуже часто крокують пліч-о-пліч. Це пов’язано передусім зі спільними патогенетечними механізмами, зокрема залученням у процес опасистих клітин. Вплив алергену на опаститу клітину при АР супроводжується виділенням гістаміну, який також відіграє ключову роль у патогенезі ХК. Крім гістаміну виділяються й інші прозапальні медіатори, що підтримують стійке запалення, результатом якого є пошкодження тканин (Pearlman, 1999; Bascom et al., 1988; Quiraishi et al. 2004; Minshall et al., 1998).
Порушення носового дихання при АР і свербіж при ХК украй негативно впливають на якість життя пацієнтів, адже згадані симптоми порушують щоденну активність, знижують здатність до навчання і працездатність, призводять до проблем зі сном. Так, результати епідеміологічних досліджень показують, що в працівників із неконтрольованими симптомами тяжкого АР на 30% знижується продуктивність праці. Доступні дані також підтверджують, що порушення дихання уві сні асоційоване з розвитком тяжких серцево-судинних патологій: артеріальної гіпертензії, захворювань серця (ішемічної хвороби серця – ІХС, хронічної серцевої недостатності – ХСН) та інфаркту (Stuck et al., 2004; Vuurman et al., 1993).
Спільними для АР і ХК є й підходи до лікування. Неседативні Н1-антигістамінні препарати (АГП) ІІ покоління є першою лінією терапії при обох захворюваннях. За відсутності контролю симптомів ХК наступним кроком є підвищення дози АГП учетверо (Zuberbier et al., 2006; EAACI/GA2LEN/EDF/WAO 2018). Попри те що таких рекомендацій у чинних гайдлайнах немає, багато пацієнтів з АР також підвищують дозу АГП для кращого контролю симптомів.
Рекомендації EAACI/GA2LEN/EDF/WAO і міжнародної програми ARIA (Allergic Rhinitis and its Impact on Asthma – Алергічний риніт і його вплив на астму) наголошують на необхідності повного контролю симптомів і проведення базисної терапії АГП навіть тоді, коли симптоми менш виражені або навіть відсутні. Причиною знову ж таки є механізми, які лежать в основі захворювання, зокрема феномен хронічного мінімального персистуючого запалення (МПЗ), зумовленого впливом алергенів (Canonica G.W., 2009).
Встановлено, що повторний вплив низьких доз алергену не спричинює появу симптомів алергії, але формує стан підвищеної чутливості до подальшого впливу алергенів і субклінічне запалення (рис. 2).
Рис. 2. Хронічне МПЗ (Canonica G.W., 2009).
Крім того, особливістю Н1-гістамінорецепторів є те, що гістамін сам по собі чинить на них позитивний і негативний регулювальний вплив (up/down регуляція). Саме тому в пацієнтів із полінозом симптоми під кінець сезону цвітіння посилюються, незважаючи на те що кількість алергену пилку в повітрі зменшується. Це пояснюється тим, що під впливом гістаміну підвищується експресія Н1-рецепторів (Dinh et al., 2013).
Відповідно, для запобігання розвитку ускладнень як при АР, так і при ХК пацієнти мають приймати АГП постійно, а не тільки в разі загострення симптомів. Лише так можна контролювати такі ланки патогенезу, як МПЗ і підвищення експресії Н1-рецепторів гістаміну.
Із цією інформацією обов’язково варто ознайомити тих пацієнтів, які відмовляються від щоденного прийому АГП, мотивуючи це небажанням пити «хімію» щодня. Треба пояснити пацієнтові, що наше тіло складається з хімічних елементів. Гістамін, який виділяється в разі захворювання на АР і ХК і підтримує постійне запалення, це теж хімічна речовина. А використання АГП, навпаки, націлене на досягнення балансу внутрішнього середовища і мінімізації негативного впливу гістаміну на організм.
Щодо вибору АГП, безперечно, необхідно віддавати перевагу препаратам ІІ покоління, адже вони безпечніші. Потенційними побічними реакціями на АГП І покоління є (Simons F.F. et al., 2011):
- зниження уваги, пам’яті, здатності до навчання і психомоторної продуктивності;
- сухість у роті;
- затримка сечі;
- синусова тахікардія;
- підвищення апетиту і ваги;
- запаморочення і «туман у голові»;
- постуральна гіпотензія;
- подовження інтервалу QT;
- шлуночкові аритмії.
Дехто з німецьких лікарів, передусім педіатри, доволі часто призначають АГП І покоління. Пацієнти, які приймають ці засоби, стверджують, що адаптувались і вже не відчувають «туману в голові» і сонливості. Насправді ж те, що пацієнт не відчуває впливу на центральну нервову систему, не означає, що його немає. Це можна порівняти із ситуацією, коли людина звикла випивати пляшку пива щодня. Із часом відчуття оп’яніння зникає, але алкоголь у крові все одно можна виявити.
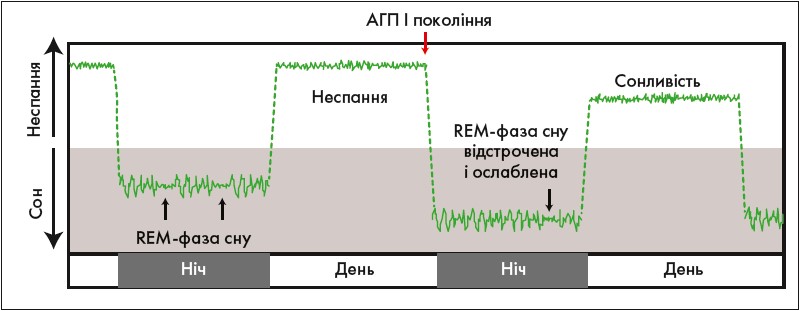
Однією з ключових причин, через які варто відмовитися від широкого використання АГП І покоління, є здатність цих засобів проникати крізь гематоенцефалічний бар’єр (ГЕБ) і чинити шкідливий вплив на сон. На рисунку 3 можна побачити, що АГП І покоління порушують REM-фазу сну, необхідну для повноцінного відпочинку і запам’ятовування нової інформації.
Рис. 3. Вплив АГП І покоління на фази сну (Maurer M. et al., 2010)
Наведені дані підтверджуються результатами епідеміологічних досліджень, проведених в Англії. Було встановлено, що в дітей з АР, які отримують АГП І покоління, на 70% нижча успішність у навчанні, що пов’язано з порушенням процесів запам’ятовування нової інформації.
АГП вперше почали використовувати в клінічній практиці ще в 1937 році. Перші з них характеризувалися вираженою седативною і холінергічною активністю. Минуло понад 70 років, і вимоги до АГП змінились. Сьогодні варто обирати антигістамінні засоби, які відповідають таким критеріям:
- здатність потужно й селективно блокувати Н1-рецептори гістаміну;
- швидкий початок і значна тривалість дії;
- забезпечення ефективного контролю симптомів;
- відсутність впливу на цитохром Р450;
- відсутність седативної дії, впливу на когнітивні і психомоторні функції;
- відсутність холінергічної активності;
- серцево-судинна безпека;
- відсутність потенціалу для розвитку тахіфілаксії;
- безпека використання в період вагітності й лактації.
Засобом, який максимально відповідає заданим критеріям, є сучасний неседативний АГП ІІ покоління біластин. Його основні переваги:
- висока афінність до Н1-рецепторів гістаміну (Corcostegui R. et al., 2005; Shamizadeh S. et al, 2014);
- сонливість при його застосуванні навіть нижча, ніж у групі плацебо, що пояснюється покращенням сну завдяки контролю симптомів;
- відсутність здатності проникати крізь ГЕБ і зв’язуватися з Н1-рецепторами мозку за результатами позитронно-емісійної томографії (Jauregui I. et al., 2016; Farre M. et al., 2014);
- відсутність впливу на здатність керувати транспортом, навіть у разі використання доз удвічі вищих за терапевтичні (Conen S. еt al., 2011).
Необхідно наголосити, що біластин повністю відповідає стандартам безпеки Управління із санітарного нагляду за якістю харчових продуктів і медикаментів США – FDA. Серцево-судинна безпека препарату була підтверджена в дослідженні фази І, де прийом однієї (в 11 разів вищої за максимальну рекомендовану дозу для людей – MHRD) та багатьох доз (у 10 разів вищих за MHRD) біластину не супроводжувався змінами на ЕКГ, а також випробуваннями довгострокової безпеки в дослідженнях фази ІІ і ІІІ і впливу біластину на інтервал QT.
Сумісне застосування біластину з еритроміцином і кетоконазолом також не супроводжувалося небажаними реакціями з боку серцево-судинної системи. Оскільки біластин не впливає на активність цитохрому Р450, донині немає жодного описання його взаємодії з іншими лікарськими засобами (Morog N. et al., 2007).
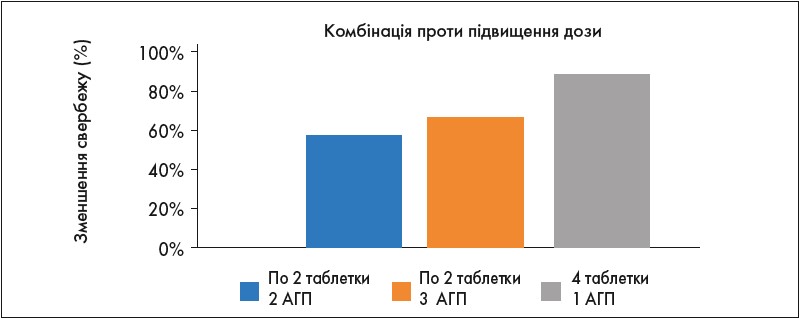
Вибір оптимального АГП – далеко не останній етап лікування. Пацієнт має приймати засіб у дозі дещо вищій за ту, що повністю контролює симптоми. Саме тому в останній версії рекомендацій із лікування кропив’янки підвищення дози АГП учетверо є наступним кроком за недостатньої ефективності стандартних доз. При цьому рекомендується підвищувати дозу гістаміноблокатора, а не додавати ще один засіб цієї групи. На рисунку 4 відображені результати дослідження S. Schulz та співавт., в якому доведено, що підвищення дози одного АГП ефективніше, ніж застосування комбінованої терапії у вигляді кількох АГП.
Рис. 4. Порівняльна ефективність контролю симптомів свербежу за допомогою комбінації кількох АГП проти підвищеної дози одного АГП (Schulz S. et al., 2009)
Безпека й ефективність використання високих доз біластину підтверджена результатами дослідження BUCUM (Bilastine Updosing – Characterization of Underlying Mechanisms), до якого були залучені пацієнти з холодовою контактною кропив’янкою (Krause K. et al, 2013). Первинною кінцевою точкою стала порівняльна ефективність біластину в стандартній (20 мг) і високих (40 і 80 мг) дозах. Вторинними кінцевими точками були:
- вплив біластину на вираженість запалення і/чи вивільнення медіаторів з опасистих клітин;
- вплив на вивільнення гістаміну, цитокінів, інтерлейкіну (ІЛ)-6 та ІЛ‑8;
- вплив на оцінку за шкалою свербежу;
- безпека і переносимість.
Результати виявилися очікуваними: підвищення дози біластину супроводжувалося покращенням контролю симптомів.
Так, при використанні стандартної терапевтичної дози симптоми повністю контролювалися в 35% пацієнтів, а частково – у 40%. При застосуванні ж дози 80 мг ці показники дорівнювали 60 і 35% відповідно.
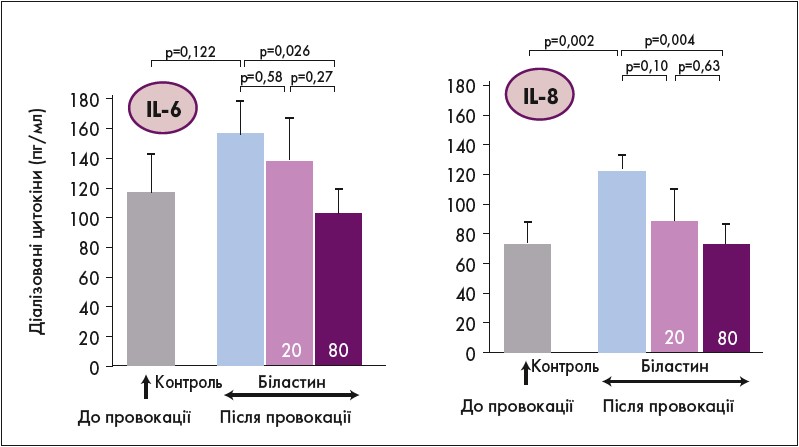
Крім цього результати BUCUM показали, що застосування біластину асоціювалося з дозозалежним зниженням вивільнення гістаміну, ІЛ‑6 та ІЛ‑8 опасистими клітинами (рис. 5).
Рис. 5. Вплив різних доз біластину на ступінь вивільнення гістаміну, ІЛ-6 та ІЛ-8 опасистими клітинами при холодовій кропив’янці (Krause K. et al., 2013)
Отримані результати узгоджуються з даними, отриманими Weller та співавт., які оцінювали вплив біластину на вираженість свербежу і кількість елементів висипки на тлі хронічної ідіопатичної кропив’янки (Weller et al., 2018). Був встановлений прямий зв’язок між вираженістю симптомів і застосованою дозою біластину.
На завершення хотілося б ще раз наголосити на важливості постійного прийому біластину, а не застосуванні його на вимогу. Лише безперервний прийом достатньої дози біластину дасть можливість усунути МПЗ, яке лежить в основі патогенезу АР і ХР, покращити якість життя пацієнтів і запобігти розвитку ускладнень.
Отже, і АР, і ХК – це гістамін-залежні захворювання. А значить, АГП є патогенетично зумовленою основою лікування цих станів. І перевагу необхідно завжди віддавати тим засобам, які не здатні долати ГЕБ і не мають седативних властивостей (біластин). Антигістамінну терапію треба розпочинати якомога раніше, у дозі трохи вищій за ту, що забезпечує контроль симптомів, і лікуватися пацієнт має постійно. Саме такий підхід до лікування допоможе вплинути на МПЗ і знизити експресію Н1-гістамінорецепторів. У результаті контролюватимуться симптоми у хворих, покращиться якість їхнього життя, а також вдасться уникнути довгострокових серцево-судинних ускладнень унаслідок порушень сну.
Список літератури – у редакції.
Підготувала Ганна Кирпач
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 4 (57), 2021 р.