30 грудня, 2022
Проблема хронічної кропи'янки. Частина 2: фармакологічне лікування, хронічна індукована кропив’янка, кропив’янка в особливих ситуаціях
Продовження. Початок №1(58)-2(59), с.18
Нещодавні дослідження розширили знання про імунологічні механізми хронічної спонтанної кропив’янки (ХСК) і ангіоневротичного набряку (AНН) та відкрили можливості для розробки нових методів лікування, спрямованих на конкретні молекулярні мішені захворювання.
Комплексні терапевтичні підходи до лікування ХСК і хронічної індукованої кропив’янки
Медикаментозне лікування
Лікування хронічної кропив’янки (ХК), а саме поетапний протокол терапії залежно від тяжкості симптомів і відповіді на лікування, описано в різних національних і міжнародних рекомендаціях [5-8]. Проте між Північноамериканськими та міжнародними рекомендаціями є деякі відмінності [9].
Антигістамінні препарати
Неседативні H1-антигістамінні препарати (НС АГП) ІІ покоління в міжнародних і Північноамериканських практичних рекомендаціях є ліками першої лінії для лікування ХК, з огляду на їхню відносну ефективність і безпеку. У разі відсутності відповіді на затверджені дози НС АГП дозування можуть бути збільшені вчетверо (2 етап лікування) для підвищення ефективності та без виникнення побічних ефектів [6].
При комбінуванні АГП не спостерігають позитивних терапевтичних ефектів у порівнянні зі збільшенням дози одного НС АГП [10]. У 40-45% пацієнтів із ХК підвищення дозування АГП може бути неефективним [11, 12]. АГП-резистентні пацієнти з ХК є кандидатами на додаткове лікування (3 і 4 етапи лікування).
Блокатори H2-рецепторів гістаміну не покращують стан пацієнтів із ХК, тому були вилучені з міжнародних рекомендацій EAACI/GA2LEN/EDF/WAO, однак їх досі рекомендують Північноамериканські настанови [6, 7].
Омалізумаб
Єдиним біологічним препаратом, який сьогодні схвалений для лікування АГП-резистентних пацієнтів із тяжкою формою ХСК, є омалізумаб (OMA), моноклональне антитіло (mAb), дія якого направлена на домен Ce3 важкого ланцюга IgE людини, саме на ту ділянку, яка зв’язується з Fc-рецепторами на опасистих клітинах і базофілах. Ефективність і безпека ОМА в пацієнтів із ХСК були підтверджені в подвійних рандомізованих плацебо-контрольованих дослідженнях і метааналізі [13, 14]. Рекомендована доза ОМА становить 150 мг або 300 мг кожні 4 тижні.
Окрім механізму зв’язування із сироватковим IgE, що призводить до зниження рівня загального та автоантиген-специфічного IgE, були запропоновані й інші потенційні механізми дії, щоб пояснити ефективність ОМА при ХСК (табл. 1) [15].
Хоча значна кількість пацієнтів достатньо швидко зазначають ефект ОМА (швидкі реакції, через 4-6 тиж), у деяких із них спостерігають сповільнену відповідь на препарат (12-16 тиж). Для класифікації пацієнтів (з повною чи частковою відповіддю на лікування або з відсутністю відповіді) використовують оцінку активності перебігу кропив’янки 7 (UAS7).
Дослідники зацікавлені в ідентифікації біомаркерів, які дадуть можливість передбачити клінічну відповідь на ОМА. Наприклад, позитивний результат аналізу вивільнення гістаміну з базофілів (BHRA), позитивний шкірний тест з автологічною сироваткою (ASST) і наявність еозинопенії визначають повільну або погану відповідь, тоді як більша експресія FcεRI, відсутність сироваткової стимулювальної активності експресії CD203c на базофілах, високі рівні загального сироваткового IgE, зниження рівня в плазмі D-димеру та IL‑31 в сироватці – швидшу або кращу відповідь [16].
Циклоспорин-А
Циклоспорин-А (CsA) є альтернативним препаратом, ефективним у пацієнтів, резистентних до лікування ХСК [17, 18]. CsA – імуносупресивний препарат, який пригнічує Т-хелперні клітини, блокуючи вироблення запальних цитокінів. Комплекс CsA і циклофіліну інгібує фосфатазну активність кальциневрину, тим самим пригнічуючи транскрипцію генів цитокінів (інтерлейкін‑2 (IL‑2), IL‑3, IL‑4), фактора некрозу пухлини-α (TNF-α) і вивільнення гістаміну, лейкотрієну та простагландину опасистими клітинами та базофілами in vitro та in vivo, а також призводить до зниження рівня IL‑2R, IL‑5 та TNF-α в сироватці крові.
Для лікування пацієнтів з АГП-резистентною ХК, які не реагують на ОМА (15-20% від загальної кількості), застосовують CsA – альтернативний препарат, ефективність якого доведена в подвійних рандомізованих плацебо-контрольованих дослідженнях [17, 18].
Частота відповіді на стандартне для дорослих дозування CsA 4 мг/кг/добу в пацієнтів із ХСК становить 60-70% [19, 20].
Попри вищесказане, деякі вчені зазначили, що завдяки CsA контролю ХК вдається досягти лише в 26-33% пацієнтів [17-21]. Згідно з метааналізом частота реакції на препарат у пацієнтів становить 54%, 66% і 73% на 4-му, 8-му і 12-му тиж відповідно [22]. Деякі лікарі віддають перевагу інгібіторам кальциневрину для лікування тяжкої форми ХК, а також як препарату допоміжної терапії при ХСК, що важко контролюється [23, 24].
Згідно з гіпотезами клініцистів показниками дерматологічного індексу якості життя (DLQI), симптомами, а також результатами ретроспективного паралельного дослідження, проведеного у Сполученому Королівстві, краща відповідь на лікування спостерігалася в когорті, яка отримувала ОМА, ніж у групі пацієнтів, яка отримувала CsA [25].
Є ймовірність виникнення побічних ефектів (підвищення артеріального тиску (АТ), нефротоксичність, головний біль, нудота, біль у животі та інфекції). Тому кожні 6 тиж рекомендується проводити ретельний контроль АТ, функції нирок і рівня CsA [26].
Пацієнти з позитивними тестами активації базофілів (BAT) та вивільнення гістаміну з базофілів (BHRA) краще реагують на лікування CsA [27, 28]. Короткий і тяжкий від початку захворювання перебіг визначають успішну відповідь на лікування CsA, тоді як вихідні рівні D-димеру демонструють суттєву негативну кореляцію з відповіддю на CsA, тому D-димер є корисним маркером активності захворювання та моніторингу клінічної відповіді на лікування CsA (табл. 2) [29-31]. Проте Култанан та співавт., провівши метааналіз, не змогли віднайти надійні практичні лабораторні біомаркери, які вказували б на сприятливу відповідь на лікування CsA [32].
Альтернативні недоказові методи лікування
Раніше для лікування рефрактерної форми ХСК використовували різні додаткові лікарські засоби. Нині ці препарати не рекомендують до застосування, оскільки вони не проходили контрольовані дослідження, інформація про результати їх застосування отримана з неофіційних джерел, а також через залучення невеликої когорти пацієнтів.
Однак деякі спеціалісти продовжують використовувати ці препарати «не за призначенням» для пацієнтів із тяжким перебігом, які не реагують на терапію.
Біологічні речовини та малі молекули на етапі досліджень
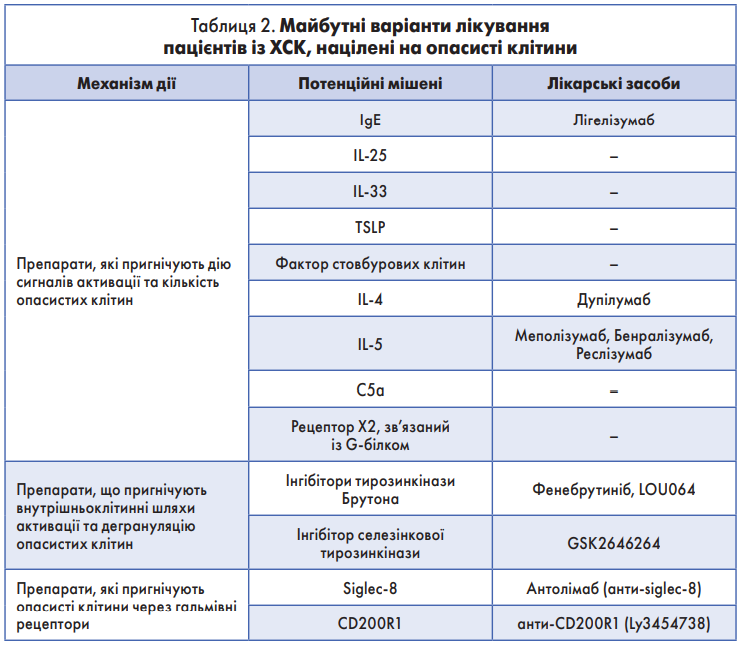
ОМА – єдиний біологічний препарат, який наразі схвалений регулюючими органами для лікування помірної та тяжкої АГП-резистентної ХК. Зазначимо, що нині в пацієнтів із ХК досліджують інші біологічні препарати та молекули [16]. Серед них: імуноглобуліни для внутрішньовенного введення, інгібітори TNF-α (етанерцепт, адалімумаб, інфліксимаб), інгібітори IL‑1 (анакінра, рилонацепт, канакінумаб), анти-CD20 моноклональні антитіла (ритуксимаб), анти-siglec‑8 (AK002), анти-TSLP (тезепелумаб), анти-IL‑4Rα (дупілумаб, пітракінра, AMG‑317, анти-IL‑5/IL‑5Rα (меполізумаб, реслізумаб, бенралізумаб), анти-IL‑13 (антукізумаб, лебрикізумаб, тралокінумаб), анти-IgE (лігелізумаб), анти-NK‑1R (атрепітант, традипітант, серлопітант, AST‑308, IMA‑026, CNTO 5825, GSK679586, QAX576, анти-C5a (екулізумаб), анти-b4-інтегрин (наталізумаб), анти-a4b-інтегрин‑7 (ведолізумаб), анти-b7-інтегрин (RhuMabb7), модулятор костимуляції Т-клітин (абатацепт), антагоніст CRTh2 [AZD1981], інгібітори BTK (GDC0853, фенебрутиніб, LOU064), інгібітор Syk (GSK2646234), анти-IL‑33, анти-IL‑25, фактор протистовбурових клітин, антигістамінний HR4 (JNJ7777120) [16, 33, 34-38, 39-41].
Лікування особливих станів, пов’язаних із кропив’янкою
Клінічними станами, пов’язаними з кропив’янкою, є автозапальні синдроми та різні форми уртикарного васкуліту. Один із них, синдром Шніцлера, характеризується гіперостозом, лімфаденопатією, переміжною лихоманкою та моноклональною гаммапатією IgM. Зазвичай для лікування цього синдрому застосовують АГП ІІ покоління і системні глюкокортикостероїди (ГКС), а також імуномодулятори й імуносупресори, такі як анти-IL‑1 (анакінра або канакінумаб) [42-44]. Канакінумаб призначали пацієнтам із періодичним синдромом, пов’язаним із кріопірином, і при уртикарному васкуліті [45, 46].
Клінічні випадки
ХІК
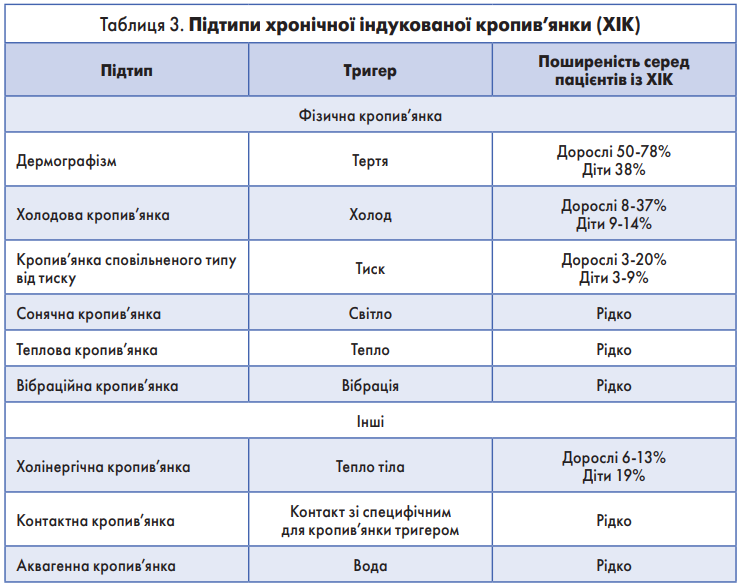
ХІК спричинюється специфічними подразниками навколишнього середовища. Різні підтипи цієї форми кропив’янки виникають після впливу специфічного і відтворюваного чинника (табл. 3).
ХІК може бути зумовлена різними факторами, як-от: холод (холодова кропив’янка), тепло (теплова кропив’янка), тиск (кропив’янка сповільненого типу від тиску), сонячне опромінення (сонячна кропив’янка), вода (аквагенна кропив’янка), вібрація (вібраційна кропив’янка), а також контактна і холінергічна кропив’янка. Детально зібраний анамнез дасть спеціалісту змогу запідозрити діагноз ХІК, а також призначити спеціальні тести, які допоможуть визначити етіологію захворювання в конкретного пацієнта. Остаточний діагноз ґрунтується на анамнезі пацієнта та результатах аналізів [48-51].
Холодова кропив’янка
Пацієнти з холодовою кропив’янкою в анамнезі зазначають появу пухирів після впливу холоду, переохолодження або зігрівання шкіри. Ці пухирі зазвичай з’являються впродовж декількох хвилин і залишаються на поверхні шкіри приблизно годину. Провокаційну пробу проводять, прикладаючи кубик льоду до долонної поверхні передпліччя впродовж 5 хв (брати до уваги поріг чутливості пацієнта). Досліджувану ділянку потрібно перевірити через 10 хвилин. Позитивною вважається реакція, яка характеризується появою пухирів і запалення в місці контакту з льодом. Ця реакція часто супроводжується свербежем і/або відчуттям печіння. За можливості пацієнтам із позитивним результатом тесту потрібно проводити визначення порогу.
Для визначення температурного порогу в пацієнтів із холодовою кропив’янкою можна використовувати комерційний пристрій TempTest. Температурний поріг – це найвища температура, яка спричинює позитивну реакцію, таким чином проінформований пацієнт може уникнути загрозливих для життя ситуацій. Якщо пристрій TempTest недоступний, можна застосувати тест із використанням кубика льоду для визначення порога часу стимуляції, найкоротшої тривалості впливу холоду, що спричиняє позитивну реакцію. Пороговий час стимуляції кубиками льоду менш ніж 3 хв асоціюються з більшою активністю захворювання.
Пацієнт із підозрою на симптоматичний дермографізм
Дермографізм, або «написи на шкірі», є найпоширенішою формою фізичної кропив’янки. Виникає внаслідок різної сили натискання на шкіру. Виділяють симптоматичний дермографізм, який є його окремою клінічною формою, у разі якої в пацієнта спостерігають, крім звичайних пухирів, що утворюються при проведенні по шкірі, свербіж і/або печіння шкіри. Пацієнту можна встановити такий діагноз за наявності в анамнезі свербежу без видимих ознак висипу, за яким слідує поява лінійних висипань, за описом чи фотографіями.
Провокація проводиться шляхом проведення по шкірі верхньою частиною ручки із сильним натиском. Поява лінійного пухиря без свербежу свідчить про простий дермографізм. Пухир, що супроводжується свербежем і пальпується вздовж лінії прикладення сили впродовж 10 хв після провокації, є проявом симптоматичного дермографізму. На ринку є дермографометри, які забезпечують точніше тестування.
Пацієнт із підозрою на холінергічну кропив’янку
Холінергічна кропив’янка може бути спровокована фізичними вправами, пасивним зігріванням, емоційним стресом, гострою їжею. Пацієнт зазвичай зазначає появу папульозного висипу, що супроводжується короткочасним виникненням дрібних пухирів, з більшою площею вираженої гіперемії; симптоми зберігаються на шкірі від 15 хв до години. Пасивне нагрівання, наприклад гарячі ванни, є поширеним тригером холінергічної кропив’янки. Провокаційний тест проводять за допомогою помірних фізичних навантажень. Використання теплого одягу і/або перебування в теплому приміщенні може полегшити проведення тесту. Пацієнт має виконувати фізичні вправи, використовуючи стандартизований протокол, що відповідає віку та загальному стану здоров’я пацієнта. Поява характерного для холінергічної кропив’янки висипу під час фізичного навантаження або впродовж 10 хв після його закінчення підтверджує діагноз.
Пацієнт із підозрою на кропив’янку сповільненого типу від тиску
Цю форму кропив’янки треба підозрювати в пацієнтів із висипом і свербежем у місцях тиску, наприклад ременями, лямками бюстгальтера і верхніми частинами шкарпеток. Ці пацієнти також можуть мати в анамнезі кропив’янку після їзди на велосипеді, носіння тісного одягу або спирання рук, наприклад, на відкрите вікно автомобіля. Традиційним тестом для визначення описаного типу кропив’янки є тест із мішком із піском, який прикріплюють до ременя, а потім до передпліччя, плеча або стегна на 15 хвилин. У цих місцях спостерігають упродовж наступних 24 год за появою еритеми чи пухирів. Цей тест не стандартизований, і тому останнім часом ведуться спроби зробити його інформативнішим за допомогою обтяжених стрижнів.
Пацієнт із підозрою на вібраційну кропив’янку
Пацієнти зазначають появу свербежу і висипу після впливу джерел вібрації, таких як ручні шліфувальні машини. Деякі пацієнти скаржаться на появу симптомів кропив’янки під час керування автомобілем. Вихровий вібратор є пристроєм, за допомогою якого можна встановити діагноз вібраційної кропив’янки. Пацієнт упродовж 10 хв тримає долонну поверхню передпліччя прикладеною до вихрового вібратора, що працює в режимі 1000 об./хв. Після тесту ділянку оглядають.
Пацієнт із підозрою на сонячну кропив’янку
Пацієнти із сонячною кропив’янкою зазвичай мають в анамнезі висип або еритему на відкритих ділянках шкіри, які з’являються впродовж декількох хвилин після перебування під прямими сонячними променями. Приблизно 16% пацієнтів спостерігають появу висипу на ділянках шкіри, закритих одягом. Пацієнти можуть реагувати на різну довжину хвилі світла, причому найпоширенішим є сонячне випромінювання, але також може бути спектра УФ-А і/або УФ-В [47].
Лікування ХІК
Першим кроком профілактики і лікування фізичної кропив’янки є виявлення і запобігання дії провокувального чинника. Симптоматична фармакотерапія першої лінії охоплює неседативні АГП, починаючи зі стандартного дозування з наступним його збільшенням учетверо в разі незадовільної відповіді, і/або альтернативні препарати (омалізумаб, циклоспорин) як додаткові лікарські засоби [48-54].
Індукція толерантності шляхом прогресувального контрольованого тривалого впливу подразника застосовується при холодовій, тепловій і сонячній кропив’янці [55-57].
Кропив’янка в особливих ситуаціях: дитячий вік, вагітність, імунодефіцити
Дитячий вік
Гостра кропив’янка (ГК) частіше спостерігається в дітей і найчастіше спричинюється вірусними інфекціями, такими як інфекції верхніх дихальних шляхів. Харчові алергени (яйця, молоко, соя, арахіс і пшениця) можуть зумовлювати IgE-опосередковану кропив’янку в малюків раннього віку, а в дітей старшого віку найпоширенішими харчовими алергенами є риба, морепродукти та горіхи. Іншими причинами є підвищена чутливість до НПЗП і антибіотиків, а також укусів комах, наприклад комарів [58, 59]. Діагностика алергії в дітей із ГК необхідна для уникнення помилкового віднесення дітей до категорії алергіків [60]. Поширеність ХК у дітей становить менш ніж 1%, суттєвої різниці між жіночою і чоловічою статтю не виявлено [61].
За даними Netchiporouk та співавт., найпоширенішим типом ХК у дитинстві є ХСК (у 78% пацієнтів), у 22% виявляють фізичну кропив’янку [62]. У дітей кропив’янка зазвичай проявляється одноразовим гострим епізодом, який може тривати від декількох днів до тижнів, тоді як у невеликої частини пацієнтів ГК переходить у ХК [63].
ГК потрібно диференціювати з анафілаксією, вірусними інфекціями і реакціями, подібними до сироваткової хвороби [64] (табл. 4). У педіатричній практиці не було виявлено маркерів, за допомогою яких визначався б перебіг захворювання [65].
Першим кроком у лікуванні пацієнта з кропив’янкою є виявлення потенційних тригерів і запобігання їх впливу [58]. Для діагностики кропив’янки використовують загальний аналіз крові, визначення швидкості осідання еритроцитів (ШОЕ) або рівня C-реактивного білка (CРБ) [66]. Наявність автоімунітету типу IIb, який має місце приблизно в 40% дітей із ХК, можна підтвердити за допомогою ASST або тесту на вивільнення гістаміну з базофілів [67, 68].
Початковим етапом фармакологічного лікування ХК у дітей є АГП ІІ покоління. Згідно з рекомендаціями EAACI/EDF/WAO дозу АГП ІІ покоління необхідно збільшити в 4 рази, якщо стандартна доза виявляється неефективною.
Застосування цетиризину в підлітків і дорослих може спричинити сонливість і зниження працездатності. Інші АГП ІІ покоління, наприклад біластин, призначають у дозах, вищих за стандартні. Для визнання безпечного застосування високих доз АГП ІІ покоління в дітей необхідно провести додаткові дослідження [64].
Для внесення відповідних рекомендацій у чинні гайдлайни все ще є потреба в широкомасштабних дослідженнях із метою визначення оптимальної дози і тривалості лікування омалізумабом у дітей із ХСК. Згідно з результатами досліджень 150 і 300 мг омалізумабу, що застосовують 1 раз на місяць упродовж 6 міс, достатньо для контролю перебігу ХСК [68]. Деякі дослідження демонструють ефективність прийому циклоспорину в дітей. Порушення функції нирок і моніторинг рівня крові можуть бути перешкодою для застосування цього препарату [69]. У пацієнтів із тяжкими загостреннями застосування пероральних ГКС рекомендовано в дозі 0,5-1 мг/кг упродовж 5-7 днів [70].
Вагітність
Оскільки кропив’янка не є загрозливим для життя станом, усім вагітним жінкам не варто призначати лікування. Однак кропив’янка може впливати на якість життя пацієнта. АГП ІІ покоління залишаються препаратами вибору через відсутність седативного ефекту [71]. Для досягнення контролю захворювання може знадобитися збільшення дози в 4 рази вище рекомендованої з двотижневими інтервалами [6].
У разі тяжких загострень можуть знадобитися короткі 3-денні курси пероральних ГКС. Але підтримувальні дози системних ГКС не показані для лікування кропив’янки у вагітних [6].
АГП І покоління не рекомендують при грудному вигодовуванні через їх потрапляння в грудне молоко, тому застосування АГП ІІ покоління є безпечнішим [72].
Щодо омалізумабу, немає доказів підвищеного ризику розвитку серйозних вроджених аномалій у дітей при прийомі цього препарату вагітними, які отримували омалізумаб, якщо порівнювати з когортою, що не отримувала препарат [73].
Імунодефіцити
Первинні імунодефіцитні захворювання (ПІЗ) є гетерогенною групою спадкової патології, спричиненою мутаціями в генах, що кодують функціональні білки імунних клітин. Припускається, що в усьому світі 6 млн людей живуть із ПІЗ [73]. Вони проявляються симптомами автоімунітету, автозапалення, злоякісних новоутворень і алергічних захворювань [74].
Ушкодження шкіри можуть бути клінічними проявами ПІЗ. Наприклад, тяжка форма ХК спостерігається у деяких пацієнтів з імунодефіцитом і автозапальними синдромами, тому такі стани потрібно диференціювати від інших фенотипів ХК [75].
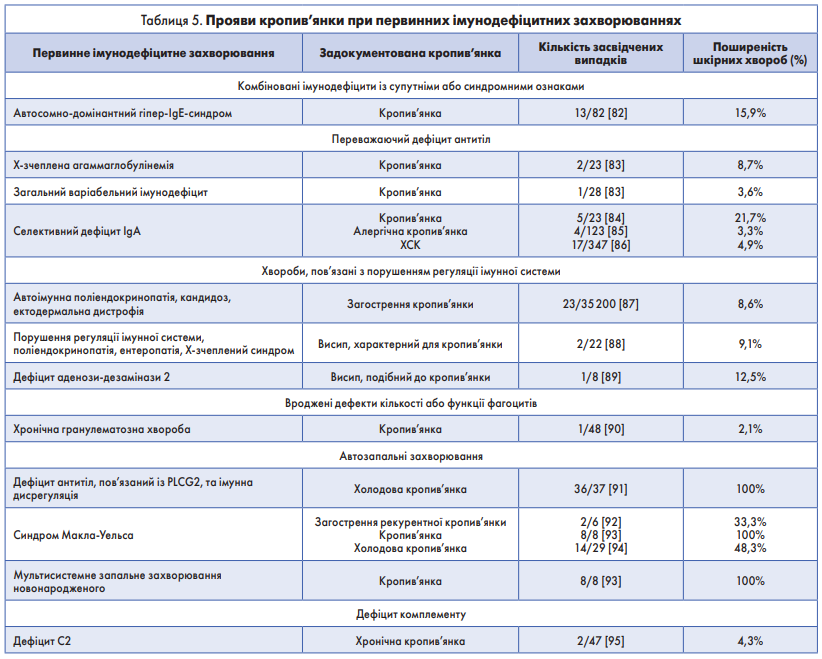
У пацієнтів із рецидивами кропив’янки, що тривають від декількох місяців до декількох років, потрібно підозрювати імунодефіцит і автозапальні синдроми. ХК у таких пацієнтів зазвичай асоціюється з іншими симптомами запалення, як-от лихоманка, артрит, серозит, гепатоспленомегалія, ураження очей і/або неврологічні захворювання. Інфекцію або злоякісне новоутворення треба диференціювати за допомогою відповідних досліджень [76] (табл. 5).
De Wit та співавт. провели систематичний пошук у 5030 пацієнтів і виявили широкий спектр шкірних захворювань при 30 різних типах ПІЗ [77-80]. Кропив’янка може спостерігатися в пацієнтів із комбінованим імунодефіцитом із супутніми або синдромними ознаками, переважно дефіцитом антитіл, захворюваннями, пов’язаними з порушеннями імунної регуляції, поліендокринопатією, ентеропатією, Х-зчепленим синдромом, вродженими дефектами кількості або функції фагоцитів, автозапальними порушеннями та дефіцитом комплементу [81].
Висновки
Поширеність ХК серед світової популяції коливається від 0,1 до 1,0%. При цьому захворювання часто значуще знижує якість життя пацієнтів, а витрати на хворобу для системи охорони здоров’я можуть бути чималими. Останніми роками розуміння патофізіології захворювання покращилось, що спонукало науковців досліджувати нові препарати, особливо біологічні, для застосування в пацієнтів із тяжкою рефрактерною кропив’янкою. У розвитку симптомів беруть участь кілька типів клітин, переважно мастоцити, базофіли, еозинофіли, Т- і В-лімфоцити, а також епітеліальні й ендотеліальні клітини. Припускається, що порушення регуляції внутрішньоклітинних сигнальних шляхів і автоімунні реакції відіграють важливу роль в активації мастоцитів/базофілів. Це призводить до вивільнення медіаторів запалення в шкірі, що, своєю чергою, сприяє появі набряків і власне АНН.
Згідно з медичними даними, у 58,5% (394 з 673) пацієнтів спостерігався АНН, пов’язаний із ХСК, тоді як у 41,0% хворих симптоми кропив’янки не спричинювалися тригерами (ХСК), хоча в деяких із них можна було запідозрити й довести вплив зовнішніх факторів, переважно фізичних (ХІК). Також доречно зазначити, що в деяких пацієнтів може спостерігатися комбінована картина ХСК і ХІК [82].
Нині виявлено біомаркери, які є корисними для прогнозування перебігу ХК і відповіді на різні види лікування. Але клініцисти мають дотримуватися рекомендацій, використовувати перевірені результати на основі оцінки пацієнтів і призначати ліки з доведеною ефективністю і безпекою.
Найближчим часом для лікування тяжкої та рефрактерної форм ХК почнуть застосовувати нові біологічні препарати і малі молекули, які нині перебувають на стадії досліджень.
Список літератури – у редакції.
Реферативний огляд статті M. Sаnchez-Borgesa et al. The challenges of chronic urticaria part 2: Pharmacological treatment, chronic inducible urticaria, urticaria in special situations. World Allergy Organization Journal. 2021.
Переклад з англ. Дарина Павленко
Друкується в скороченому обсязі, повну версію дивіться: https://www.worldallergyorganizationjournal.org/article/S1939-4551(21)00027-2/fulltext
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (60) 2022 р.