1 жовтня, 2017
Лечение ХСН, ассоциированной с хроническим обструктивным заболеванием легких. Место бета-адреноблокаторов
Данные популяционных исследований, проведенных в Соединенных Штатах Америки [1, 2], позволили установить, что хроническая сердечная недостаточность (ХСН) и хроническое обструктивное заболевание легких (ХОЗЛ) являются наиболее распространенными патологиями в клинической практике. Тенденцией нынешнего времени является неуклонный рост контингента больных с сочетанной кардиореспираторной патологией [3]. Продемонстрировано, что у больных ХОЗЛ риск развития ХСН в 4,5 раза выше в сравнении с группой контроля без ХОЗЛ, сопоставимой по возрасту и другим факторам сердечно-сосудистого риска [4]. Среди пациентов, госпитализированных в связи с обострением ХОЗЛ, в 3 раза чаще выявляется ХСН в сравнении с больными без легочной патологии [5]. В то же время необходимо учесть, что в большинстве исследований не использовались диагностические критерии GOLD (Global Initiative for Chronic Obstructive Lung Disease) и не анализировались данные эхокардиографии [6]. В исследовании с применением объективных оценочных критериев при сочетанной патологии ХОЗЛ и ХСН показано, что распространенность бронхообструкции у больных ХСН составляет 37,3%, а распространенность дисфункции левого желудочка (ЛЖ) у пациентов с ХОЗЛ – 17% [7]. Кроме того, у больных ХОЗЛ с дисфункцией ЛЖ наблюдалась тенденция к повышению смертности, тогда как наличие бронхообструкции у больных ХСН на выживаемость не влияло. При этом ХСН при ХОЗЛ является существенным и независимым предиктором общей смертности [8].
В исследовании Н.А. Кароли и соавт. [9] частота выявления ХСН у пациентов, госпитализированных по поводу ХОЗЛ, составила 36,2%. Отмечено, что развитие ХСН у больных ХОЗЛ было обусловлено как наличием сопутствующей патологии (ишемической болезни сердца – ИБС, артериальной гипертензии – АГ), так и непосредственным прогрессированием хронического легочного сердца. Установлено, что в структуре ХСН при ХОЗЛ преобладает СН с сохраненной фракцией выброса (ФВ) ЛЖ, тогда как снижение ФВ ЛЖ ассоциировано с наличием ИБС. Значимое влияние на формирование ХСН оказывают такие факторы, как курение, выраженность бронхообструктивных нарушений, гипоксемия, увеличение частоты сердечных сокращений (ЧСС) [9].
Следует обратить внимание на то обстоятельство, что ХОЗЛ относится к числу заболеваний второй половины жизни человека и развивается в основном после 40 лет, когда у многих пациентов уже есть и другие заболевания. Установлено, что среди больных ХОЗЛ старших возрастных групп в 62% случаев выявляется ХСН [10]. В эпидемиологических исследованиях показано, что распространенность ХСН в развитых странах мира составляет около 1-2,3% среди населения в общей популяции и от 5 до 10% среди лиц старше 65 лет [11]. Результаты крупных эпидемиологических исследований [12-14] позволили установить, что ведущей причиной смертности больных ХОЗЛ легкого и среднетяжелого течения являются ИБС и ХСН. Риск фатальных сердечно-сосудистых осложнений у больных ХОЗЛ повышен в 2-3 раза, и они составляют не менее 50% от общего количества случаев смерти [15, 16].
Сочетание кардиальной патологии и ХОЗЛ сопровождается синдромом взаимного отягощения с определенными особенностями клинической картины вследствие общности некоторых звеньев патогенеза, что приводит к снижению эффективности лечения, ухудшению прогноза заболеваний и требует новых подходов к диагностике и лечению [17].
Лечение больных с сочетанной патологией всегда представляет определенные трудности в связи с тем, что попытки активного медикаментозного воздействия на течение одного заболевания сопряжены с реальной угрозой ятрогенного обострения другого. При выборе лечебной стратегии у пациентов с ХОЗЛ и ХСН необходимо помнить о суммарном риске возможных осложнений, в особенности у пациентов старших возрастных групп [18]. Известно, что некоторые лекарственные средства, традиционно применяемые при ХСН, отрицательно влияют на течение ХОЗЛ, а бронхолитические препараты, без которых трудно представить лечение обструктивного бронхита, могут оказывать неблагоприятное действие на сердечно-сосудистую систему (ССС). Вследствие этого выбор препаратов, применяемых для лечения сердечно-сосудистых заболеваний (ССЗ), может быть существенно ограничен при наличии ХОЗЛ.
У пациентов с коморбидным течением ХОЗЛ и ИБС характерной клинической особенностью является высокая частота возникновения синусовой тахикардии. Так, при ХОЗЛ и ИБС у 70% пациентов регистрируется более высокая среднесуточная ЧСС по сравнению с больными без ИБС. У 77% пациентов с ХОЗЛ и ИБС ЧСС в покое составляет >80 уд/мин, тогда как статически значимое повышение смертности от всех причин наблюдается уже при ЧСС в покое 77-79 уд/мин [19]. Развитию тахикардии при ХОЗЛ способствуют гипоксия, нарушение баланса вегетативной нервной системы (ВНС), невротизирующее влияние длительного кашля и связанной с ним бессонницы, лихорадка и интоксикация при обострении болезни, влияние лекарственных средств.
Основой симптоматической терапии ХОЗЛ являются бронхолитики. В настоящее время длительнодействующие бронходилататоры являются основными препаратами в лечении больных ХОЗЛ [20]. Согласно последней программе GOLD (2017) применение фиксированных комбинаций длительнодействующих антихолинергических препаратов / длительнодействующих β2-агонистов рекомендуется больным ХОЗЛ с выраженными симптомами (группы В и D) независимо от величины объема форсированного выдоха за первую секунду (ОФВ1) и пациентам с невыраженными симптомами, но низкими значениями ОФВ1 (<50% от должного) и повторными обострениями (группа С) [21].
β-адренергические агонисты ассоциируются с неблагоприятным влиянием на работу сердца, в основном это связано с развитием синусовой тахикардии [22, 23]. Еще одним механизмом, способствующим возникновению нарушений ритма сердца при использовании β2-агонистов, может быть гипокалиемия. Бесконтрольное применение β2-агонистов, особенно при тяжелых формах ХОЗЛ, осложненных гипоксемией, на фоне которой их кардиотоксическое действие возрастает, увеличивает риск смерти [22, 23].
С другой стороны, для лечения ХСН и других заболеваний ССС широко применяются β-адреноблокаторы. Фармакологические свойства лекарственных средств, относящихся к β-агонистам и β-блокаторам, реализуются посредством взаимодействия с адренергической системой (β-адренорецепторами). Выделяют несколько типов β-адренорецепторов, которые располагаются в одних и тех же органах и тканях, но количество их сильно варьирует, что и определяет физиологический эффект воздействия препаратов.
Установлено, что при назначении β-агонистов снижается экспрессия (количество) рецепторов на поверхности клетки. Длительное воздействие агонистов приводит к развитию десенситизации (снижению чувствительности) [24, 25], что ведет к снижению эффективности терапии и увеличивает риск развития побочных эффектов. Применение же β-адреноблокаторов сопровождается увеличением экспрессии рецепторов и увеличением аффинности (сродства к лиганду), что также может приводить к появлению нежелательных реакций при применении отдельных препаратов при сочетанной патологии. При этом данные многочисленных клинических исследований продемонстрировали высокую клиническую эффективность β-адреноблокаторов у больных ССЗ и β-адреномиметиков – при бронхообструктивной патологии.
В исследовании О.Ю. Агаповой [26] отмечено, что характер изменения активности связывания β2-адренорецепторов у здоровых добровольцев и пациентов с кардиореспираторной патологией различается. При этом у здоровых добровольцев, имеющих индекс курящего человека >10 пачка/лет, профиль изменения активности связывания β-адренорецепторов соответствует таковому у пациентов с бронхиальной астмой и сочетанной сердечно-сосудистой патологией. Установлена взаимосвязь между активностью связывания β1- и β2-адренорецепторов, что проявляется в виде изменения активности связывания β2-адренорецептотов на фоне применения β1-адреноблокаторов в зависимости от дозы и длительности приема препарата. Так, у пациентов с бронхиальной астмой и АГ, имеющих показания к назначению β-адреноблокаторов, выявлено различие динамики активности связывания β2-адренорецепторов Т-лимфоцитов в зависимости от первой дозы селективного β1-адреноблокатора. Назначение селективного β-адреноблокатора в низких дозах приводило к снижению активности связывания β2-адренорецепторов Т-лимфоцитов с последующим увеличением на фоне применения β2-агониста, тогда как назначение средних доз селективного β-адреноблокатора не вызывало изменения активности и приводило к снижению на фоне применения β2-агониста.
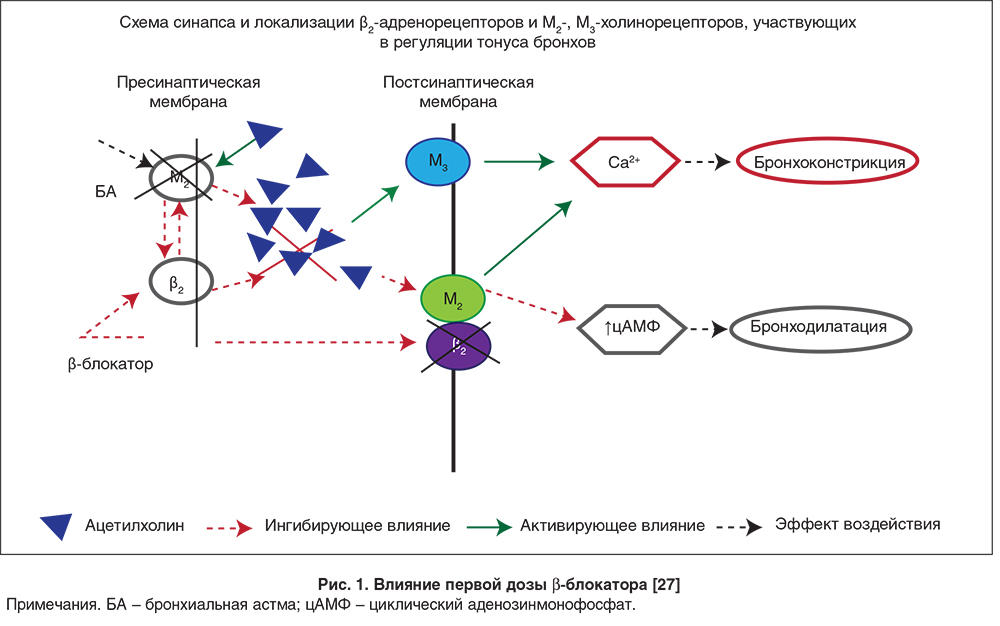
Назначение даже селективных β1-блокаторов при бронхообструктивной патологии может сопровождаться развитием такой нежелательной реакции, как бронхоспазм, особенно при назначении первой дозы [27]. Предполагается, что этот эффект может развиться вследствие непосредственного воздействия на β1-адренорецепторы, расположенные в легких, и за счет влияния на пресинаптические β2-адренорецепторы, что ведет к увеличению ацетилхолина в синапсе и активации парасимпатического пути развития бронхообструкции (рис. 1).
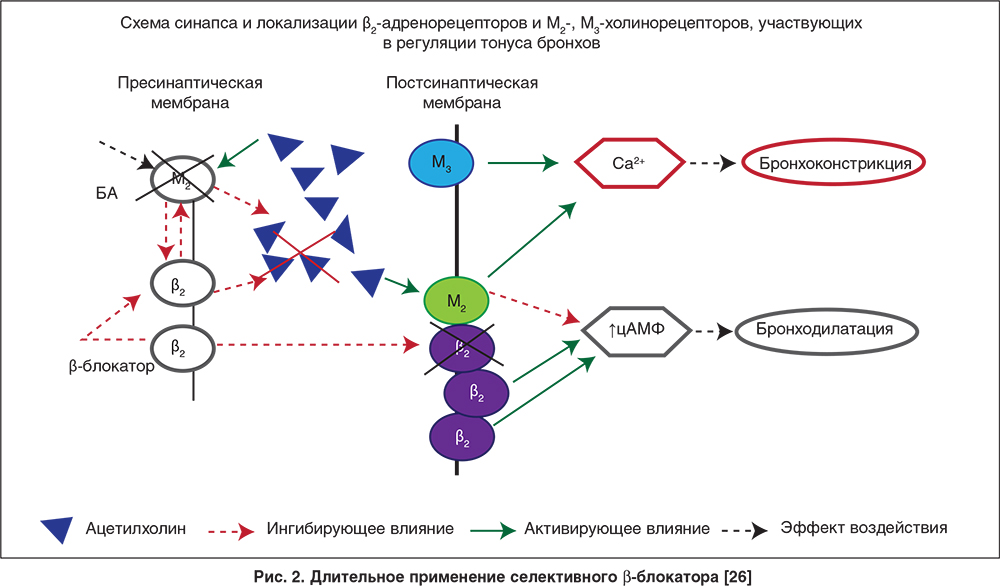
Применение β-блокаторов в основном приводит к увеличению экспрессии β-адренорецепторов [28]. Однако у части пациентов число рецепторов на фоне применения пропранолола уменьшалось при исходно более высоком уровне. Установлено, что возрастание количества рецепторов под влиянием пропранолола коррелирует с исходными данными: чем ниже был исходный уровень, тем большее увеличение наблюдали, а при высоком уровне рецепторов их количество или уменьшалось, или не изменялось [29]. Показано, что не только однократное назначение увеличивает плотность рецепторов на поверхности клетки, но и длительное применение β-блокатора приводит к увеличению на поверхности β-адренорецепторов, как на пре-, так и постсинаптической мембране [28]. Предполагаемые изменения на рецепторном уровне при длительном применении β-блокаторов представлены на рисунке 2.
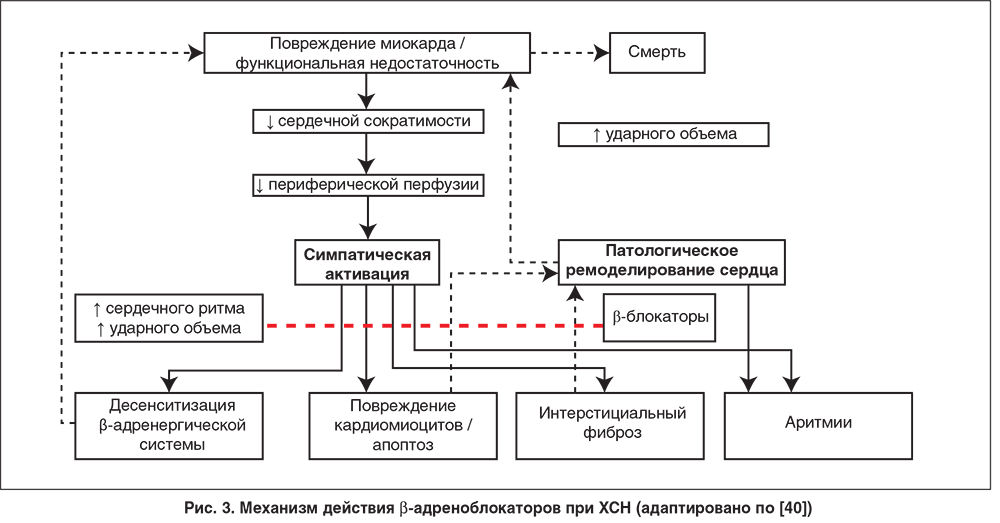
ХСН характеризуется активацией ряда нейрогормональных вазоконстрикторных систем, среди которых симпатико-адреналовая, ренин-ангиотензин-альдостероновая системы (РААС), вазопрессин, а также система эндотелина и уротензин II [30, 31]. Симпатическая нервная система отвечает на уменьшение сердечного выброса высвобождением катехоламинов, которые увеличивают частоту сердечного ритма, уровень артериального давления и сократимость миокарда, а также активируют РААС [32]. Нарушение функции сердечно-легочных барорецепторов низкого давления ведет к уменьшению парасимпатической и увеличению симпатической импульсации, что является одним из возможных механизмов повышения уровня норадреналина в плазме крови у пациентов с ХСН [33]. Однако если кратковременная активация симпатико-адреналовой системы является важным компенсаторным механизмом, направленным на инотропную поддержку и поддержание сердечного выброса, то более длительная симпатическая активация может быть неблагоприятной и обусловливать прогрессирование болезни и ухудшение клинических исходов. Неблагоприятное действие симпатико-адреналовой системы на систему кровообращения может опосредоваться несколькими путями:
1. Воздействуя на β1-адренергические рецепторы, норадреналин может вызывать дисфункцию и гибель кардиомиоцитов [34]. Это связано как с повышением содержания внутриклеточного кальция, ведущим к клеточному некрозу, так и с резким усилением окислительных процессов в миоцитах.
2. Активация симпатико-адреналовой системы способствует увеличению размера ЛЖ и внутрижелудочкового давления вследствие периферической вазоконстрикции и повышения внутрисосудистого объема (в связи с нарушением почечной экскреции натрия хлорида и воды) [35]. Эти эффекты опосредуются действием катехоламинов на α1-рецепторы и способны повышать потребность миокарда в кислороде [36]. Кроме того, норадреналин может вызывать гипертрофию сердца, одновременно ограничивая способность коронарных артерий обеспечивать кровоснабжение утолщенной желудочковой стенки. Взаимодействие указанных механизмов провоцирует ишемию миокарда, вне зависимости от состояния коронарного кровотока.
3. При ХСН норадреналин может оказывать проаритмогенное действие посредством структурно-функциональных эффектов, прежде всего в результате формирования гипертрофии и фиброза, а также повышения автоматизма кардиомиоцитов [37]. Неблагоприятные электрофизиологические эффекты катехоламинов опосредуются β1- и β2-адренорецепторами. Стимуляция β2-адренергических рецепторов, кроме того, может приводить к гипокалиемии путем усиления транспорта калия из внеклеточных во внутриклеточные компартменты [35].
4. Активация симпатико-адреналовой системы (через β1- и β2-рецепторы) вызывает увеличение ЧСС, которое неблагоприятно влияет на соотношение между потребностью миокарда в кислороде и его доставкой. Кроме того, при ХСН тахикардия ассоциируется с ослаблением силы сердечных сокращений, а не с их усилением, как это наблюдается при нормальном функционировании сердца [38]. Посредством этого механизма тахикардия может нарушать работу сердца, независимо от других ее потенциально неблагоприятных эффектов.
Хроническая симпатическая активация при СН также ведет к уменьшению плотности β1-адренергических рецепторов на кардиомиоцитах – важный фактор в ослаблении инотропного эффекта циркулирующих катехоламинов при СН [39].
Теоретические преимущества β-блокаторов включают прямую защиту миокарда от токсического воздействия катехоламинов, снижение стимуляции других нейрогормональных вазоконстрикторных систем, блокаду проаритмогенных эффектов катехоламинов и антиишемические эффекты посредством увеличения коронарного кровотока в диастолу, а также снижение потребности миокарда в кислороде (рис. 3).
В настоящее время β-адреноблокаторы заняли прочное место в первом ряду препаратов для медикаментозной терапии ХСН. Их способность замедлять прогрессирование болезни, снижать число госпитализаций и улучшать прогноз декомпенсированных больных не вызывает сомнений (уровень доказательств А) [42]. Данные доказательной медицины демонстрируют, что β-блокаторы эффективно снижают смертность и заболеваемость (потребность в госпитализациях) у пациентов с ХСН, обусловленной систолической дисфункцией ЛЖ, наряду с улучшением клинического статуса (функциональный класс – ФК ХСН, толерантность к физической нагрузке, качество жизни). Причем по способности снижать риск осложнений и смерти у больных с ХСН β-адреноблокаторы даже превосходят ингибиторы ангиотензинпревращающего фермента (ИАПФ).
К представителям класса β-блокаторов, подтвердившим свою эффективность при ХСН, относятся: бисопролола фумарат, метопролола сукцинат, карведилол и небиволол [43]. Небиволол является β-адреноблокатором III поколения, состоящим из рацематного соединения энантиомеров d-/l-небиволола. Энантиомеру d-небиволола свойственна уникально высокая кардиоселективность, проявляющаяся в отсутствии отрицательного влияния на показатели бронхиальной проводимости. L-небиволол обладает способностью модулировать синтез оксида азота эндотелием сосудов, нивелирует выраженность дисфункции эндотелия и вызывает вазодилатацию. Оксид азота обеспечивает прямое бронходилатирующее действие и нейтрализует бронхоконстрикцию, вызванную ацетилхолином. Уменьшение давления в легочной артерии при использовании небиволола связано с вазодилатацией и вазопротективными эффектами в результате уменьшения дисфункции эндотелия [41]. Для небиволола характерна также высокая липофильность, отсутствие внутренней симпатомиметической активности и хорошая переносимость. В исследовании SENIORS [44], включившем 128 пациентов, оценивали эффективность небиволола в дозе 1,25-10 мг/сут (средняя доза – 7,7 мг/сут) у больных пожилого и старческого возраста (средний возраст – 76,0±4,7 года) с ХСН вне зависимости от ФВ ЛЖ.
Длительность наблюдения составила в среднем 21 мес. Небиволол не показал статистически значимых отличий от плацебо по влиянию на смертность, хотя и продемонстрировал небольшое недостоверное (16%) снижение суммы риска госпитализаций и смерти. Однако результаты SENIORS достаточно трудно было сопоставлять с результатами других исследований в связи с особенностями контингента больных (в первую очередь пожилой возраст пациентов), отсутствием такого критерия включения, как снижение ФВ ЛЖ <40%, и весьма длительным периодом наблюдения. Последующий анализ результатов исследования SENIORS показал, что небиволол был особенно эффективным в подгруппе больных моложе 75 лет и с ФВ ЛЖ ≤35%: общее число случаев смерти или госпитализаций в связи с сердечно-сосудистыми причинами уменьшилось в среднем на 27%. В этой подгруппе общая смертность снизилась под влиянием небиволола в среднем на 38%. Таким образом, небиволол сравним по эффективности с бисопрололом, карведилолом и метопрололом, эффективность и безопасность которых были доказаны у больных с систолической дисфункцией ЛЖ преимущественно не старше 60-65 лет. Назначение β-адреноблокатора небиволола абсолютно показано пациентам с симптомами ХСН и сниженной ФВ ЛЖ независимо от этиологии заболевания.
В исследовании, проведенном под руководством Ф.Т. Агеева [45], установлено, что при переводе больных ХСН в условиях амбулаторной практики с терапии нерекомендованными к применению β-адреноблокаторами на небиволол или бисопролол оба препарата продемонстрировали сопоставимую эффективность в отношении клинико-функционального, гемодинамического и нейрогуморального статуса больных ХСН. Однако выявлено достоверно более выраженное снижение уровня маркера синтеза коллагена I типа (СICP) у больных в группе небиволола по сравнению с группой бисопролола (на -12,8 против -1,4% соответственно; р<0,01). Анализ соотношения СIСP/CITP (С-концевого телопептида коллагена I), более точного маркера уменьшения интенсивности фиброобразования, показал, что только на фоне терапии небивололом происходило достоверное снижение этого показателя. Авторы заключили, что выявленное различие между небивололом и бисопрололом в отношении способности подавлять синтез коллагена делает предпочтительным назначение небиволола у пациентов с ХСН в условиях повышенного фиброобразования в миокарде.
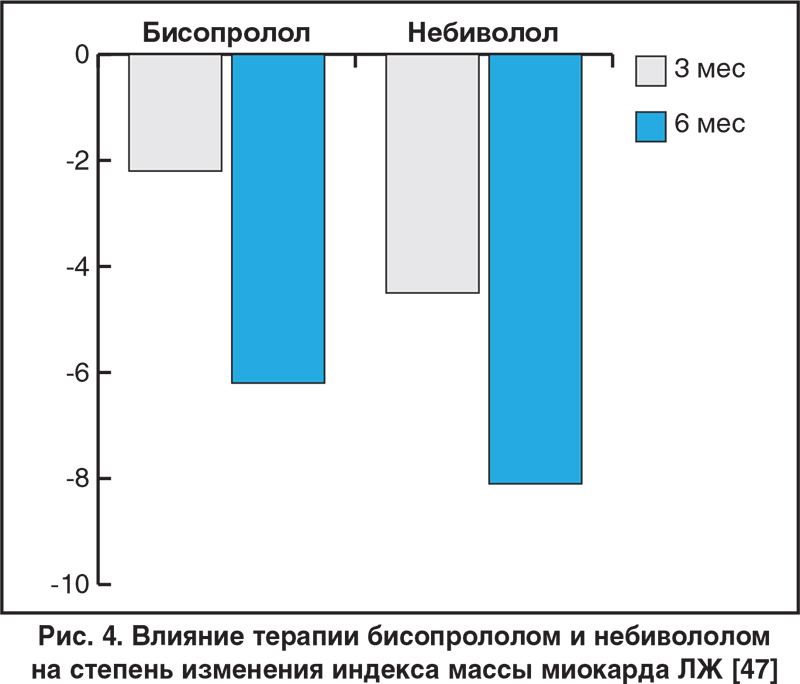
Включение небиволола в состав длительной комплексной терапии пожилых больных с ХСН не оказывает кардиодепрессивного действия и положительно влияет на показатели геометрии ЛЖ [46]. В исследовании [47] с участием пациентов с АГ 1 и 2 степени, получавших терапию бисопрололом или небивололом в течение 6 мес, было показано, что при одинаковой антигипертензивной эффективности препаратов органопротективные свойства небиволола (по данным индекса массы миокарда ЛЖ (рис. 4), толщины интима-медиа в сонной и плечевой артериях и степени эндотелийзависимой дилатации) более выражены и появляются в более ранние сроки. Кроме того, продемонстрировано положительное влияние небиволола на вариабельность ритма сердца (ВРС) вне зависимости от исходного тонуса ВНС, тогда как бисопролол у пациентов с повышенным тонусом парасимпатического звена ВНС ухудшал параметры ВРС, особенно в ортостатическом положении.
В украинском исследовании НЕБОСВОД (НЕБиволол в лечении пациентов с хронической сердечной недостаточностью и сопутствующими ОбСтруктивными заболеВаниями Органов Дыхания) [48] установлено, что добавление небиволола к базисной терапии больных с гемодинамически стабильной (II-III ФК по NYHA) ХСН c систолической дисфункцией ЛЖ и сопутствующим ХОЗЛ 1-2 степени в течение 3 мес сопровождается достоверным увеличением ФВ ЛЖ и дистанции в тесте 6-минутной ходьбы. Длительный прием небиволола пациентами с ХСН и ХОЗЛ легкого и среднетяжелого течения в поддерживающей суточной дозе 7,3±0,43 мг не сопровождается ухудшением показателей функции внешнего дыхания (ОФВ1, ОФВ1 / форсированная жизненная емкость легких). При этом значимая корреляционная зависимость между поддерживающей суточной дозой небиволола и величиной показателя ОФВ1, отражающего выраженность бронхообструктивных нарушений, отсутствует. Продемонстрировано, что увеличение ЧСС на каждые 5 уд/мин ассоциируется с повышением смертности от сердечно-сосудистых причин на 8%. Основной причиной прекращения титрования дозы небиволола раньше достижения ее целевого уровня (10 мг/сут) у вышеуказанной категории пациентов является снижение ЧСС <55 уд/мин и/или систолического артериального давления <90 мм рт. ст. На фоне приема препарата не отмечено случаев усугубления клинических проявлений ХОЗЛ либо СН, а также появления клинических признаков ухудшения периферического кровотока.
В проспективное открытое контролируемое исследование [49] были включены 63 пациента в возрасте 40-70 лет с ХСН II-IV ФК по NYHA, с ФВ ЛЖ ≤45%, из которых у 43 было диагностировано ХОЗЛ (основная группа) и 20 – не имели бронхолегочной патологии (контрольная группа). Части пациентов основной группы (n=23) дополнительно к стандартной терапии назначали небиволол (Небилет, «Берлин Хеми АГ / Менарини Групп», Германия). Начальная доза небиволола составила 1,25 мг/сут; титрацию дозы проводили согласно схеме, принятой при лечении ХСН [50]. В течение 1 мес до рандомизации была оптимизирована терапия ХСН (ИАПФ и диуретики, а при наличии показаний – спиронолактон, дигоксин, нитросодержащие препараты) и ХОЗЛ (бронходилататоры – тиотропиум бромид и ингаляционные глюкокортикостероиды). Длительность наблюдения составила 6 мес. В группе пациентов с коморбидной патологией ХСН и ХОЗЛ исходно отмечали высокую частоту встречаемости гипертонической болезни, перенесенного инфаркта миокарда, фибрилляции предсердий, а также более высокий ФК стенокардии напряжения. Установлено, что у пациентов без ХОЗЛ снижение ФК ХСН и значимое уменьшение одышки при нагрузке (шкала Борга) отмечались уже через 1 мес лечения, тогда как в основной группе – только через 6 мес. Включение небиволола (средняя доза – 5 мг) в схему лечения у пациентов с ХСН и сопутствующей ХОЗЛ не оказывало значимого воздействия на показатели спирометрии и пикфлоуметрии при отчетливом положительном влиянии на такие показатели статуса больных ХСН, как ФК заболевания, ЧСС, дистанция в тесте 6-минутной ходьбы, выраженность одышки и качество жизни. Авторы заключили, что комплексная терапия ХСН, включающая небиволол, значимо повышает эффективность лечения вне зависимости от наличия ХОЗЛ.
Особенностями применения небиволола у больных ХСН с сопутствующей ХОЗЛ являются менее выраженный ответ на терапию β-адреноблокаторами и увеличенное время достижения эффекта лечения ХСН по сравнению с пациентами без ХОЗЛ. Применение небиволола у больных с сочетанием ХСН и ХОЗЛ на фоне базисной терапии ХОЗЛ не ухудшает клинико-инструментальные показатели, характеризующие бронхиальную проходимость [49]. При наблюдении на протяжении 12 мес [51] продемонстрированы безопасность комбинированной кардиопульмональной терапии (базисная терапия ХОЗЛ + стандартная терапия ХСН, включающая небиволол) и лучший контроль над симптомами сочетанной патологии наряду с улучшением функционального статуса пациента с ХСН и ХОЗЛ.
Кардиоселективные β-адреноблокаторы следует назначать пациентам с ХСН и ХОЗЛ в малых дозах под контролем электрокардиографии и функции внешнего дыхания. За счет избирательной блокады β1-адренорецепторов небиволол в терапевтических дозах практически не оказывает влияния на гладкую мускулатуру бронхов [52]. Важно помнить, что кардиоселективность уменьшается с увеличением дозы. Чтобы не вызвать ухудшения течения ХОЗЛ, назначать β-блокаторы следует при стабилизации ХОЗЛ с минимальных доз с контролем ОФВ1 и самочувствия больного и придерживаться медленного титрования (при сомнительной переносимости – 1 р/мес).
Применение β-адреноблокаторов позволяет нивелировать неблагоприятное влияние на ССС метилксантинов и β2-агонистов. Применение β2-агонистов у пациентов при коморбидности ХОЗЛ и ССЗ по возможности следует ограничивать в связи с их негативным влиянием на состояние ССС, предпочтительным в этой ситуации является назначение антихолинергических средств.
При появлении клинических симптомов ухудшения бронхиальной проходимости и неблагоприятном влиянии препаратов на показатели функции внешнего дыхания дозировку β-адреноблокатора следует уменьшать, а при сохранении снижения функции внешнего дыхания от их приема необходимо отказаться. После достижения стабильного состояния следует возобновить лечение и/или продолжить титрование дозы β-адреноблокатора. Средством выбора в такой ситуации является высокоселективный β-адреноблокатор бисопролол или небиволол.
Таким образом, ХОЗЛ и сердечно-сосудистая патология составляют опасный «дуэт», требующий особого внимания. Применение высокоселективных β-адреноблокаторов снижает риск сердечно-сосудистых осложнений при сочетании ХОЗЛ и ССЗ. Более того, получены данные, свидетельствующие о том, что в случае длительного приема β-адреноблокаторов улучшается выживаемость и снижается риск развития обострений у различных категорий пациентов с ХОЗЛ. У пациентов с ХСН и ХОЗЛ предпочтительно назначение высокоселективного β-адреноблокатора бисопролола или небиволола. Лечение следует начинать при стабилизации ХОЗЛ с минимальных доз под контролем функции внешнего дыхания и самочувствия больного, медленно титруя дозу препарата.
Литература
1. Barnes P.J. Chronic obstructive pulmonary disease // N. Engl. J. Med. – 2000. – Vol. 343. – P. 269-280.
2. Jessup M., Brozena S. Medical progress: heart failure // N. Engl. J. Med. – 2003. – Vol. 348. – P. 2007-2018.
3. Фещенко Ю.И., Яшина Л.А., Полянская М.А. Основы спирометрии и ее особенности при хроническом обструктивном заболевании легких // Астма та алергія. – 2012. – № 2. – С. 22-27.
4. Curkendall S.M., DeLuise C., Jones J.K. Cardiovascular disease in patients with chronic obstructive pulmonary disease, Saskatchewan Canada cardiovascular disease in COPD patients // Ann. Epidemiol. – 2006. – Vol. 16 (1). – P. 63-70.
5. Hawkins N.M., Petrie M.C., Jhund P.S., et al. Heart failure and chronic obstructive pulmonary disease: diagnosis pitfalls and epidemiology // Eur. J. Heart Fail. – 2009. – Vol. 11 (2). – P. 130-139.
6. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (revised 2011). Available at: www.goldcopd.com.
7. Macchia A., Rodriguez Moncalvo J.J., et al. Unrecognised ventricular dysfunction in COPD // Eur. Respir. J. – 2012. – Vol. 39 (1). – P. 51-58.
8. McGarvey L.P., John M., Anderson J.A., Zvarich M., Wise R.A. Ascertainment of cause-specific mortality in COPD: operations of the TORCH Clinical Endpoint Committee // Thorax. – 2007. – Vol. 62. – P. 411-415.
9. Кароли Н.А., Бородкин А.В., Ребров А.П. Хроническая сердечная недостаточность различного генеза у больных хронической обструктивной болезнью легких // Пульмонология. – 2016. – 26 (1). – C. 38-45.
10. Беловол А.Н., Князькова И.И., Цыганков А.И., Толкачева И.А., Гребенюк О.В., Плиева И.Ю. Оптимизация лечения больных хронической сердечной недостаточностью в сочетании с хроническим обструктивным заболеванием легких // Раціональна фармакотерапія. – 2014.
11. Weir R.A., McMurray J.J. Epidemiology of heart failure and left ventricular dysfunction after acute myocardial infarction // Curr. Heart Fail. Rep. – 2006. – Vol. 3 (4). – P. 175-180.
12. Janssens J.P., Herrmann F., MacGee W., et al. Cause of death in older patients with anatomo-pathological evidence of chronic bronchitis or emphysema: a case-control study based on autopsy findings // J. Am. Ger. Soc. – 2001. – Vol. 49, № 5. – P. 571-576.
13. Hansell A., Walk J., Soriano J., et al. What do chronic obstructive pulmonary disease patients die from? Amultiple cause coding analysis // Eur. Respir. J. – 2003. – Vol. 22, № 5. – P. 809-814.
14. Rutten F. Unrecognized heart failure in elderly patients with stable chronic obstructive pulmonary disease: reply // European Heart Journal. – 2005. – Vol. 27, № 3. – P. 372-373.
15. Huiart L., Ernst P., Suissa S. Cardiovascular morbidity and mortality in COPD // Chest. – 2005. – Vol. 128, № 4. – P. 2640-2646.
16. Engstrom G., Hedblad B., Valind S., et al. Increased incidence of myocardial infarction and stroke in hypertensive men with reduced lung function // Journal of Hypertension. – 2001. – Vol. 19, № 2. – P. 295-301.
17. Кубажи Х. Особенности течения и прогноза у больных хронической обструктивной болезнью легких в сочетании с ишемической болезнью сердца и артериальной гипертензией: Дисс. … канд. мед. наук. – Рязань, 2013.
18. Вахненко А.В. Современные подходы лечения хронической обструктивной болезни легких с сопутствующей хронической сердечной недостаточностью // Світ медицини та біології. – 2013. – № 3. – C. 70-73.
19. Egred M., et al. Under-use of beta-blockers in patients with ischemic heart disease and concomitant chronic obstructive pulmonary disease // Q. J. Med. – 2005. – Vol. 98. – P. 493-497.
20. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO workshop report. Last updated 2016. www.goldcopd.org. Accessed December 26, 2016.
21. Global Initiative for Chronic Obstructive Lung Disease (GOLD).Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO workshop report. Last updated 2017. www.goldcopd.org.
22. Salpeter S.R., Ormiston T.M., Salpeter E.E., et al. Cardioselective beta-blockers for chronic obstructive pulmonary disease: a meta-analysis // Respir. Med. – 2003. – Vol. 97 (10). – P. 1094-101.
23. Shin H.T., Webb C.R., Conway W.A., et al Frequency and significance of cardiac arrhythmias in chronic obstructive lung disease // Chest. – 1988. – Vol. 94. – P. 44.
24. Bourne H.R. How receptors talk to trimeric G proteins // Curr. Opin. Cell Biol. – 1997. – Vol. 9. – P. 134-142.
25. Branot D.R., Ross E.M. Catecholamine-stimulated GTPase cycle. Multiple sites of regulation by beta-adrenergic receptor and Mg2+ studied in reconstituted receptor-Gs vesicles // J. Biol. Chem. – 1986. – Vol. 261. – P. 1656-1664.
26. Агапова О.Ю. Характеристика активности β-адренорецепторов при применении специфических агонистов и антагонистов у пациентов с бронхиальной астмой с сочетанной сердечно-сосудистой патологией // Автореф … канд. мед. н. – М., 2016.
27. Shelley R., Salpeter M.D., Thomas M., et al. Cardioselective beta-blockers in Patients with Reactive Airway Disease: a Meta-Analysis // PhD. – 2002.
28. Engelmeteier R.S., O’Connell J.B., Walsh К. Improvement in sympyoms and exercise tolerance by metoprolol in patients with dilated cardiomyopathy:
a double-blind, randomized, placebo-controlled trial // Circulation. – 1985. – Vol. 72. – P. 536-546.
29. Арипова Н.А. Характеристика состояния бета2-адренорецепторов лимфоцитов у больных гипертонической болезнью при амбулаторном лечении бета-блокаторами: Автореф. дис. … канд. мед. наук / Н.А. Арипова. – М., 1989. – 24 с.
30. Packer M. The neurohormonal hypothesis: a theory to explain the mechanism of disease progression in heart failure // J. Am. Coll. Cardiol. – 1992. – Vol. 20. – P. 248-254.
31. Francis G.S., Goldsmith S.R, Olivari M.T., et al. The neurohormonal axis in congestive heart failure // Am. Intern. Med. – 1984. – Vol. 101. – P. 370-377.
32. Воронков Л.Г., Богачова Н.В. Варіабельність ритму серця та її прогностичне значення у хворих з хронічною серцевою недостатністю // Укр. кардіол. журн. – 2004. – № 2. – С. 49-52.
33. Амосова Е.Н., Бойчак М.П., Сидорова Л.Л. Вариабельность сердечного ритма и ее взаимосвязь с функциональным состоянием миокарда левого желудочка у больных ишемической болезнью сердца с начальной сердечной недостаточностью // Серце і судини. – 2003. – № 4. – С. 88-95.
34. Малая Л.Т., Горб Ю.Г. Хроническая сердечная недостаточность: достижения, проблемы, перспективы. – Х.: Торсинг, 2002. – 768 с.
35. Packer M. Current role of beta-adrenergic blockers in the management of chronic heart failure // Am. J. Med. – 2001. – Vol. 110 (7A). – P. S81-S94.
36. Hasenfuss G., Holubarsch C., Blanchard E.M., et al. Influence of isoproterenol on myocardial energetics. Experimental and clinical investigations // Basic Research Cardiol. – 1989. – Vol. 84 (Suppl. 1). – P. 147-155.
37. Meredith I.T., Eisenhofer G., Lambert G.W., et al. Cardiac sympathetic nervous activity in congestive heart failure: evidence for increased neuronal norepinephrine release and preserved neuronal uptake // Circulation. – 1993. – Vol. 88. – P. 136-145.
38. Parmley W. Neuroendocrine changes in heart failure and their clinical relevance // Clin. Cardiol. – 1995. – Vol. 18. – P. 440-445.
39. Bristow M., Hershberger R., Port J., et al. B-adrenergic pathways in nonfailing and failing human ventricular myocardium // Circulation. – 1990. – Vol. 82 (Suppl. 1). – P. 12-25.
40. Lee H.Y., Baek S.H. Optimal Use of Beta-Blockers for Congestive Heart Failure // Circ. J. – 2016. – Vol. 80 (3). – P. 565-71.
41. Kubota Y., Asai K., Furuse E., et al. Impact of β-blocker selectivity on long-term outcomes in congestive heart failure patients with chronic obstructive pulmonary disease // Int. J. Chron. Obstruct. Pulmon. Dis. – 2015. – Vol. 10. – P. 515-23.
42. McMurray J.J., Adamopoulos S., Anker S.D., et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC // Eur. J. Heart Fail. – 2012. – Vol. 14 (8). – P. 803-69.
43. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008 // Europ. Heart J. – 2008. – Vol. 29. – P. 2388-2442.
44. Flather M.D., Shibata M.C., Coats A.J.S., et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS) // Europ. Heart J. – 2005. – Vol. 26 (3). – P. 215-225.
45. Журбина Е.С., Агеев Ф.Т. Бета-адреноблокаторы – возможности оптимизации терапии хронической сердечной недостаточности в амбулаторных условиях // Лечащий врач. – 2013. – № 3.
46. Логачева И.В., Павленко Е.П., Зотов И.Л. Сравнительная оценка длительного применения бета-адреноблокаторов у пожилых больных тяжелой сердечной недостаточностью // Сердечная недостаточность. – 2004. – № 5 (6). – С. 292-294.
47. Глезер М.Г., Соболев К.Э., Бойко Н.В., Абильдинова А.Ж. Сравнительная эффективность лечения небивололом и бисопрололом больных артериальной гипертензией // Кардиоваскулярная терапия и профилактика. – 2004. – № 5. – С. 43-51.
48. Воронков Л.Г., Перцева Т.А, Василенко А.М., Волков В.И., Серкова В.К., Стасюк Л.Б. Дизайн и предварительные результаты украинского кооперативного исследования НЕБОСВОД (НЕБиволол в лечении пациентов с хронической сердечной недостаточностью и сопутствующими ОбСтруктивными заболеВаниями Органов Дыхания) // Серцева недостатність. – 2010. – № 1. – С. 2-6.
49. Федотов П.А., Ситникова М.Ю., Сафьянова Н.В., Шапорова Н.Л. Хроническая сердечная недостаточность ишемического генеза и хроническая обструктивная болезнь легких: возможности комбинированной терапии, включающей небиволол // Клиницист. – 2013. – № 3-4. – C. 40-47.
50. Воронков Л.Г., Амосова К.М., Багрій А.Е. та ін. Рекомендації Асоціації кардіологів України з діагностики, лікування та профілактики хронічної серцевої недостатності у дорослих // Київ. – 2009. – С. 4-22.
51. Федотов П.А., Ситникова М.Ю., Шапорова Н.Л., Марченко В.Н. Течение хронической обструктивной болезни легких в сочетании с хронической сердечной недостаточностью на фоне лечения с применением небиволола // Пульмонология. – 2011. – № 5. – C. 53-56.
52. Овчаренко С.И., Лещенко И.В. Хроническая обструктивная болезнь легких и сопутствующая сердечно-сосудистая патология. Подходы к ведению больных // Участковый терапевт. – 2017. – № 1. – С. 4.
Журнал "СЕРЦЕВА НЕДОСТАТНІСТЬ та коморбідні стани" № 2, вересень, 2017 р.



