21 грудня, 2017
Лечение распространенной метастатической саркомы мягких тканей: обсуждение и обзор последних клинических данных

Саркома мягких тканей (СМТ) представляет собой гетерогенную группу злокачественных новообразований, в которую входят около 50 гистологических подтипов. Исторически сложилось, что существует небольшое количество вариантов системной терапии этого относительно редкого заболевания. Вне первой линии терапии эффективность традиционных цитотоксических препаратов, таких как антрациклины, алкилирующие агенты и таксаны, ограниченна: медиана общей выживаемости (ОВ) при всех подтипах распространенной метастатической СМТ высокой степени злокачественности по-прежнему составляет около 12-18 мес. Развитие таргетной терапии привело к одобрению Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) четырех новых препаратов для лечения высокозлокачественной метастатической СМТ.
Лечение СМТ остается одной из наиболее сложных проблем в клинической онкологии. Саркома – это мезенхимальное новообразование, которое может возникать в любой части тела, включая конечности, туловище, забрюшинное пространство, голову и шею. СМТ представляют собой гетерогенную группу новообразований, которая включает около 50 подтипов с различными молекулярными, гистологическими и клиническими характеристиками. Среди высокозлокачественных СМТ преобладают недифференцированная плеоморфная саркома, липосаркома (ЛПС), лейомиосаркома (ЛМС), синовиальная саркома (СС) и злокачественные опухоли периферических нервных оболочек.
В целом СМТ довольно редкая патология, ее доля среди всех злокачественных заболеваний взрослого населения составляет всего 1%. У пациентов с высоким риском и СМТ высокой степени злокачественности в 50% случаев происходит метастазирование. У людей молодого возраста и детей СМТ является одной из 5 наиболее частых причин смерти от онкологических заболеваний. Медиана ОВ больных распространенной метастатической СМТ составляет около 12 мес, в более ранних исследованиях отмечено, что выживаемость достигает 18-19 мес. Тем не менее необходимо совершенствование терапевтических опций в отношении высокозлокачественной СМТ.
В связи с относительно низкими показателями заболеваемости и гетерогенностью новообразований количество исследований по применению новых активных системных агентов по-прежнему остается небольшим. Благодаря разработке молекулярных и гистологических классификаций, а также созданию новых лекарственных средств для определенных подтипов, удалось достичь лучшего понимания как самой патологии, так и тактики лечения СМТ.
Антрациклинсодержащая терапия: первая линия терапии при всех подтипах СМТ
По состоянию на 2016 год антрациклины (например, доксорубицин) остаются стандартом первой линии терапии при высокозлокачественных СМТ вне зависимости от подтипа опухоли, клинической картины и характеристик самого пациента. Антрациклины встраиваются в ДНК, тем самым блокируя синтез ДНК и РНК, а также интерферируют с топоизомеразой II, что приводит к разрыву ДНК. Доксорубицин обладает активностью в качестве единственного агента при высокозлокачественных СМТ и демонстрирует дозозависимый эффект; при дозе <60 мг/м2 он малоэффективен. Вследствие токсичности даже самые интенсивные схемы лечения содержат доксорубицин в дозировке 75 мг/м2.
Алкилирующие агенты (например, ифосфамид) оказывают противоопухолевое действие за счет перекрестного сшивания нитей ДНК. Ифосфамид также характеризуется активностью в качестве единственного агента при СМТ, и хотя он не обладает синергизмом действия с антрациклинами, применение этих двух препаратов увеличивает показатели частоты ответа (ЧО), выживаемости без прогрессирования (ВБП) и возможности паллиативной помощи.
В ходе ретроспективных исследований было выяснено, что молодой возраст и хорошие показатели эффективности лечения являются прогностическими факторами более высокой выживаемости, тогда как Van Glabbeke в своем исследовании отметил, что молодой возраст также может быть прогностическим фактором ответа на антрациклинсодержащую терапию. Между тем более высокая степень злокачественности ассоциирована с лучшей ЧО на химиотерапию (ХТ), но худшим показателем ОВ. Это, вероятно, свидетельствует о том, что такие опухоли более чувствительны к ХТ, но также склонны к более быстрому рецидивированию и прогрессированию. Другие характеристики, такие как пол, локализация первичной опухоли, расположение метастазов и гистологический подтип, также были изучены как дополнительные прогностические факторы.
Следует отметить, что, помимо упомянутых выше 5 основных подтипов СМТ, существует ряд других, менее распространенных подтипов, устойчивых к антрациклину, для которых терапия доксорубицином в сочетании с ифосфамидом не рекомендуется в первой линии.
Вторая и последующие линии терапии: выбор терапевтической тактики в зависимости от гистологического подтипа
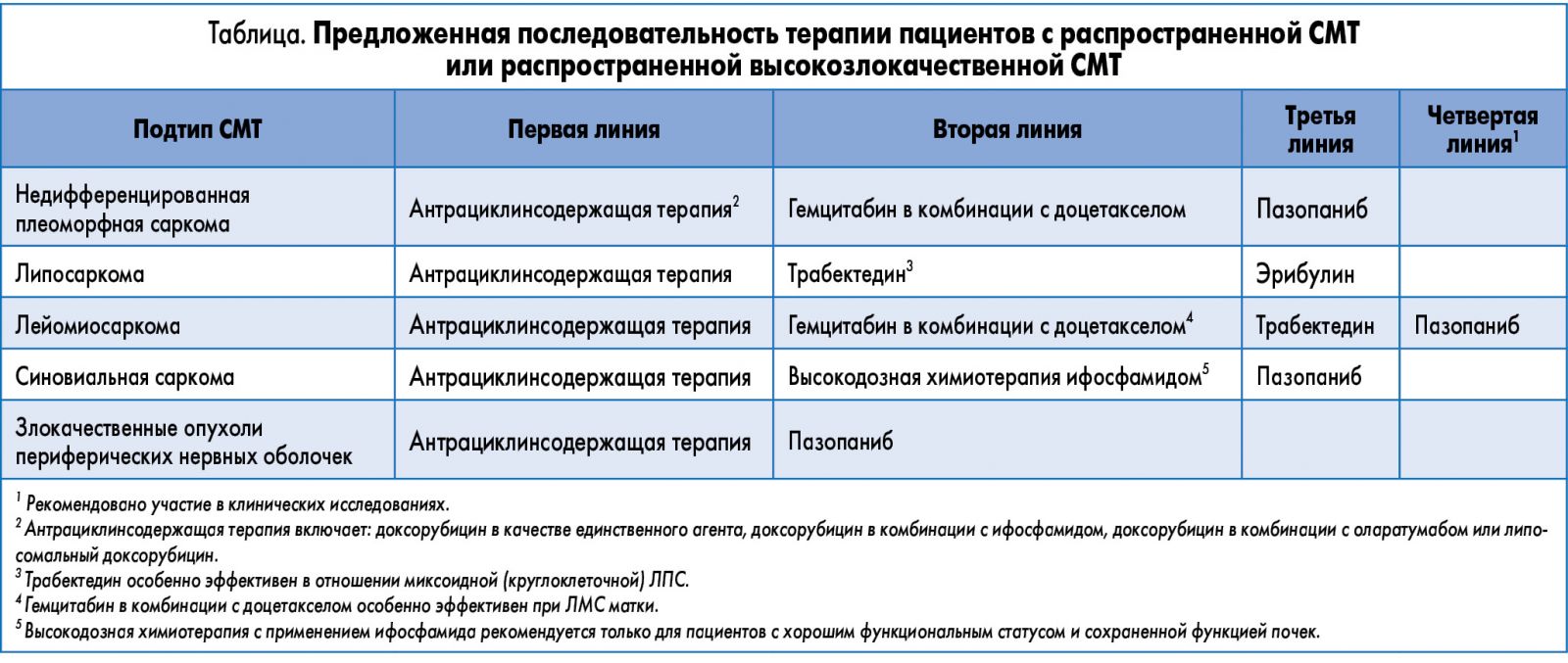
В случае неудачи первой линии терапии при выборе лечения рекомендовано учитывать данные гистологического исследования, молекулярный подтип опухоли, а также характеристики самого пациента (таблица). В то время как число режимов во второй линии терапии растет, ни один препарат не продемонстрировал улучшения результатов одновременно для всех подтипов СМТ.
Высокодозная терапия ифосфамидом
Для соответствующих пациентов с хорошим функциональным статусом в случае СС (то есть с транслокацией хромосом Т (Х, 18) или SYT/SSX) во второй линии терапии рекомендован повторный курс высокодозной ХТ ифосфамидом. Как упоминалось ранее, ифосфамид обладает активностью в монотерапии как первичной, так и рецидивирующей СМТ, при этом ЧО находится в пределах 25-50%. Ифосфамид обладает дозозависимым эффектом, в особенности в дозе 5-12 г/м2, доза >16 г/м2 не повышает эффективность, и в то же время препарат демонстрирует увеличение токсичности и ухудшение фармакокинетики. Первичная токсичность, связанная с его приемом, может вызывать тошноту, рвоту, миелосупрессию, геморрагический цистит, нефротоксичность (тубулярный ацидоз, солетеряющую нефропатию), астению и энцефалопатию. Ифосфамид можно вводить в виде продолжительной инфузии в комбинации с препаратом месна через портативные насосы с хорошей физико-химической стабильностью.
В ряде исследований был изучен потенциал высокодозной ХТ ифосфамидом у пациентов с рефрактерной СМТ, особенно тех, у кого отмечено прогрессирование на фоне предшествующей ХТ, включавшей антрациклины, в том числе на комбинированной терапии доксорубицином и ифосфамидом. Ретроспективный анализ данных 67 пациентов с СМТ, получавших высокодозную ХТ ифосфамидом после предшествующей адъювантной терапии доксорубицином в сочетании с ифосфамидом либо паллиативной терапии на основе ифосфамида, который проводился в Королевской больнице Marsden, показал, что этот режим обладает значительной активностью, включая ответ во второй, третьей и четвертой линии терапии. Хотя клиническое преимущество было выше для СС, ответ на терапию также наблюдался при ЛПС и ЛМС.
Несмотря на свою токсичность, а также дорогостоящее и трудоемкое планирование, высокодозная терапия ифосфамидом показана в качестве второй линии терапии при СС в случае прогрессирования заболевания на фоне антрациклинсодержащей терапии. Так, рекомендован 14-дневный курс непрерывной инфузии ифосфамида в дозе 1 г/м2 в сутки каждые 4 недели в комбинации с гранулоцитарным колониестимулирующим фактором, поскольку этот режим хорошо переносится и обладает высокой эффективностью в качестве «терапии спасения». Тем не менее оговаривается, что подобное лечение необходимо проходить в академических центрах, располагающих достаточным опытом и возможностью проведения соответствующей поддерживающей терапии, включая адекватное введение месны. Следует принять дополнительные меры предосторожности у пациентов с риском развития нефротоксичности (перенесенная почечная недостаточность или нефрэктомия в анамнезе). Для пациентов, которым подходит данная терапия, особенно для тех, кто продемонстрировал ранее чувствительность к ифосфамиду, этот режим является вариантом «терапии спасения».
Гемцитабин и доцетаксел
Во второй линии терапии пациентов с плеоморфной саркомой или ЛМС гемцитабин в комбинации с доцетакселом (GD) рекомендован в рамках «терапии спасения». Гемцитабин представляет собой нуклеозидный аналог, который ингибирует синтез ДНК и продемонстрировал активность в монорежиме в исследованиях II фазы у пациентов с СМТ, прогрессировавшей после введения антрациклина и алкилирующих препаратов. Среди прочего отмечен ответ на терапию при плеоморфной и ангиосаркоме.
Результаты исследования II фазы показали ограниченную эффективность гемцитабина в комбинации с винорелбином или дакарбазином при СМТ. Между тем доцетаксел является таксаном, ингибирующим микротрубочковую активность, а также обладает активностью в качестве единственного агента во второй линии терапии. Учитывая, что гемцитабин и доцетаксел имеют отличающийся от антрациклинов и алкилирующих агентов механизм действия, а также подтвержденный в доклинических исследованиях синергизм действия, было целесообразно объединить эти препараты для лечения СМТ.
Как и в случае высокодозной ХТ ифосфамидом, ответ на GD, по-видимому, сильно зависит от гистологического подтипа СМТ. В частности, в нескольких исследованиях показана эффективность GD при ЛМС, при этом ЧО составляла 36-53% в первой линии и 24-27% – во второй линии терапии. Кроме того, похоже, что ЛМС матки более чувствительна к GD по сравнению с внематочной локализацией ЛМС. Небольшие исследования показывают, что режим GD активен и при других, менее распространенных подтипах СМТ, включая эпителиоидную и ангиосаркому.
Учитывая умеренную эффективность GD во второй линии терапии, практическое применение этого режима заключается в использовании гемцитабина в дозе 900 мг/м2 (в 1-й и 8-й день) и доцетаксела 100 мг/м2 (на 8-й день) в комбинации с гранулоцитарным колониестимулирующим фактором каждые 3 недели во второй линии терапии рефрактерных ЛМС и плеоморфных сарком. Этот режим может быть особо эффективен для ЛМС матки, в отличие от ЛМС внематочной локализации. Хотя практическое применение варьируется в зависимости от учреждения, многие онкологи предпочитают назначать более низкую дозу доцетаксела – 75 мг/м2, – учитывая данные о токсичности, полученные в исследовании SARC002. В качестве единственного агента гемцитабин также может рассматриваться как вариант терапии ослабленных пациентов.
Трабектедин
Трабектедин одобрен FDA во второй и последующей линиях терапии при СМТ для таких подтипов, как ЛПС и ЛМС. Он представляет собой синтетическое соединение, выделенное из карибского оболочника Ecteinascidia turbinata. В отличие от других алкилирующих агентов, которые нацелены на большую бороздку ДНК, трабектедин связывает и алкилирует малую бороздку ДНК, в результате чего спираль ДНК изгибается в сторону большой бороздки, что приводит к сбою в позднюю S- и G2-фазу, тем самым индуцируя p-53-независимый апоптоз. Другие эффекты включают модуляцию воспаления в микроокружении опухоли и индуцирование апоптоза, опосредованного каспазой-8, макрофагов, ассоциированных с опухолью, и уменьшение ангиогенеза. Доклинические исследования показывают, что трабектедин также эффективен в модулировании транскрипции онкогенных сливных белков и, таким образом, может быть особенно эффективен при лечении саркомы, сопряженной с транслокацией.
В отличие от высокодозной ХТ ифосфамидом и GD, ответ на трабектедин был специфичным не только в отношении гистологических подтипов L-саркомы, но также и для молекулярного подтипа СМТ. Миксоидная (круглоклеточная) ЛПС оказалась особенно чувствительной к трабектедину, в ретроспективных исследованиях частота объективного ответа достигала 50%, медиана ВБП – 14-17 мес, а 6-месячная ВБП – 88%. Кроме того, пациенты с рецидивом миксоидной ЛПС были чувствительны к пробному возобновлению терапии трабектедином. Неожиданно высокая противоопухолевая активность объясняется способностью препарата модулировать транскрипцию онкогенных слитых белков, таких как FUS-DDIT3, и тем самым приводить к дифференциации липобластов. Эти результаты обусловили дальнейшее изучение трабектедина в качестве варианта лечения для других связанных с транслокацией СМТ, но в последующих исследованиях получено недостаточно доказательств в пользу активности трабектедина при СС, альвеолярной мягкотканной саркоме или рабдомиосаркоме.
Помимо L-саркомы, он может быть активным в отношении других сарком, что потребует дальнейшего изучения. Ряд текущих исследований оценивают потенциальную эффективность трабектедина в комбинации с другими агентами, а также применение биомаркеров, основанных на репарации ДНК, для прогнозирования ответа на трабектедин.
Пазопаниб
Пазопаниб – единственное одобренное FDA пероральное лекарственное средство, применяемое при высокозлокачественной СМТ. Этот препарат является приемлемым вариантом при всех подтипах СМТ, за исключением ЛПС, у пациентов после прогрессирования на фоне антрациклинсодержащей терапии. Пазопаниб представляет собой мультитаргетный ингибитор тирозинкиназы, который обладает активностью в отношении различных рецепторов, включая рецептор фактора роста эндотелия сосудов (VEGFR), рецептор тромбоцитарного фактора роста и с-КIТ. Чрезмерная экспрессия VEGFR в мягких тканях, а также серологических образах наблюдается при различных типах СМТ, в том числе при недифференцированной плеоморфной саркоме и ЛМС. Более того, повышенная экспрессия VEGFR коррелирует с более выраженной степенью злокачественности, большим размером опухоли и худшим прогнозом, что обусловливает роль VEGFR в качестве терапевтической мишени при СМТ.
Изучение эффективности приема пазопаниба в дозе 800 мг в сутки при распространенной СМТ проводилось в исследовании II фазы EORTC62043 с участием 142 больных, которые не могли получать ХТ или получали <2 линий ХТ. Пациенты были разделены на 4 подгруппы, в 3 из которых (больные с ЛМС, СС и другими видами сарком) была достигнута первичная конечная точка – 12-недельная ВБП, тогда как пациенты 4-й подгруппы были исключены из дальнейшего исследования, так как не достигли первичной конечной точки в промежуточном анализе. Так, в группах пациентов с ЛМС, СС и другими опухолями 12-недельная ВБП составила 44, 49 и 30% соответственно. У 9 пациентов наблюдался частичный ответ (у 5 больных с СС, у 1 с ЛМС и у 3 с другими видами сарком), но полный ответ не был достигнут ни у одного пациента.
В исследовании III фазы PALETTE приняли участие 369 пациентов, которые были рандомизированы в соотношении 2:1 в группы пазопаниба и плацебо соответственно. В исследование были включены пациенты, ранее получавшие до 4 курсов ХТ, в 99% – антрациклинсодержащую терапию, 56% прошли по меньшей мере 2 курса ХТ. Гистологические подтипы включали СС, ЛМС и другие саркомы; пациенты с ЛПС не были включены в исследование. Пазопаниб увеличил медиану ВБП – 4,6 против 1,6 мес в сравнении с плацебо. Так же, как и в исследовании ІІ фазы, уровень частичного ответа оставался низким (6 против 0%), но стабилизация заболевания была значительно выше в группе пазопаниба – 67 и 38% соответственно. Не было отмечено значительной разницы в медиане ОВ: 12,5 мес в группе пазопаниба и 10,7 мес в группе плацебо. Наиболее частыми побочными эффектами были гипертензия, усталость, диарея, тошнота, снижение массы тела.
В ретроспективном анализе исследований EORTC62043 и PALETTE в целом у 77 пациентов отмечен длительный ответ с ВБП >6 мес и ОВ >18 мес, включая 12 пациентов, у которых лечение продолжалось более 2 лет. Исследователи выявили, что хороший функциональный статус, низкая или средняя степень злокачественности и нормальный уровень гемоглобина являются хорошими прогностическими факторами. Мутации TP53 могут служить прогностическим маркером ответа на пазопаниб, что требует дальнейших исследований. Гипертензия не показала себя в качестве надежного предиктивного биомаркера ответа на пазопаниб.
В 2012 г. пазопаниб был одобрен FDA для лечения прогрессирующей СМТ, за исключением ЛПС, у пациентов после антрациклинсодержащей ХТ. Дополнительные исследования подтвердили, что пазопаниб обладает противоопухолевой эффективностью в отношении нескольких подтипов, включая ЛМС, СС, недифференцированную плеоморфную саркому и злокачественные опухоли периферических нервных оболочек, но характеризуется минимальной активностью при ЛПС. Данные, позволяющие предположить, что пазопаниб проявляет активность в качестве единственного агента при других, менее распространенных подтипах, таких как светлоклеточная саркома, одиночная фиброзная опухоль и гемангиоэндотелиома, также ограниченны.
Пазопаниб рассматривается в качестве терапевтической опции во второй и третьей линиях терапии у пациентов с СС, недифференцированной плеоморфной саркомой и злокачественными опухолями периферических нервных оболочек. Пациенты с ЛМС могут принимать пазопаниб во второй, третьей или даже четвертой линиях в зависимости от соматического статуса и наличия сопутствующих заболеваний. Поскольку пазопаниб является единственным пероральным средством, одобренным для применения при высокозлокачественной СМТ, и обладает относительно хорошей переносимостью, он представляет собой отличную альтернативу другим вариантам «терапии спасения» для ослабленных пациентов. В ходе продолжающегося исследования II фазы будет рассмотрена роль пазопаниба в первой линии терапии в качестве альтернативы доксорубицину у пожилых пациентов. Дополнительные исследования также ведутся для изучения потенциальной комбинации пазопаниба с ингибиторами PIK3/mTOR и эпигенетически модифицированными агентами.
Эрибулин
Эрибулин одобрен FDA для применения у пациентов с прогрессирующей ЛПС, ранее получавших лечение антрациклинами. Эрибулин – синтетический аналог галихондрина В, который был выделен из морской губки Halichondria okadai. В отличие от других ингибиторов микротрубочек (например, таксанов, алкалоидов барвинка), эрибулин обладает уникальным механизмом действия, который связывает тубулин с нефункционирующими агрегатами. Эрибулин также приводит к ремодуляции сосудов опухоли и инверсии эпителиально-мезенхимального перехода. Эрибулин обладает активностью в отношении нескольких видов солидных опухолей и одобрен FDA для лечения рака молочной железы, а также ЛПС, у пациентов, ранее получавших антрациклины.
В рандомизированном исследовании III фазы, охватившем 22 страны, 452 пациента с ЛПС и ЛМС средней и высокой степени злокачественности, которым проводилось <2 линий предшествующей терапии, были рандомизированы в группы эрибулина и дакарбазина. Эрибулин значительно улучшил медиану ОВ – 13,5 против 11,5 мес, по сравнению с дакарбазином. Преимущество медианы ОВ в группе эрибулина выше для ЛПС (15,6 против 8,4 мес) по сравнению с ЛМС (12,7 против 13,0 мес). Поразительно, что медиана ВБП была одинаковой в обеих группах – 2,6 мес.
Остается неясным, почему эрибулин в исследованиях улучшил ОВ, но не влиял на вторичные конечные точки этого исследования, включая ВБП, ЧО и уровень контроля заболевания. Исследователи объясняют это воздействием эрибулина на микроокружение опухоли и индуцированием ремоделирования сосудов. Тем не менее эрибулин является важным агентом, который увеличивает выживаемость при ЛПС.
Оларатумаб: новый агент в первой линии терапии
В ноябре 2016 г. FDA предоставило ускоренное одобрение оларатумаба в сочетании с доксорубицином на основании результатов исследования Ib/II фазы для лечения СМТ у пациентов, ранее не получавших антрациклинсодержащую терапию. Было показано, что, в отличие от других вышеупомянутых агентов, оларатумаб в сочетании с доксорубицином улучшает ОВ таких пациентов и как таковой может изменить парадигму лечения распространенной высокозлокачественной СМТ. Подтверждающие результаты исследования III фазы будут важны для получения одобрения FDA.
Оларатумаб является полностью человеческим рекомбинантным моноклональным антителом IgG1, блокирующим связывание PDGF-AA и PDGF-BB с PDGFR. Повышенная экспрессия PDGFR была обнаружена во многих злокачественных новообразованиях, включая СМТ, связывание PDGFR-лиганда играет важную роль в клеточных процессах (деление, старение и апоптоз) при саркоме, а также ассоциировано с метастатическим прогрессированием. В моделях ксенотрансплантатов ЛМС и глиобластомы оларатумаб продемонстрировал противоопухолевую активность посредством модуляции пути PDGFR и дальнейшего ингибирования Akt и MAPK.
Потенциальная роль иммунотерапии при СМТ
Несмотря на то что нет утвержденных препаратов для использования в иммунотерапии при саркоме, она остается областью активного исследования и требует упоминания. Первое упоминание о роли иммунотерапии при саркоме датируется XIX веком, когда William Coley описал пациента с регрессией саркомы после бактериальной инфекции. Совсем недавно успех ингибиторов контрольных точек иммунного ответа в лечении солидных опухолей вызвал интерес к их применению в терапии пациентов с саркомой. Хотя общепризнано, что иммунное распознавание имеет решающее значение для применения иммунотерапии при онкологических заболеваниях, оптимальная стратегия иммунотерапии в случае СМТ еще не разработана.
Общая мутационная нагрузка опухоли была определена как предиктор реакции на блокирование контрольных точек при различных злокачественных новообразованиях. В то же время существует мнение, что саркома в целом имеет низкую мутационную нагрузку, что, вероятно, обусловлено особенностями каждого подтипа. Другая стратегия заключалась в идентификации иммуногенных антигенов с экспрессией, характерной для саркомы. Характерные транслокации или слияние белков, определяемые при СС и MRC-LPS, могут представлять собой один из антигенов для иммунного распознавания. Другим антигеном является антиген рака яичника, NY-ESO-1, который экспрессируется до 100% при MRC-LPS и 80% при СС, а также в других подтипах, включая ЛМС матки и остеосаркому. Это привело к началу пилотного исследования ингибирования контрольных точек с использованием анти-CTLA-4 антитела при СС с экспрессией NY-ESO-1. Хотя у 6 пациентов не было объективного ответа, ипилимумаб хорошо переносился и не вызывал серьезных побочных эффектов. Однако в другом исследовании с использованием Т-клеток, обработанных NY-ESO-1, 4 из 6 ответов были отмечены у пациентов с СС с экспрессией NY-ESO-1.
Инфильтрирующие опухоль лимфоциты играют важную роль в иммунном ответе и выявлены при нескольких подтипах СМТ, включая ЛПС, ЛМС, СС и MPNST, хотя одно лишь их наличие не приводит к регрессии опухоли. Экспрессия PD-L1 составляет 12-58% в зависимости от подтипа саркомы. В ретроспективном исследовании с участием 82 пациентов с СМТ экспрессия PD-L1 наблюдалась в 100% случаев (7/7 пациентов) при эпителиоидной саркоме, 53% (10/19) – СС, 38% (12/32) – рабдомиосаркоме, 33% (6/18) – саркоме Юинга и 0% (0/6) – мезенхимальной хондросаркоме. Позитивный PD-1 статус и экспрессия PD-L1 при СМТ коррелировали с плохим прогнозом, продвинутой стадией, высшей степенью злокачественности, развитием отдаленных метастазов и степенью дифференциации опухоли и некроза. В исследовании II фазы предварительно был получен частичный ответ на анти-PD-1 терапию при недифференцированных ЛПС и плеоморфных саркомах, активно планируется расширение исследования. Необходимы дальнейшие исследования для определения роли конкретных подмножеств инфильтрирующих опухоль лимфоцитов в микроокружении СМТ и поиска наилучших способов использования биомаркеров, таких как NY-ESO-1 и PD-1/PD-L1, позволяющих правильно отобрать пациентов для назначения терапии.
Несмотря на появление современных стратегий лечения, включая иммуно- и таргетную терапию, СМТ остается серьезной проблемой в практической онкологии. Поскольку СМТ является относительно редкой патологией, возможности проведения традиционных клинических исследований и разработки новых лекарств ограниченны. С 2007 г. для лечения высокозлокачественной СМТ во второй линии при прогрессировании после введения антрациклинов было одобрено 3 новых препарата: трабектедин, пазопаниб и эрибулин. Пазопаниб является пероральным таргетным агентом, действие которого направлено на VEGFR. Дальнейшие достижения в терапии потребуют лучшего понимания биологических различий между подтипами СМТ, а также выявления специфичных биомаркеров, которые позволят определить ответ на лечение и механизмы резистентности.
Статья печатается в сокращении.
In G.K., Hu J.S., Tseng W.W. Treatment of advanced,
metastatic soft tissue sarcoma: latest evidence and clinical
considerations. Ther Adv Med Oncol, 2017.
Перевела с англ. Екатерина Марушко
Тематичний номер «Онкологія» № 5 (51), грудень 2017 р.