15 квітня, 2020
Досвід ефективного застосування пазопанібу для лікування метастатичної позакісткової саркоми Юїнга
При саркомі Юїнга зазвичай уражаються довгі трубчасті кістки та глибокі м’які тканини кінцівок у дітей і підлітків. Комплексне лікування захворювання за допомогою хірургічних методів, променевої та хіміотерапії дає змогу зменшити вираженість симптомів і покращити віддалені наслідки, проте перебіг метастатичної саркоми Юїнга погано контролюється. Пазопаніб – новий мультитаргетний інгібітор тирозинкінази, який насамперед пригнічує рецептори факторів росту ендотелію судин (Vascular Endothelial Growth Factor Receptors, VEGFR)-1, -2 і -3, рецептори тромбоцитарного фактора росту (Platelet-Derived Growth Factor Receptors, PDGFR)-α і -β та рецептор фактора стовбурових клітин (c-KIT). Пазопаніб схвалений для лікування осіб із саркомою м’яких тканин, які пройшли курс стандартної хіміотерапії та мають рефрактерну форму захворювання. Сьогодні доступна невелика кількість даних щодо клінічної ефективності пазопанібу у лікуванні саркоми Юїнга, також відсутні відомості про довгострокову ефективність такого виду терапії. У клінічному випадку наведено успішний досвід застосування пазопанібу для лікування метастатичної позакісткової саркоми Юїнга.
Клінічний випадок
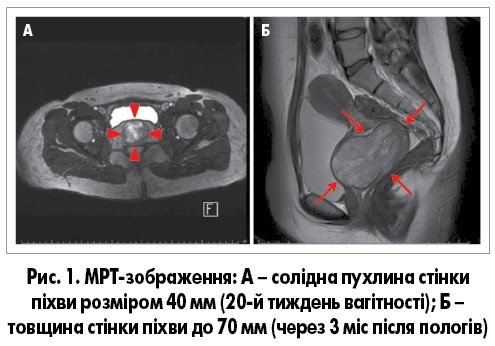 Пацієнтка, 17 років. Під час планового акушерського обстеження на 20-му тижні вагітності випадково виявлена пухлина піхви. Методом магнітно-резонансної томографії (МРТ) візуалізована солідна пухлина стінки піхви розміром 40 мм (рис. 1А). На 37-му тижні гестації виникла кровотеча зі статевих шляхів, з приводу якої був виконаний екстрений кесарів розтин. Новонароджений хлопчик був здоровим. Через 3 міс після пологів проведено МРТ-дослідження, яке показало збільшення товщини стінки піхви до 70 мм (рис. 1Б). Пацієнтці було рекомендовано резекцію пухлини, проте вона відмовилася від проведення операції. На деякий час контроль стану пацієнтки був втрачений.
Пацієнтка, 17 років. Під час планового акушерського обстеження на 20-му тижні вагітності випадково виявлена пухлина піхви. Методом магнітно-резонансної томографії (МРТ) візуалізована солідна пухлина стінки піхви розміром 40 мм (рис. 1А). На 37-му тижні гестації виникла кровотеча зі статевих шляхів, з приводу якої був виконаний екстрений кесарів розтин. Новонароджений хлопчик був здоровим. Через 3 міс після пологів проведено МРТ-дослідження, яке показало збільшення товщини стінки піхви до 70 мм (рис. 1Б). Пацієнтці було рекомендовано резекцію пухлини, проте вона відмовилася від проведення операції. На деякий час контроль стану пацієнтки був втрачений.
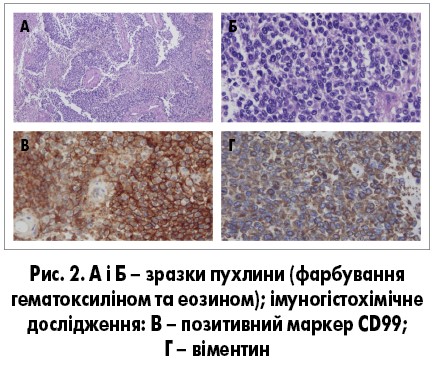 Через 4 міс після пологів на тлі кровотечі з пухлини й анемії жінка знепритомніла, у зв’язку з цим була виконана екстрена резекція пухлини. За результатами післяопераційного патоморфологічного дослідження біологічний матеріал мав вигляд однорідного солідного скупчення дрібних круглих проліферувальних клітин (рис. 2А та Б). Дані імуногістохімічного дослідження: виявлені пухлинні маркери CD99 (рис. 2В) та віментин (рис. 2Г). Метод флуоресцентної гібридизації in situ (FISH): виявлений перерваний ген EWS у пухлинних клітинах, що свідчить про його перебудову. За результатами МРТ, солідна пухлина розміром 16 мм також виявлена у крижовій кістці справа. Дані рентгенографії (Rh) органів грудної клітки (ОГК) – без змін (рис. 3А); комп’ютерна томографія (КТ) ОГК – мікронодулярне ураження нижньої частки лівої легені (рис. 3Г).
Через 4 міс після пологів на тлі кровотечі з пухлини й анемії жінка знепритомніла, у зв’язку з цим була виконана екстрена резекція пухлини. За результатами післяопераційного патоморфологічного дослідження біологічний матеріал мав вигляд однорідного солідного скупчення дрібних круглих проліферувальних клітин (рис. 2А та Б). Дані імуногістохімічного дослідження: виявлені пухлинні маркери CD99 (рис. 2В) та віментин (рис. 2Г). Метод флуоресцентної гібридизації in situ (FISH): виявлений перерваний ген EWS у пухлинних клітинах, що свідчить про його перебудову. За результатами МРТ, солідна пухлина розміром 16 мм також виявлена у крижовій кістці справа. Дані рентгенографії (Rh) органів грудної клітки (ОГК) – без змін (рис. 3А); комп’ютерна томографія (КТ) ОГК – мікронодулярне ураження нижньої частки лівої легені (рис. 3Г).
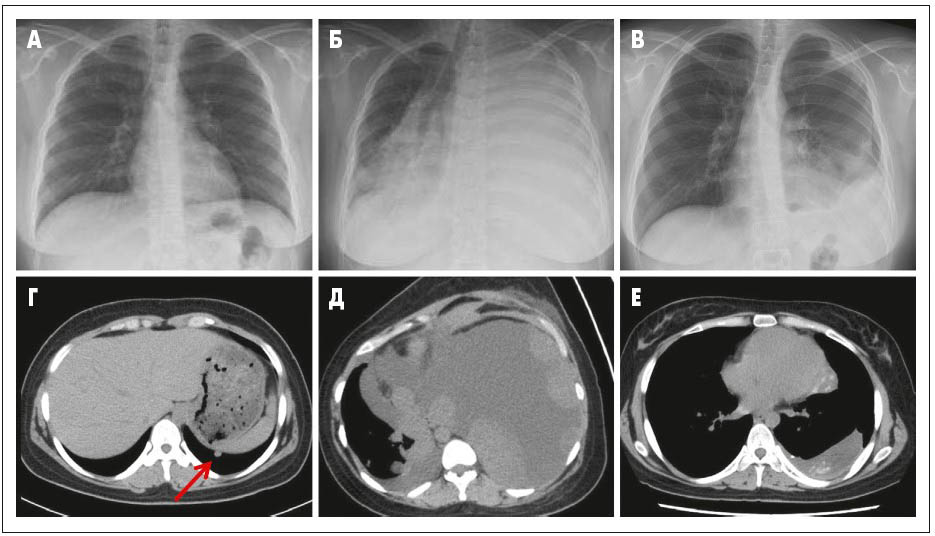 Рис. 3. Візуалізаційні методи дослідження, використані під час лікування пацієнтки. А – Rh ОГК: патологічних змін не виявлено; Б – Rh ОГК: гомогенне затемнення зліва, початок лікування пазопанібом; В – Rh ОГК – зменшення розміру пухлини через 11 міс прийому пазопанібу; Г – КТ: мікронодулярне ураження нижньої частки лівої легені; Д – КТ: масивний плевральний випіт і множинні пухлини у лівій половині грудної клітки перед початком лікування пазопанібом; Е – КТ: зменшення розміру пухлини через 11 міс прийому пазопанібу
Рис. 3. Візуалізаційні методи дослідження, використані під час лікування пацієнтки. А – Rh ОГК: патологічних змін не виявлено; Б – Rh ОГК: гомогенне затемнення зліва, початок лікування пазопанібом; В – Rh ОГК – зменшення розміру пухлини через 11 міс прийому пазопанібу; Г – КТ: мікронодулярне ураження нижньої частки лівої легені; Д – КТ: масивний плевральний випіт і множинні пухлини у лівій половині грудної клітки перед початком лікування пазопанібом; Е – КТ: зменшення розміру пухлини через 11 міс прийому пазопанібу
Діагноз: первинна вагінальна саркома Юїнга з метастазами у крижовій кістці та легені.
Пацієнтка отримала таке лікування: 6 циклів хіміотерапії з вінкристином (2 мг/м2 площі поверхні тіла), доксорубіцином (75 мг/м2 або актиноміцином D 1,25 мг/м2) та циклофосфамідом (1200 мг/м2) – 1-го дня кожного циклу (VDC), чергуючи з 5 циклами іфосфаміду 1800 мг/м2 та етопозиду (100 мг/м2) у 1‑5‑й день через кожні 3 тижні (IE). Доксорубіцин було замінено на актиноміцин D (1,25 мг/м2) після того, як сумарна доза першого досягла 375 мг/м2. Попередньо пацієнтка відмовилася від хірургічного лікування. Згодом хвора отримала курс променевої терапії з приводу залишкової пухлини таза.
Результати контрольних КТ і МРТ підтвердили часткову ремісію захворювання, проте через виражені побічні ефекти (нудоту та втому) хвора відмовилася від подальшого проведення хіміотерапії. Через 6 міс після припинення фази ініціації у грудній клітці зліва розвинулися метастази, з приводу яких пацієнтці була призначена хіміотерапія, що включала 1 цикл гемцитабіну (675 мг/м2 у 1 та 8-й дні) та доцетакселу (75 мг/м2 у 8-й день), а також 1 цикл карбоплатину (300 мг/м2 у 1‑2‑й день) та етопозиду (100 мг/м2 у 1‑5‑й день), проте нові пухлини не відповідали на проведену терапію. Через 2 міс хвору почала турбувати інтенсивна задишка, через яку вона погодилася на терапію пазопанібом (800 мг/день).
На тлі прийому пазопанібу виявлене регресування пухлин і зменшення задишки. Через 9 міс лікування була проведена контрольна позитронно-емісійна томографія (ПЕТ), за результатами якої у пацієнтки відзначили повне регресування пухлини (рис. 3 В-Е). На момент написання цієї статті пацієнтка отримує лікування пазопанібом протягом 26 міс. На цей час не було виявлено рецидиву захворювання, єдиним несприятливим явищем, пов’язаним із терапією, є легкі прояви синдрому «кисть – стопа» та втома (ступінь 2).
Обговорення
Стандартом хіміотерапевтичного лікування при саркомі Юїнга є схема VDC і актиноміцин D , що чергується зі схемою ІЕ. Проте використання цих терапевтичних схем асоціюється з частим виникненням тяжких побічних ефектів.
Основну терапевтичну мішень при саркомі Юїнга становить химерний онкоген EWS‑FLI1, який є результатом транслокації між генами. Як можливі терапевтичні напрями досліджувалися нові агенти, які інгібують синтез білка EWS-FLI1, проте результати більшості випробувань були незадовільними. Новими мішенями терапії при саркомі Юїнга є ангіогенні шляхи, mTOR та шлях інсуліноподібного фактора росту (IGF‑1), кісткове мікросередовище, шлях полі(АДФ-рибоза)-полімерази 1 (PARP1), гангліозидні шляхи GD2. У попередніх клінічних дослідженнях встановлено, що перспективними терапевтичними мішенями при саркомі Юїнга є судинний фактор росту ендотелію A (VEGF-A) та фактор росту тромбоцитів (PDGF). Ці відомості дають підставу припустити, що ангіогенний шлях є потенційною мішенню терапевтичного впливу при цьому захворюванні.
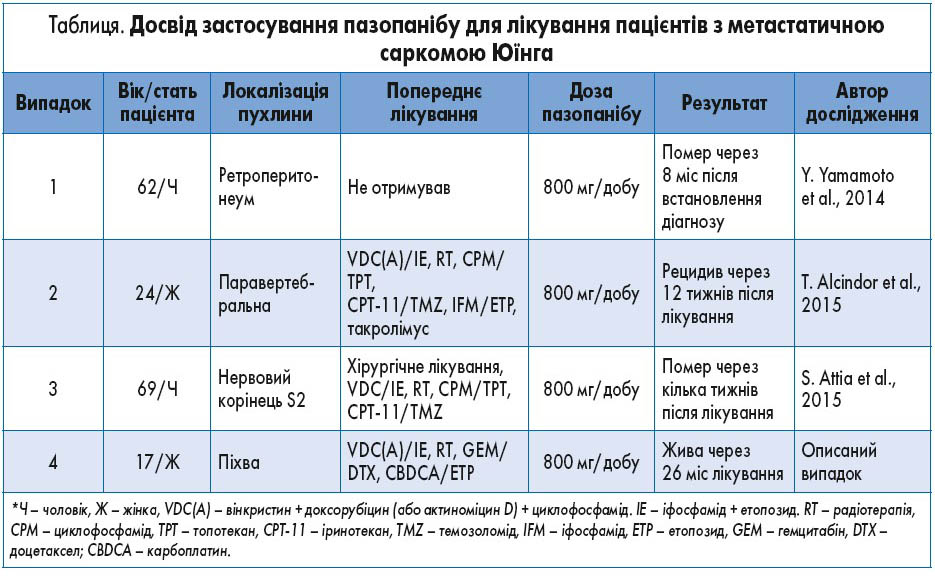
Сьогодні пазопаніб не входить у стандарти лікування при саркомі Юїнга. У таблиці наведено відомості про клінічні випадки лікування саркоми Юїнга пазопанібом.
У цьому клінічному випадку після початку прийому пазопанібу настало різке поліпшення стану хворої з повним регресуванням пухлини за даними ПЕТ з мінімальними побічними ефектами порівняно з такими у пацієнтів, які отримують радіо- та хіміотерапію. Така локалізація пухлини є дуже рідкісною. Зазвичай саркома Юїнга локалізується у довгих трубчастих кістках, позакісткові форми – у глибоких м’яких тканинах кінцівок, ретроперитонеумі, грудній клітці. В літературі описані поодинокі випадки саркоми Юїнга з локалізацією в яєчнику чи матці. Первинна вагінальна саркома Юїнга зустрічається вкрай рідко, має більш сприятливий перебіг порівняно з іншими локалізаціями, що, ймовірно, пов’язано з ранньою діагностикою та кращою доступністю пухлини для проведення резекції.
Таким чином, наведений клінічний випадок метастатичної позакісткової саркоми Юїнга, яку успішно лікували пазопанібом, є підставою для проведення подальших досліджень у цьому напрямі (зокрема, вивчення механізмів, які лежать в основі ефективності пазопанібу при лікуванні саркоми Юїнга, та виділення біомаркерів для прогнозування терапевтичної ефективності пазопанібу).
За матеріалами: Intern Med. 2018; 57: 2753-2757. Doi: 10.2169/internalmedicine.9879-17.
Переклала з англ. Ілона Цюпа
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 1 (62), 2020 р.