9 березня, 2019
Хронічний панкреатит при коморбідному перебігу з ішемічною хворобою серця: особливості фармакотерапії
 Відсутність значного прогресу в лікуванні хронічного панкреатиту (ХП), особливо на тлі коморбідної патології з ішемічною хворобою серця (ІХС), пов’язана зі складною симптоматикою та з великою варіабельністю клінічної картини, широким діапазоном морфологічних змін підшлункової залози (ПЗ), системним характером ураження і тяжким перебігом цих захворювань. Саме коморбідність ХП та ІХС створює умови, за яких нервово-рефлекторні больові реакції та харчове навантаження провокують ангінальний біль. Однак у пацієнтів з ІХС і атеросклерозом черевної та інших артерій черевної порожнини також спостерігаються інтенсивні больові відчуття і зниження толерантності до фізичного навантаження (внаслідок вісцеровісцеральних рефлексів та патологічної постпрандіальної гемодинамічної реакції). Наявність у пацієнта коморбідної патології зумовлює необхідність комплексного лікування, яке передбачає дію на етіологічні та патогенетичні ланки патологічного процесу за допомогою диференційованого застосування мінімальної кількості медикаментозних засобів.
Відсутність значного прогресу в лікуванні хронічного панкреатиту (ХП), особливо на тлі коморбідної патології з ішемічною хворобою серця (ІХС), пов’язана зі складною симптоматикою та з великою варіабельністю клінічної картини, широким діапазоном морфологічних змін підшлункової залози (ПЗ), системним характером ураження і тяжким перебігом цих захворювань. Саме коморбідність ХП та ІХС створює умови, за яких нервово-рефлекторні больові реакції та харчове навантаження провокують ангінальний біль. Однак у пацієнтів з ІХС і атеросклерозом черевної та інших артерій черевної порожнини також спостерігаються інтенсивні больові відчуття і зниження толерантності до фізичного навантаження (внаслідок вісцеровісцеральних рефлексів та патологічної постпрандіальної гемодинамічної реакції). Наявність у пацієнта коморбідної патології зумовлює необхідність комплексного лікування, яке передбачає дію на етіологічні та патогенетичні ланки патологічного процесу за допомогою диференційованого застосування мінімальної кількості медикаментозних засобів.
Базисна фармакотерапія ХП, яку проводять з метою запобігти розвитку інфекційно-гнійних ускладнень, включає антибактеріальні засоби (за необхідності). За показаннями для забезпечення функціонального спокою ПЗ використовують регуляторні пептиди (соматостатин, сандостатин, октреотид, стиламін, даларгін) [1], а також препарати, які пригнічують секретинову стимуляцію ПЗ, – блокатори Н2-гістамінових рецепторів (ранітидин, фамотидин) та інгібітори протонної помпи (ІПП; езомепразол, рабепразол, пантопразол) [2, 3].
Мета протисекреторної терапії при ХП – зменшити пошкоджуючу дію на слизову оболонку шлунка та дванадцятипалої кишки хлористоводневої кислоти та пепсину, які сприяють підвищенню кислотності.Блокатори Н2-гістамінових рецепторів забезпечують активне відновлення кореляційних зв’язків між утриманням гістаміну та серотоніну у сироватці крові, гістаміну і трипсину у панкреатичному секреті, а також нормалізацію амілолітичної та протеолітичної функцій ПЗ. Препарати цієї групи ефективно знижують секрецію соляної кислоти у шлунку (базальну, нічну, стимульовану їжею та лікарськими препаратами), гальмують секрецію пепсину, при цьому не пошкоджують ацинарні клітини ПЗ. Тривалість терапевтичного ефекту залежно від дози препарату становить від 12 до 18 год.
У лікуванні кислотозалежної патології починаючи з 90-х рр. ХХ ст. розпочалася епоха використання ІПП як протисекреторної монотерапії. На сучасному етапі ця стратегія лікування захворювань цієї групи є основною. Один із механізмів дії ІПП полягає у пригніченні активності аденозинтрифосфатази (АТФ-ази) у парієтальних клітинах шлунка та припиненні заключної стадії секреції хлористоводневої кислоти.
Слід враховувати те, що ефективність ІПП залежить від генотипу цитохрому Р450. Пацієнтів із кислотозалежною патологією залежно від генотипу CYP2C19, який визначає активність ферментів, розподіляють на 3 групи: I група – «швидких метаболізаторів» (з підвищеною активністю ферментів), II група – «середніх метаболізаторів» (із середньою), III група – «повільних метаболізаторів» (зі зниженою). Від групи, до якої належить пацієнт, також залежить проведення антихелікобактерної терапії з підвищенням дози ІПП або використання ІПП за типом метаболізму, не пов’язаним із генетичним поліморфізмом CYP2C19.
Після прийому першої дози ІПП істотне значення має встановлення стабільного кислотосупресивного ефекту відповідно до рівня рН протягом доби. Так, застосування ІПП забезпечує: рубцювання виразкового дефекту при рН >3 протягом 16-18 год, терапевтичний ефект при рН >4 протягом 18 год при гастроезофагеальній рефлюксній хворобі (ГЕРХ), ерадикацію Helicobacter pylori при рН >5 протягом 6-8 год.
Згідно з рекомендаціями Маастрихту V перше місце у терапії ІПП займає езомепразол, друге – рабепразол і пантопразол незважаючи на те, що кожний із цих препаратів має свою нішу ефективності застосування. Призначення езомепразолу при ІХС, особливо у поєднанні з ГЕРХ (спостерігається у більшості пацієнтів), усуває нічні симптоми (у тому числі печію), забезпечує високу частоту загоєння ерозій, що покращує якість життя хворого.
У пацієнтів із коморбідною патологією ХП та ІХС, яка супроводжується порушеннями функції печінки (легкого або середнього ступеня тяжкості), езомепразол завдяки своїм фармакокінетичним властивостям усуває необхідність корекції дози цього препарату, що особливо важливо для осіб літнього віку. Однак у низці рекомендацій вказано, що при найменших порушеннях функції печінки необхідно призначати пантопразол через його незначний вплив на метаболізм інших лікарських засобів [3]. Якщо пацієнту з ІХС призначено клопідогрель, то рекомендується використовувати саме пантопразол, тому що він не зв’язується (або слабко зв’язується) із системою цитохрому Р450. У клінічній практиці найчастіше застосовують пантопразол, який забезпечує купірування атак, функціональний спокій ПЗ, нормалізує її зовнішньосекреторну функцію, запобігає потраплянню ферментів у кровообіг. Завдяки цим ефектам препарату істотно покращується якість життя пацієнтів із ХП.
Високу ефективність у лікуванні ГЕРХ, рефлюкс-езофагіту, у профілактиці гастропатій, індукованих нестероїдними протизапальними препаратами (НПЗП), при виразках, спричинених тривалим використанням НПЗП, гіперсекреторних станах (у тому числі синдромі Золлінгера – Еллісона, ХП), у профілактиці виникнення стресових виразок, підтриманні гомеостазу і профілактиці повторних кровотеч із пептичних «німих» виразок (які часто спостерігаються у пацієнтів із ІХС) демонструє езомепразол. Тривалість курсу лікування лікар визначає індивідуально у кожному конкретному випадку. Наприклад, пацієнтам із ГЕРХ у поєднанні з ІХС за наявності ерозивного рефлюкс-езофагіту езомепразол призначають у дозі 40 мг 1 р/добу впродовж 4 тижнів, за відсутності терапевтичного ефекту курс лікування подовжують ще на 4 тижні. При прийомі препарату необхідно дотримуватися таких правил: ковтати таблетки цілими (не розжовувати) за 1 год до їди, запивати достатньою кількістю води.
Якщо у пацієнта з ХП, особливо у поєднанні з ГЕРХ, не досягнуто належної відповіді на лікування стартовим ІПП, частоту та час прийому препарату рекомендують підбирати індивідуально. Підвищення дози препарату або його заміна може забезпечити додатковий терапевтичний ефект.
У лікуванні ХП аналгетиками першого вибору є саліцилати та ацетамінофени. Часте використання парацетамолу у таких пацієнтів зумовлено його мінімальним пошкоджуючим впливом на слизову оболонку шлунка [4]. Парацетамол чинить енергетичний, антипіретичний та протизапальний ефекти. Окрім цього, його застосування забезпечує зниження інтенсивності перекисного окислення ліпідів (ПОЛ), підвищення секреції інтерлейкіну‑6, контроль впливу основного фактора росту фібробластів на фіброзування ПЗ [4]. Проте призначати парацетамол слід з обережністю, враховуючи його можливу побічну дію.
Для купірування больового синдрому використовують комбінацію ненаркотичних аналгетиків та спазмолітиків. Медикаментозна терапія включає також регулятори моторики – спазмолітики (короткої та пролонгованої дії) та/або прокінетики (домперидон, мозаприд та ін.), ферментні засоби, які містять панкреатин, ліпазу, амілазу, протеазу, у відповідному дозуванні залежно від ступеня зовнішньосекреторної недостатності ПЗ та доступності для пацієнта [5]. При загостренні ХП замісна терапія за механізмом зворотного зв’язку знижує панкреатичну секрецію, а в стадії ремісії усуває порушення абсорбції жирів, білків та вуглеводів, що сприяє покращенню їх обміну, зокрема, у пацієнтів з ІХС та атеросклерозом. Клінічна ефективність препаратів панкреатину є вищою у хворих без гіперпластичних та кістозних змін [6].
Дисфункція сфінктера Одді при коморбідній патології ХП та ІХС часто спричиняє біль біліарного типу у правому підребер’ї, можливо, через анатомічний зв’язок головної панкреатичної протоки з жовчовивідними шляхами. Розрізняють 2 типи порушення тонусу сфінктера Одді – гіпо- та гіпертонус. При порушенні I типу відбувається рефлюкс дуоденального вмісту в загальну жовчну та панкреатичну протоки, що призводить до розвитку запального процесу у ПЗ та жовчних шляхах. При порушенні II типу утруднюється вихід жовчі та панкреатичного секрету у дванадцятипалу кишку, підвищується тиск у загальній жовчній та панкреатичній протоках і, як наслідок, збільшується вираженість больового синдрому. При цьому тривалий спазм сфінктера Одді призводить до порушення відтоку не тільки жовчі, а й панкреатичного соку, що може стати причиною розвитку ХП або його загострення. Тому усунення спазму сфінктера Одді та нормалізація відтоку жовчі – важливі фактори нормального функціонування внутрішньо- та зовнішньопечінкових жовчних проток, що є профілактикою розвитку жовчнокам’яної хвороби, холангіту, біліарного панкреатиту. У таких пацієнтів застосування спазмолітиків мебеверину та прифінію броміду може бути ефективним у комплексі зі знеболювальною терапією [3, 5].
У пацієнтів із ХП часто зустрічаються порушення моторики травного тракту, які мають різноспрямований характер і проявляються розладами як акомодації шлунка, так і евакуації шлункового вмісту. Крім цього, приблизно 20% хворих мають синдром подразненого кишечнику (СПК). У випадках коморбідної патології добре себе зарекомендував отилонію бромід: він зменшує абдомінальний біль та здуття живота і запобігає загостренню СПК після відміни препарату. Високоселективний спазмолітик отилонію бромід у комбінації з антифлатулентом флороглюцинолом дигідратом також зменшує біль у кишечнику при порушенні дефекації та здутті живота. До того ж на тлі його застосування зменшуються біль в епігастральній ділянці, нудота та відчуття постпрандіального переповнення і раннього насичення.
Таким чином, найвищої ефективності медикаментозної терапії можна досягти у пацієнтів із порушенням акомодації шлунка та вісцеральною гіперчутливістю. Хворі по-різному реагують на одноразове курсове призначення цих засобів, що, зокрема, залежить від періодичності появи симптомів (рідко, час від часу, постійно) та їх інтенсивності (легкого, середнього, високого ступеня). Домінуючий симптом диктує вибір відповідного препарату. Спазмолітики, проносні засоби (при запорах), лоперамід (при діареї) призначають одноразово, коротким курсом або протягом тривалого часу. Прокінетики не підходять для одноразового прийому, оскільки ефекти цих препаратів реалізуються поступово (протягом кількох днів чи тижнів). У разі ефективності лікування його можна призупинити. Якщо розвинувся рецидив, слід продовжити терапію препаратом, який призначили раніше. У стадії ремісії лікування не проводять [4].
Для біліарного панкреатиту характерні вторинна зовнішньосекреторна недостатність ПЗ та хронічна біліарна недостатність, які спричинені асинхронізмом надходження жовчі та панкреатичного соку у дванадцятипалу кишку. Виділяють 3 патогенетичні механізми біліарного панкреатиту: недостатню активацію панкреатичної ліпази, ацидифікацію дванадцятипалої кишки (інактивацію ліпази), порушення емульгації жирів та формування міцел. Саме тому у лікуванні пацієнтів із біліарним ХП використовують урсодезоксихолеву кислоту (УДХК), яка має властивість інгібувати скоротливу активність жовчного міхура, панкреатичну секрецію та викид панкреатичного поліпептиду (РР) і при цьому не впливає на антродуоденальну моторику, що забезпечує функціональний спокій органів біліарно-панкреатичної зони у міжтравний період. Застосування УДХК у пацієнтів із ЦД та ІХС також знижує рівень глюкози у крові за рахунок збільшення кількості секреторних гранул у β-клітинах і, відповідно, підвищення продукції інсуліну [5]. До того ж УДХК сприяє виведенню екзогенного холестерину з кишечнику, що забезпечує усунення гіперліпідемії [3, 6], і це має вкрай важливе значення, оскільки уповільнює прогресування цих захворювань.
У пацієнтів із фіброзно-інфільтративною формою ХП, із коморбідністю з неерозивною формою ГЕРХ, функціональною диспепсією, у лікуванні яких використовують монотерапію ІПП, розвиваються порушення функціонального стану захисного бар’єра слизової оболонки шлунка та характерні для атрофії гістологічні зміни. Такі самі патологічні процеси можуть супроводжувати НПЗП-індуковані гастропатії, гастропатії на тлі ЦД 2 типу, ІХС у курців, застосування медикаментозних засобів.
У таких випадках проводять гастропротекторну терапію депротеїнізованим гемодериватом із крові телят, лікарськими засобами, які містять у своєму складі меглюміну натрію сукцинат, натрію хлорид, калію хлорид, магнію хлориду гексагідрат, сукральфат, метіонін та його похідні (S-метилметіонін – вітамін U). За результатами досліджень, проведених у 1970-х рр., встановлено, що використання вітаміну U протягом 1 місяця сприяло прискореній репарації слизової оболонки верхніх відділів травного тракту і покращувало зовнішньосекреторну функцію ПЗ [26].
Сьогодні в Україні доступні засоби, які містять метилметіонінсульфонію хлорид (вітамін U) у комбінації з іншими корисними компонентами (наприклад, з декспантенолом, який є коферментом вітаміну В5). Вітамін U є донатором метильних груп, трансформується в активну форму метіоніну (метіонін-S-аденозилметилметіонін), що забезпечує його позитивний вплив на функції печінки, жовчного міхура, кишечнику. Цей вітамін – «будівельний матеріал» для відновлення білків клітин. Провітамін В5 бере участь в енергетичному забезпеченні клітини за рахунок підвищення синтезу аденозинтрифосфату (АТФ), біосинтезу жирних кислот, кортикостероїдів, ацетилхоліну, що сприяє відновленню перистальтики кишечнику. Крім того, він зв’язує ксенобіотики, інактивує їх та елімінує з клітини. Необхідно також враховувати те, що недостатність вітаміну В5 зумовлює підвищення продукції хлористоводневої кислоти у 2-3 рази. Тому використання пантотенової кислоти (одночасно зі стимуляцією репаративних процесів) нормалізує секреторну функцію ПЗ, що забезпечує ефективність лікування або реабілітації (у післяопераційний період).
У клінічній практиці як гастропротектор широко використовують ребаміпід, який забезпечує цитопротекцію на всій протяжності травного каналу, тобто надійний захист слизової оболонки шлунка та кишечнику від пошкоджуючого впливу. Так, застосування цього препарату у пацієнтів із коморбідною патологією ХП та ГЕРХ запобігає загостренню захворювань та знижує частоту ускладнень. За наявності ерозій та виразок при хронічному гастродуоденіті та хронічному гастриті він прискорює епітелізацію слизової оболонки шлунка та дванадцятипалої кишки. Доведено, що ребаміпід значно знижує ризик злоякісного перетворення хронічного гастриту у рак шлунка.
Вираженими гастропротекторними властивостями володіють засоби рослинного походження. Серед компонентів таких засобів – представники роду Opuntia (родина кактусових), які завдяки високому вмісту клейких речовин та пектинів чинять не тільки гастропротекторну, а й знеболювальну дію; листя та кора оливи – знешкоджує інфекційні агенти; сухий екстракт кореня солодки – завдяки гліциризиновій кислоті має протизапальний, протиерозивний та гастропротекторний ефекти; ківі, який завдяки поєднанню аскорбінової кислоти, вітаміну Е, калію, міді, заліза та ферменту актинідину покращує перетравлення протеїнів; м’ята – як засіб профілактики метеоризму та диспепсичного шлункового синдрому.
Особливості фармакотерапії ІХС при коморбідному перебігу з ХП
На рисунку представлений алгоритм тактики ведення пацієнта з ІХС при коморбідності з ХП. Базисна терапія ІХС включає статини [7], дія препаратів цієї групи спрямована на контроль розвитку кардіоваскулярних подій, що пов’язані з обміном ліпідів, на досягнення первинної мети – зниження рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) шляхом інгібування 3-гідрокси‑3-метилглутарил-коензим-А-редуктази (ГМГ-КоА-редуктази), яка бере участь у синтезі ХС у печінці. Найчастіше використовують аторвастатин (10 мг 2 р/добу) або розувастатин. Проте тривала терапія статинами призводить до загострення мезенхімально-запального синдрому у печінці, сприяє прогресуванню стеатозу та фіброзу печінки, що зумовлює необхідність застосування гепатопротекторів, у тому числі тих, які мають виражений антиоксидантний ефект.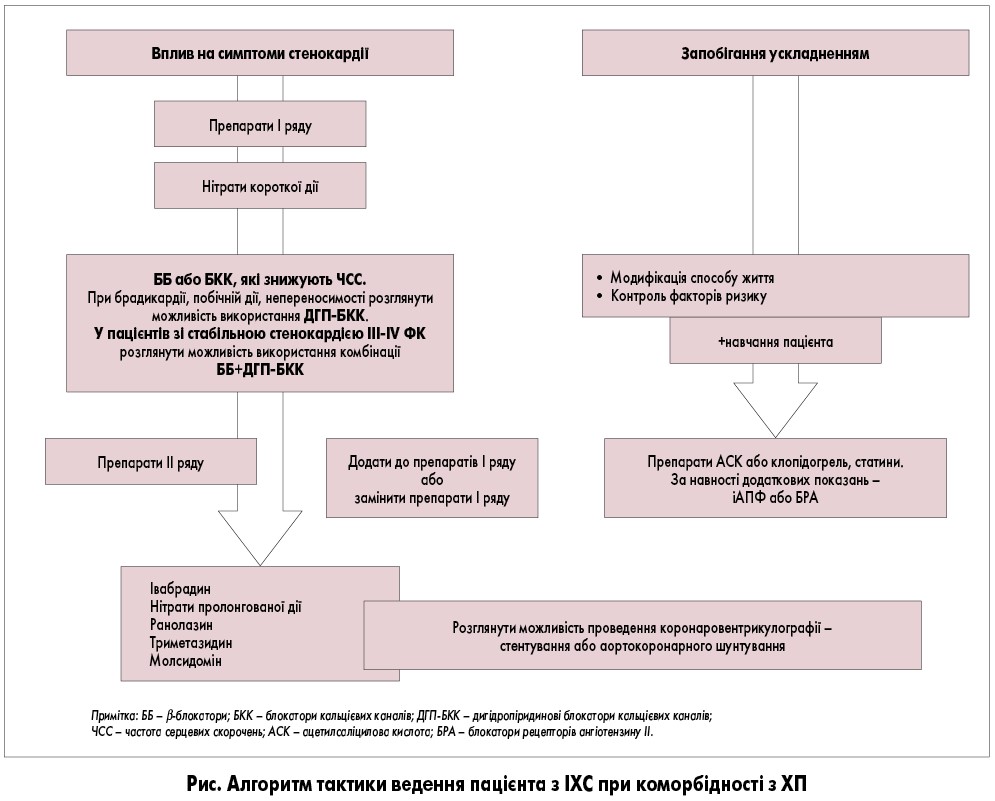
Пацієнтам із ХП (навіть у стадії ремісії) за наявності інсулінорезистентності, в яких низький рівень холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) та гіпертригліцеридемія 5,7-10 ммоль/л, можна призначати фібрати та нікотинову кислоту або самостійно, або у комбінації з аторвастатином (з обережністю з огляду на ризик розвитку міопатії) [8]. Відомо, що нікотинова кислота у поєднанні з аторвастатином, яка метаболізується у печінці за участі ізоферменту 3А4 цитохрому Р450, сприяє розвитку міопатії [9].
У зв’язку з підвищенням загального периферичного опору судин внаслідок рефлекторної активації ренін-ангіотензин-альдостеронової системи (РААС) і симпатоадреналової системи (САС) у відповідь на зменшення серцевого викиду при хронічній серцевій недостатності (ХСН) доцільно використовувати селективні блокатори β1-адренорецепторів, які блокують гіперактивність САС та чинять мінімальний вплив на β2- і β3-адренорецептори [9]. У пацієнтів із коморбідністю ХП із ІХС і ХСН доцільно застосовувати небіволол, особливо із захворюванням середнього ступеня тяжкості, якщо ХСН має ішемічний генез – інгібітори ангіотензинперетворюючого ферменту (іАПФ), у разі затримки рідини необхідно використовувати діуретичні засоби – фуросемід або торасемід [10].
З метою забезпечення цитопротективного ефекту клітин міокарда в умовах ішемії застосовують парціальні інгібітори жирних кислот (partial fatty acid oxidation inhibitors – pFOX). Представники цієї групи препаратів уповільнюють окислення жирних кислот у мітохондріях (наприклад, триметазидин) або обмежують транспорт жирних кислот через їх мембрани. Результати проспективного рандомізованого подвійного сліпого плацебо-контрольованого клінічного дослідження ІІІ фази MILSSII (2010) продемонстрували, що у пацієнтів, які отримували pFOX, після лікування тривалість фізичного навантаження подовжилась на 10% порівняно з показниками у групі плацебо. До того ж препарати цієї групи покращують якість життя пацієнтів з ІХС. За наявності у таких хворих ХСН терапія pFOX покращує гемодинаміку та підвищує толерантність до фізичного навантаження.
Слід враховувати гендерні особливості перебігу ІХС, у тому числі при коморбідності з ХСН. Вони проявляються у тому, що у жінок частіше розвивається такий тип дисфункції лівого шлуночка (ЛШ), як діастолічна дисфункція ЛШ, при незміненій фракції серцевого викиду. Потрібно також зважати на те, що ХСН маніфестує у жінок у більш похилому віці.
Препарати першої лінії терапії у пацієнтів зі зниженою систолічною функцією ЛШ – це іАПФ. Згідно з даними, отриманими у дослідженні CONSENSUS (Cooperative North Scandinavian Enalapril Survival Study), у результаті використання еналаприлу смертність у чоловіків знизилась на 51%, а у жінок – лише на 6%. Таку різницю показників в осіб різної статі можна пояснити меншою вираженістю постінфарктної гіпертрофії міокарда, а також дією естрогенів, які деякою мірою нівелюють дію іАПФ у жінок. Однак у дослідженні AIRE (The Acute Infarction Ramipril Efficacy) було продемонстровано вищу ефективність раміприлу у жінок (виживаність після інфаркту міокарда у них збільшилась на 32%, а у чоловіків – на 25%).
Отже, препарати цієї групи необхідно призначати усім пацієнткам із систолічною дисфункцією ЛШ і, особливо, у постменопаузі та за наявності гіпертонічної хвороби. При веденні хворих із супутнім ХП слід враховувати ступінь зовнішньосекреторної недостатності ПЗ, оскільки іАПФ можуть посилювати інтенсивність диспепсичного та больового синдромів. У таких випадках можна призначати β-блокатори, найкраще – небіволол. У пацієнтів із ХСН ІІ-ІV ФК за NYHA (ішемічного та неішемічного генезу) при зниженні фракції серцевого викиду за відсутності протипоказань застосування препаратів цієї групи у комплексі з іАПФ та діуретиками є обов’язковим. До цього часу не встановлено переваги в ефективності використання блокаторів рецепторів до ангіотензину (БРА) [9, 10].
Терапію діуретиками призначають у випадках перевантаження системи кровообігу об’ємом рідини, що проявляється недостатністю кровообігу по малому колу і периферичними набряками. Антагоністи рецепторів альдостерону також призначають усім пацієнтам із ХСН ІІ-ІV ФК за NYHA, їх ефективність однакова як у жінок, так і у чоловіків. Дослідження з вивчення впливу дигоксину на смертність показало, що його застосування забезпечує зниження показників у чоловіків. Однак дигоксин рекомендується призначати усім пацієнтам із фібриляцією передсердь [10].
Інтенсивність хронічного оксидативного стресу має важливе значення у розвитку і прогресуванні ХП [11, 13] та ІХС [14] при коморбідній патології, тому що спричиняє через цитокінову ланку дисбаланс секреторних та інкреторних механізмів прогресування фіброзу ПЗ, міокарда, печінки [15]. Розвиток супутніх порушень обміну речовин і тканинної гіпоксії ще більшою мірою погіршує функціональний стан антиоксидантної системи захисту [16, 17].
Певну роль відіграє також тривала гіперінсулінемія, яка може бути компенсаторною у пацієнтів із коморбідністю ХП та ІХС. На тлі цього патологічного стану відбувається звуження просвіту артеріол завдяки проліферації гладеньком’язових клітин, розвиваються порушення кровообігу у ПЗ, міокарді та печінці, що призводить до дистрофічних змін їх паренхіми [18]. У таких пацієнтів терапевтичні заходи насамперед спрямовані на лікування кардіальної патології, при цьому не враховують побічну дію β-блокаторів, антагоністів кальцію, серцевих глікозидів, статинів, які сприяють розвитку інсулінорезистентності, прогресуванню хронічної запальної реакції як у печінці, так і в ПЗ [19].
У випадках коморбідного перебігу ХП та ІХС застосування у комплексному лікуванні препаратів антиоксидантної дії є ефективним [20-22]. Проведення такої терапії для зменшення інтенсивності больового синдрому рекомендують експерти робочої групи з діагностики та лікування Іспанського панкреатологічного клубу (2013) і провідні фахівці Німеччини, Австрії та Швейцарії (рекомендації 2013 року). Так, враховуючи зниження активності механізмів регуляції, особливості виникнення та перебігу гіпоксії, атеросклерозу, незадовільний стан імунологічного гомеостазу та мікроциркуляції, виникає необхідність у призначенні детоксикаційної та цитопротекторної терапії (антиоксидантів) та застосуванні засобів, які нормалізують ендотеліальну функцію та покращують стан не тільки кардіоміоцитів, а й панкреоцитів [23-25].
Отже, невід’ємна складова лікування ХП – використання засобів з антиоксидантною дією (токоферолу, унітіолу, β-каротину, вітаміну С) [29]. Комбінація антиоксидантів – вітамінів С, Е, ліпоєвої кислоти – як засіб профілактики прогресування ХП та ІХС у курців більш ефективна, ніж монотерапія вітаміном С [27, 28].
В антиоксидантному захисті клітин значну роль відіграє L-глютамін, який складається з глютаміну, цистеїну та гліцину. Він знаходиться у кожній клітині організму. У свою чергу, глутатіонзалежні ферменти діють в органелах, у тому числі в ядрі, мітохондріях та ендоплазматичному ретикулумі. Система глутатіону бере участь у трьох із чотирьох ліній антиоксидантного захисту. На першій лінії супероксиддисмутаза відновлює вільні радикали кисню, утворюючи пероксиди та воду. На другій лінії каталаза і глутатіонпероксидаза відновлює органічні пероксиди, які утворюються у результаті перекисного окислення ліпідів. На третій та четвертій лінії глутатіонтрансфераза каталізує відновлення глутатіону з різних пошкоджуючих радикалів, ксенобіотиків, утворюючи нетоксичні кон’югати.
Серед препаратів з антиоксидантною дією, які можуть бути корисними у лікуванні пацієнтів з коморбідною патологією ХП та ІХС, особливо із хронічними, гіпоксичними процесами у тканинах міокарда та ПЗ, варто звернути особливу увагу на антиоксиданти на основі бурштинової кислоти, яка є універсальним метаболітом [13]. Бурштинова кислота швидко окислюється сукцинатдегідрогеназою. Ця реакція отримала назву «монополізація дихального ланцюга», її біологічне значення полягає у відновленні важливого фермента цитохромоксидази і швидкому ресинтезі АТФ. Завдяки цьому забезпечується протиішемічна дія. Бурштинова кислота нормалізує рівень гістаміну, серотоніну, покращує мікроциркуляцію в органах і тканинах, при цьому не впливає на артеріальний тиск і функціональні показники міокарда, тобто відіграє роль енергокоректора. Енергокорекція забезпечує посилення захисних механізмів та підвищення резистентності до проявів оксидативного стресу за рахунок активації власних протиоксидантних систем організму. Реалізація основного ефекту бурштинової кислоти є кращою при її одночасному застосуванні з іншими активними компонентами: рибоксином, нікотинамідом (вітаміном РР), рибофлавіном (вітаміном В2). Рибофлавін бере участь у реакціях, реагентом яких є бурштинова кислота. Нікотинамід при гіпоксії активує антиоксидантні системи убіхінону – селективного інгібітора ферменту полі-АДФ-рибозилсинтетази, який при ішемії призводить до дисфункції внутрішньоклітинних білків та апоптозу. Рибоксин (інозит) завдяки тому, що є донатором рибози, стимулює анаеробний гліколіз, інгібує активність ксантиноксидази та вільних радикалів, активізує мітохондріальне дихання.
Впродовж останніх років значно зріс науковий інтерес до вивчення впливу біофлавоноїдів на перебіг поєднаних захворювань. Одним із представників цієї групи препаратів є кверцетин. Кверцетин – 3,5,7,3,4-пентагідроксифлавон – аглікон флавоноїдного глікозиду рутину [26]. Серед флавоноїдних сполук кверцетин чинить найбільш потужну протиоксидантну дію. Встановлено, що за рахунок раціонального поєднання та особливостей електронної та стереохімічної будови вуглецевого скелета, а також розміщення в ньому кисневмісних замісників у молекулах флавоноїдних сполук є система сайтів, яка забезпечує багатофункціональність механізму їх антиоксидантної дії [11]. Насамперед йдеться про дію на рівні мітохондрій, які є тими субклітинними структурами, від яких залежить характер запалення, оскільки вони продукують аденозинтрифосфат (АТФ).
Механізм антиоксидантної дії є подібним до такого супероксиддисмутази. Кверцетин пригнічує продукцію супероксидних аніон-радикалів. Доведено, що він має властивість пригнічувати не тільки неферментативне, а й ферментативне ПОЛ. Окрім цього, кверцетин запобігає окисненню аскорбінової кислоти та адреналіну, продукти окиснення яких здатні додатково активізувати ПОЛ. Цей представник біофлавоноїдів має виражений протизапальний та протиалергічний ефекти, які зумовлені блокуванням ферменту 5-ліпоксигенази, за рахунок чого знижується синтез лейкотрієнів з арахідонової кислоти. Крім того, кверцетин блокує протеїнкіназу С, кальмодулінзалежну протеїнкіназу, активує аденілатциклазний цикл, підвищує резистентність артерій та вен, що забезпечує зменшення їхньої ламкості та збільшення еластичності.
Враховуючи те, що серед компонентів клітини головне місце в антиоксидантному захисті займають субстрати окислення вільних радикалів, з метою впливу на них можна використовувати препарати есенціальних фосфоліпідів (EPL), основним активним компонентом яких є 1,2-дилінолеоїлфосфатидилхолін (DLPC).
У нормі в організмі людини вміст фосфатидилхолінів та лінолевої кислоти посідає 2-гу позицію, насичені або мононенасичені жирні кислоти – 1-шу позицію, і тільки невелику частку (трохи більше 1%) складають поліненасичені фосфатидилхоліни, наприклад DLPC. Завдяки введенню додаткової лінолевої кислоти на 1-шу позицію виходить додатковий зігнутий ланцюг жирної кислоти. Така молекула більш гнучка і займає більше простору у мембранах, ніж фосфатидилхолін з лінолевою кислотою тільки у 2-й позиції. Таким чином, у EPL за рахунок поліненасичених фосфатидилхолінів зменшується компактність мембрани, збільшується її гнучкість і текучість, що сприяє активації мембранозалежних процесів обміну речовин у клітині.
Отже, EPL – це універсальні цитопротектори, а не тільки гепатопротектори, що свідчить на користь доцільності їх ширшого використання у клінічній практиці: в пульмонологічній – при хронічних обструктивних захворюваннях легень (ХОЗЛ), коморбідності ХОЗЛ із гепатитами, гепатозами; в гастроентерологічній практиці – при ХП, коморбідності ХП із ІХС. EPL захищають мембрану клітин від пошкоджень, відновлюють пошкоджені структури мембран клітин за рахунок вбудовування їх молекул у мембрани та заповнення щілин у них, підвищують метаболічний, детоксикаційний, екскреторний потенціал мембран. Завдяки цим ефектам вони є своєрідним мембранним «клеєм». EPL гальмують синтез прозапальних цитокінів, забезпечують протиоксидантні властивості мембран, захищають мітохондріальні та мікросомальні ензими від пошкодження алкоголем або токсинами, уповільнюють синтез колагену, підвищують активність колагенази (гальмування фібринолізу), позитивно впливають на клітинний цикл, клітинну диференціацію та агрегацію еритроцитів і тромбоцитів, беруть участь у синтезі простагландинів, чинять гіполіпідемічний та гіпоглікемічний ефекти (підвищують чутливість інсулінових рецепторів), покращують функціонування транспортної системи гепатоцитів.
Усі перелічені властивості EPL обґрунтовують патогенетичну універсальність і доцільність їх включення у схеми комплексної терапії пацієнтів із коморбідною патологією ХП та ІХС. Отже, з метою захисту та покращення функції гепатоцитів, ентероцитів, міоцитів і панкреоцитів, які зазнають пошкоджень при коморбідності захворювань (особливо при ХСН), можна використовувати EPL. Важливо при цьому враховувати відсутність антагоністичної взаємодії з препаратами базисної терапії [13].
Пацієнти з коморбідним перебігом ХП та ІХС можуть мати жирову хворобу печінки різного генезу (в тому числі алкогольного, вірусного). Незалежно від етіологічного фактора захворювання таким хворим доцільно проводити метаболічну терапію. Так, у результаті застосування пентоксифіліну завдяки покращенню мікроциркуляції, інгібуванню фосфодіестерази, регулюванню рівня циклічних нуклеотидів та цитокінів знижується вираженість хронічного генералізованого низькоінтенсивного запалення. Пентоксифілін – один із патогенетичних засобів і в лікуванні ХП при коморбідності з ІХС.
Результати багатьох клінічних досліджень підтверджують ефективність використання S-адеметіоніну у лікуванні коморбідної патології ХП та ІХС. Він знижує рівень білірубіну, трансаміназ, гамма-глутамілтрансферази у сироватці крові, пригнічує фіброгенез, зменшує інтенсивність стеатозу, некрозу гепатоцитів та панкреоцитів. У дослідженнях, які провели північноамериканські та українські вчені, показано, що використання S-адеметіоніну є ефективним у лікуванні пацієнтів із хронічним алкогольним та вірусним панкреатитом.
У лікуванні цих захворювань важливе місце займають гепатопротектори рослинного походження, у тому числі на основі розторопші плямистої, яка містить силібінін, що чинить потужну антиоксидантну дію. Використання силімарину при супутньому ЦД і цирозі печінки знижує потребу в інсуліні. Зважаючи на це, препарати розторопші плямистої можуть бути корисними у лікуванні пацієнтів із ХП та ІХС, оскільки локалізують запальний процес у тканинах, дають змогу запобігти пошкодженню і фіброзуванню зірчастих клітин. Ці препарати покращують обмін ліпідів, у тому числі при ліпоматозі ПЗ (спостерігається у 30% хворих на ХП із супутньою ІХС), блокують ангіогенез і ріст пухлинних клітин у печінці та молочній залозі. Проте, враховуючи те, що силімарин покращує синтез білка, основними механізмами дії препарату є антиоксидантний, дезінтоксикаційний, відновлювальний (активує регенераторно-репаративні процеси), що нормалізує функціонування пошкоджених зірчастих клітин не тільки печінки, а й ПЗ [17].
Доведено, що першим бар’єром захисту від впливу несприятливих факторів зовнішнього середовища є ендотелій [27]. Дія чинників ризику на ендотелій може стати причиною його дисфункції, потовщення інтими, розвитку артеріальних стенозів, розриву бляшок та атеротромбозу внаслідок порушень вивільнення ендотеліального фактора релаксації (за хімічною структурою – оксид азоту) та участі С-реактивного білка (СРБ) у розвитку хронічної запальної відповіді як на місцевому (судини, пухка сполучна тканина печінки та ПЗ), так і на системному рівні. При тривалому перебігу хронічного запального процесу і постійній стимуляції синтезу оксиду азоту індуцибельною NO‑синтазою відбувається поступове виснаження запасів L-аргініну – субстрату для утворення необхідної концентрації оксиду азоту. Внаслідок цього знижується його синтез і, відповідно, зменшується потенціал фагоцитуючих клітин [17], що створює сприятливі умови для ангіогенезу та фіброгенезу у пацієнтів із ХП, особливо у поєднанні з ІХС. Тому використання L-аргініну, який є попередником оксиду азоту, є теоретично і практично обґрунтованим у лікуванні не тільки серцево-судинних захворювань та їх ускладнень, а й ХП при коморбідності з ІХС. Тим більше, що активації процесів вільнорадикального окиснення ліпідів (ВРОЛ) та покращенню функції ендотелію надається великого значення, оскільки їх порушення є основними патогенетичними ланками у розвитку та рецидивуванні як ХП, так і ІХС.
Встановлення ролі зниження ВРОЛ та дисфункції ендотелію у патологічному процесі при коморбідному перебігу ХП з ІХС є актуальним для призначення комплексної терапії. У лікуванні таких хворих застосовують L-аргініну гідрохлорид та L-аргініну аспартат. Препарати L-аргініну покращують функцію ендотелію, уповільнюють розвиток ЕКГ-ознак ішемії та/або збільшують час до появи болю при проведенні проб із дозованим фізичним навантаженням, зменшують потребу у прийомі нітрогліцерину, підвищують толерантність до фізичного навантаження та покращують якість життя пацієнта.
Згідно з результатами дослідження, яке провели Е.А. Bocchi та співавт. (2000) за участі 7 пацієнтів (вік 39±8 років) із тяжкою формою застійної серцевої недостатності, внутрішньовенне введення L-аргініну (у середньодобовій дозі 30,4±1,9 г) сприяло зниженню частоти серцевих скорочень, середнього системного АТ і системного судинного тиску, збільшенню хвилинного серцевого викиду і систолічного об’єму крові [21].
Дані, отримані у низці досліджень, є обґрунтуванням для вивчення ефективності препаратів L-аргініну та доцільності їх включення у схеми комплексного лікування пацієнтів із коморбідною патологією ХП та ІХС на етапі амбулаторного лікування та реабілітації.
Особливості фармакотерапії ожиріння при коморбідному перебігу ХП з ІХС
У пацієнтів із коморбідними ХП та ІХС часто розвивається ожиріння (є складовою метаболічного синдрому), яке зустрічається більш як у 30% таких хворих. Вважається, що у цьому випадку ожиріння може бути вторинним, наприклад, індукованим такими лікарськими засобами, як аміодарону гідрохлорид, ніфедипін, аспірин (у великих дозах), тетрациклін, вальпроат натрію, які приймають пацієнти із ХСН. При цьому відбувається посилення ліполізу, підвищення секреції ХС ЛПДНЩ, гіперглікемії, збільшення рівня СРБ та фібриногену, що може призвести до виникнення тромбоемболічних ускладнень. Таким чином, ці порушення прямо або опосередковано сприяють розвитку локального атеросклерозу у коронарних судинах, дисфункції ендотелію у судинах печінки та ПЗ. Тому у лікуванні таких хворих рекомендується використовувати препарати, які містять у своєму складі L-аргінін, який інгібує продукцію ендотеліну‑1, підсилює секрецію оксиду азоту, дає змогу запобігти розвитку фіброзу печінки при захворюваннях серця і судин.
Однак на тлі ожиріння у пацієнтів із ХП та ІХС може розвинутися неалкогольна жирова хвороба печінки, яка потребує медикаментозної корекції. Для цього можна використати лікарські засоби на основі гліциризину. Ця речовина метаболізується та екскретується у печінку, а потім – у кишечник, де під впливом кишкової мікрофлори перетворюється у гліциризинову кислоту, яка може реабсорбуватися. Результати клінічних досліджень дозволяють розглядати гліциризин як препарат, який має доведені гепатопротекторний, протизапальний, антифібротичний та антиканцерогенний ефекти. Важливе значення для ефективності лікування має кратність введення препарату гліциризину (5-6 разів у тиждень) і тривалість лікування (не менше 6 міс). Варто також враховувати роль УДХК у нормалізації обміну холестерину у печінці. Окрім цього, слід звернути увагу на ефективність застосування метформіну (за відсутності протипоказань).
За даними О.А. Бондаренко, включення лікарських засобів, які містять у своєму складі карнітину хлорид, лізину гідрохлорид, кобаламін, кокарбоксилазу, а також селен, комплекс ферментів рослинного і тваринного походження, у схеми лікування хворих на ХП з ожирінням із подальшим курсом амбулаторної терапії з використанням дієтичної добавки на основі стевії та антигомотоксичних препаратів покращує зовнішньосекреторну функцію ПЗ [3, 6].
Зважаючи на те, що поряд із неалкогольною хворобою печінки у низці випадків розвивається стеатоз ПЗ, постпрандіальна гіперглікемія, прогресує інсулінорезистентність, доцільним є призначення метформіну (тим більше, що він запобігає розвитку ЦД 2 типу). Важливо, що, згідно з результатами дослідження UKPDS (The UK Prospective Diabetes Stady), застосування метформіну у дозі 2500 мг/добу впродовж 10 років знижує ризик розвитку інфаркту міокарда на 39%, інсульту – на 41% і загальну смертність – на 36%.
Ожиріння та інсулінорезистентність пов’язані з порушеннями кишкової мікробіоти, а саме змінами генів бактерій (їх вивчає метагеноміка і метатранскриптоміка). Кишковий метагеном визначає властивість мікробіоти засвоювати поживні речовини з раціону організму-хазяїна. Мікробіоту вважають ще одним органом, оскільки вона отримує, зберігає та перерозподіляє енергію, має здатність самостійно підтримувати свій якісно-кількісний склад, а також відновлюватися. На сьогодні існують переконливі докази того, що порушення мікробіоти призводить до домінування патогенної мікрофлори, зменшення видового розмаїття мікроорганізмів. Слід зауважити, що при коморбідності ХП з ІХС дисбіоз асоціюється з синдромом надлишкового бактеріального росту у тонкому кишечнику та СПК. Встановлено, що дисбіоз кишечнику пов’язаний з розвитком або прогресуванням бронхіальної астми, ЦД 2 типу, метаболічного синдрому, атеросклерозу, патології печінки та ін.
У патогенезі уражень печінки патогенна мікрофлора займає відповідну нішу: її домінування зумовлює накопичення тригліцеридів у печінці. Ще одним патогенетичним механізмом є синтез етанолу деякими видами мікроорганізмів. Етанол через ворітну вену надходить у печінку, зумовлюючи накопичення тригліцеридів у клітинах печінки, і через неконтрольованість оксидативного стресу вторинно уражає печінку з наявним стеатозом [3]. Ще одним патогенетичним механізмом є недостатня кількість фосфатидилхоліну внаслідок порушення функціонування кишкових бактерій при нераціональному харчуванні. Важливе значення у патологічному процесі мають також ліпополісахариди – продукти життєдіяльності кишкових бактерій та розриву міжклітинних контактів між епітеліоцитами. Таким чином, при коморбідності ХП та ІХС на тлі ожиріння формується дисбактеріоз, який поряд із медикаментами негативно вливає на зміни у структурі та функціонуванні печінки, що, у свою чергу, погіршує функціональний стан серцево-судинної системи. Такі пацієнти потребують періодичного призначення курсів про- і пребіотиків (принаймні тричі на рік).
У керівництві «Пробіотики та пребіотики» Всесвітньої гастроентерологічної організації (WGO, 2017) зазначено, що пробіотики – це живі мікроорганізми, використання яких в адекватній кількості позитивно впливає на здоров’я людини. Пребіотики – це селективно ферментовані складові, які утворюються внаслідок специфічних змін у складі або функціонуванні кишкової мікробіоти і таким чином позитивно впливають на здоров’я людини. Найбільш відомі пребіотики – олігофруктоза, інулін, галактоолігосахариди, лактулоза. Існують також синбіотики – це продукти, які містять про- та пребіотики.
Слід зауважити, що пробіотики показані до застосування з метою запобігання розвитку дисбіозу або корекції наявного дисбіозу. Ефекти пробіотиків умовно поділяють на імунологічні та неімунологічні. Імунологічні ефекти полягають в активації місцевих макрофагів, збільшенні продукції імуноглобулінів (Ig), модуляції реакцій цитокінового каскаду. Неімунологічні ефекти включають покращення травлення, зміну рН, продукцію бактеріоцинів.
У Римському консенсусі ІV підкреслюється, що «пробіотики модифікують мікробіоту, покращують імунну та бар’єрну функції слизової оболонки кишечнику, а також підсилюють дію нейроендокринних клітин та ферментів». Серед пробіотиків важливу роль відіграють лакто- та біфідобактерії. Лактобактерії – це модулятори кишкового запалення та агресивності імунної відповіді. Біфідобактерії продукують деякі вітаміни, ензими, оцтову та молочну кислоту, вони здатні інгібувати збудники різних захворювань та активувати імунну систему.
Встановлено, що у пацієнтів із коморбідним перебігом ХП та ІХС у 27-30% випадків формуються запори, спричинені ожирінням та дією деяких лікарських засобів, які використовують у кардіологічній практиці. Запор у таких хворих може бути функціональним, а може асоціюватись із СПК, функціональним абдомінальним болем, що пов’язано з особливостями харчування, зі зміною моторики шлунка, порушенням гастроінтестинальної регуляції. Так, холецистокінін та глюкагон уповільнюють спорожнення шлунка, а гормон грелін стимулює апетит, прискорює спорожнення шлунка, впливає на мікроциркуляцію у стінках кишечнику, метаболізм глюкози та ліпідів.
Виділяють 3 основні патогенетичні варіанти функціонального запору: запор повільного транзиту, диссинергічна дефекація та СПК із запорами. Лікування таких хворих спрямоване на нормалізацію консистенції випорожнень та забезпечення регулярності дефекації. Для пацієнтів із коморбідністю ХП та ІХС важливо рекомендувати спочатку рослинні препарати. Вони безпечні, чинять поступову, м’яку дію, не мають кумулятивного ефекту.
Отже, призначення базової фармакотерапії пацієнтам із коморбідним перебігом ХП та ІХС потребує ґрунтовного та диференційованого підходу. Однак лікування супутніх синдромів, таких як стеатоз, запори, дисбіоз, також потребує індивідуального підходу з обов’язковим встановленням домінуючих складових клінічної картини. У лікуванні пацієнтів із коморбідною патологією актуальною є проблема поліпрагмазії, якої можна уникнути шляхом послідовного призначення препаратів на певний термін, який визначає лікар.
Література
1. Христич Т.М., Гонцарюк Д.О. Особливості клінічного перебігу хронічного панкреатиту в поєднанні з ішемічною хворобою серця // Вестник Клуба Панкреатологов. – 2011. – № 4(13). – С. 43-44.
2. Христич Т.Н. Коморбидность хронического панкреатита и ишемической болезни сердца: о возможных механизмах развития и прогрессирования // Вестник Клуба Панкреатологов. – 2014. – № 4(25). – С. 4-9.
3. Ивашкин В.Т., Шифрин О.С., Соколов И.А. [и др.]. Стеатоз поджелудочной железы и его клиническое значение // Рос. ж. гастроэнтерол., гепатол., колопроктол. – 2006. – № 4. – С. 32-37.
4. Гавриш І.Т. Клініко-патогенетичні особливості перебігу хронічного панкреатиту: обґрунтування для використання парацетамолу: автореф. дис. на здобуття наук. ступеня канд. мед. наук: спеціальність 14.01.36 «Гастроентерологія». – 2006. – 20 с.
5. Христич Т.Н., Пишак В.П., Кедзерская Т.Б. Хронический панкреатит: нерешенные проблемы: монография. – Черновцы, 2006.
6. Бондаренко О.А. Оптимизация внешнесекреторной функции поджелудочной железы у больных хроническим панкреатитом на фоне ожирения // Гастроентерологія: Міжвідомчий збірник. – Вип. 45. – С. 371‑375.
7. Пархоменко А.Н. Применение статинов у больных высокого риска: путь от ожидания к клинической практике // Український медичний часопис. – 2010. – № 5(79). – С. 34-38.
8. Амосова Е.Н. От лечения к модификации прогноза: фокус на липидосодержащую терапию // Серце і судини. – 2011. – № 2. – С. 12-23.
9. Дзяк Г.В., Ханюков А.А. Аспекты рационального применения блокаторов β-адренорецепторов в лечении хронической сердечной недостаточности. Результаты сравнительного исследования эффективности и безопасности селективних блокаторов β-адренорецепторов // Укр. мед. часопис. – 2009. – № 6(74). – С. 37-42.
10. ESC Guidelines for the diagnosis and treatment of acute and chronik heart failure 2008. The Task Force for the diagnosis treatment of acute and chronik heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur J Heart Fail. 2008; (10): 933-989.
…
31. Bocchi E.A., Vilella de Moraes A.V., Esteves-Filho A. L-arginine reduces heart rate and improves hemodynamics in severe congestive heart failure. Clin Cardiol. 2000; 23(3): 205-210.
Повний список літератури знаходиться в редакції.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (51), лютий 2019 р.


