22 грудня, 2020
Вторинна профілактика венозного тромбоемболізму в пацієнтів із тромбоемболією легеневої артерії: показання, тривалість та оптимальні препарати
Останнім часом захворюваність на венозний тромбоемболізм (ВТЕ) та тромбоемболію легеневої артерії (ТЕЛА) має тенденцію до збільшення. З одного боку, це зумовлено поліпшенням діагностичних можливостей щодо виявлення даних патологій, з іншого – фактичним зростанням їхньої кількості через зміну способу життя та харчування, вищу частоту супутніх хвороб, які є факторами ризику тромбозів, та загальне постаріння населення.
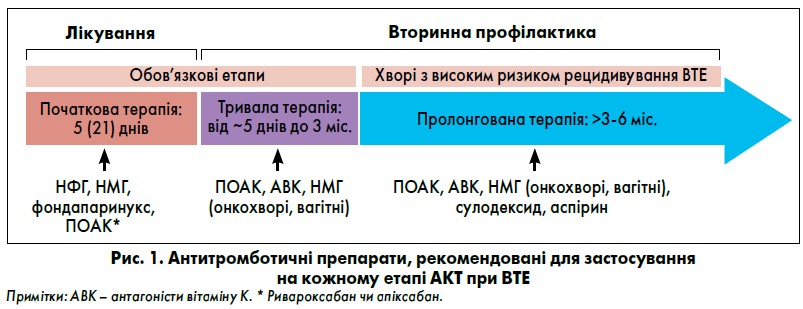
Основою лікування ВТЕ є антикоагулянтна терапія (АКТ) [1‑4]. Її слід розпочинати якомога раніше ще на етапі діагностики і проводити щонайменше протягом трьох місяців. АКТ проходить у декілька етапів (рис. 1):
- Початковий (або лікувальний) етап триває в середньому 5‑7 днів (до 21 дня при використанні ривароксабану). У цей період можна застосовувати парентеральні препарати – нефракціонований (НФГ), низькомолекулярні гепарини (НМГ) – переважно у пацієнтів із ТЕЛА груп високого та проміжного ризику або лікувальні дози прямих оральних (не вітамін К-залежних) антикоагулянтів (ПОАК) ривароксабану чи апіксабану при ТЕЛА проміжного/низького та низького ризику.
- Етап тривалої АКТ становить від 5‑7 (21) днів до трьох місяців. Терапія спрямована на профілактику повторних ВТЕ у хворих.
- Етап пролонгованого лікування, що триває понад трьох місяців та невизначено довго. Призначувана терапія також спрямована на запобігання повторним ВТЕ.
Перші два етапи є обов’язковими для всіх пацієнтів. Етап пролонгованої АКТ проводять у частини хворих з обов’язковою оцінкою співвідношення користі й ризику щодо подальшої АКТ кожні 3‑4 місяці.
Препаратами вибору для вторинної профілактики ВТЕ є ПОАК (апіксабан, ривароксабан, дабігатран, едоксабан), які мають зіставну з варфарином ефективність щодо попереджання тромбоемболій, але суттєво (приблизно на 40%) нижчий ризик геморагічних ускладнень. Антагоністи вітаміну К (АВК) для вторинної профілактики ВТЕ на даний час перейшли у категорію препаратів другого ряду [5‑6]. Якщо все ж таки призначають АВК, терапію слід починати паралельно з іншим антикоагулянтом (НМГ, ПОАК тощо), відміна якого можлива лише після досягнення міжнародного нормалізованого відношення (МНВ) 2,0‑3,0 протягом щонайменше двох днів поспіль.
Подальша терапія АВК вважається безпечною та ефективною, тільки якщо більш ніж 70% вимірювань МНВ знаходяться у вказаному інтервалі: від 2,0 до 3,0. Рішення щодо продовження лікування понад обов’язкових 3‑6 місяців приймають на основі оцінки тромботичних та геморагічних ризиків для кожного окремого пацієнта. Надалі доцільність продовження медикаментозної вторинної профілактики слід аналізувати кожні 3‑4 місяці.
Метою тривалої антикоагулянтної терапії після ТЕЛА є запобігання рецидивам ВТЕ. Для цього у більшості хворих застосовують ПОАК, як альтернативу – АВК. При лікуванні осіб із ВТЕ та онкологічними захворюваннями тривало використовують НМГ або ПОАК, окрім пацієнтів зі злоякісними новоутвореннями шлунково-кишкового тракту (ШКТ) [3, 7]. НМГ також рекомендовані для вторинної профілактики ВТЕ у вагітних. У пацієнтів з антифосфоліпідним синдромом для проведення оральної АКТ перевагу варто віддавати АВК.
Більшість рандомізованих випробувань, присвячених вивченню ефективності тривалої АКТ після ВТЕ, включали осіб із тромбозом глибоких вен (ТГВ) з/без ТЕЛА, і лише декілька досліджень фокусувалися тільки на пацієнтах із ТЕЛА. Ймовірність рецидиву ВТЕ після ТЕЛА чи проксимального ТГВ майже однакова, втім після ТЕЛА частіше рецидивує саме ТЕЛА. Як наслідок, рецидиви захворювання після ТЕЛА мають майже вдвічі більшу летальність.
Результати досліджень свідчать, що пацієнти з ТЕЛА повинні отримувати АКТ протягом щонайменше 3‑6 місяців. Частина хворих із високою вірогідністю рецидивів потребують подовження АКТ довше цього обов’язкового терміну. Рішення щодо продовження терапії приймають на підставі оцінки тромботичних та геморагічних ризиків для кожного пацієнта індивідуально. Визначення тривалості АКТ після епізоду ТЕЛА є однією з найбільш складних задач у лікуванні цих хворих.
Загалом АКТ характеризується високою ефективністю в попереджанні рецидивів ВТЕ під час лікування (зниження ризику на ~90%), але не позбавляє рецидивів після його припинення [5]. Відповідно, антикоагулянти відміняють, коли ймовірність рецидивів ВТЕ стає нижчою за ризик розвитку кровотеч, та через незручності, пов’язані з продовженням АКТ. Залучення пацієнта до прийняття спільного рішення щодо доцільності продовження АКТ є дуже важливим та суттєво покращує комплаєнс.
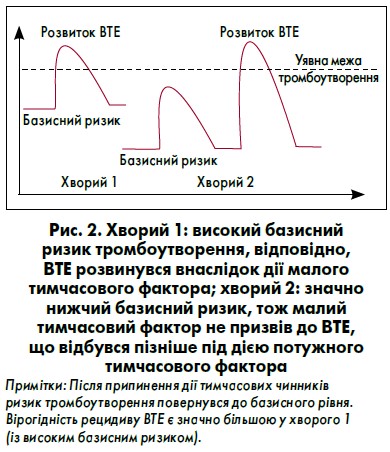 Вважається, що ризик рецидиву ВТЕ після припинення АКТ залежить від особливостей виникнення індексної події [3]. В основі цього підходу лежить уявлення про те, що кожний пацієнт має певний «базисний» тромботичний ризик, який складається з низки факторів, таких як вік, стать, вага, генетичні особливості системи згортання крові, супутні захворювання та стани тощо. Дія будь якого додаткового, зазвичай тимчасового, чинника підвищує цей ризик та у деяких хворих призводить до подолання уявної межі тромбоутворення, що є причиною розвитку ВТЕ. Чим менший за тромбогенністю фактор призвів до виникнення ВТЕ, тим вищий базисний ризик має пацієнт і, відповідно, більша вірогідність появи повторних тромбоемболічних ускладнень (рис. 2).
Вважається, що ризик рецидиву ВТЕ після припинення АКТ залежить від особливостей виникнення індексної події [3]. В основі цього підходу лежить уявлення про те, що кожний пацієнт має певний «базисний» тромботичний ризик, який складається з низки факторів, таких як вік, стать, вага, генетичні особливості системи згортання крові, супутні захворювання та стани тощо. Дія будь якого додаткового, зазвичай тимчасового, чинника підвищує цей ризик та у деяких хворих призводить до подолання уявної межі тромбоутворення, що є причиною розвитку ВТЕ. Чим менший за тромбогенністю фактор призвів до виникнення ВТЕ, тим вищий базисний ризик має пацієнт і, відповідно, більша вірогідність появи повторних тромбоемболічних ускладнень (рис. 2).
Таким чином, усіх пацієнтів можна розділити на п’ять основних груп:
- хворі, в яких ТЕЛА була спровокована дією значного (потужного) тимчасового або оборотного фактора ризику (велике хірургічне втручання або травма);
- пацієнти, в котрих індексний епізод ТЕЛА виник на тлі дії малого (слабкого) тимчасового/оборотного чинника ризику або наявного на момент відміни АКТ (незлоякісне новоутворення);
- особи без явного фактора ризику для виникнення первинного епізоду ТЕЛА («ідіопатична» ТЕЛА);
- пацієнти з одним або більшою кількістю епізодів ВТЕ в анамнезі, а також особи із протромботичними станами (антифосфоліпідний синдром, тромбофілії);
- хворі з активним злоякісним новоутворенням.
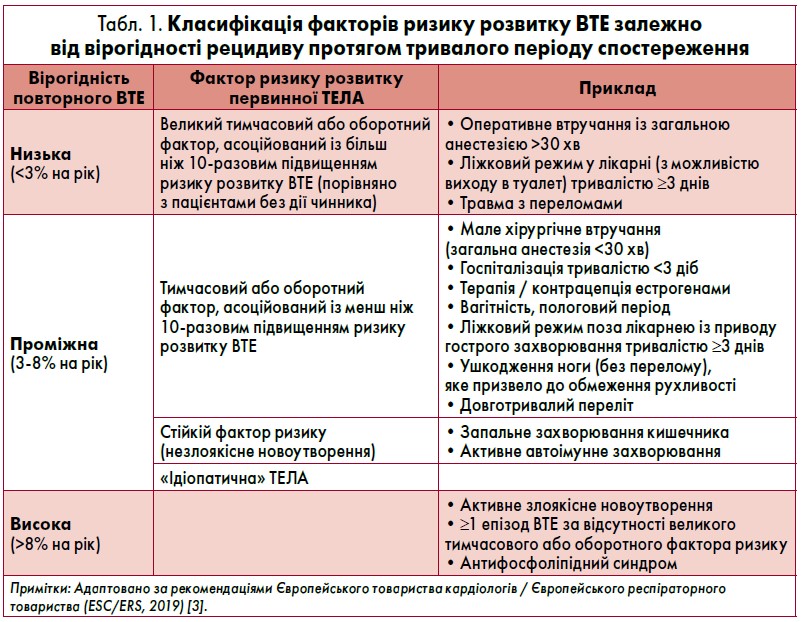
У таблиці наведений ризик повторних тромбоемболічних ускладнень у хворих залежно від основного фактора, який призвів до розвитку первинної ТЕЛА. Вважається, що найнижчий ризик повторення мають пацієнти, в яких перший епізод ВТЕ стався після великого оперативного втручання (тривалістю понад 30 хв), травми з переломами або довгочасного ліжкового режиму із приводу соматичного захворювання.
Згідно з рекомендаціями, у хворих, в яких причиною первинної ТЕЛА був великий тимчасовий або оборотний чинник, АКТ можна відмінити після обов’язкових трьох місяців лікування. Раннє припинення АКТ також інколи доцільно розглянути в молодих жінок, у котрих ВТЕ діагностовано в перші 2‑3 місяці після початку приймання гормональних контрацептивів із вмістом естрогену, за умови відміни такої терапії.
Навпаки, у разі активного злоякісного новоутворення, повторного ВТЕ за відсутності дії великого тимчасового або оборотного фактора ризику чи в осіб із тромбофіліями (як-то антіфосфоліпідний синдром, дефіцит антитромбіну, протеїну С/S, гомозиготна мутація V фактора Leiden або протромбіну G20210A), АКТ слід продовжити на невизначений термін. Таким чином, тестування на тромбофілії (зокрема на розвиток антифосфоліпідного синдрому) рекомендоване всім хворим віком до 50 років з «ідіопатичною» ТЕЛА та за наявності ВТЕ у родинному анамнезі. Втім на сьогодні відсутні докази переваг тривалої АКТ у пацієнтів із гетерозиготною мутацією V фактора Leiden або протромбіну G20210A.
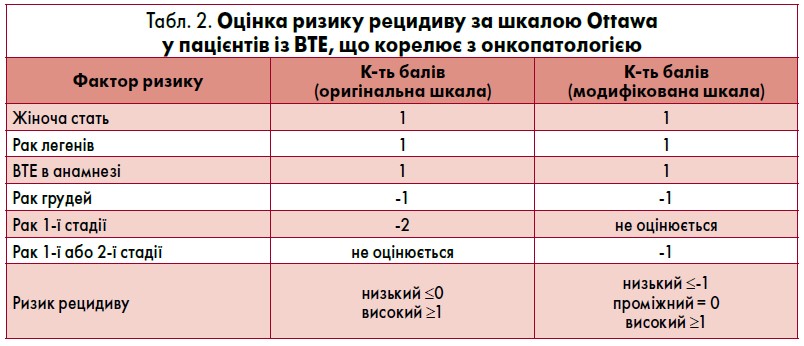
Онкологічне захворювання в активній стадії також є одним з основних факторів ризику повторних ВТЕ, при цьому частота рецидивів становить близько 20% протягом перших 12 місяців після індексної події. Для оцінки схильності до розвитку рецидиву ВТЕ в онкохворих можна використовувати шкалу Ottawa, запропоновану як в оригінальному, так і модифікованому варіантах (табл. 2) [8‑9].
Метааналіз дев’яти досліджень (n=14 963) показав, що за оригінальною шкалою Ottawa 49,3% пацієнтів було віднесено до категорії високого ризику, при цьому рецидиви ВТЕ протягом шістьох місяців спостерігали у 18,6% даної групи хворих. Імовірність рецидиву в осіб із низьким ризиком (50,7%) становила 7,4%.
За модифікованою шкалою до групи низького ризику було включено 19,8% хворих із вірогідністю рецидиву ВТЕ 2,2% протягом шести місяців, проміжного ризику – 40,7% із ризиком рецидиву 7,1% та високого ризику – 39,5% з імовірністю рецидиву 10,2%.
За даними п’ятьох рандомізованих клінічних досліджень, тривала терапія НМГ протягом 3‑6 місяців при рак-асоційованих тромбозах порівняно з комбінацією НМГ (5‑10 днів) та АВК супроводжувалася зниженням ризику рецидивів ВТЕ на 40% за подібної кількості великих кровотеч на тлі двох режимів лікування [10].
Завдяки цьому НМГ стали стандартом вторинної профілактики ВТЕ в онкологічних пацієнтів, втім імовірність рецидивів ВТЕ навіть на тлі НМГ в осіб з активним новоутворенням лишається у межах 7‑9% (порівняно з 1,5‑3% у загальній популяції хворих). На додаток, висока вартість НМГ та незручність тривалої парентеральної терапії потребують пошуку нових підходів до лікування.
Останнім часом активно вивчається використання ПОАК у даної категорії пацієнтів. У дослідженні HOKUSAI VTE Cancer терапія едоксабаном мала зіставну з НМГ дальтепарином ефективність щодо попереджання первинної комбінованої кінцевої точки (рецидив ВТЕ / велика кровотеча) протягом 12 місяців спостереження: відносний ризик (ВР) 0,97; 95% довірчий інтервал (ДI) 0,70‑1,36 [11]. Великі кровотечі частіше мали місце у групі едоксабану, ніж дальтепарину (6,9 та 4% випадків відповідно; ВР 1,77; 95% ДI 1,03‑3,04). Різниця переважно була зумовлена збільшенням кровотеч у хворих на рак ШКТ.
Подібні результати були отримані у дослідженні SELECT-D, в якому ривароксабан (відкрите призначення) мав переваги перед дальтепарином щодо запобігання повторним ВТЕ (ВР 0,43; 95% ДI 0,19‑0,99). Однак лікування асоціювалося з несуттєвим підвищенням частоти великих кровотеч (ВР 1,83; 95% ДI 0,68‑4,96) та достовірним збільшенням клінічно значущих кровотеч (ВР 3,76; 95% ДI 1,63‑8,69) [12]. У випробуванні CARAVAGGIO апіксабан мав подібну з дальтепарином ефективність щодо попереджання розвитку повторних ВТЕ (ВР 0,63; 95% ДІ 0,37‑1,07) та не призводив до зростання кількості великих кровотеч (ВР 0,82; 95% ДI 0,40‑1,69) [13].
На сьогодні НМГ у більшості настанов лишаються препаратами першого ряду для вторинної профілактики ВТЕ в онкохворих [7]. НМГ також рекомендовані пацієнтам із порушеннями ковтання або всмоктування на тлі злоякісного захворювання чи особам із виразною дисфункцією нирок. Однак останні дослідження свідчать, що ПОАК (апіксабан, едоксабан та ривароксабан) є дієвою та безпечною альтернативою НМГ в онкологічних пацієнтів, особливо за низького ризику кровотеч та відсутності злоякісного ураження ШКТ [3].
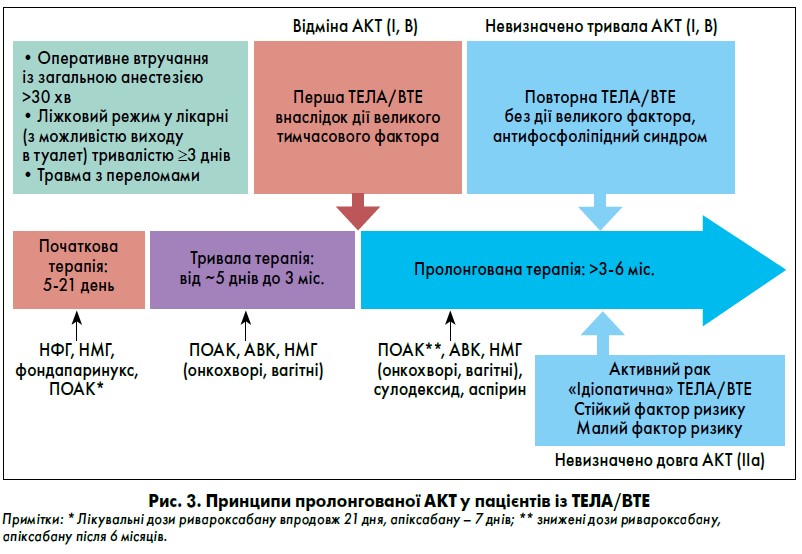
Більшість пацієнтів із проміжним ризиком рецидиву ВТЕ також потребують пролонгованої АКТ (рис. 3). До цієї категорії відносять осіб з:
- «ідіопатичною» або «неспровокованою» ТЕЛА, коли не вдається виявити фактор, який став причиною хвороби;
- ТЕЛА на тлі дії постійного чинника ризику (незлоякісного новоутворення), наприклад активного автоімунного захворювання, хронічного запального процесу кишечника, дія яких продовжується;
- ТЕЛА на тлі малого оборотного фактора (нетривале або малоінвазивне хірургічне втручання, нетривала/позалікарняна іммобілізація, вагітність чи терапія естрогеном за відсутності антифосфоліпідного синдрому).
Після закінчення перших двох (обов’язкових) етапів АКТ в осіб із ВТЕ, причиною якого стала дія потужного тимчасового оборотного фактора (велике оперативне втручання, травма з переломами, тривалий ліжковий режим), АКТ відміняють (І, В). У всіх інших пацієнтів терапію продовжують (I/IIa) та кожні 3‑4 міс. проводять оцінку тромботичних і геморагічних ризиків. АКТ відміняють, коли геморагічні ризики починають переважати.
До додаткових факторів ризику тромбоутворення (відповідно до рецидиву ТЕЛА) також відносять підвищений рівень D-димеру, що зберігається на тлі АКТ чи після припинення, залишкові явища тромбозу в глибоких венах нижніх кінцівок при проведенні компресійної ультрасонографії або комп’ютерної томографії, залишкову обструкцію прохідності легеневих артерій за даними вентиляційно-перфузійної сцинтіграфії [14‑16]. Повторні ВТЕ частіше виникають у чоловіків віком ≤50 років та пацієнтів після 70‑75 років, осіб із ожирінням та парезом нижніх кінцівок [17, 18].
Додаткові фактори ризику рецидивів ВТЕ
- Чоловіча стать
- Вік (чоловіки ≤50 років та всі пацієнти ≥70 років)
- Підвищення індексу маси тіла
- Парез нижніх кінцівок
- Високий рівень Д-димеру, що зберігається
- Залишковий венозний тромбоз (за даними УЗД)
- Залишкова обструкція прохідності легеневих артерій
Існує низка клінічних шкал, що допомагають у визначенні тромботичного ризику в пацієнтів після ВТЕ: віденська шкала, HERDOO2, DASH, DAMOVES тощо. Із них валідизовані у клінічних дослідженнях віденська шкала та HERDOO2, яку розроблено для оцінки ризику в жінок [19‑20].
Після шістьох місяців АКТ для продовження вторинної профілактики можна використовувати знижені дози апіксабану (2,5 мг двічі на день) або ривароксабану (10 мг/добу). Ефективність та безпеку цих дозувань ПОАК було підтверджено у дослідженнях AMPLIFY Extension та EINSTEIN CHOICE [21, 22].
У деяких пацієнтів із непереносимістю чи протипоказаннями до АКТ або ж високим геморагічним ризиком для проведення пролонгованої АКТ можна використовувати сулодексид. Сулодексид – це глікозаміноглікан природного походження, який на 80% складається з гепариноїдної фракції та на 20% – із дерматану сульфату. Крім антикоагулянтної дії, сулодексид активує фібриноліз та сприяє відновленню глікокаліксу на поверхні клітин ендотелію.
Ефективність сулодексиду для вторинної профілактики ВТЕ було доведено у дослідженні SURVET [23]. У випробування було залучено 615 пацієнтів із першим епізодом «неспровокованої» ВТЕ (92% ТГВ та 8% ТЕЛА), які впродовж 3‑12 місяців до включення отримували терапію АВК. Спостереження протягом двох років виявило достовірне зниження (~50%) кількості рецидивів ВТЕ на тлі терапії сулодексидом (500 ліпопротеїнліпазних одиниць двічі на добу) порівняно із плацебо (ВР 0,49; 95% ДІ 0,27‑0,92; р=0,02). При цьому в жодного пацієнта як на тлі сулодексиду, так і плацебо не зареєстровано розвитку великої кровотечі. Кількість клінічно значущих кровотеч була також однаковою в обох групах (2 при застосуванні сулодексиду та 2 – плацебо). Тому використання сулодексиду має найбільші переваги в осіб із високим геморагічним ризиком.
У межах двох випробуваннях ASPIRE та WARFASA, в які сумарно було включено 1224 пацієнти, призначення ацетилсаліцилової кислоти (АСК) після закінчення стандартної АКТ супроводжувалося зниженням ризику рецидивів ВТЕ на 30‑35% порівняно із плацебо [24‑25]. Клінічно значущі кровотечі реєстрували у 12 хворих (7 великих) групи плацебо та 18 (9 великих) – АСК, що не мало статистичної достовірності. Втім, ривароксабан у дозі 10 або 20 мг/добу в дослідженні EINSTEIN CHOICE був значно ефективніший за АСК щодо вторинної профілактики ВТЕ при однаковому ризику великих та клінічно значущих кровотеч [22].
Належну оцінку геморагічних ризиків у пацієнтів, що отримували АКТ із приводу ВТЕ, не проводили. З огляду на наявні дані, до факторів ризику відносять [3]:
- похилий вік (зокрема >75 років);
- шлунково-кишкові кровотечі в анамнезі (особливо, якщо захворювання, що їх викликало, не було вилікуване);
- геморагічний або ішемічний інсульт в анамнезі;
- хронічна ниркова чи печінкова недостатність;
- супутнє лікування антиагрегантами (за можливості слід уникати);
- інші серйозні гострі чи хронічні захворювання;
- незадовільний контроль за проведенням АКТ (погане дотримання рекомендацій щодо лікування або <70% значень МНВ у межах 2,0‑3,0 на тлі приймання АВК).
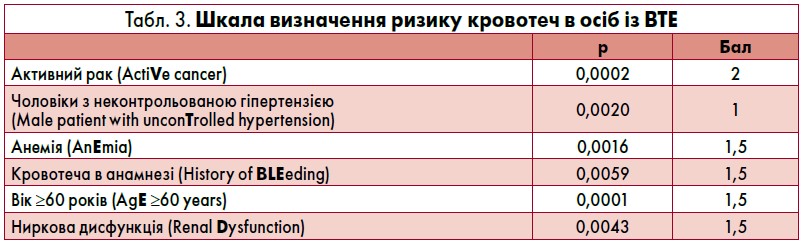
Із метою оцінки ризику кровотеч на тлі АКТ у хворих на ТЕЛА можна використовувати клінічні шкали, як-то RIETE, OBRI, HAS BLEED тощо. На сьогодні єдиною верифікованою шкалою у пацієнтів із ВТЕ, які приймають ПОАК, є VTE-BLED (табл. 3) [26]. Ризик кровотеч вважається високим, якщо хворий набирає більш як 2 бали.
Висновки
Таким чином, після обов’язкових трьох місяців лікування АКТ можна безпечно відмінити лише у хворих, в яких ТЕЛА була спровокована дією великого (сильного) тимчасового або оборотного фактора ризику. В інших пацієнтів слід проводити «безстрокову» АКТ. При цьому «безстрокова» терапія не є синонімом «пожиттєвої». Мається на увазі, що тривалість лікування неможливо встановити одразу чи навіть впродовж обов’язкового тримісячного періоду терапії. У таких хворих потрібно періодично оцінювати необхідність припинення АКТ з огляду на співвідношення ризиків виникнення рецидивів ВТЕ та кровотеч, що й визначає успіх пролонгованої АКТ. Пожиттєва терапія рекомендована більшості пацієнтів із повторними ВТЕ або за наявності вроджених порушень системи гемостазу – тромбофілій.
Препаратами вибору для пролонгованої терапії є ПОАК, як альтернатива – АВК. При лікуванні осіб із ВТЕ та онкологічними захворюваннями використовують тривалу терапію НМГ, окрім пацієнтів зі злоякісними новоутвореннями ШКТ, коли можливе також застосування ПОАК апіксабану, едоксабану або ривароксабану. НМГ рекомендовані для вторинної профілактики ВТЕ у вагітних. У пацієнтів з антифосфоліпідним синдромом для проведення пероральної АКТ перевагу слід віддавати АВК.
Згідно з рекомендаціями ESC/ERS (2019) у межах пролонгованого лікування після ТЕЛА в неонкологічних пацієнтів, за умови непереносимості антикоагулянтів першої лінії, доцільно призначати аспірин чи сулодексид для профілактики ВТЕ (IIb, B). На додаток, у хворих із дуже високим геморагічним ризиком для запобігання розвитку повторних ВТЕ після скасування стандартної АКТ можна застосовувати сулодексид.
Список літератури знаходиться в редакції
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 5 (72) 2020 р.