4 січня, 2021
Окремі аспекти системної терапії у пацієнтів з меланомою шкіри
 За клінічними настановами NCCN (версія 4.2020 від 1 вересня 2020 р.)
За клінічними настановами NCCN (версія 4.2020 від 1 вересня 2020 р.)
Вступ
Поза клінічним дослідженням для пацієнтів із захворюваннями I/II стадії ад’ювантне лікування не рекомендується, хоча обґрунтування цієї рекомендації різними експертними групами Національної онкологічної мережі США (NCCN) різниться. Для пацієнтів з меланомою Управлінням з контролю якості харчових продуктів і лікарських препаратів США (FDA) не затверджено інгібіторів імунних контрольних точок або BRAF-мішеневої терапії. Хоча у більшість досліджень на сьогодні не включали пацієнтів із захворюваннями I/II стадії, проводяться клінічні дослідження для визначення ефективності ад’ювантного застосування інгібіторів контрольних точок у пацієнтів II стадії високого ризику.
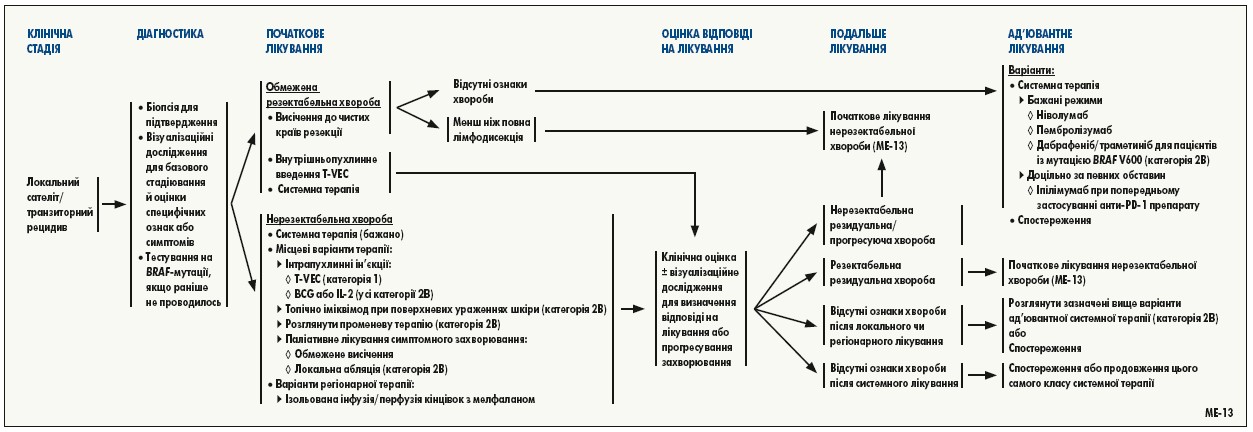
Для хворих після операції з приводу поширеної меланоми проведено низку проспективних рандомізованих досліджень, результати яких свідчать про те, що інгібітори імунних контрольних точок та BRAF-мішенева терапія є ефективними варіантами ад’ювантного лікування. Вибір специфічної ад’ювантної системної терапії для пацієнтів з оперованою поширеною меланомою залежить від багатьох факторів, включаючи ризик рецидиву, потенційну клінічну користь, потенційну токсичність, вибір пацієнта, його вік та супутні захворювання. Альтернативою є участь у клінічному дослідженні та спостереження.
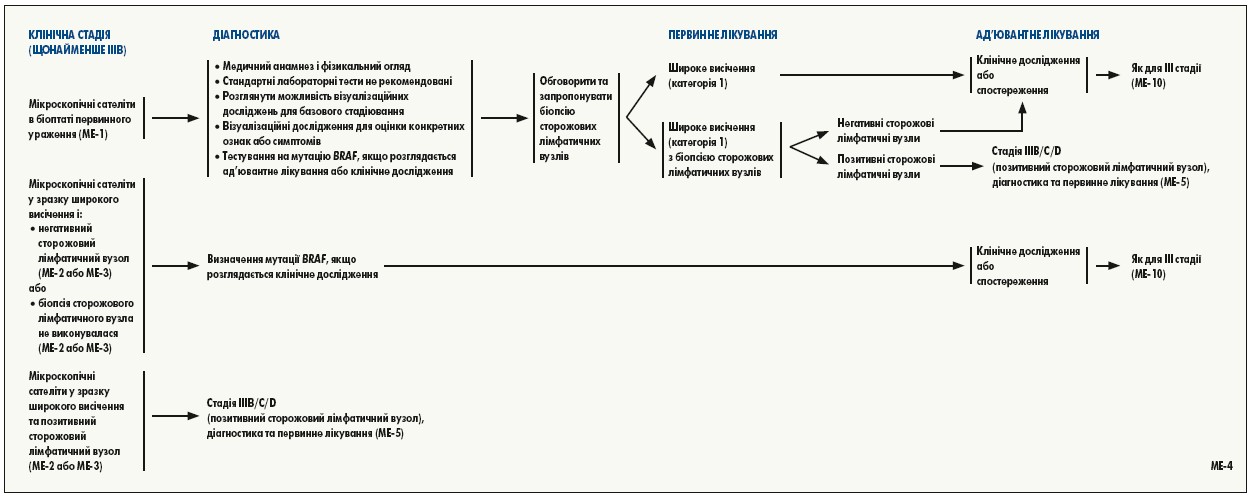
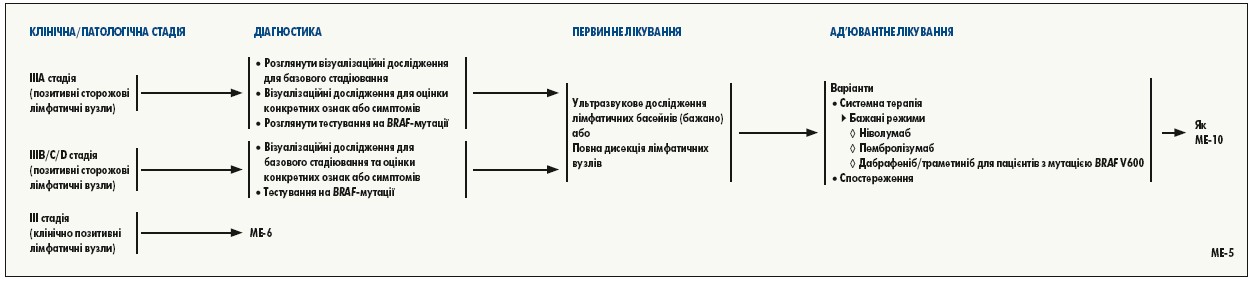
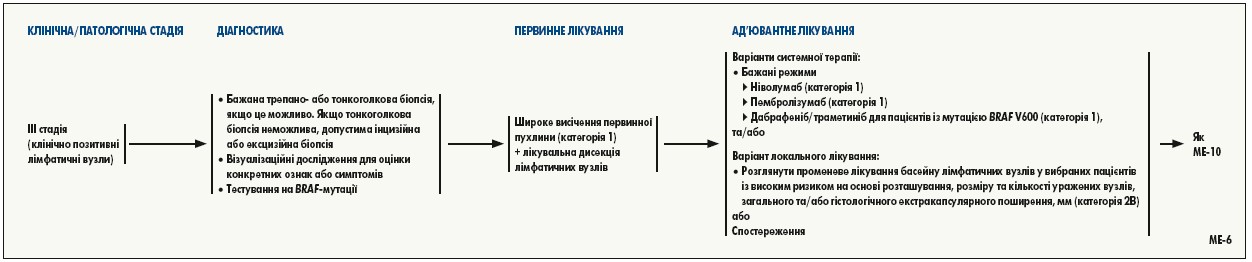
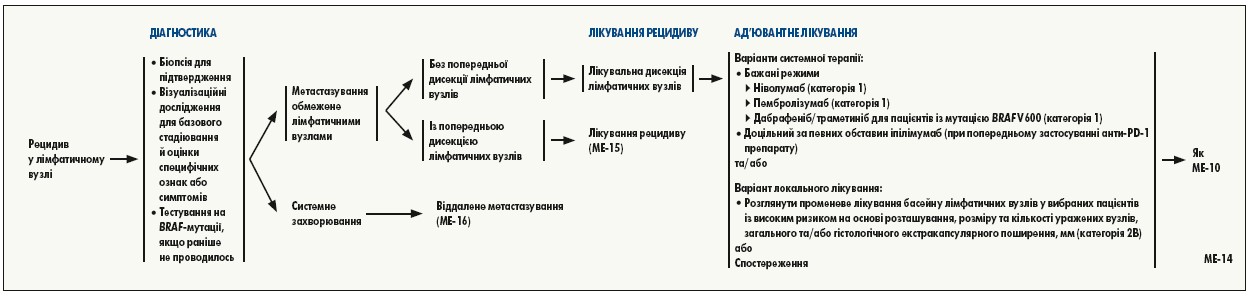
Найважливішим фактором, який слід враховувати, є ризик рецидиву та/або смерті від хвороби. Пацієнти з меланомою IIIA стадії є групою найнижчого ризику, для якої у настановах NCCN рекомендовано розглянути ад’ювантне лікування. У кілька нещодавно проведених рандомізованих досліджень III фази, у яких тестували інгібітори імунних контрольних точок або BRAF-мішеневу терапію, включали деяких пацієнтів із IIIA стадією (загалом у дослідження включали лише пацієнтів із позитивними сторожовими лімфатичними вузлами з метастазами діаметром не менше 1 мм, оскільки вони оцінювались як фактор підвищеного ризику).
Важливо, однак, зазначити, що критерії включення у ці дослідження базувались на класифікації Американського об’єднаного комітету із раку (AJCC) 7-го видання і що пацієнти із захворюванням IIIA стадії, як визначено у вказаному виданні, складають групу вищого ризику, ніж з такою ж стадією відповідно до класифікації AJCC 8-го видання, що теж включає товщину інвазії за Breslow у хворобу III стадії. П’ятирічна виживаність при меланомі IIIA стадії згідно з класифікацією AJCC 7-го видання становить 78%, а 8-го видання – 93%. Після хірургічного лікування у пацієнтів з меланомою III стадії з низьким ризиком рецидиву (наприклад, IIIA стадії за класифікацією AJCC 8-го видання та/або з метастазами у сторожовому лімфатичному вузлі <1 мм), токсичність ад’ювантної терапії може перевищувати користь, тому її слід обговорити з пацієнтом.
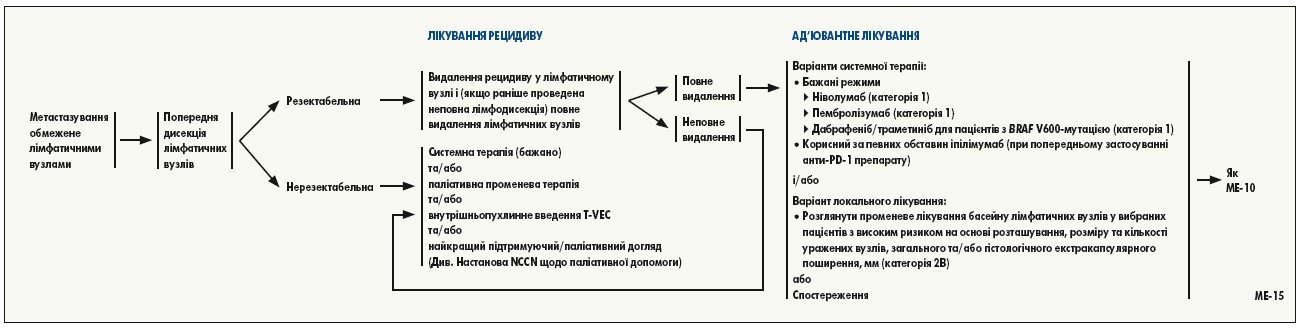
Ризик токсичності є іншим важливим фактором, на який зважають ухвалюючи рішення про те, чи повинен пацієнт із III стадією захворювання отримувати ад’ювантну терапію. Хоча анти-PD‑1 препарати та інгібітори BRAF/MEK асоціюються з нижчою токсичністю, ніж препарати ад’ювантної терапії, що використовувалися раніше (інтерферон альфа, біохіміопрепарати), небажані явища 3-4 ступеня спостерігались у 25-41% пацієнтів, які отримували лікування в рамках досліджень ад’ювантних режимів. У невеликої частини пацієнтів, які отримували в ад’ювантному режимі інгібітори імунних контрольних точок, тривалі небажані явища пов’язані з імунною системою. У пацієнтів, які отримували попередню анти-PD‑1 терапію та для яких додатковим ад’ювантним препаратом є іпілімумаб, рішення слід приймати, ретельно враховуючи індивідуальний ризик рецидиву і переносимість токсичності та пов’язаного з нею лікування.
BRAF-мішенева терапія
Результати проспективних рандомізованих досліджень показали, що інгібітори імунних контрольних точок і BRAF-мішенева терапія ефективні при нерезектабельній меланомі III та IV стадії, ці препарати зараз схвалені FDA та широко використовуються у вказаній клінічній ситуації. BRAF-мішенева терапія досліджена як ад’ювантне лікування після резекції меланоми у двох проспективних подвійних сліпих рандомізованих контрольованих дослідженнях COMBI-AD та BRIM8. Результати COMBI-AD засвідчили, що у відібраних пацієнтів з меланомою III стадії та мутацією BRAF V600 E/K після хірургічного втручання ад’ювантне лікування комбінацією інгібіторів BRAF/MEK дабрафеніб/траметиніб сприяло покращенню безрецидивної виживаності та знижувало ризик розвитку віддалених метастазів, хоча і з більшим ризиком токсичності. Рівень загальної виживаності був вищим у разі застосування дабрафенібу/траметинібу порівняно з плацебо, але значення Р (Р=0,0006) не відповідало заданій проміжній межі. У дослідження включено пацієнтів з резекованою пухлиною IIIA стадії (класифікація AJCC 7‑го видання), у яких був принаймні один метастаз у лімфатичних вузлах >1 мм або IIIB чи IIIC стадія. Аналіз за підгрупами показав, що безрецидивна виживаність була значно кращою при застосуванні дабрафенібу/траметинібу у пацієнтів із BRAF V600E, і, ймовірно, також в осіб із менш поширеною мутацією BRAF V600K. На основі результатів COMBI-AD комбінована терапія дабрафенібом/траметинібом була затверджена FDA як ад’ювантна терапія для пацієнтів з мутаціями BRAF V600E/K.
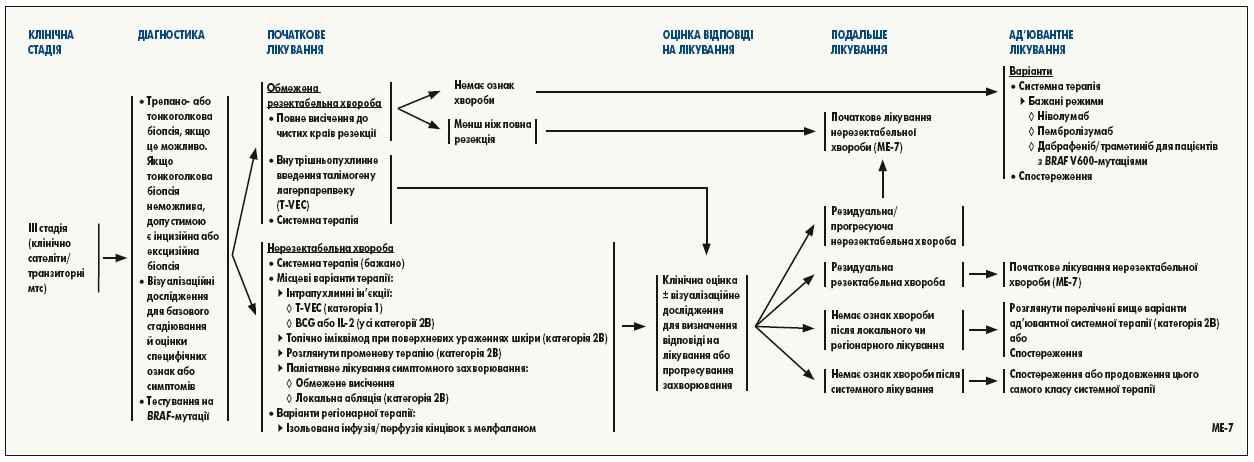
Неоад’ювантна системна терапія. У пілотних дослідженнях і дослідженнях I/II фази показано багатообіцяючі результати щодо використання BRAF-мішеневої терапії та інгібіторів імунних контрольних точок як неоад’ювантного лікування при резектабельній меланомі III-IV стадії. На сьогодні недостатньо даних, щоб рекомендувати будь-який конкретний засіб як неоад’ювантну терапію при меланомі, але враховуючи багатообіцяючі результати початкових досліджень і кількість доступних на даний момент досліджень, NCCN радить розглянути можливість включення до них неоад’ювантної системної терапії у пацієнтів з погранично резектабельною лімфаденопатією або з дуже високиим ризиком розвитку рецидиву після лімфаденектомії.
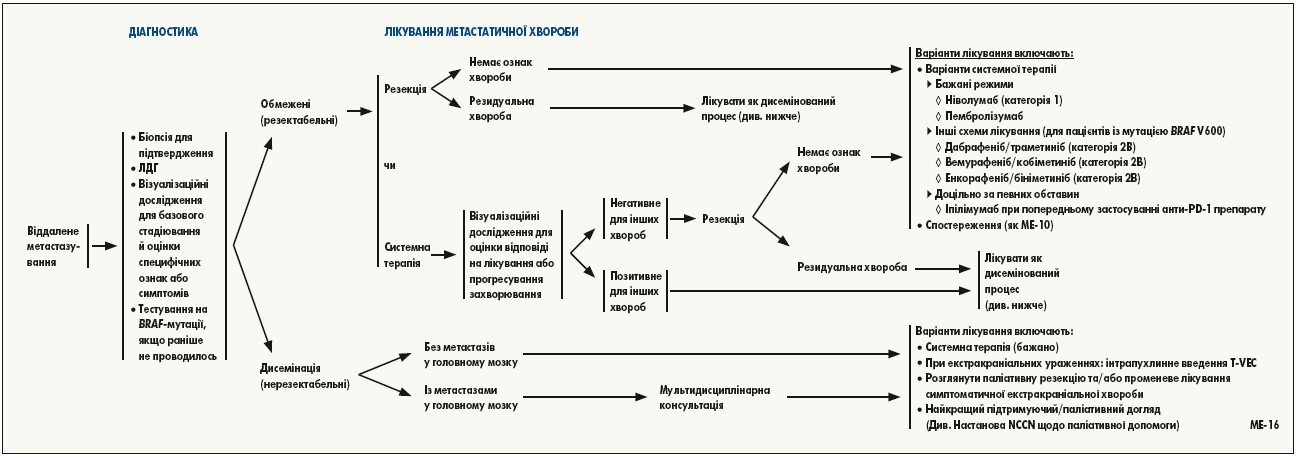
Лікування при нерезектабельній III стадії або віддаленій метастатичній хворобі (IV стадія). Обсяг терапевтичних можливостей при метастатичній меланомі швидко змінюється з розробленням нових лікарських засобів, які продемонстрували вищу ефективність, ніж традиційна хіміотерапія. Перше покоління нових мішеневих та імунотерапевтичних засобів (тобто вемурафеніб, дабрафеніб, іпілімумаб) забезпечило істотне покращення рівня відповіді та результатів порівняно зі стандартними методами лікування. Отримано варті уваги результати досліджень II та III фази, у яких вивчали нові імунотерапевтичні, мішеневі препарати та їх комбінації.
Імунна система може виявляти і знищувати певні злоякісні клітини. Цей процес називається імунонаглядом. Умови або події, які загрожують імунній системі, можуть призвести до того, що ракові клітини уникнуть імуноспостереження. Як тільки ракові клітини уникли імунологічного нагляду і почали ділитися, їх генетична та фенотипова пластичність дозволяє розвивати додаткові механізми, за допомогою яких нова пухлина може ухилятися від імунної системи, перешкоджати або навіть використовувати її. Імунотерапія спрямована на посилення імунної відповіді для подолання або обходу механізмів імунного ухилення, що застосовуються раковими клітинами та пухлинами.
Деякі з найбільш ефективних імунопрепаратів спрямовані на імунні контрольні точки, які часто використовуються пухлинами для зниження імунної активності. Вважається, що інгібітори анти-PD‑1 втручаються головним чином у механізм зворотного зв’язку на межі розділу Т-клітин і клітин пухлини. Приблизно у половини пацієнтів з метастатичною меланомою шкіри зберігається мутація BRAF. Більшість мутацій, що виникають у меланомах та активують BRAF, мають залишок V600 (зазвичай V600E, але іноді V600K або інші). Показано, що інгібітори BRAF проявляють клінічну активність при нерезектабельних метастатичних меланомах з мутаціями BRAF V600. Спільне введення інгібіторів МЕК (сигнальної молекули) після BRAF посилює ці ефекти. Дані великих рандомізованих досліджень, у яких вивчають інгібітори BRAF та MEK, про ефективність і безпеку істотно вплинули на рекомендовані варіанти лікування пацієнтів із BRAF-позитивною нерезектабельною поширеною меланомою.
Вемурафеніб і дабрафеніб були розроблені для інгібування BRAF із мутаціями V600. Для пацієнтів з раніше не лікованою меланомою IV стадії або неоперабельною меланомою III стадії з мутаціями BRAF V600 результати досліджень III фази (тобто BRIM‑3, BREAK‑3) показали, що монотерапія будь-яким із цих препаратів покращує рівень відповіді, виживаність без прогресування та загальну виживаність порівняно з хіміотерапією (дакарбазин). Незважаючи на високі початкові показники відповіді, у половини пацієнтів, які отримували BRAF-мішеневу монотерапію, пухлина рецидивує протягом 6 місяців через розвиток стійкості до препаратів. Альтернативні методи таргетування MAP-кінази вивчають як варіанти подолання резистентності до терапії інгібіторами BRAF. Траметиніб, кобіметиніб і бініметиніб є пероральними інгібіторами невеликих молекул MEK1 та MEK2.
Пацієнти із метастазами у ЦНС. У більшість проспективних рандомізованих досліджень, у яких вивчають інгібітори імунних контрольних точок у пацієнтів з меланомою та віддаленою метастатичною хворобою, не включають пацієнтів з активними метастазами в мозку. Хоча пацієнти з безсимптомними метастазами в мозку не були виключені, у багатьох із цих досліджень підгрупи пацієнтів з метастазами цієї локалізації були дуже малими, та/або дані з цих підгруп не повідомлялись. Пацієнти з активними метастазами в мозку були виключені з проспективних порівняльних досліджень, у яких тестували BRAF-мішеневу терапію. У кількох проспективних непорівняльних дослідженнях вивчали ефективність монотерапії дабрафенібом, монотерапії вемурафенібом і комбінації дабрафеніб/траметиніб у пацієнтів з метастазами в мозку. У деякі з цих досліджень включали пацієнтів із симптомними метастазами в мозку, а в деякі – пацієнтів, у котрих інтракраніальне захворювання прогресувало після місцевої терапії. У всі дослідження залучали пацієнтів, які попередньо отримували системну терапію з приводу метастатичної хвороби, але у більшості виключили пацієнтів із попередньою терапією інгібіторами BRAF. Результати цих досліджень свідчать, що метастази меланоми в мозку можуть реагувати на монотерапію інгібіторами BRAF або комбіновану терапію інгібіторами BRAF/MEK, хоча і з меншим рівнем відповіді, ніж при екстракраніальній хворобі. Примітно, що інтракраніальна відповідь спостерігалась навіть у пацієнтів, котрим попередньо проводили системну терапію з приводу метастатичної хвороби, із симптомними метастазами в мозку та інтракраніальним прогресуванням після місцевої терапії, оскільки ці популяції, як правило, важко піддаються лікуванню.
Для планування лікування пацієнтів із метастазами в ЦНС слід розглянути пріоритет системних методів лікування з активністю проти метастазів у ЦНС. Для системної терапії у пацієнтів із безсимптомними метастазами у головному мозку, які не потребують кортикостероїдів, комбінована терапія анти-PD‑1 препарат/іпілімумаб є кращою, ніж монотерапія анти-PD‑1 засобом або дабрафенібом і траметинібом, завдяки вищій інтрацеребральній активності.
При метастазах меланоми у мозку з наявністю мутації BRAF V600 недостатньо даних, щоб визначити, чи є імунна терапія або терапія інгібіторами BRAF/MEK доцільною як системна терапія першої лінії.
План лікування пацієнтів з метастазами в мозку слід узгоджувати з радіологами, навіть коли опромінення спочатку не застосовується.
Пацієнтам із симптомним ураженням головного мозку або яким для контролю симптомів потрібне введення кортикостероїдів, настійно рекомендується лікування під наглядом мультидисциплінарної команди, включаючи нейрохірургів, променевих онкологів, медичних онкологів і спеціалістів паліативної допомоги.
Деякі пацієнти можуть бути кандидатами на системну терапію як єдиний початковий спосіб лікування, без необхідності в хірургічному втручанні або променевій терапії, якщо немає інтракраніального прогресування хвороби. Для всіх пацієнтів, які отримують лікування за таким підходом, настійно рекомендується ретельне спостереження (магнітно-резонансна томографія головного мозку через кожні 6-8 тижнів).
За матеріалами Cutaneous Melanoma. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Version 4.2020 – September 1, 2020. NCCN.org
Підготував Назар Лукавецький
Більше матеріалів тут: http://health-ua.com/actual-theme/oncology/42113-aktualna-tema-targetna-terapya-melanomi-z-mutatcyami-BRAF?utm_source=qr-code&utm_medium=AT_oncology_42113_melanomi&utm_campaign=Novartis
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (66) 2020 р.