24 січня, 2021
Сучасні аспекти діагностики та лікування хворих на хронічну ішемію мозку
У жовтні 2020 року в онлайн-режимі відбувся науково-практичний симпозіум із міжнародною участю «Нові моделі та технології надання неврологічної, психіатричної та наркологічної допомоги». Серед найактуальніших питань сучасної медицини були, зокрема, розглянуті аспекти етіопатогенезу, діагностики й терапії хронічної ішемії мозку (дисциркуляторної енцефалопатії, ДЕ) та її важливої складової – хвороби малих судин головного мозку (ХМС), надання допомоги пацієнтам із мозковим інсультом і деменцією, а також проблеми, пов’язані зі старінням.
Сучасний погляд на патогенез і терапію пацієнтів із хронічною ішемією мозку
 Тамара Сергіївна Міщенко, д. мед. н., професор, завідувач кафедри неврології, психіатрії, наркології та медичної психології Харківського національного університету імені В.Н. Каразіна, розглянула сучасні аспекти етіопатогенезу, діагностики й лікування ДЕ. Як зазначила лекторка, за даними МОЗ, в Україні на цю недугу страждають більш ніж 2 млн осіб.
Тамара Сергіївна Міщенко, д. мед. н., професор, завідувач кафедри неврології, психіатрії, наркології та медичної психології Харківського національного університету імені В.Н. Каразіна, розглянула сучасні аспекти етіопатогенезу, діагностики й лікування ДЕ. Як зазначила лекторка, за даними МОЗ, в Україні на цю недугу страждають більш ніж 2 млн осіб.
Термінологія: розмаїття і розбіжності
Термін ДЕ запропонували ще у 50-х рр. минулого століття Е.В. Шмідт та Г.А. Максудов. ДЕ було визначено як стан, що проявляється прогресуючими багатоосередковими розладами функцій головного мозку, зумовлений хронічною судинною мозковою недостатністю та/або повторними епізодами гострих порушень мозкового кровообігу.
Як відомо, критеріями ДЕ є наявність:
- клінічних ознак ураження мозку: неврологічних, когнітивних, емоційно-ефективних, що підтверджені психодіагностичними та психопатологічними методами;
- серцево-судинного захворювання (ССЗ), як-от атеросклероз, артеріальна гіпертензія тощо, виявленого за анамнезом та інструментально;
- причинно-наслідкового зв’язку між клінічними ознаками ураження мозку та ССЗ;
- структурних змін мозку за даними нейровізуалізації – комп’ютерної (КТ) та магнітно-резонансної томографії (МРТ) головного мозку;
- клінічних та параклінічних ознак прогресування цереброваскулярної недостатності.
Невизначеність діагностичних критеріїв ДЕ часто призводить до гіпердіагностики. Тож досить часто під маскою ДЕ можуть «ховатися» хвороби Альцгеймера та Паркінсона, деменція з тільцями Леві, лобно-скронева деменція, нормотензивна гідроцефалія, доброякісне позиційне запаморочення, вестибулопатія, порушення з боку емоційної сфери, головний біль напруги.
Варто зауважити, що терміну «дисциркуляторна енцефалопатія» немає у Міжнародній класифікації хвороб 10-го перегляду (МКХ‑10), натомість йому відповідають «церебральний атеросклероз», «прогресуюча судинна лейкоенцефалопатія» (хвороба Бінсвангера), «гіпертензивна енцефалопатія», «хронічна ішемія мозку», «легкі когнітивні розлади», «органічний емоційно-лабільний розлад». Термін «хронічна ішемія мозку» прийшов на зміну терміну ДЕ.
Хронічна ішемія мозку – хронічна прогресуюча форма цереброваскулярної недостатності, що пов’язана із дрібноосередковим або дифузним ураженням головного мозку та проявляється комплексом неврологічних і нейропсихологічних розладів (Левін, 2010).
Отже, сучасним тенденціям більше задовольняє термін «хронічна ішемія мозку».
Етіологія та патогенез
Етіологічними факторами хронічної ішемії мозку є артеріальна гіпертензія, хвороби серця (миготлива аритмія, вади серця, серцева недостатність), атеросклероз та ССЗ, а також метаболічний синдром і цукровий діабет (ЦД). При цьому ризик розвитку хронічної ішемії мозку збільшується при коморбідній патології.
Своєю чергою до факторів ризику хронічної ішемії мозку належать похилий вік, генетичні фактори, артеріальна гіпертензія, атеросклероз, церебральна амілоїдна ангіопатія, запалення та імунна патологія, колагеноз вен, пострадіаційна ангіопатія, недостатня тривалість сну (Pantoni, 2014).
Патогенетичними механізмами розвитку хронічної ішемії мозку є (Дамулін, 2004; Міщенко, 2012; Pantoni et al., 2014; Левін та співавт., 2018):
- порушення функціонування нейроваскулярних одиниць (об’єднаних у загальну функціональну одиницю нейронів, астроцитів та клітин дрібних судин);
- порушення авторегуляції мозкового кровотоку та цілісності гематоенцефалічного бар’єру (ГЕБ);
- ендотеліальна дисфункція;
- гіпоперфузія головного мозку.
У ґенезі розвитку всіх неврологічних, когнітивних, підкіркових синдромів лежать порушення трансмітерних систем, зокрема синтезу дофаміну, ацетилхоліну, норадреналіну та серотоніну.
Клінічні ознаки
Симптомами хронічної ішемії мозку є поєднання неврологічних порушень із когнітивними та психоемоційними розладами. Хворі скаржаться на головний біль, головокружіння, шум у вухах, тривожність, зниження пам’яті, порушення сну. Також мають місце порушення ходи: так звана обережна хода, короткі кроки, труднощі ініціації ходьби, тупотіння, «залипання» до підлоги, «хода лижника», порушення підтримки рівноваги, падіння. Для хронічної ішемії мозку характерні наростання емоційно-афективних порушень, повільно прогресуючий когнітивний дефіцит, поступова поява порушень координації та ходи, темпу та ритму рухів, синдром паркінсонізму, пірамідний, псевдобульбарний синдроми, порушення контролю за функцією тазових органів.
Облігатною ознакою хронічної ішемії мозку є нейрокогнітивні порушення, а саме дефіцит уваги, неспроможність до концентрації; дезорієнтація в обстановці, що змінюється; погіршення пам’яті, уповільнення мислення, звуження кола інтересів. Виділяють такі типи перебігу хронічної ішемії мозку, як повільно-прогредієнтний (класичний) – 70%, швидкопрогредієнтний (галопуючий) – 20%, ремітивний (шубоподібний) – 10%.
Медикаментозна та немедикаментозна терапія
Діагностика хронічної ішемії мозку передбачає проведення клініко-неврологічного, психодіагностичного, інструментального та лабораторного досліджень, а також методів нейровізуалізації (КТ, МРТ).
Мета лікування хворих на хронічну ішемію мозку полягає у зниженні ризику розвитку мозкового інсульту та деменції, підвищенні якості життя.
Принципи терапії хронічного цереброваскулярного захворювання передбачають:
- корекцію факторів ризику;
- лікування соматичної патології;
- поліпшення мозкової перфузії;
- вплив на ендотеліальну дисфункцію;
- профілактику повторних тромбоемболічних ускладень;
- лікування неврологічних симптомів та синдромів;
- корекцію емоційних порушень;
- нейропротективну терапію.
Актуальним медичним, фармакологічним і соціальним завданням лишається відновлення та збереження когнітивних функцій у пацієнтів із цереброваскулярними захворюваннями.
Відомо, що фактор росту нервової тканини (NGF) відновлює зв’язки нейронів після ішемічного пошкодження мозку. Серед безлічі засобів та природних факторів увагу дослідників вже давно привертають базидіоміцети як джерело речовин, що збільшують у мозку вміст нейротрофінів (NGF, нейротрофічного фактора головного мозку, нейротрофіну‑3).
До останніх належить екстракт герицію гребінчастого (Hericium erinaceus), діючою речовиною якого є дитерпеноїд еринацин, що виявляє біологічну активність як потужний стимулятор синтезу NGF та може бути корисним для лікування нейродегенеративних розладів і периферичної невропатії (Li et al., 2018). Збільшення вмісту NGF після використання еринацину зафіксовано, зокрема, в гіпокампі, що страждає від хронічної ішемії, та у ретикулярній формації (рис. 1). Еринацин зменшує гліальну активацію і розвиток апоптозу в гіпокампі, а також корі головного мозку (Tzeng, 2016).
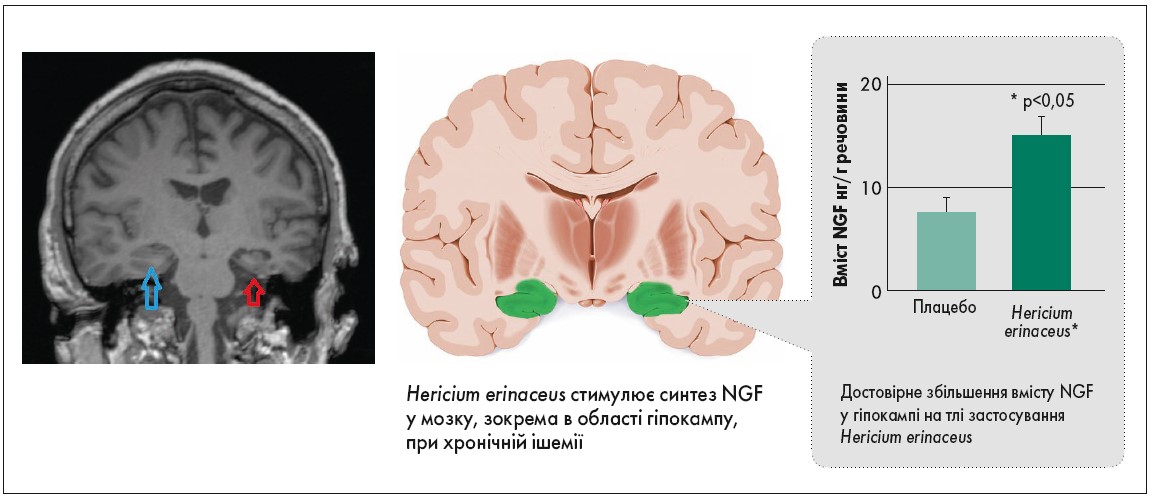 Рис. 1. Збільшення вмісту NGF у гіпокампі осіб із хронічною ішемією мозку при лікуванні препаратом Цеброфіт
Рис. 1. Збільшення вмісту NGF у гіпокампі осіб із хронічною ішемією мозку при лікуванні препаратом Цеброфіт
Адаптовано за M. Shimbo et al., 2005.
Цеброфіт компанії «Крео Фарм» – комплекс ериноцинів грибного походження з низькою молекулярною масою, при створенні якого було використано екстракт Hericium erinaceus (2 капсули екстракту відповідають 3 г оригінального Hericium erinaceus). Він збільшує синтез NGF у пацієнтів із цереброваскулярною недостатністю та сприяє відновленню руху, поліпшенню пам’яті, а також зменшує прояви запаморочення.
Натепер продемонстровано ефективність Цеброфіту (Hericium erinaceus mycelium) при хворобі Альцгеймера, зниженні когнітивного дефіциту, тривоги та депресії при хворобі Паркінсона, а також у хворих із цереброваскулярними захворюваннями (Zhang et al., 2016; Lee t al., 2020).
Поліпшення когнітивних функцій спостерігається вже на другому тижні його застосування. У хворих після ішемічного інсульту Цеброфіт знижує ризик інвалідизації та зменшує залежність від сторонньої допомоги. У пацієнтів із цереброваскулярними патологіями при застосуванні дози, еквівалентної 2 капсулам Цеброфіту, після двох місяців лікування достовірно поліпшуються рухова функція, пам’ять та координація (рис. 2) (Mori et al., 2009).
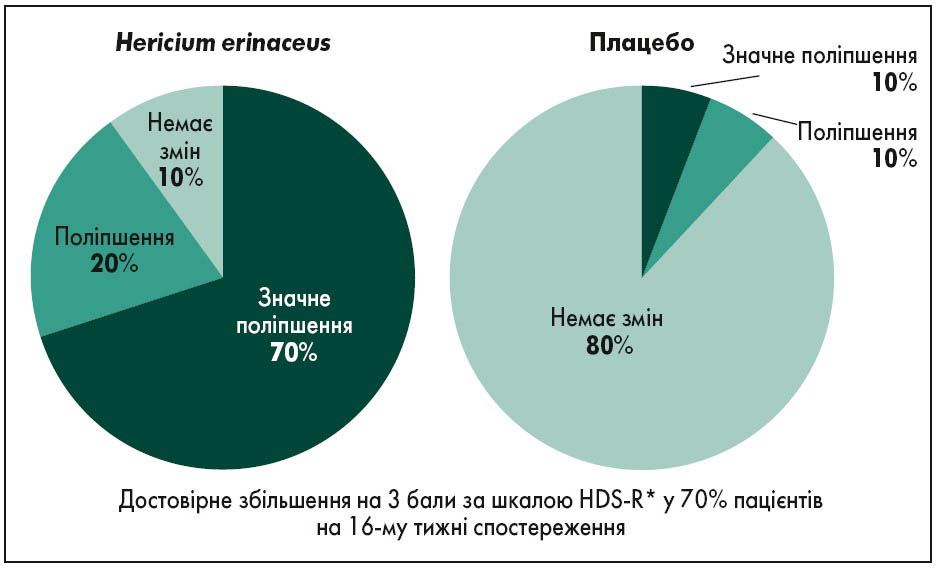 Рис. 2. Значне поліпшення когнітивних функцій у пацієнтів при лікуванні препаратом Цеброфіт
Рис. 2. Значне поліпшення когнітивних функцій у пацієнтів при лікуванні препаратом Цеброфіт
Адаптовано за K. Mori et al., 2009.
Своєю чергою немедикаментозні методи лікування осіб із хронічною ішемією мозку передбачають заходи для підвищення когнітивного резерву (когнітивні тренінги, розвиток соціальних зв’язків, зниження рівня депресії, розумові та фізичні вправи), тренування утримання балансу та запобігання падінням, психо-, арома-, музико-, арт-терапії, застосування масажних технік, організацію повсякденної активності, середземноморську дієту тощо (Livingston et al., 2017).
Хвороба малих судин головного мозку: що нам відомо?
 Владислав Миколайович Міщенко, д. мед. н., керівник відділу судинної патології головного мозку та реабілітації ДУ «Інститут неврології, психіатрії та наркології НАМН України» (м. Харків), присвятив свою доповідь особливостям патогенезу, діагностики та лікування хвороби малих судин (ХМС) головного мозку.
Владислав Миколайович Міщенко, д. мед. н., керівник відділу судинної патології головного мозку та реабілітації ДУ «Інститут неврології, психіатрії та наркології НАМН України» (м. Харків), присвятив свою доповідь особливостям патогенезу, діагностики та лікування хвороби малих судин (ХМС) головного мозку.
Як зазначив спікер, терміном «хвороба малих судин» позначають групу патологічних процесів різної етіології, що супроводжуються пошкодженням дрібних перфоруючих артерій, артеріол, венул та капілярів, які забезпечують кровопостачання глибоких структур головного мозку (Pantoni et al., 2014; Charidimou, 2015).
Етіопатогістологічна класифікація ураження малих судин головного мозку визначає шість типів (Thompson et al., 2009; Wardlaw et al., 2013):
- тип 1: артеріолосклероз (при ураженнях дрібних судин, пов’язаних із віком і судинними факторами ризику);
- тип 2: спорадична і спадкова церебральна амілоїдна ангіопатія;
- тип 3: спадкові та генетичні захворювання дрібних судин, відмінні від церебральних амілоїдних ангіопатій (церебральна автосомно-домінантна артеріопатія з субкортикальними інфарктами та лейкоенцефалопатією, хвороба Фабрі тощо);
- тип 4: ураження дрібних судин, пов’язані із запаленням та імунною патологією (гранулематоз Вегенера, васкуліт нервової системи, синдром Шегрена та ін.);
- тип 5: колагеноз вен;
- тип 6: інші захворювання дрібних судин – неамілоїдна мікроваскулярна дегенерація при хворобі Альцгеймера, пострадіаційна ангіопатія.
До патогістологічних особливостей ХМС належать ліпогіаліноз, мікроаневризми в ділянці таламуса, фібриноїдний некроз, мікроатерома.
Чинники ризику
Чинниками ризику ХМС є похилий вік, генетичні фактори, артеріальна гіпертензія (АГ), атеросклероз, церебральна амілоїдна ангіопатія, запалення та імунна патологія, колагеноз вен, пострадіаційна ангіопатія (Dichgans, 2007). Серед основних факторів судинного ризику варто відзначити такі, як АГ (>140/90 мм рт. ст.), дисліпідемія, цукровий діабет (ЦД), фібриляція передсердь, метаболічний синдром, куріння, підвищений рівень креатиніну, знижена швидкість клубочкової фільтрації, інфаркт міокарда в анамнезі, ураження периферичних артерій, апное уві сні тощо (Hara et al., 2009).
Діагностика
Оскільки дрібні судини поки що неможливо візуалізувати in vivo, основним методом визначення цієї патології є нейровізуалізація. З-поміж діагностичних методів слід відзначити магнітно-резонансну (МРТ) і комп’ютерну томографію головного мозку, клініко-неврологічне обстеження, ультразвукову доплерографію судин голови та шиї, а також біохімічні дослідження.
Одним із нейрорадіологічних маркерів ХМС є симптомні та безсимптомні (німі) лакунарні інфаркти. «Німі» інфаркти мозку мають розмір від 3 до 15 мм у діаметрі та виявляються при проведенні нейровізуалізації або посмертно, але клінічно не проявляються ознаками гострого порушення мозкового кровообігу (Yoshida et al., 2009). Своєю чергою лакунарні інфаркти мозку – незначні за величиною (менш ніж 1,5 см у максимальному діаметрі), що виникають внаслідок ураження глибоких дрібних пенетруючих гілок основних інтракраніальних артерій та проявляються ознаками симптомного мозкового інсульту.
Також одним із поширених нейрорадіологічних маркерів ХМС є патологія білої речовини, яка зустрічається у 80% осіб білого населення віком >60 років. Гіперінтенсивність білої речовини спостерігається у 2/3 хворих із деменцією та 1/3 осіб із хворобою Альцгеймера (De Leeuw et al., 2011; Isaac et al., 2015).
Широке впровадження у клінічну практику методів нейровізуалізації сприяло зростанню частоти виявлення мозкових мікрокрововиливів – гіперінтенсивних пошкоджень діаметром 2‑5 мм на МРТ у режимі градієнтного відлуння або візуалізації. Їхня поширеність становить 5% серед здорових дорослих, 34% – у пацієнтів після ішемічного інсульту та 60% – серед осіб після травматичного внутрішньомозкового крововиливу. Відомо, що мікрокрововиливи пов’язані з порушенням когнітивних функцій (Greenberg, 2009; Moran, 2011).
Також нейрорадіологічними маркерами ХМС є розширення периваскулярних просторів та церебральна атрофія.
Інші біомаркери
Клінічні дослідження біомаркерів ХМС перебувають на стадії розвитку, при цьому найбільш вивченими вважають нейрональні (як-то глутамат, гомоцистеїн, нейрон-специфічна енолаза, τ-протеїн, N-ацетиласпартат, NR2-пептид, NR2-антитіла) та гліальні (білок S‑100β, основний білок мієліну, гліальний фібрилярний білок). Серед неспецифічних маркерів у хворих із ХМС визначають концентрацію протизапальних цитокінів, маркери вродженого імунітету. З огляду на одну із провідних ролей у патогенезі ХМС ендотеліальної дисфункції та системного запалення, рекомендоване визначення С-реактивного білка та деяких інших показників – асиметричного диметиларгініну, простацикліну, вітамінів групи В тощо (Jain, 2010; Путиліна, 2017).
З урахуванням важливої ролі АГ у патогенезі ХМС, перспективним є вивчення генів ренін-ангіотензин-альдостеронової системи, до складу якої входить низка ферментів, як-от ренін-ангіотензиноген, ангіотензинперетворювальний фермент, ангіотензин І, ІІ тощо (Сooper et al., 2007).
Клінічні маркери
Часто ХМС розвивається без грубої клінічної симптоматики, але його пізні стадії асоційовані з когнітивним зниженням, високим ризиком деменції та інсульту. Передбачається, що ХМС часто зумовлює виникнення судинної деменції та робить значний внесок у розвиток поєднаної деменції. Відомо, що ХМС є причиною майже 50% інсультів (Norving, 2008).
Основні клінічні маркери ХМС:
- неврологічні розлади (порушення ходи та рівноваги, сфінктерні порушення, екстрапірамідні розлади, мозочкові порушення, псевдобульбарний синдром);
- когнітивні порушення;
- астенічні розлади;
- апатія і депресивні розлади.
Особливостями когнітивних порушень при ХМС є поступовий початок захворювання; часто когнітивні порушення мають латентний характер. Також спостерігається неухильне наростання когнітивного дефіциту. Водночас особливості когнітивних порушень багато в чому залежать від локалізації та кількості «німих інфарктів». Зокрема, переважають лобно-підкірковий профіль деменції з раннім розвитком регуляторних, когнітивних, емоційних та поведінкових порушень, зокрема депресії та апатичних розладів; до того ж нові осередки підсилюють когнітивний дефіцит. Когнітивні порушення поєднуються з підкірковим, пірамідним, вестибуло-атактичним та іншими синдромами (Norving, 2008).
Натепер описано понад 25 синдромів, що супроводжуються лакунарними інфарктами мозку. Найчастіше зустрічаються такі варіанти: чисто руховий (50%), сенсомоторний за гемітипом (35%), атактичний геміпарез (10%), чисто сенсорний (5%) (Путиліна, 2019).
Клінічні наслідки
Наслідками ХМС можуть бути деменція (судинна та нейродегенеративна) та мозковий інсульт. Факторами ризику розвитку деменції у хворих на ХМС є вік, ЦД 2-го типу, наявність множинних вогнищ німих інфарктів міокарда, їхня локалізація у базальних гангліях, патологія білої речовини головного мозку, ознаки виразної церебральної атрофії, мікрокрововиливи (Bernick et al., 2001).
Хвороба Альцгеймера та ХМС мають загальні чинники ризику та разом призводять до зниження когнітивних функцій і розвитку деменції (Dichgans et al., 2012). Клінічні відмінності хвороби Альцгеймера від судинних когнітивних порушень або судинної деменції залишаються поки що розпливчастими.
Наявність у хворого ХМС підвищує ризик симптомного інсульту в 2‑4 рази (Sleffens et al., 2002).
Факторами ризику симптомного мозкового інсульту у хворих на ХМС є АГ із порушенням циркадного ритму та недостатнім зниженням артеріального тиску вночі, наявність ≥3 чинників судинного ризику чи їхній незадовільний контроль, патологія білої речовини мозку, нерегулярне приймання ліків (Міщенко, 2016).
Стратегія лікування
Стратегія терапії осіб із ХМС передбачає виявлення та корекцію факторів судинного ризику, поліпшення мозкової гемодинаміки, профілактику тромбоутворення, вплив на ендотеліальну дисфункцію, корекцію неврологічних симптомів та синдромів, а також лікування когнітивних порушень.
Для зменшення когнітивної дисфункції застосовують інгібітори ацетилхолінестерази (донепезил, галантамін, ривастигмін та ін.), антиоксиданти (вітамін Е, селегілін тощо), протизапальні засоби, антагоністи рецепторів N-метил-D-аспартату (мемантин), інші препарати (церебролізин, цитиколін, ніцерголін, екстракт гінкго білоба, пірацетам, німодипін, вінкамін). Також доцільним є застосування засобів герицію гребінчастого (Hericium erinaceus), який достовірно поліпшує когнітивні функції (Mori et al., 2008).
Цеброфіт компанії «Крео Фарм», 1 капсула якого містить 150 мг екстракту (1:10) Hericium erinaceus, сприяє збільшенню вмісту факторів росту нервової тканини, зокрема в гіпокампі, який страждає при хронічній ішемії. В результаті його застосування відбуваються поліпшення пам’яті, мислення та зменшення наслідків ішемії головного мозку.
Підготувала Олександра Демецька
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (55) 2020 р.



