15 травня, 2021
Ураження серця, пов’язані з COVID-19: діагностика та лікування
На початку пандемії коронавірусної хвороби (COVID‑19) вважалося, що захворювання уражає переважно легеневу тканину. Втім, досить швидко з’явилися дані про високу поширеність уражень інших органів і систем. Із накопиченням клінічного досвіду стає очевидною висока частота ковід-асоційованих уражень серця (особливо в пацієнтів із несприятливим преморбідним фоном). Згідно з даними світової статистики, в 7,2% усіх пацієнтів, госпіталізованих щодо COVID‑19, реєструють клінічну маніфестацію уражень серця, серед яких 23% припадає на серцеву недостатність – СН (Guzik T. J. et al., 2020). Встановлення патофізіологічних механізмів впливу COVID‑19 на серцево-судинну систему в перспективі дасть змогу розробити стратегію профілактики, своєчасної діагностики та лікування кардіальних ускладнень. Найсвіжіші дані про зв’язок COVID‑19 із захворюваннями серця мали змогу отримати українські лікарі, котрі взяли участь в онлайн-конференції «Школа із серцевої недостатності для сімейних лікарів», яка відбулася 27 квітня. У рамках заходу за участю провідних вітчизняних кардіологів проведений окремий симпозіум «Ураження серця, пов’язані з COVID‑19: діагностика та лікування».
Доповідь, присвячену взаємозв’язку між COVID‑19 і СН представив президент Української асоціації фахівців із серцевої недостатності, керівник відділу серцевої недостатності ДУ «ННЦ «Інститут кардіології ім. М. Д. Стражеска» НАМН України» (м. Київ), доктор медичних наук, професор Леонід Георгійович Воронков.
 Найперше доповідач зазначив, що зв’язок між COVID‑19 і СН доцільно розглянути в 3 аспектах:
Найперше доповідач зазначив, що зв’язок між COVID‑19 і СН доцільно розглянути в 3 аспектах:
» CН розвивається на тлі COVID-19;
» пацієнт із хронічною СН (ХСН) захворів на коронавірусну інфекцію;
» пацієнт із ХСН не мав COVID‑19.
CН маніфестує на тлі COVID‑19
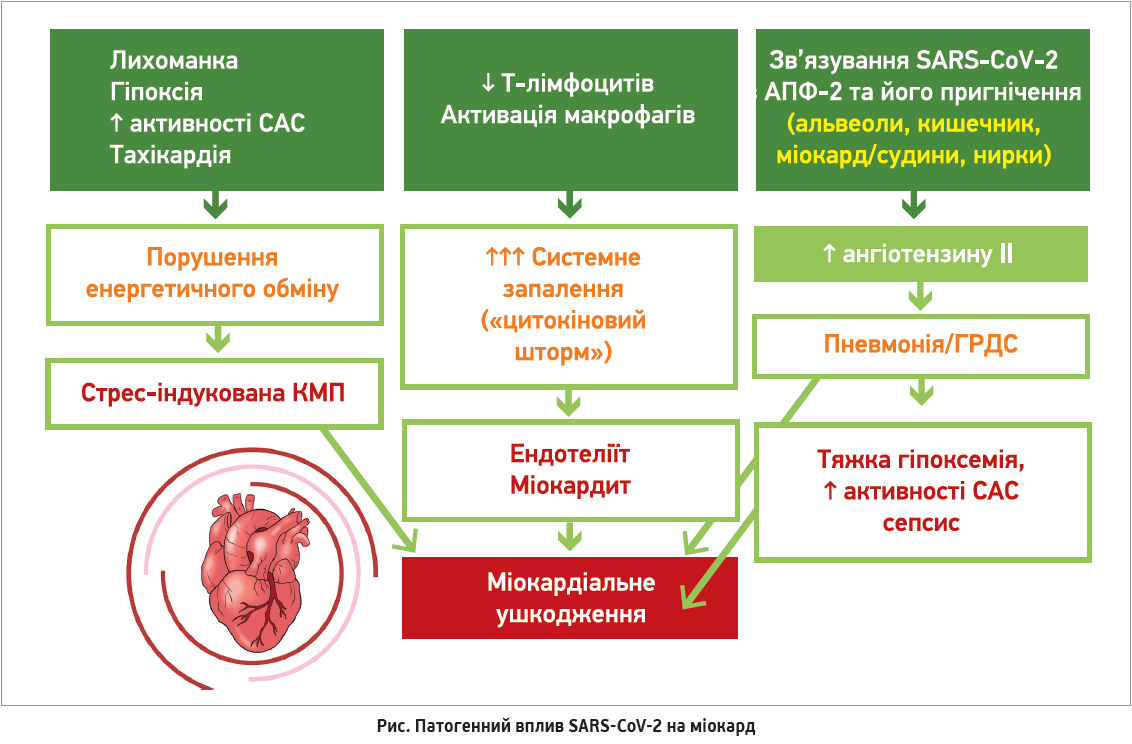
СН, яка з’явилася вперше в пацієнта з коронавірусною інфекцією, можна вважати ускладненням тяжкого перебігу COVID‑19. Виокремлюють декілька основних механізмів ушкоджувальної дії цього захворювання на серцевий м’яз: прямий вплив самого вірусу SARS-CoV‑2 на міокард, несприятлива дія численних факторів патогенезу COVID‑19. Зокрема, такі прояви інфекції, як лихоманка, гіпоксія, збільшення активності симпатоадреналової системи, тахікардія, здатні зумовлювати порушення енергетичного обміну, виснаження енергетичних резервів міокарда з подальшим розвитком стрес-індукованої кардіоміопатії.
Активація макрофагів і надмірна продукція прозапальних цитокінів, які часто супроводжують тяжкий перебіг COVID‑19, у період між 1-2 тиж захворювання ускладнюються розвитком оксидативного стресу та вираженого системного запалення (цитокіновий шторм). Наслідком перелічених змін є гостре генералізоване запалення ендотелію (гострий ендотеліїт) із залученням судин серця, включаючи мікроциркуляторне русло, що спричиняє порушення регуляції серцевого кровотоку, формування мікротромбозів і суттєве погіршення перфузії міокарда.
Доведено, що для проникнення всередину клітини вірус SARS-CoV‑2 використовує рецептор ангіотензинперетворювального ферменту 2 типу (АПФ‑2). Зв’язування вірусу з рецепторами АПФ‑2, які широко представлені в альвеолах, кишечнику, міокарді, судинах і нирках, спричиняє зниження їхньої активності, що супроводжується компенсаторним підвищенням рівня ангіотензину ІІ в крові. Як відомо, ангіотензин ІІ є потужним фактором стимуляції системного запалення, вазоконстрикції, оксидативного стресу, активності симпатоадреналової системи. Описані зміни вважаються однією з провідних причин розвитку пневмонії, гострого респіраторного дистрес-синдрому (ГРДС), тяжкої гіпоксії, сепсису, котрі, своєю чергою, чинять негативний вплив на стан міокарда (рис.).
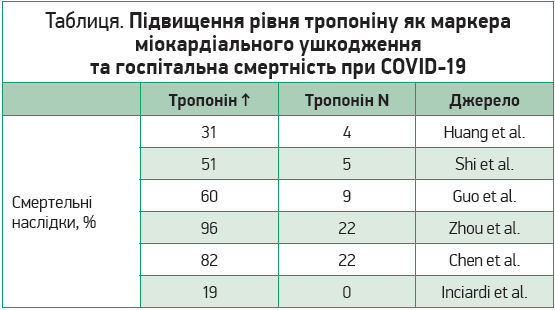
Лабораторним маркером ушкодження міокарда, в т. ч. спричиненого COVID‑19, є підвищення рівня тропоніну в крові. За допомогою низки робіт було продемонстровано, що понаднормове підвищення концентрації цього маркера супроводжується стрімким зростанням смертності пацієнтів із коронавірусною інфекцією (табл.).
Ще одним переконливим свідченням несприятливого впливу SARS-CoV‑2 на міокард є частий розвиток СН за тяжкого перебігу захворювання. Згідно з наданими китайськими дослідниками даними, серед госпіталізованих пацієнтів із COVID‑19 у 25% випадків діагностували гостру СН, при цьому в 52% хворих, які померли внаслідок COVID‑19, спостерігалася гостра СН (Zhou E. еt al., 2020).
Значна поширеність СН у госпіталізованих пацієнтів із COVID‑19 потребує обов’язкового моніторингу концентрації тропоніну. На жаль, українські фахівці не проводять визначення рівня тропоніну в госпіталізованих пацієнтів із коронавірусною інфекцією.
Лікування гострої СН при COVID‑19, згідно з чинним клінічним протоколом, має включати призначення діуретиків, інотропних засобів, антикоагулянтів. За наявності даних, які свідчать про гострий міокардит, із метою пригнічення системного запалення необхідно призначити глюкокортикоїди та блокатор рецепторів інтерлейкіну‑6 (тоцилізумаб).
Слід пам’ятати, що в пацієнтів із гострою СН часто з’являються аритмії, включаючи життєво небезпечні, тому в таких осіб необхідно проводити ретельний контроль електрокардіограми (ЕКГ).
Перебіг гострої СН при COVID‑19 має певні особливості. У таких пацієнтів дисфункція/дилатація правого шлуночка спостерігається значно частіше, ніж дисфункція лівого (31-39 проти 10%). Саме дисфункція правого шлуночка частіше асоціюється з тяжкістю перебігу коронавірусної інфекції та смертю пацієнтів.
Достеменно невідомо, чому за тяжкого перебігу COVID‑19 переважає дисфункція правого шлуночка. Припускають, що її причинами є легеневі ураження, цитокіновий шторм, гіперактивація ренін-ангіотензинової системи (РАС) і тромбоемболія мілких гілок легеневої артерії.
Пацієнт із ХСН захворів на COVID‑19
У загальній популяції поширеність ХСН становить приблизно 2%. Серед госпіталізованих із COVID‑19 пацієнтів від 5 до 7% мають ХСН (Mancia et al., 2020; Reynolds et al., 2020; Richardson et al., 2020). Наведені дані дають змогу припустити, що ХСН є обтяжувальним фактором перебігу COVID‑19.
На сьогодні ідентифіковано досить багато захворювань і патологічних станів, які є предикторами смерті при COVID-19. Серед них позиції лідерів займають гостре ушкодження нирок під час госпіталізації – відносний ризик (ВР) 5,62 (2,25-14,05), ХСН в анамнезі – ВР 5,38 (1,65-17,54) та кардіогенний шок – ВР 3,93 (1,25-12,37) (Giustino G. et al., 2020), тобто наявність ХСН збільшує ризик смерті внаслідок COVID‑19 більш ніж у 5 разів.
Анамнез ХСН у пацієнтів, госпіталізованих із COVID‑19, асоціюється зі смертністю, що є в 10 разів вищою, ніж у хворих, госпіталізованих щодо гострої СН без COVID‑19 (24,2 проти 2,6% відповідно) (Bhatt A. et al., 2021).
Чи мають змінюватися підходи до лікування ХСН під час COVID-19?
Фармакотерапія пацієнта з ХСН і зниженою фракцією викиду має включати:
Стандартні призначення:
- інгібітор АПФ (сартан – за непереносимості);
- сакубітрил/валсартан (як альтернатива інгібітору АПФ);
- β-блокатор;
- антагоніст мінералокортикоїдних рецепторів;
- інгібітори натрійзалежного котранспортера глюкози 2 типу (з 2021 р.).
Діуретик – у разі схильності до затримки рідини. Додатково за наявності показань: івабрадин, дигоксин.
У пацієнта із ХСН, який був госпіталізований щодо COVID‑19, немає жодних підстав змінювати зазначену схему лікування. Якщо спостерігаються лихоманка, посилена пітливість або виражена інтоксикація, може з’явитися потреба в зменшенні дози інгібіторів АПФ у зв’язку з ризиком зниження артеріального тиску. Дозу інгібіторів АПФ також необхідно знижувати в разі розвитку гіпотензії.
На початку пандемії COVID‑19 були побоювання, що призначення ІАПФ/БРА (переважно з метою лікування артеріальної гіпертензії) пацієнтам із коронавірусною інфекцією може зумовити погіршення клінічних наслідків, але вони не підтвердилися. Натомість призначення цих препаратів сприяло зменшенню смертності на 11% (порівняно з плацебо), госпіталізації чи смерті – на 14% (Savarese G. et al., 2020).
Рандомізоване клінічне випробування BRASE-CORONA продемонструвало, що продовження прийому БРА впродовж госпіталізації не впливає на перебіг COVID‑19.
Пацієнт із ХСН в умовах пандемії ще не хворів на COVID‑19
Ураховуючи високий рівень смертності пацієнтів із COVID‑19 і ХСН, украй важливо запобігти коронавірусній інфекції в осіб, які страждають на ХСН. Насамперед слід запровадити досить жорстку побутову профілактику, включаючи навіть заборону виходити з власного помешкання. Планові візити до лікаря також мають бути значно обмежені, а консультування таких пацієнтів рекомендується проводити у відеорежимі. Безумовно, пацієнти з ХСН потребують проведення першочергової вакцинації проти COVID‑19.
Якщо пацієнт із ХСН захворів на COVID‑19, про що свідчать результати тестування, госпіталізувати його не потрібно. Такий хворий має продовжувати раніше призначене лікування ХСН. Доведено, що прийом інгібіторів АПФ, сакубітрилу/валсартану, β-блокаторів й антагоністів мінералокортикоїдних рецепторів істотно знижує ризик раптової смерті в амбулаторних пацієнтів.
Провідний науковий співробітник відділу некоронарогенних хвороб серця та клінічної ревматології ДУ «ННЦ «Інститут кардіології ім. М. Д. Стражеска» НАМН України», доктор медичних наук Дмитро Васильович Рябенко розповів про вплив вірусу SARS-CoV‑2 на кардіоваскулярну систему.
 Доповідач нагадав, що необхідною умовою розвитку інфекційного процесу є прикріплення вірусу SARS-CoV‑2 до клітинної мембрани з подальшим проникненням всередину клітини. Основним мембранним рецептором, з яким зв’язується шиповий протеїн S (spike protein) вірусу SARS-CoV‑2, є рецептор АПФ‑2, що є «вхідними воротами» вірусу. В результаті зв’язування S‑протеїну з рецептором АПФ‑2 відбувається проникнення SARS-CoV‑2 до клітини. Рецептори АПФ‑2 широко представлені на мембранах пневмоцитів 2 типу, ентероцитів, ендотеліальних клітин артерій і вен, а також клітин посмугованих м’язів багатьох органів. Допоміжну роль у проникненні вірусу до клітини мають Fc-рецептори, рецептори системи комплементу, екзосоми, апоптичні тільця, мікровезикули. Проте найбільша щільність рецепторів притаманна не легеневій тканині. Позиції лідерів за цим показником мають клітини товстої кишки, жовчного міхура, міокарда та нирок.
Доповідач нагадав, що необхідною умовою розвитку інфекційного процесу є прикріплення вірусу SARS-CoV‑2 до клітинної мембрани з подальшим проникненням всередину клітини. Основним мембранним рецептором, з яким зв’язується шиповий протеїн S (spike protein) вірусу SARS-CoV‑2, є рецептор АПФ‑2, що є «вхідними воротами» вірусу. В результаті зв’язування S‑протеїну з рецептором АПФ‑2 відбувається проникнення SARS-CoV‑2 до клітини. Рецептори АПФ‑2 широко представлені на мембранах пневмоцитів 2 типу, ентероцитів, ендотеліальних клітин артерій і вен, а також клітин посмугованих м’язів багатьох органів. Допоміжну роль у проникненні вірусу до клітини мають Fc-рецептори, рецептори системи комплементу, екзосоми, апоптичні тільця, мікровезикули. Проте найбільша щільність рецепторів притаманна не легеневій тканині. Позиції лідерів за цим показником мають клітини товстої кишки, жовчного міхура, міокарда та нирок.
Отже, COVID‑19 – поліорганне захворювання, що уражає багато органів і систем: нирки (некронефроз, ДВЗ‑синдром, гломерулопатія), печінка (стеатогепатоз, венозне повнокрів’я, ДВЗ‑синдром, масивний некроз гепатоцитів), шлунково-кишковий тракт (коліти, фібринозний коліт, гастрит, дуоденіт, васкуліти), підшлункова залоза (атрофія острівців і ліпоматоз, некроз острівців, нові випадки чи загострення цукрового діабету), головний мозок (набряк, ДВЗ‑синдром, ішемія, енцефаліт), щитоподібна залоза (тиреоїдит), м’язи (запальна міопатія).
Основними механізмами ураження міокарда є:
→ пряме ушкодження клітин вірусом SARS-CoV‑2;
→ дихальна недостатність і гіпоксія;
→ АПФ‑2-опосередкований вплив;
→ системне запалення (цитокіновий шторм);
→ коагулопатії.
Коронавірус здатен ушкоджувати не лише міокард, а й судини (ендотелій) і клітини імунної системи. Кардіальні ускладнення виявляють в 11-20% пацієнтів, які були госпіталізовані щодо COVID‑19. До них належать:
- гострий коронарний синдром;
- СН;
- кардіогенний шок;
- зупинка серця;
- тромбоемболії;
- кардіоміопатія;
- міокардит;
- перикардит і перикардіальний випіт;
- аритмії.
Слід розрізняти 2 типи міокардитів, які з’являються внаслідок COVID‑19: SARS-CoV‑2-індукований міокардит, який розвивається в гострому періоді розвитку інфекції та пост-SARS-CoV‑2-міокардит (постковідний міокардит). SARS-CoV‑2-індукований міокардит має фульмінантний тяжкий перебіг. Постковідний міокардит має легший перебіг, тому часто не діагностується. Проте дані скринінгових магнітно-резонансних томографій (МРТ) серця в пацієнтів, які перенесли COVID‑19, виявляють у 70% випадків ознаки запалення міокарда, у 22% – перикардиту.
SARS-CoV‑2-індукований міокардит розвивається здебільшого у хворих, які мають дуже тяжкий клінічний перебіг захворювання й отримують лікування у відділеннях інтенсивної терапії. Для своєчасного виявлення міокардиту в таких пацієнтів варто проводити моніторинг рівня тропоніну, натрійуретичного пептиду (NT‑proBNP), D‑димеру, фібриногену, С‑реактивного білка, феритину, глюкози. Із лабораторних методів діагностики слід застосовувати ЕКГ, холтерівський моніторинг, ехокардіографію (ЕхоКГ). КТ‑коронарографію рекомендується застосовувати в тому випадку, коли є підозра на ураження коронарних судин і результати обстеження можуть вплинути на тактику ведення такого пацієнта. Перелічені дослідження дають можливість установити лише попередній діагноз міокардиту.
Для остаточного підтвердження діагнозу необхідно виконати МРТ із контрастуванням. Рішення про необхідність ендоміокардіальної біопсії приймає команда експертів перед обговоренням застосування альтернативних методів терапії.
Пост-SARS-CoV‑2-міокардит слід запідозрити в пацієнтів, які перенесли коронавірусну інфекцію, але повторно звертаються по медичну допомогу зі скаргами, характерними для ураження кардіоваскулярної системи:
- біль у грудях;
- задишка;
- прискорене серцебиття;
- виражена слабкість.
Для підтвердження діагнозу міокардиту варто провести визначення рівня тропоніну, NT‑proBNP, ЕКГ, ЕхоКГ.
Для лікування тяжкого SARS-CoV‑2-індукованого міокардиту зазвичай використовують вазопресорні препарати, дофамін, добутамін, левосимендан, профілактичні дози низькомолекулярних гепаринів, екстракорпоральну мембранну оксигенацію. Для специфічного лікування рекомендують застосовувати метилпреднізолон у високих дозах (200-500 мг/добу), імуноглобулін внутрішньовенно (20-80 мг/добу), тоцилізумаб. Застосування противірусних препаратів у гострому періоді SARS-CoV‑2-індукованого міокардиту виявилося неефективним. Певний позитивний вплив на перебіг міокардиту спостерігався за призначення протипаразитарного препарату івермектину у високих дозах, які значно перевищують рекомендовані.
Лікування пост-SARS-CoV‑2-міокардитів розподіляють на протизапальне та симптоматичне. З метою протизапальної терапії рекомендується призначати противірусні препарати, інтерферон-β, імуноглобулін, нестероїдні протизапальні засоби, глюкокортикоїди. Для симптоматичного лікування постковідних міокардитів застосовують β-адреноблокатори, інгібітори РАС.
Глюкокортикоїди пригнічують усі фази запалення (незалежно від причини його виникнення). Дія цих препаратів реалізується за рахунок геномних і негеномних ефектів.
Негеномні ефекти реалізуються здебільшого за призначення високих доз глюкокортикоїдів нетривалим курсом. Ці ефекти включають:
◆ стабілізацію клітинних мембран і мембран лізосом;
◆ зниження проникності капілярів;
◆ гальмування міграції нейтрофілів і макрофагів у вогнище запалення та пригнічення їхньої фагоцитарної активності;
◆ пригнічення проліферації фібробластів і синтезу колагену;
◆ захист клітин від цитотоксичного впливу.
Чітких алгоритмів імуносупресивної терапії COVID‑19 за рахунок прийому глюкокортикоїдів наразі не існує.
Нерідко перебіг SARS-CoV‑2-індукованого міокардиту ускладнюється розвитком СН. З огляду на те що причиною СН у цьому випадку виступає запальний процес у міокарді, основним завданням є проведення ефективної протизапальної терапії. Звичайно, варто застосовувати сучасну підтримувальну терапію СН.
На сьогодні стандартне лікування ХСН включає інгібітор АПФ (сартан – за непереносимості) та β-блокатор. Утім, ці препарати не достатньо просто призначити – їх потрібно призначити правильно. Лікування слід розпочинати якнайраніше з мінімальних доз, поступово титруючи до цільових або максимально переносимих. Згодом пацієнт має продовжувати прийом препаратів у цільових дозах до повного припинення запального процесу в міокарді й одужання.
Підготував В’ячеслав Килимчук