30 липня, 2021
Ефективна гіполіпідемічна терапія – шлях до зниження серцево-судинного ризику
Серцево-судинні захворювання (ССЗ), серед яких атеросклероз коронарних артерій та судин головного мозку, є причиною понад 4 млн летальних випадків у Європі щороку. Тож важливість профілактики атеросклеротичних ССЗ залишається безперечною. Відповідно до рекомендацій Європейського товариства кардіологів (ESC) та Європейського товариства з атеросклерозу (EAS) 2019 р., слід проводити просвітницьку роботу на рівні загальної популяції шляхом залучення до здорового способу життя та зменшення причинних факторів ризику ССЗ, зокрема холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ). Саме тому корекції дисліпідемії приділяється значна увага як у вітчизняних, так і міжнародних настановах, а також присвячено численні дослідження. Корекція ХС ЛПНЩ при первинній або вторинній профілактиці за дуже високого ризику ССЗ передбачає застосування фармакотерапії, що включає статини, а за їх непереносимості чи недостатньої ефективності у максимально переносимих дозах наступним кроком є призначення інгібітора всмоктування ХС езетимібу.
Лікування дисліпідемії, зокрема зниження підвищеного рівня ХС ЛПНЩ, є невід’ємною складовою ведення пацієнтів із серцево-судинним (СС) ризиком. У численних генетичних, епідеміологічних та клінічних дослідженнях було доведено ключову роль ХС ЛПНЩ у формуванні атеросклерозу, а також пряму залежність між вмістом ХС ЛПНЩ та ймовірністю розвитку ішемічної хвороби серця (ІХС) (Ference et al., 2017). На сьогодні не викликає сумніву, що зниження рівня ХС ЛПНЩ скорочує імовірність виникнення атеросклеротичних ССЗ. На кожен 1 ммоль/л зменшення концентрації ХС ЛПНЩ у крові можна очікувати зниження ризику великих СС-подій на 21-24%, загальної смертності – на 12% (Ference et al., 2017).
Згідно з настановою ESC/EAC (2019), корекція ХС ЛПНЩ при первинній або вторинній профілактиці за дуже високого ризику ССЗ передбачає застосування терапевтичної схеми, що забезпечує зниження на ≥50% ХС ЛПНЩ від початкового значення та досягнення цільового рівня ХС ЛПНЩ <1,4 ммоль/л (<55 мг/дл). У разі розвитку атеросклеротичних ССЗ, повторної судинної катастрофи впродовж двох років та приймання максимально толерантної дози статину має бути розглянутий цільовий рівень ХС ЛПНЩ <1,0 ммоль/л, або <40 мг/дл (ІІb, В).
За наявності високого ризику ССЗ терапевтична тактика повинна забезпечувати зниження на ≥50% ХС ЛПНЩ від початкового показника та досягнення цільового рівня ХС ЛПНЩ <1,8 ммоль/л, або <70 мг/дл (І, А).
Визначення загального ризику ССЗ залежно від клінічних характеристик та даних лабораторних, інструментальних досліджень представлене в таблиці.
Фармакологічне зниження ХС ЛПНЩ
У рекомендаціях ESC/EAS щодо менеджменту осіб із дисліпідемією зазначено, що першим кроком медикаментозної терапії є високоінтенсивні статини, які застосовуть до найвищої толерантної дози для досягнення цільового рівня ХС ЛПНЩ, залежно від ступеня СС-ризику пацієнта (І, А). Якщо при терапії статином у максимально переносимій дозі цільового рівня не досягнуто, рекомендується додати езетиміб (І, В).
На сьогодні терапія статинами залишається основою як у первинній, так і вторинній профілактиці атеросклеротичних ССЗ (I, A). Слід пам’ятати, що для всіх статинів працює «правило 6 відсотків»: кожне подвоєння дози додає до гіполіпідемічної активності препарату лише 6%. Тобто у разі підвищення дози аторвастатину та розувастатину від мінімальної до максимальної можна додатково отримати лише 18% гіполіпідемічної ефективності. З одного боку, це може призвести до збільшення імовірності виникнення побічних явищ, з іншого – до негативної реакції з боку пацієнта щодо приймання статинів у максимальних дозах і, як наслідок, зменшення комплаєнсу.
Одним із варіантів розв’язання проблеми стосовно досягнення цільових значень ХС ЛПНЩ відповідно до наявного ступеня СС-ризику є додавання до статинотерапії інгібітора абсорбції ХС езетимібу. Комбіноване застосування статинів та езетимібу – яскравий приклад синергічної дії двох препаратів, що впливають на різні ланки розвитку гіперхолестеринемії.
Відомо, що на тлі приймання статинів відбувається пригнічення активності ГМГ-КоА-редуктази, що зумовлює низку послідовних реакцій, внаслідок яких спостерігаються зниження внутрішньоклітинного вмісту ХС, компенсаторне підвищення активності ЛПНЩ-рецепторів і, відповідно, прискорення катаболізму ХС ЛПНЩ. За принципом зворотного зв’язку, якщо у клітинах знижується концентрація ХС, компенсаторно може зрости абсорбція ХС у кишечнику, який поступає з їжею або жовчними кислотами (рис. 1) (Assmann et al., 2004).
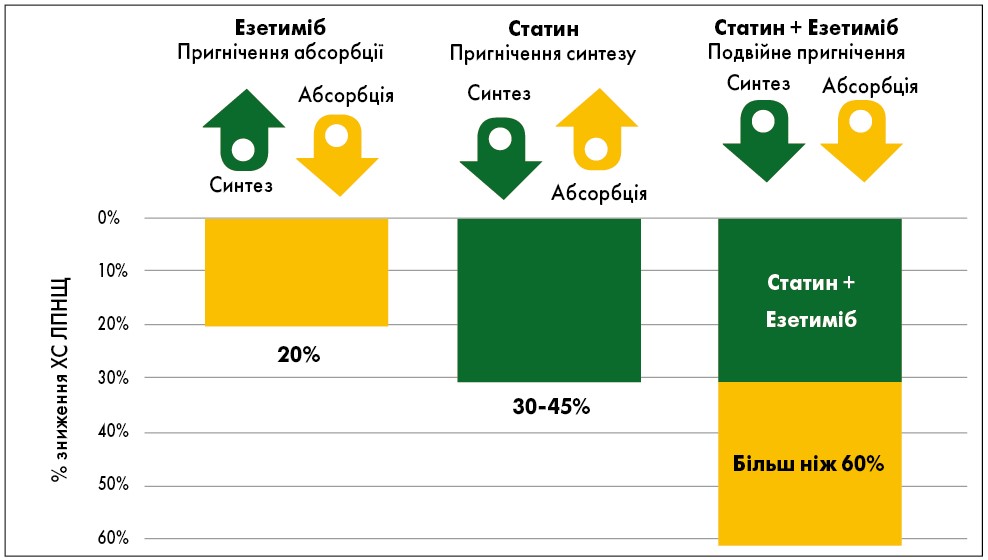 Рис. 1. Статин та езетиміб – взаємодоповнювальний механізм дії
Рис. 1. Статин та езетиміб – взаємодоповнювальний механізм дії
Примітка: Адаптовано за G. Assmann et al., 2004.
Езетиміб – це представник класу гіполіпідемічних засобів, які селективно пригнічують інтестинальну абсорбцію ХС і відповідних рослинних стеролів. Молекулярною мішенню езетимібу є переносник стеролів Niemann-Pick Cl-Like 1 (NPC1L1), що відповідає за всмоктування холестерину та фітостеролів у кишечнику.
Езетиміб локалізується на щітковій смужці тонкої кишки і пригнічує абсорбцію холестерину, зменшуючи доставку інтестинального холестерину в печінку, а статини знижують синтез холестерину в печінці. Разом ці механізми забезпечують додаткове зниження холестерину.
Клінічна ефективність та безпека
У контрольованих клінічних дослідженнях езетиміб у якості монотерапії, а також при супутньому застосуванні зі статином значно знижував загальний ХС, ХС ЛПНЩ, аполіпопротеїн В (Апо-В) та тригліцериди (ТГ) і підвищував ХС ліпопротеїнів високої щільності (ЛПВЩ) у пацієнтів із гіперхолестеринемією. Доклінічні дослідження показали, що езетиміб не індукує ферменти системи цитохрому Р450, які метаболізують препарат. Не спостерігалося жодних клінічно значущих фармакокінетичних взаємодій між езетимібом та препаратами, що метаболізуються ферментами системи цитохрому P450 1A2, 2D6, 2C8, 2C9 та 3A4 або N-ацетилтрансферазою.
Одним із найбільших досліджень, присвячених вивченню доцільності включення препарату до терапії статинами, стало EASE (Ezetimibe Add-on to Statin for Effectiveness Trial) за участю пацієнтів, які вже отримували статини протягом шести тижнів. У 77% хворих в анамнезі було діагностовано ІХС або її еквівалент, у 17% – два чи більше фактори ризику ІХС (Pearson et al., 2005).
Аторвастатин отримували 40% хворих, симвастатин – 30%, правастатин – 20%, інші – флувастатин або ловастатин. Пацієнти були розподілені на дві групи:
- 2020 осіб 1-ї групи отримували комбіновану терапію статином у дозі, яку застосовували раніше, та езетимібом по 10 мг;
- 1010 хворих 2-ї групи отримували статинотерапію та плацебо.
Дослідження тривало шість тижнів. Автори реєстрували ступінь зниження концентрації ЛПНЩ і кількість хворих, які досягли цільового рівня ЛПНЩ. Середнє зниження вмісту ЛПНЩ становило 23% у групі езетимібу порівняно із плацебо. Таким чином, сумісне використання 10 мг езетимібу зі статинотерапією додатково знизило концентрацію ЛПНЩ у середньому на 23%, що насамперед необхідне пацієнтам, які не досягають цільового рівня ЛПНЩ при застосуванні одного статину.
Вагомі результати щодо зниження СС-ризику досягнуті у межах багатонаціонального рандомізованого плацебо-контрольованого подвійного сліпого дослідження SHARP за участю 9438 осіб із хронічним захворюванням нирок, третина з яких на початковому етапі знаходилася на діалізі. Загалом 4650 пацієнтів отримували фіксовану дозу комбінації 10 мг езетимібу та 20 мг симвастатину, а 4620 – плацебо; хворі перебували під наглядом у середньому 4,9 року.
У пацієнтів, які застосовували комбінацію 10 мг езетимібу і 20 мг симвастатину, спостерігалося зниження СС-подій, як-то інфаркт міокарда, інсульт, реваскуляризація міокарда, на 17%. Через рік ХС ЛПНЩ знизився на 26% при монотерапії симвастатином у дозі 20 мг та на 38% при використанні 10 мг езетимібу в комбінації з 20 мг симвастатину порівняно із плацебо (Sharp Collaborative Group, 2010).
Переконливими є також дані випробування IMPROVE-IT за участю 18 144 пацієнтів із нещодавно перенесеним гострим коронарним синдромом (ГКС) (Cannon et al., 2015). Учасники були рандомізовані для приймання симвастатину/езетимібу (40/10 мг) та симвастатину (40 мг) 1:1.
На початку дослідження середній рівень ХС ЛНПЩ серед осіб із ГКС становив 2,46 ммоль/л в обох групах лікування. При використанні симвастатину в дозі 40 мг рівень ХС ЛНПЩ знизився до 1,81 ммоль/л через один рік. При додаванні езетимібу (10 мг) до симвастатину середній вміст ХС ЛНПЩ упродовж року зменшився ще більше: до 1,38 ммоль/л. Протягом семи років між двома видами терапії зберігалася значна різниця у досягнутих рівнях ХС ЛПНЩ. Так, додавання езетимібу до симвастатину на 25% додатково знижувало рівень ХС ЛНПЩ і на 6% – відносний ризик основних СС-ускладнень (рис. 2).
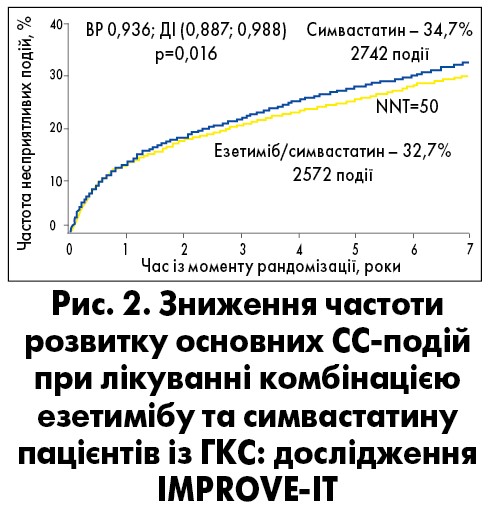
У групі лікування симвастатином та езетимібом спостерігалося статистично значуще зниження частоти таких несприятливих клінічних результатів, як смерть від СС-подій, тяжкі ускладнення ІХС (нелетальний інфаркт міокарда, нестабільна стенокардія, яка потребує госпіталізації, виконання реваскуляризації) або нефатальний інсульт (у 32,7 і 34,7% хворих відповідно; p=0,016).
Дослідження PRECISE-IVUS було присвячене оцінці впливу комбінованої гіполіпідемічної терапії езетимібом і статином на регрес атеросклеротичних бляшок із використанням методу внутрішньосудинного ультразвукового дослідження у хворих, яким виконували черезшкірні втручання на коронарних артеріях (Tsujita et al., 2015). Результати довели, що таке лікування сприяє зменшенню об’єму атеросклеротичних бляшок у пацієнтів із ГКС на 2,3%, що значно перевершує результати подібних випробувань із застосуванням монотерапії статинами.
Отримані дані підтверджують гіпотезу про пряму залежність між регресом атеросклеротичної бляшки і низькою концентрацією ХС ЛПНЩ у хворих на ГКС. Отже, дослідження PRECISE-IVUS вкотре підтверджує, що поєднане використання статинів і езетимібу може бути особливо ефективним підходом у веденні хворих із високим ризиком розвитку ускладнень, асоційованих з ІХС, наприклад, за наявності високої концентрації ХС ЛПНЩ, цукрового діабету, встановленого діагнозу ССЗ або сімейної гіперхолестеринемії.
Зменшення дисфункції ендотелію у стентованих коронарних артеріях на тлі застосування езетимібу зі статинами
Ендотеліальна дисфункція коронарних артерій передує атерогенезу і відіграє важливу роль у прогресуванні атеросклерозу та ІХС (Egashira et al., 1993).
Вивчення функції ендотелію коронарних судин є корисним для оцінки захисних ефектів серцево-судинної системи (Flammer et al., 2012). У клінічних дослідженнях було показано, що монотерапія езетимібом покращувала функцію ендотелію периферичних артерій, однак вплив препарату на таку коронарних судин невідомий (Nochioka et al., 2012).
У цьому контексті S. Takase et al. (2017) вирішили провести багатоцентрове рандомізоване контрольоване дослідження CuVIC, присвячене застосуванню езетимібу в поєднанні зі статинами з метою поліпшення функції ендотелію коронарних артерій порівняно з монотерапією статинами у пацієнтів після ЧКВ.
Пацієнтів, яким успішно виконали ЧКВ (n=260), рандомізували для отримання монотерапії статинами (група S, n=131) або езетимібу в комбінації зі статинами (група E + S, n=129). Автори оцінювали дисфункцію, недостатність судин-мішеней протягом досліджуваного періоду та ендотеліальну дисфункцію коронарних артерій за допомогою внутрішньокоронарного тестування на ацетилхолін (АХ) при проведенні рутинної коронарної ангіографії через 68 місяців після ЧКВ. На вихідному рівні учасники обох груп були зіставними за демографічними характеристиками, факторами ризику ураження коронарних артерій та фармакотерапією.
За протоколом дослідження, мета статинотерапії полягала у досягненні еквівалентних цільових рівнів ХС ЛПНЩ (≤2,6 ммоль/л) згідно з рекомендаціями Японського товариства атеросклерозу (JAS) (Teramoto et al., 2013).
У межах дослідження статини у вищих дозах частіше використовували у групі S, ніж E + S. У двох групах спостерігалися значущі відмінності щодо змін вмісту загального ХС, ХС ЛПНЩ та аполіпопротеїну В. Рівні маркерів поглинання ХС кампестерину та ситостерину суттєво зростали у групі S, тоді як у групі E + S – знижувалися. Концентрація латостерину незначно збільшувалася у групі E + S, де застосовували помірні або нижчі дози статинів. Унаслідок окисної модифікації ЛПНЩ у сироватці крові малоновим диальдегідом утворювався окислений ХС ЛПНЩ, який знижувався при додатковому лікуванні езетимібом порівняно з монотерапією статинами. Дослідники зафіксували значне зниження рівня загального оксистерину, 5β-/6β-епоксихолестерину, 4β-/7β-/27-гідроксихолестерину в групі E + S, тоді як зміни у групі S були відсутні.
Аналіз первинних результатів та складових комбінованої кінцевої точки через 68 місяців лікування показав, що частота дисфункції судин-мішеней під час спостереження у групі S становила 62%, у групі E + S – 43%, а їх недостатність була у групі S – 21% та у групі E + S – 12%. Сукупна частота реваскуляризації судин-мішеней, спричиненої ішемією, склала 20 та 12% у групах S і E + S відповідно. При внутрішньокоронарному тестуванні на АХ серед пацієнтів без недостатності судин-мішеней частота ендотеліальної дисфункції коронарних артерій становила 52 і 35% у групах S і E + S відповідно.
Лікування езетимібом суттєво зменшувало вазоконстрикцію, викликану застосуванням додаткових доз АХ. Максимальне звуження судин, зумовлене використанням низьких, середніх або високих доз АХ у кожного учасника, становило 49±19% у групі S та 43±23% у групі E + S. Це свідчило про те, що гіполіпідемічна терапія езетимібом та статинами зменшувала ендотеліальну дисфункцію коронарних артерій.
Таким чином, первинні висновки дослідження CuVIC полягали в тому, що гіполіпідемічне лікування езетимібом у комбінації зі статинами порівняно з монотерапією статинами чинило наступні ефекти:
- Зниження рівня ХС ЛПНЩ, навіть при додаванні езетимібу до статинів у низьких дозах.
- Зменшення дисфункції судин-мішеней, зокрема частоти летальних випадків внаслідок ураження судин-мішеней, нефатального інфаркту міокарда, повторної реваскуляризації, зумовленої ішемією, та ендотеліальної дисфункції коронарних артерій серед хворих на ІХС після ЧКВ.
- Зниження рівня атерогенних ліпідів, зокрема оксистеринів та окислених ЛПНЩ.
Результати дослідження CuVIC показали, що застосування езетимібу разом зі статинами порівняно з монотерапією статинами поліпшувало функціональні прогнози хворих на ІХС шляхом зменшення дисфункції ендотелію у стентованих коронарних артеріях. Окрім того, що гіполіпідемічне лікування здатне, принаймні частково, знижувати ендотеліальну дисфункцію завдяки зменшенню вмісту окислених ЛПНЩ, інгібітор абсорбції ХС езетиміб чинить сприятливий вплив щодо підтримання функції ендотелію коронарних артерій за рахунок зниження рівня оксистерину. Це своєю чергою дозволяє знизити ризик розвитку ймовірних серцево-судинних подій у цій когорті пацієнтів у майбутньому.
Висновки
Отже, застосування інгібітора абсорбції ХС езетимібу рекомендоване усіма сучасними настановами з лікування дисліпідемій. Окрім того, на підставі викладених даних можна стверджувати, що додавання езетимібу до схем лікування гіперліпідемій збільшує ефективність терапії та вторинної профілактики атеросклеротичних ССЗ, дозволяє не підвищувати дозу статину до максимальної, що, зокрема, суттєво покращує комплаєнс пацієнта. А за непереносимості чи неефективності лікування статинами можлива монотерапія езетимібом.
Підготувала Наталія Нечипорук
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (76) 2021 р.




