12 вересня, 2021
Застосування пероральних антикоагулянтів в окремих когортах пацієнтів із фібриляцією передсердь: рекомендації EHRA 2021
Пероральні антикоагулянти, які не належать до групи антагоністів вітаміну К (non-vitamin K antagonist oral anticoagulant, ПОАК), у всьому світі рекомендовані хворим на фібриляцію передсердь (ФП) як найкращий вибір антикоагулянтів для запобігання інсульту (Hindricks G. et al., 2021; January C. T. et al., 2019; Andrade J. G. et al., 2018; Chiang C. E. et al., 2017).
Порівняно з антагоністами вітаміну K (АВК), як-от варфарин, ПОАК (апіксабан, едоксабан, ривароксабан, дабігатран) мають покращене співвідношення ефективності/безпеки та передбачуваний антикоагулянтний ефект без необхідності в рутинному моніторингу коагуляції (Ruff C. T. et al., 2014; Steffel J. et al., 2011). Проте правильне використання цих антикоагулянтів потребує ретельно продуманого підходу до багатьох практичних аспектів. Кожен із наявних ПОАК супроводжується інструкціями з його належного застосування в багатьох клінічних ситуаціях (короткий опис характеристик препарату, картки пацієнта, інформаційні листівки для пацієнтів і лікарів), але вони часто дещо відрізняються (від препарату до препарату та від країни до країни), що іноді створює плутанину. Крім того, існують менш вивчені аспекти використання ПОАК, які, втім, є актуальними, коли ці препарати призначають кардіологи, неврологи, геріатри, лікарі загальної практики й інші спеціалісти в умовах повсякденної клінічної практики. З огляду на ці міркування Європейська асоціація серцевого ритму (EHRA) вирішила скоординувати єдиний спосіб інформування лікарів про використання ПОАК (Steffel J. et al., 2021). Метою створення «Практичного посібника» EHRA є надання підтримки в безпечному й ефективному використанні ПОАК у повсякденній практиці, доповнення міжнародних керівних настанов, які зосереджені переважно на наукових даних щодо лікування пацієнтів із ФП антикоагулянтами взагалі та ПОАК зокрема (Hindricks G. et al., 2021; January C. T. et al., 2019; Andrade J. G. et al., 2018; Chiang C. E. et al., 2017).
Далі представлено розділи посібника, в яких висвітлюються практичні аспекти застосування ПОАК в окремих категорій пацієнтів, а саме хворих похилого віку, з недостатньою чи надлишковою масою тіла, епілепсією, злоякісними новоутвореннями, тромбоцитопенією.
Застосування ПОАК у пацієнтів літнього віку
Захворюваність на ФП неухильно зростає з віком; водночас згідно з даними досліджень до 2050 року вік 4,4% світового населення буде >80 років (Rietbrock S. et al., 2008). Профілактика інсульту в літніх пацієнтів із ФП має велике значення, оскільки ризик інсульту значно зростає з віком (Wolf P. A. et al., 1991). Поява ПОАК покращила показники призначення антикоагулянтної терапії в літніх людей, але пероральні антикоагулянти (ПАК) залишаються недостатньо використаними приблизно в 30% пацієнтів із високим ризиком інсульту (Fohtung R. B. et al., 2017; Henrard S. et al., 2017).
Усі дослідження, в яких вивчали ефективність лікування ПОАК при ФП, включали значну кількість людей похилого віку (визначених як особи віком ≥75 років) – від 31 до 43%. Відповідно до результатів цих досліджень частота інсультів серед пацієнтів старшого віку знижувалася однаково в групах, які отримували ПОАК й АВК. Проте важливо зазначити, що за вищого вихідного абсолютного ризику розвитку інсульту в літніх пацієнтів відзначалося суттєвіше його зниження на тлі прийому ПОАК, аніж у разі застосування АВК, порівняно з молодшими хворими (Kato E. T. et al., 2016; Halperin J. L. et al., 2014; Halvorsen S. et al., 2014; Lauw M. N. et al., 2017).
Хоча ризик розвитку внутрішньочерепної кровотечі (ВЧК) залишається нижчим за прийому всіх ПОАК порівняно з АВК, значний вплив віку на збільшення ризику екстракраніальної великої кровотечі спостерігався при застосуванні вищих доз дабігатрану (Graham D. J. et al., 2015; Eikelboom J. W. et al., 2011). І навпаки: вікової залежності щодо частоти екстракраніальної великої кровотечі не спостерігалося з апіксабаном, едоксабаном або ривароксабаном порівняно із загальними результатами досліджень. Окрім того, ризик виникнення великої кровотечі виявився нижчим у разі застосування апіксабану й едоксабану порівняно з АВК навіть у старших вікових групах (Granger C. B. et al., 2011; Kato E. T. et al., 2016; Halvorsen S. et al., 2014). Реєстри спостережень у когортах літніх осіб показують, що ризик кровотечі з віком є значною мірою узгодженим із сучасними результатами досліджень (Graham D. J. et al., 2015, 2016; de Groot J. R. et al., 2020; Bassand J. P. et al., 2018; Kwon S. et al., 2020).
Пацієнти літнього віку з ФП мають сприятливіші результати при застосуванні ПАК, аніж без них, і в разі прийому ПОАК порівняно з АВК (Haas S. et al., 2019; Bai Y. et al., 2018; Huisman M. V. et al., 2017; Chao T. F. et al., 2018; Chao T. F. et al., 2020) Тому ПОАК є найкращим вибором у цій когорті відповідно до чинних керівних принципів ESC (Hindricks G. et al., 2021; Fumagalli S. et al., 2017; Pazan F. et al., 2020).
Чиста клінічна користь від ПАК зменшується з віком через конкурентні ризики кровотечі та смерті, але зберігається довше з ПОАК, аніж з АВК (Shah S. J. et al., 2019). Хоча синдроми слабкості та когнітивних порушень пов’язані з більшою смертністю й недостатнім використанням ПАК, переваги цих препаратів зберігаються в когортах літніх пацієнтів (Madhavan M. et al., 2019). Кращі інструменти прогнозування можуть допомогти ідентифікувати тих, хто отримає найменшу користь від антикоагулянтної терапії через ранню смертність (Bassand J. P. et al., 2019), але наразі відсутні надійні докази для ідентифікації осіб, які апріорі не мають отримувати ПАК.
У літніх пацієнтів частіше трапляється церебральна амілоїдна ангіопатія та мозкові мікрокровотечі (ММК), а їх наявність збільшує ризик внутрішньомозкової кровотечі (An S. J. et al., 2017). ММК є маркерами церебральної хвороби дрібних судин і можуть бути ідентифіковані в послідовностях магнітно-резонансної томографії (МРТ) головного мозку, чутливих до гемосидерину. МРТ може бути корисною для оцінки ризику ВЧК у літніх людей, особливо з попереднім її анамнезом, що також включає субарахноїдальні, епідуральні та субдуральні крововиливи (Purrucker J. C. et al., 2018; Soo Y. et al., 2018). Незважаючи на те що поширеність ММК серед хворих похилого віку є подібною, повідомлялося про значно більший тягар ВЧК у пацієнтів, які отримували АВК, порівняно з ПОАК (Lioutas V. A. et al., 2019). Як зазначено в рекомендаціях ESC (2020), не слід відмовлятися від застосування антикоагулянтів виключно через наявність ММК.
Застосування ПОАК у «крихких» пацієнтів
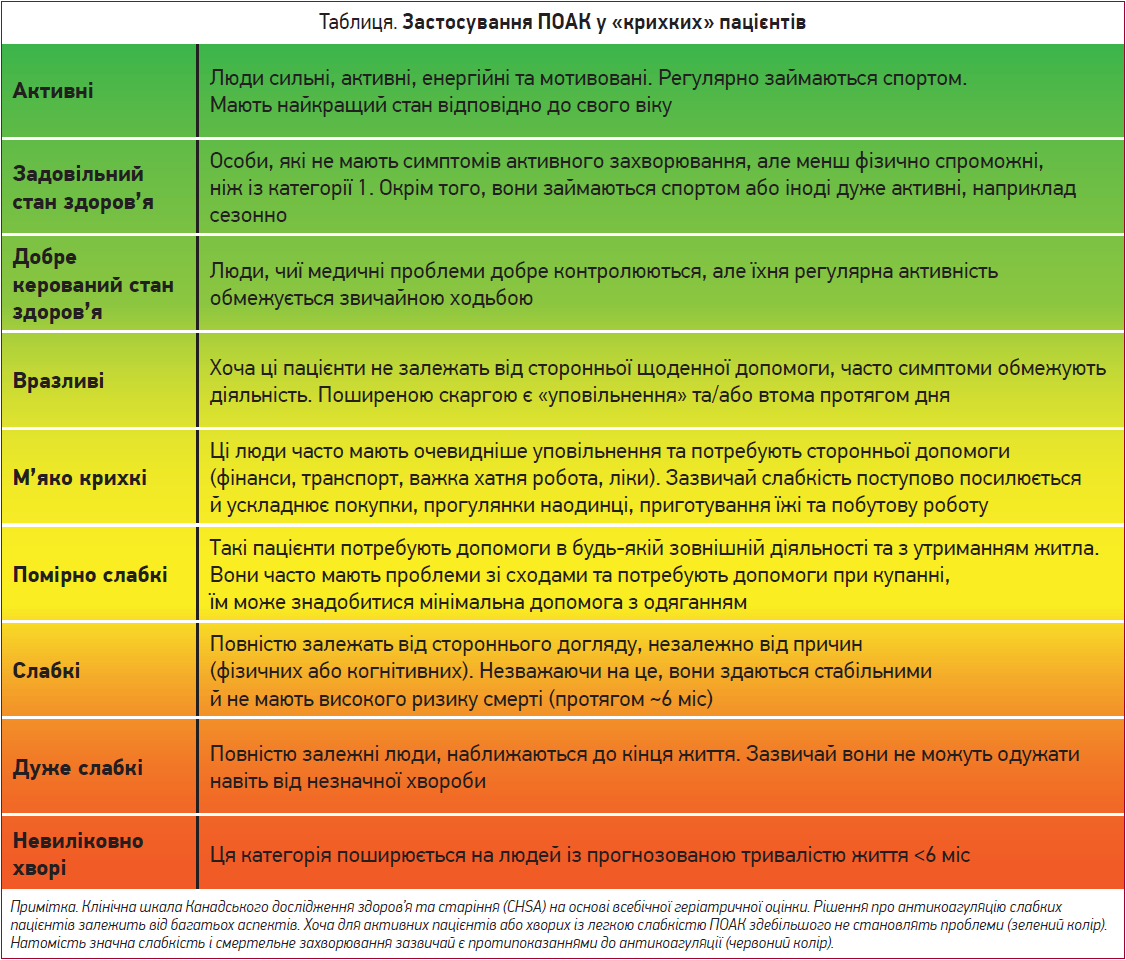
«Крихкість» – окремий фенотип, який зазвичай заснований на критеріях або клінічних судженнях і свідчить про дефіцит функцій за так званою шкалою слабкості (табл.) (Fried L. P. et al., 2001; Rockwood K. et al., 1999, 2005). Обидві моделі ідентифікують пацієнтів із ризиком або зі встановленим поганим фізіологічним резервом, високим ризиком падінь, депресією й деменцією, поганою фізичною працездатністю та збільшенням смертності. «Крихкість» і нестабільні стани є загальними для старшого віку та зумовлюють конкретні міркування щодо ризику та користі застосування ПАК. Консенсус експертів виступає за комплексну геріатричну оцінку в усіх літніх пацієнтів з ознаками «крихкості» (Hanon O. et al., 2013). Слабкість зазвичай асоціюється зі зниженням ваги та ризиком погіршення функції нирок, тому таким пацієнтам необхідно регулярно контролювати масу тіла й функцію нирок, щоб забезпечити, зокрема, безпечне дозування ПОАК. Очевидно, що немає користі від ПАК у разі станів тяжкої слабкості чи коли тривалість життя, ймовірно, буде обмеженою (табл.).
Небезпека падіння
Щорічна поширеність падінь, зумовлених усіма причинами, та випадкових падінь серед осіб віком понад 75 років може досягати 25 та 8% відповідно (Bhangu J. et al., 2017). Відсоток падінь зростає з поліфармацією й інституційною допомогою (Rubenstein L. Z., 2006).
Падіння часто вважали протипоказанням до ПАК через ризик розвитку ВЧК (Hylek E. M. et al., 2006). Утім, аналітична модель прийняття рішення Маркова продемонструвала, що пацієнту доведеться впасти 295 разів, щоб ризик субдуральної гематоми переважав користь від антикоагуляції за допомогою АВК (Man-Son-Hing M. et al., 1999). Ці оглядові розрахунки мають відповідні обмеження, й невідомо, чи вони релевантні до поточної ситуації. Проте, враховуючи ще менший ризик розвитку ВЧК у разі застосування ПОАК порівняно з АВК, кількість падінь, яка необхідна для зміни співвідношення ризиків, буде ще вищою при використанні ПОАК.
Питання падінь у пацієнтів, які отримували ПОАК, було спеціально проаналізовано в кількох дослідженнях. Наприклад, у дослідженні ARISTOTLE (Rao M. P. et al., 2018) пацієнти з анамнезом падіння були старшими й частіше мали деменцію та цереброваскулярні захворювання. Ці пацієнти мали підвищений ризик серйозної кровотечі та ВЧК, а також смерті. Проте статус падінь жодним чином не впливав на безпеку й ефективність апіксабану порівняно з варфарином. Серед крихких пацієнтів не було зареєстровано жодної субдуральної кровотечі на тлі прийому апіксабану.
Це також відображається в даних спостережень, які вказують на кращі результати застосування ПОАК проти АВК у пацієнтів із ризиком падіння (Connolly B. J. et al., 2014; Scotti P. et al., 2019; Feeney J. M. et al., 2016). Проте слід бути обережним, оскільки також повідомлялося про ймовірність виникнення віддаленої ВЧК у пацієнтів із ризиком падінь у разі прийому ПОАК (Cocca A. T. et al., 2019).
Отже, падіння як таке не є протипоказанням до застосування ПОАК, але слід ужити запобіжних заходів та оцінити фактори ризику кровотечі, що змінюються, включно з оцінкою одночасного застосування антитромбоцитарних засобів (Tinetti M. E. et al., 1994).
Застосування ПОАК при надлишковій і зниженій масі тіла
Вага й індекс маси тіла (ІМТ) є важливими змінними в розподілі ліків і рівнях їх концентрації в плазмі крові. Через відсутність легкодоступних вимірювань антикоагулянтної дії існує занепокоєння, що ПОАК можуть бути не такими ефективними чи безпечними при екстремальних показниках маси тіла з потенційним передозуванням або недостатнім дозуванням. Вага й ІМТ не були критеріями виключення в рандомізованих випробуваннях ПОАК, а саме апіксабану й едоксабану у хворих на ФП або венозну тромбоемболію (ВТЕ). Хоча зниження дози цих препаратів для пацієнтів із недостатньою масою тіла (≤60 кг) було обов’язковим (Patel M. R. et al., 2011; Granger C. B. et al., 2011; Connolly S. J. et al., 2009; Giugliano R. P. et al., 2013).
Вплив ожиріння на рівень ПОАК у плазмі крові
Із 1975 року рівень ожиріння в загальній популяції зріс утричі. Всесвітня організація охорони здоров’я (ВООЗ) нині вважає це епідемією. За даними ВООЗ, у 2016 році 1,3 млрд дорослих мали надлишкову вагу (ІМТ >25 кг/м2), з яких 650 млн страждали на ожиріння (ІМТ >30 кг/м2). Ожиріння збільшує як ризик розвитку ФП (можливо, через електромодуляцію передсердя), так і ризик виникнення повторної ФП після успішної абляції (Wang T. J. et al., 2004; Abed H. S. et al., 2013; Lavie C. J. et al., 2017; Sivasambu B. et al., 2018). Зниження ваги є невід’ємною частиною багатопрофільного підходу до профілактики та лікування пацієнтів із ФП й ожирінням (Abed H. S. et al., 2013).
Ожиріння впливає на фармакокінетику ліків, у тому числі об’єм розподілу (зокрема, ліпофільних препаратів), а також кліренс (Wang S. Y. et al., 2020). Було показано, що при ожирінні збільшується нирковий кровоток і кліренс креатиніну; це, своєю чергою, може збільшити елімінацію ПАК (Chagnac A. et al., 2000). Низка досліджень АВК показали, що пацієнтам з ожирінням потрібні більші дози та триваліші періоди застосування для досягнення терапевтичних значень міжнародного нормалізованого відношення (Wallace J. L. et al., 2013).
У початкових дослідженнях дабігатрану не повідомлялося про вплив маси тіла на фармакокінетичні показники, хоча аналізи за участю літніх здорових осіб не включали пацієнтів із надмірною вагою (Stangier J. et al., 2008; Liesenfeld K. H. et al., 2011; Stangier J. et al., 2007). Однак у дослідженні RE-LY пацієнти з масою тіла >100 кг мали на 21% нижчі нормалізовані дозові мінімальні концентрації, ніж пацієнти з вагою 50-100 кг (Reilly P. A. et al., 2014). Первинні ефективність і безпека були подібними в пацієнтів із масою тіла ≥100 кг порівняно з вагою 50-99 і <50 кг (Ezekowitz et al., 2014; Connolly S. J. et al., 2009; Eikelboom J. W. et al., 2011).
Фармакокінетичні дані щодо апіксабану та ривароксабану спочатку повідомляли про залежні від маси тіла зміни розподілу об’єму та періоду напіврозпаду в різних діапазонах ваги; проте вони не вважалися клінічно значущими (Mueck W. et al., 2011; Kubitza D. et al., 2007; Upreti V. V. et al., 2021; Barsam S. J. et al., 2017). У дослідженні ENGAGE AF-TIMI 48 жодних змін у плазмових концентраціях едоксабану чи його фармакодинамічному ефекті на фактор зсідання Xa не спостерігалося в пацієнтів з ожирінням і нормальною вагою (Boriani G. et al., 2019, 2021).
Ефективність і безпека ПОАК у пацієнтів з ожирінням
Було висловлено занепокоєння щодо надійності антикоагулянтної дії ПОАК у пацієнтів з ожирінням (Martin K. et al., 2016; Burnett A. E. et al., 2016). У дослідженні RE-LY не було виявлено відмінностей у виникненні інсульту чи системної емболії при застосуванні дабігатрану проти варфарину в пацієнтів з ожирінням (≥100 кг) порівняно з хворими без нього (Reilly P. A. et al., 2014; Proietti M. et al., 2017). Проте повідомлялося про випадки «неефективності лікування» з низьким рівнем дабігатрану в плазмі крові у хворих із тяжким ожирінням (ІМТ ≥40 кг/м2) (Breuer L. et al., 2013; Safouris A. et al., 2014).
Не спостерігалося зниження ефективності апіксабану в пацієнтів з ожирінням (ІМТ >40 кг/м2 або 120 кг) (Sandhu R. K. et al., 2016; Hohnloser S. H. et al., 2019), ривароксабану (ІМТ ≥35 кг/м2) (Balla S. R. et al., 2017) й едоксабану (ІМТ >40 кг/м2) (Boriani G. et al., 2019). Проте слід зазначити, що лише 620 пацієнтів із ROCKET-AF (випробування ефективності ривароксабану) мали дуже високий ІМТ (>40 кг/м2), а дані з дослідження RE-LY щодо дабігатрану відсутні для цього діапазону маси тіла (Proietti M. et al., 2017; Balla S. R. et al., 2017). Натомість 1003 та 1149 пацієнтів з ІМТ ≥40 кг/м2 були включені до випробувань ARISTOTLE (дослідження ефективності апіксабану) й ENGAGE AF-TIMI 48 (дослідження ефективності едоксабану) відповідно.
Різниці у виникненні великих кровотеч не спостерігалося для дабігатрану проти варфарину, ривароксабану проти варфарину й едоксабану проти варфарину в пацієнтів з ожирінням і без нього (Boriani G. et al., 2019; Proietti M. et al., 2017; Balla S. R. et al., 2019). Відносно більші кровотечі спостерігалися при застосуванні апіксабану проти варфарину в пацієнтів з ІМТ ≥30 кг/м2 порівняно з нижчим ІМТ, а також із масою тіла >120 кг проти <120 кг, хоча захворюваність була нижчою при застосуванні апіксабану проти АВК навіть у пацієнтів з ожирінням (Sandhu R. K. et al., 2016; Hohnloser S. H. et al., 2019).
Кілька досліджень із повсякденної клінічної практики не показали істотно вищої частоти кінцевих точок у пацієнтів з ожирінням порівняно з пацієнтами з нормальною вагою, які приймали ПОАК (Tittl L. et al., 2018). Систематичний огляд і метааналіз впливу маси тіла на ефективність і безпеку ПОАК порівняно з АВК виявили загальну кращу ефективність для всіх діапазонів маси тіла (низька, нормальна, надмірна вага, ожиріння). При цьому не спостерігалося збільшення кровотеч у категоріях пацієнтів із низькою вагою або ожирінням (Malik A. H. et al., 2020). Два невеликі ретроспективні порівняльні дослідження виявили подібну ефективність і безпеку в групі ПОАК порівняно з АВК у когорті учасників з ожирінням; більшість даних була доступною для апіксабану та ривароксабану, одне повідомляло про значно більшу кількість транзиторних ішемічних атак та інсульту на тлі прийому дабігатрану, й жодне дослідження не включало дані про едоксабан (Kido K. et al., 2019; Kushnir M. et al., 2019).
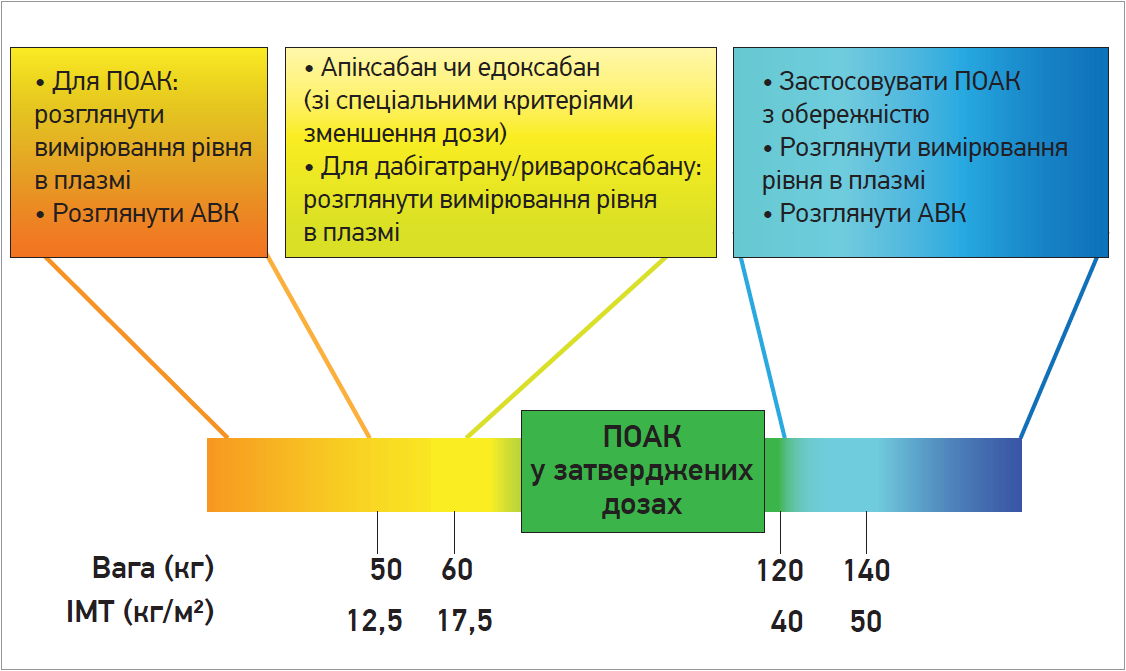
Отже, з огляду на фармакокінетичні властивості та наявні дані, використання всіх ПОАК є безпечним та ефективним для пацієнтів з ІМТ до 40 кг/м2 (без урахування інших клінічно значущих факторів). При ІМТ ≥40 кг/м2 дані менш надійні (Boriani G. et al., 2019; Proietti M. et al., 2017; Sandhu R. K. et al., 2016; Hohnloser S. H. et al., 2019; Balla S. R. et al., 2017). При ІМТ ≥50 кг/м2 вимірювання рівня ПОАК у плазмі або перехід на терапію АВК може бути доцільним (рис.).
Застосування ПОАК у пацієнтів із низькою масою тіла
Не існує універсального визначення низької маси тіла, хоча ІМТ <18,5 кг/м2 розглядається багатьма західними організаціями як ознака недостатньої ваги (ВООЗ, 2020). Низька маса тіла може збільшити вплив будь-якого ПОАК, а отже, підвищити ризик кровотечі порівняно з пацієнтами з нормальною вагою (Braekkan S. K. et al., 2019; Park C. S. et al., 2017). Ризик кровотечі також зростає при терапії АВК у пацієнтів із недостатньою вагою (Park C. S. et al., 2017; Barba R. et al., 2005). Важливо, що в пацієнтів із низькою масою тіла часто спостерігаються інші стани та супутні захворювання, котрі можуть збільшити ризик інсульту, а також кровотеч, як-от старість, слабкість, рак, хронічна хвороба нирок.
Отож слід з обережністю призначати антикоагулянтну терапію пацієнтам із низькою вагою (рис.). У хворих із масою тіла ≤60 кг необхідно зменшити дозу апіксабану (в пацієнтів віком >80 років та/або з концентрацією креатиніну в сироватці крові >1,333 ммоль, або 1,5 мг/дл) й едоксабану. Низька маса тіла сама по собі не є фактором для зменшення дози ривароксабану чи застосування меншої дози дабігатрану.
Рис. ПОАК у пацієнтів із недостатньою та надмірною вагою
Однак у post hoc аналізі ефективності дабігатрану в пацієнтів із низькою масою тіла (<50 кг) було вказано на збільшення кровотеч у пацієнтів із нижчим ІМТ (особливо <20 кг/м2) (Ezekowitz et al., 2014; Connolly S. J. et al., 2009). Обсерваційні дослідження однаковою мірою припустили, що низький ІМТ може бути незалежним провісником кровотеч у разі застосування дабігатрану, й тенденція до більшої кровотечі була відзначена при застосуванні високих доз дабігатрану в метааналізі за участю пацієнтів із низькою вагою (Malik A. H. et al., 2020; Lee C. H. et al., 2017).
Ривароксабан показав подібну ефективність і безпеку в дослідницькому аналізі ROCKET-AF у хворих із низькою масою тіла, але в цій роботі порівняли лише пацієнтів із вагою <70 та >70 кг (Patel M. R. et al., 2011). Немає даних про конкретні результати для пацієнтів із масою тіла <60 або <50 кг, які отримували повну дозу ривароксабану. Подальші метааналізи та дані спостережень є обнадійливими щодо безпеки ривароксабану для пацієнтів із недостатньою масою тіла (<50 кг), але певні обмеження зберігаються (Malik A. H. et al., 2020; Lee S. R. et al., 2019).
Апіксабан і едоксабан послідовно демонстрували ефективність і безпеку порівняно з варфарином у пацієнтів із недостатньою масою тіла порівняно із загальною популяцією (Ruff C. T. et al., 2015; Boriani G. et al., 2019; Hohnloser S. H. et al., 2019). Концентрації ліків та інгібування фактора зсідання Ха не відрізнялися в пацієнтів із низькою масою тіла (діапазон ваги – 30-55 кг) від пацієнтів із середньою масою тіла (Boriani G. et al., 2021). Отже, обидва препарати можуть бути кращим вибором для пацієнтів із вагою ≤60 кг.
Застосування ПОАК при епілепсії
Епілепсія може мати як генетичні, так і набуті причини, в тому числі травми головного мозку, інсульт, пухлини та нейроінфекції. Розвиток епілепсії після інсульту не є рідкістю (Myint P. K. et al., 2006). Про ризик судом повідомляється в 7-11,5% випадків після інсульту, з них у 3-6% випадків після кардіоемболічних інсультів (Burn J. et al., 1997; Zou S. et al., 2015; Beghi E. et al., 2011; Stefanidou M. et al., 2017; Wang J. Z. et al., 2017). Частота повторних неспровокованих нападів судом після інсульту може досягати 71% і запобігання таким подіям за допомогою протиепілептичних препаратів (ПЕП) є бажаним, особливо коли пацієнти перебувають на ПAК (Holtkamp M. et al., 2017; van Tuijl J. H. et al., 2011; Hesdorffer D. C. et al., 2009).
Багато особливостей інсульту, пов’язаного з ФП, як-от ураження кори, множинні інфаркти, тяжкий дефіцит і геморагічна трансформація, також передбачають розвиток післяінсультної епілепсії (Galovic M. et al., 2018; Leung T. et al., 2017). Хоча більшість нападів у людей похилого віку та після інсульту є осередковими, пацієнти, які страждають на судоми без аури чи рідкісні атонічні судоми, особливо вразливі до травм голови. Тож призначення ПAК потребує особливої обережності в пацієнтів з епілепсією.
Потенційні взаємодії між лікарськими засобами
Багато ПЕП (наприклад, етосуксимід, карбамазепін, фенобарбітал, фенітоїн, примідон) індукують печінкові ферменти або є помірними індукторами (окскарбазепін, ламотриджин, тіагабін тощо), тим самим потенційно знижують ефективність АВК, а також деяких ПОАК. Інші ПЕП (як-от фелбамат, топірамат, вальпроат, вігабатрин) інгібують печінковий метаболізм і можуть збільшити ризик кровотечі при застосуванні АВК. Вальпроат (вальпроєва кислота) може мати непередбачуваний вплив на CYP3A4 (Stollberger C., Finsterer J., 2016). Окрім того, дослідження на тваринах та/або людях показали, що карбамазепін, леветирацетам, фенобарбітал, фенітоїн і вальпроєва кислота можуть зменшити дію ПОАК шляхом індукції активності P-глікопротеїну. Новіші ПЕП третього покоління, як-от бриварацетам, лакосамід та еслікарбазепін, можуть мати менший потенціал для медикаментозної взаємодії (de Biase S. et al., 2019).
Також ПЕП можуть непрямо впливати на систему згортання крові, спричиняючи розвиток тромбоцитопенії чи дисфункції тромбоцитів (Manohar C. et al., 2011). Існують епізодичні повідомлення про випадки взаємодії між ПОАК і ПЕП (Di Gennaro L. et al., 2019; Langenbruch L. et al., 2020). Більшість повідомлень про лікарську взаємодію посилаються на зниження ефективності ПОАК через перелічені механізми (Taha M. et al., 2020). Утім, повідомлялося й про підвищений ризик кровотечі при застосуванні фенітоїну (Chang S. H. et al., 2020). Під час дослідження іншої когорти пацієнтів із Тайваню, які приймали ПОАК та 11 різних ПЕП, було виявлено посилення асоціації кровотеч із супутнім призначенням фенітоїну, вальпроєвої кислоти чи леветирацетаму. Проте невідомо, чи цей результат може бути узагальненим для інших груп населення (Wang C. L. et al., 2020).
Нині, на жаль, немає дослідження, що достовірно досліджувало би вплив леветирацетаму на рівень ПОАК у плазмі та клінічні події в пацієнтів, які одночасно отримували ці препарати в умовах реальної клінічної практики.
Практичні поради
Немає надійних доказів щодо взаємодії ПОАК із ПЕП, а міжнародні довідники препаратів погано узгоджені щодо цього питання (Acton E. K. et al., 2019). Коли терапія ПЕП бажана в пацієнтів з епілепсією та ФП, необхідно забезпечити пильне спостереження та регулярний міждисциплінарний огляд із закріпленим кардіологом, неврологом, лікарем первинної медичної допомоги та клінічним фармацевтом, особливо в контексті спільного застосування ПОАК із протисудомними препаратами. Таких пацієнтів слід лікувати в експертних центрах із великим досвідом вимірювання рівнів ПОАК у плазмі та їх інтерпретації (von Oertzen T. J. et al., 2019; Mathy F. X. et al., 2019; Potpara T. et al., 2019; Steffel J., Potpara T. S., 2019).
Застосування ПОАК у разі тромбоцитопенії
Кількість тромбоцитів <100×103/мл була критерієм виключення в дослідженнях RE-LY (дабігатран проти АВК) та ENGAGE AF-TIMI 48 (едоксабан проти АВК), а <90×103/мл – у дослідженні ROCKET-AF (ривароксабан проти АВК) у пацієнтів із ФП (Patel M. R. et al., 2011; Connolly S. J. et al., 2009; Giugliano R. P. et al., 2013). Тромбоцитопенія не була фактором виключення в дослідженні ARISTOTLE, в якому вивчали ефективність апіксабану проти АВК при ФП (Granger C. B. et al., 2011). Пацієнти з кількістю тромбоцитів <50×103/мл були включені у випробування едоксабану та ривароксабану (Raskob G. E. et al., 2018; Young A. M. et al., 2018), а <75×103/мл – у дослідження ефективності апіксабану для лікування ВТЕ, пов’язаної з раком (Agnelli G. et al., 2018). Дані спостережень показують, що ПОАК асоціюються з подібною частотою ішемічного інсульту й системної емболії та меншою частотою кровотеч, аніж АВК у пацієнтів із тромбоцитопенією та ФП (Wang C. L. et al., 2019). У невеликому проспективному дослідженні, в якому брали участь пацієнти з ФП та легкою тромбоцитопенією (кількість тромбоцитів – 50-100×103/мл) при зниженій дозі дабігатрану (110 мг двічі на добу), апіксабану (2,5 мг 2 рази на добу) та ривароксабану (15 мг на добу), не виявлено різниці щодо частоти великих кровотеч або ішемічного інсульту порівняно з пацієнтами з нормальними рівнями тромбоцитів, які приймали рекомендовані дози цих препаратів (Janion-Sadowska A. et al., 2018).
Не існує «безпечної» межі, за якою терапія ПОАК не становила би ризику в пацієнтів із тромбоцитопенією. На додаток до абсолютної кількості тромбоцитів слід ураховувати динаміку кількості тромбоцитів, основну причину тромбоцитопенії й особливі фактори ризику (в тому числі ймовірність наявності дисфункціональних тромбоцитів, інших порушень згортання крові) (Kearon C. et al., 2016). Через відсутність великої доказової бази для орієнтирів рішення щодо терапії ПОАК має ухвалюватися із застосуванням індивідуалізованого підходу, що базується на спільному прийнятті рішень з огляду на думку пацієнта, його потреби й очікування.
Застосування ПОАК у пацієнтів із ФП та злоякісними новоутвореннями
У літніх пацієнтів як онкологічні захворювання, так і ФП не є рідкістю (Hu Y. F. et al., 2013). Рак і зумовлена ним терапія можуть спричиняти розвиток ФП, тоді як вік і злоякісні пухлини виступають незалежними факторами ризику тромбозу та кровотечі.
Антикоагулянтна терапія в пацієнтів зі злоякісними пухлинами
У випробуваннях фази III, в яких брали участь онкологічні хворі, едоксабан (Raskob G. E. et al., 2018), ривароксабан (Young A. M. et al., 2018) й апіксабан (Agnelli G. et al., 2018) не поступалися за ефективністю дальтепарину в профілактиці рецидиву ВТЕ. Хоча були повідомлення про підвищення кількості кровотеч на тлі прийому едоксабану та ривароксабану порівняно з дальтепарином. Щоправда, ці несприятливі події спостерігалися переважно в пацієнтів із раком шлунково-кишкового тракту. Водночас ефективність і безпека були загалом подібними між апіксабаном і низькомолекулярними гепаринами.
Щодо профілактики інсульту та системної емболії у хворих на ФП з онкологічними захворюваннями, то наявні дані менш достовірні, оскільки активний злоякісний процес був критерієм виключення в більшості досліджень ІІІ фази з вивчення застосування ПОАК при ФП.
У нещодавньому метааналізі (Deng Y. et al., 2019) п’яти досліджень (post hoc-аналіз ROCKET AF, ENGAGE AF-TIMI 48, ARISTOTLE та два ретроспективні дослідження в популяційних когортах) використання ПОАК порівняно з варфарином асоціювалося зі значним зниженням ризику інсульту, системної емболії та ВТЕ, суттєвою тенденцією до зменшення кількості ішемічних інсультів (p=0,05) і значно нижчою частотою інфарктів міокарда, смерті від усіх причин і серцево-судинної смерті.
На тлі прийому ПОАК спостерігалася тенденція до зменшення кількості великих кровотеч (p=0,05), внутрішньочерепних або шлунково-кишкових кровотеч і клінічно значущих або незначних кровотеч. Об’єднання трьох post hoc досліджень показало схожі показники ефективності та безпеки ПОАК порівняно з варфарином у пацієнтів із ФП та раком і без нього.
У великому реєстрі з використанням рецептурного аналізу пацієнтів із ФП та онкологічними захворюваннями чи без них, які приймали АВК або ПОАК, повідомляється про еквівалентність кровотеч, тромбоемболічних ускладнень і статусу раку, хоча показники обох подій були нижчими в когорті хворих на терапії ПОАК (Ording A. G. et al., 2017).
Однак у відомостях щодо медикаментозної взаємодії між ПОАК і специфічними хіміотерапевтичними засобами все ще багато прогалин, тому автори цього матеріалу закликають до обережності.
Загалом антикоагуляція з використанням ПОАК є допустимим варіантом у пацієнтів із ФП та злоякісними пухлинами з огляду на дані рандомізованих клінічних досліджень. Антикоагулянтна терапія в пацієнтів із ФП, які страждають на онкологічне захворювання, потребує спеціального підходу міждисциплінарної команди (Zamorano J. L. et al., 2016). Особливо коли планується мієлосупресивна хіміотерапія чи променева терапія, необхідно розглянути тимчасове зниження дози чи припинення терапії ПОАК, зважаючи на показники крові, в тому числі тромбоцити, функцію нирок/печінки та фізичні ознаки кровотечі. Доцільно застосовувати інгібітори протонної помпи чи блокатори H2-гістамінових рецепторів для захисту шлунка в цих пацієнтів.
Steffel J., Collins R., Antz M. et al. 2021 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Europace. 2021 Apr 25; euab065.
Переклала з англ. Наталя Нечипорук