24 жовтня, 2021
Коморбідний пацієнт із хронічним панкреатитом
Чаша жовчі була би прісною, якби у ній не було б хоч краплі гіркоти.
Цар Соломон
 У статті розглянуті патогенетичні механізми виникнення дуоденогастрального рефлюксу (ДГР), дуоденогастроезофагеального рефлюксу (ДГЕР), їх ролі у виникненні жовчного рефлюкс-гастриту, рефлюкс-езофагіту. Принциповими засадами формування жовчного рефлюксу є неспроможність сфінктерного апарату, антродуоденальна дисмоторика, ліквідація природного антирефлюксного бар’єру. Факторами ризику розвитку первинного ДГР вважають дисфункцію жовчного міхура і дуоденальну дисмоторику. Провідним механізмом розвитку ДГР, ДГЕР після холецистектомії є порушення гастродуоденальної моторики та гастродуоденальна гіпертензія. Ці синдроми виникають не тільки після холецистектомії, але і при жовчнокам’яній хворобі (ЖКХ), інших органічних і функціональних патологічних станах, у тому числі при панкреатичній недостатності. Синдром хронічної дуоденальної гіпертензії («дуоденального демона») проявляється відчуттям важності в епігастрії, відрижкою, печією, нудотою, блюванням, метеоризмом, порушенням дефекації. Він доповнюється явищами психосоматичної астенізації, зниженням розумової і фізичної працездатності, апатією, похмурою оцінкою життєвих перспектив.
У статті розглянуті патогенетичні механізми виникнення дуоденогастрального рефлюксу (ДГР), дуоденогастроезофагеального рефлюксу (ДГЕР), їх ролі у виникненні жовчного рефлюкс-гастриту, рефлюкс-езофагіту. Принциповими засадами формування жовчного рефлюксу є неспроможність сфінктерного апарату, антродуоденальна дисмоторика, ліквідація природного антирефлюксного бар’єру. Факторами ризику розвитку первинного ДГР вважають дисфункцію жовчного міхура і дуоденальну дисмоторику. Провідним механізмом розвитку ДГР, ДГЕР після холецистектомії є порушення гастродуоденальної моторики та гастродуоденальна гіпертензія. Ці синдроми виникають не тільки після холецистектомії, але і при жовчнокам’яній хворобі (ЖКХ), інших органічних і функціональних патологічних станах, у тому числі при панкреатичній недостатності. Синдром хронічної дуоденальної гіпертензії («дуоденального демона») проявляється відчуттям важності в епігастрії, відрижкою, печією, нудотою, блюванням, метеоризмом, порушенням дефекації. Він доповнюється явищами психосоматичної астенізації, зниженням розумової і фізичної працездатності, апатією, похмурою оцінкою життєвих перспектив.
Також розглянуто клінічні особливості хологенної діареї, продемонстровано диференційно-діагностичні ознаки діареї при хронічній дуоденальній гіпертензії і синдромі подразненого кишечнику (СПК). Наведено також клініко-патогенетичне обґрунтування лікування препаратами колоїдного вісмуту хронічної дуоденальної гіпертензії, котра супроводжується хологенною діареєю. Коротко викладено результати порівняльного аналізу фізико-хімічних і структурних властивостей таблетованих форм препаратів, що містять вісмуту трикалію діцитрат: оригінального лікарського засобу Де-Нол® (Astellas) і дженерика Улькавіс® (КRКА). Зроблено висновок щодо доцільності включення препарату Улькавіс® у схему лікування пацієнтів із хологенною діареєю.
Наслідки надлишку жовчі у шлунку і стравоході
ДГР, гастроезофагеальний рефлюкс (ГЕР) у ряді випадків можна вважати фізіологічними, але ДГЕР завжди є патологічним станом [1]. При патологічному ДГР розвивається жовчний рефлюкс-гастрит (гастрит типу С), а при ДГЕР – ще і жовчний рефлюкс-езофагіт [18, 22, 23].
Рефлюкс-гастрит дещо частіше діагностують у чоловіків, ніж у жінок (1,5:1 відповідно). Причому захворювання більш характерне для пацієнтів старше 40 років. У чоловіків 40-60 років частота рефлюкс-гастриту вдвічі та навіть більше разів вища, ніж у жінок того ж віку, а після 60 років ця частота стає схожою в осіб обох статей [48]. Виділяють 3 принципових механізми формування жовчного рефлюксу [1]:
- неспроможність сфінктерного апарату: дуоденальний вміст може вільно досягати шлунка і стравоходу через пілоричний і нижній стравохідний сфінктери;
- антродуоденальна дисмоторика – порушення координації між антральним, пілоричним відділами шлунка і дванадцятипалої кишки (ДПК), які керують напрямком току дуоденального вмісту;
- ліквідація природного антирефлюксного бар’єру.
Протягом багатьох років ДГР розглядався в рамках хірургічних захворювань як наслідок операцій на шлунку, що супроводжуються резекцією або ушкодженням воротаря (вторинний ДГР). Встановлено, що значно частіше ДГР розвивається у пацієнтів без попереднього хірургічного втручання. У таких випадках він розцінюється як первинний біліарний рефлюкс. Пацієнтам як з первинним, так і з вторинним ДГР у певних ситуаціях (у першу чергу за наявності клінічної симптоматики) потрібно різне лікування [21]. Факторами ризику розвитку первинного ДГР є дисфункція жовчного міхура (ЖМ) і дуоденальна дисмоторика. Вторинний ДГР нерідко розвивається після операцій на шлунку (резекція воротаря, пілоропластика), жовчному міхурі або жовчовивідних шляхах (холецистектомія, біліарна сфінктеротомія). Вторинний ДГР частіше розвивається через недостатність пілоричного жому, яка, у свою чергу, частіше є наслідком анатомічних змін після оперативних втручань (гастректомії, резекції шлунка, гастроентеростомії, ваготомії). Частою причиною ДГР стає дуоденостаз і пов’язана з ним дуоденальна гіпертензія [1, 6]. Це пояснює високу частоту розвитку ДГР і ДГЕР після холецистектомії й при зовнішньосекреторній недостатності підшлункової залози (ПЗ).
Патогенез ДГР і ДГЕР після холецистектомії
Через втрату скорочувальної функції ЖМ порушується гастродуоденальна моторика. Справа в тому, що ЖМ виконує роль своєрідного «насоса», при скороченні якого відбувається не тільки викид жовчі, але й підтримка нормального інтрадуоденального тиску. За відсутності цього «насоса» розвивається дуоденостаз і дискоординація гастродуоденального моторного комплексу, тому для постхолецистектомічного синдрому (ПХЕС) характерні ГЕР, ДГР і навіть ДГЕР [5].
Одним із клінічних проявів ПХЕС є кишковий дисбіоз, що виникає через втрату концентраційної функції ЖМ й адекватного викиду жовчі в ДПК під час їди, внаслідок чого розвиваються порушення пасажу жовчі у кишечник і розлад травлення. Зміна хімічного складу жовчі й хаотичне її надходження в ДПК порушують перетравлювання і всмоктування жиру та інших речовин ліпідної природи, зменшують бактерицидність дуоденального вмісту, що призводить до мікробного обсіменіння ДПК, ослаблення зростання і функціонування нормальної кишкової мікрофлори, розладу ентерогепатичної циркуляції й зниження загального пулу жовчних кислот (ЖК).
Під впливом мікрофлори ЖК піддаються передчасній декон’югації, що супроводжується пошкодженням слизової оболонки ДПК, тонкої й товстої кишки з розвитком дуоденіту, рефлюкс-гастриту, ентериту і коліту. Дуоденіт супроводжується дуоденальною дискінезією і, у першу чергу, дуоденальною гіпертензією з посиленням ДГР і закидом вмісту в загальну жовчну протоку і протоку ПЖ [5]. При синдромі надлишкового бактеріального росту (СНБР) у кишці накопичуються продукти життєдіяльності бактерій, починаються гниття і бродіння, внаслідок чого розвиваються метеоризм і дистензійний біль, посилюється ДГР [5].
Традиційно симптомами ДГЕР і ГЕР вважають гіркоту в роті, печію, відрижку [16]. За відчуття гіркого смаку відповідають пов’язані з G-білками рецептори типу T2R, що локалізуються не тільки в ротовій порожнині, а й у верхніх дихальних шляхах, де вони виконують роль бар’єру на шляху поширення інфекційних агентів [16, 24]. І.В. Козлова зі співавт. (2010) провели анкетування 625 хворих, які перенесли холецистектомію [14]. Автори показали, що через 1-3 роки після операції абдомінальний біль відзначався вірогідно частіше, ніж до операції. Гіркота у роті була у 65,1% опитаних, печія – у 58,1%. При цьому про гіркоту в роті пацієнти повідомляли частіше, ніж до операції (54,8%). Через 3 і більше років після холецистектомії біль в епігастральній ділянці відчували 31,4% хворих, біль оперізуючого характеру – 49%, гіркоту в роті – 66,7%, нудоту – 43,1%, відрижку – 39, 2% пацієнтів. Лікарі вважають, що однією з основних причин скарг пацієнтів після холецистектомії є підвищення частоти розвитку ДГР, діагностованого за допомогою рН-метрії [14, 16]. Як було зазначено вище, в патогенезі ДГР і ДГЕР велике значення має дуоденальна гіпертензія. Цей синдром формується не тільки після холецистектомії, а й при наявності жовчнокам’яної хвороби (ЖКХ), інших органічних і функціональних патологічних станів, зокрема при панкреатичній недостатності [6].
Не заглиблюючись у фізіологічні взаємозв’язки між ДПК і ПЗ, скажемо, що існує надійна залежність між наявністю в ДПК нутрієнтів і зовнішньою секрецією ПЗ. Так, якщо в ДПК знаходяться негідролізовані або недостатньо гідролізовані нутрієнти, які надійшли зі шлунка, то до ПЗ надходить команда: «Подайте-но травні ферменти у просвіт ДПК!» Ця команда здійснюється через стимуляцію S- і I-клітин слизової ДПК білками, жирами й іонами Н+. Коли необхідна кількість ферментів, бікарбонатів, обсягу панкреатичного секрету надійде в ДПК і відбудеться достатній гідроліз нутрієнтів, стимуляція ПЗ слабшає. У міжтравний період ДПК не вимагає від ПЗ ферментів або вимагає їх мінімальну кількість. А що ж відбувається при хронічному панкреатиті (ХП), тобто панкреатичній недостатності? Природно, що при зменшенні кількості функціонально активних ацинарних клітин ПЗ (атрофії, фіброзі) вона не може забезпечити надходження в ДПК потрібної кількості ферментів, тобто такої, що необхідна для повного гідролізу нутрієнтів. Негідролізовані нутрієнти затримуються в ДПК в надії компенсувати недолік ферментів часом, тобто в очікуванні того, що панкреатичні ферменти, які надходять у зниженій кількості, але протягом тривалого часу, все ж забезпечать необхідний гідроліз компонентів хімусу. Саме таким шляхом формуються дуоденостаз і хронічна дуоденальна гіпертензія (ХДГ) при ХП із зовнішньосекреторною недостатністю ПЗ. Клінічний результат – тяжкість, біль, розпирання, дискомфорт у верхніх відділах живота, тобто диспепсія. Крім того, дуоденостаз рефлекторним шляхом викликає збудження блювотного центру для зниження тиску в ДПК, що призводить до нудоти і блювання, яке не дає полегшення, тому що подразнення центру продовжується. Рефлекторне збудження блювотного центру сприяє також розтягненню стінок головної панкреатичної протоки (характерне для обструктивного панкреатиту), загальної жовчної протоки (наприклад, у випадку ЖКХ при біліарному ХП), інтоксикації, типовій для вираженого загострення панкреатиту. В результаті нудота посилюється, збільшується ймовірність блювання. Виходячи з описаних вище патогенетичних механізмів болю і диспепсії, стає зрозумілим, що основний шлях їх усунення – це призначення сучасних ферментних препаратів. Мінімікросфери ферментного препарату евакуюються в ДПК зі шлунка разом із хімусом, тим самим забезпечують швидкий і повний гідроліз компонентів цього хімусу в ДПК, що сприяє ліквідації дуоденостазу. Якщо ж використовувати таблетовані ферментні препарати, то через асинхронізм вони затримаються у шлунку, а хімус, що потрапив у ДПК, як і раніше, буде «очікувати» ферменти, щоб гідролізуватися й рухатися далі у тонку кишку. Виходячи з патогенезу, зменшенню вираженості відчуття важкості в епігастрії, нудоти, блювання також сприяє забезпечення безперешкодного відтоку жовчі і панкреатичного секрету, зменшення інтоксикації при купіруванні загострення ХП.
При розвитку дуоденостазу в пацієнтів із ХП він нерідко є причиною не тільки компенсованої, але й суб- і навіть декомпенсованої ХДГ. При цьому рефлюкс у вірсунгову протоку призводить до збільшення ХП (ентерокіназа, потрапляючи у ПЗ, викликає внутрішньоорганну активацію трипсиногену); рефлюкс у загальну жовчну протоку призводить до розвитку холециститу; рефлюкс у шлунок, а потім і у стравохід – до формування рефлюкс-гастриту, жовчного ДГЕР. Далі останній нестримний рефлюкс сприяє формуванню діафрагмальної грижі, яка зустрічається при ХП досить часто. Рефлюксні явища клінічно проявляються відрижкою, печією, а у деяких випадках – болем у стравоході.
Таким чином, у патогенезі клінічних проявів панкреатичної недостатності важливу роль відіграє дуоденостаз. Не випадково навіть в науковій медичній літературі дуоденостаз називають «дуоденальним демоном» [4, 35]. Синдром ХДГ, або «дуоденального демона», проявляється цілою низкою розладів: відчуттям важкості в епігастрії, відрижкою, печією, нудотою, блюванням, метеоризмом, порушенням дефекації. Однак це не всі симптоми. Синдром ХДГ часто проявляється явищами психосоматичної астенізації, зниженням розумової продуктивності і фізичної працездатності, апатією до всього, з похмурою оцінкою життєвих перспектив [4, 35]. Для ХДГ характерний також головний біль за типом мігрені (дуоденальна мігрень), патогенез якої, ймовірно, має нервово-рефлекторний характер у відповідь на активацію вагальних і нервових симпатичних аферентних импульсів при розтягуванні ДПК [9].
Наявність ДГР може провокувати і підтримувати розвиток ГЕР. Це може відбуватися двома шляхами: через підвищення інтрагастрального тиску; через приєднання нових компонентів, таких як дуоденальний вміст із ЖК і панкреатичними ензимами, що потенційно шкідливо для слизової оболонки стравоходу [1, 10]. При рефлюкс-гастриті шкідливу дію на слизову шлунка чинять ЖК, лізолецитин і трипсин.
О.Я. Бабак так описує механізм пошкодження слизової: «ЖК, що мають детергентні властивості, сприяють солюбілізації ліпідів мембран поверхневого епітелію. Такий ефект залежить від концентрації, рівня кон’югації та гідроксилювання ЖК і, що дуже важливо, від рівня рН вмісту шлунка» [1]. При низьких значеннях останнього слизову оболонку пошкоджують лише тауринові кон’югати; інші кон’югати у таких умовах преципітують. Навпаки, при високих значеннях рівня рН, що особливо характерно для кукси резектованого шлунка, некон’юговані й дигідроксильні ЖК володіють значно більшими ушкоджувальними властивостями, ніж кон’юговані і тригідроксильні [2, 38, 39, 44]. Певну роль у пошкодженні шлункового епітелію відіграє й лізолецитин, що утворюється при дуоденальному гідролізі лецитину панкреатичною фосфоліпазою А. Відомо, що поверхня слизової оболонки гідрофобна. Це пов’язано з абсорбцією поверхнево-активних фосфоліпідів зовнішньою мембраною епітеліоцитів. В умовах експерименту було показано, що така гідрофобність різко знижується після короткочасної інкубації шматочка слизової оболонки в середовищі, що містить дезоксихолат натрію: це пояснюють дією ЖК на фосфоліпіди клітинних мембран [10, 27, 47]. Що стосується пошкодження слизової стравоходу при ДГЕР, то найкраще вивчено значення ЖК, які, мабуть, відіграють основну роль у патогенезі ушкодження стравоходу при ДГЕР. Встановлено, що кон’юговані ЖК, в першу чергу тауринові кон’югати, і лізолецитин спричинюють більш виражену шкідливу дію на слизову оболонку стравоходу при кислому рН, що визначає їх синергізм із соляною кислотою в патогенезі езофагіту. Некон’юговані ЖК і трипсин більш токсичні при нейтральному і слаболужному рН [16, 37]. Токсичність некон’югованих ЖК зумовлена переважно їх іонізованими формами, які легше проникають через слизову оболонку стравоходу. Ендоскопічні зміни, які виявляються при рефлюкс-гастриті, представлені у табл. 1.
За результатами ендоскопії виділяють 3 ступеня ДГР в залежності від кольору рефлюктату: від світло-жовтого прозорого (I ступінь) до яскраво-жовтого (II ступінь) і зеленого (III ступінь). Найбільш характерні гістологічні зміни при рефлюкс-гастриті наведені у табл. 2. Деякі автори справедливо, на наш погляд, вважають, що ДГР може бути спровокований самою процедурою ендоскопії [13, 48]. Що стосується рефлюкс-езофагіту, то ДГЕР може призводити до розвитку важкого езофагіту, метаплазії стравохідного епітелію і навіть аденокарциноми, що розвивається на тлі останньої [41, 42]. С.А. Gutschow та співавт. (2002) також переконливо продемонстрували роль ДГЕР у поєднанні з кислим рефлюксом у патогенезі циліндричної метаплазії стравохідного епітелію, стравоходу Барретта й аденокарциноми стравоходу [31]. Цікаво, що результати експериментального дослідження, виконаного на щурах, яким було проведено гастректомію, свідчать про домінування не залозистого, а плоскоклітинного раку стравоходу на тлі ДГЕР [16, 30].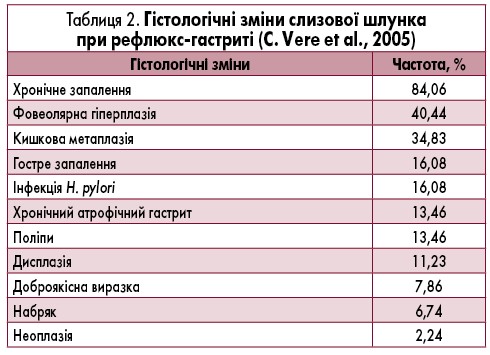
Особливою категорією є біліогенні виразки. Найчастіше вони формуються у шлунку, тому що слизова ДПК адаптована до контакту з жовчю. Проте після холецистектомії виразки можуть формуватися і в ДПК (рис. 1). Патогенез біліогенних дуоденальних виразок, які розвиваються після холецистектомії, уявляється так. У разі наявності значної кількості жовчі в дуоденальному просвіті за відсутності у ньому хімусу, в умовах дуоденостазу й зниження кількості біліарного слизу, з лецитину жовчі при контакті з панкреатичною фосфоліпазою А2 продукується лізолецитин. Він і викликає пошкодження слизової оболонки ДПК. Крім того, трипсиноген взаємодіє в дуоденальному просвіті з ЖК, які його активують. Активний трипсин також сприяє пошкодженню слизової оболонки ДПК і утворенню виразок (рис. 1).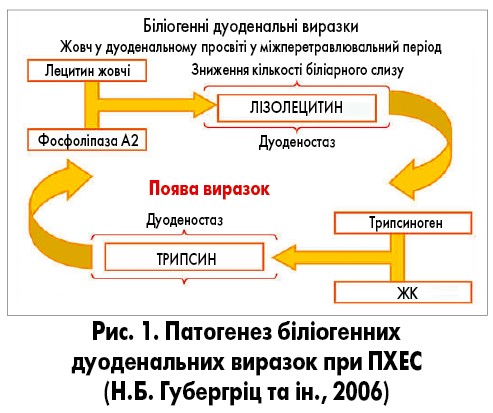
У лікуванні рефлюкс-гастриту і рефлюкс-езофагіту основну роль відводять препаратам урсодезоксихолевої кислоти (УДХК) [3, 10, 33]. Пропонуємо розглянути клініко-патогенетичне обґрунтування лікування препаратами колоїдного вісмуту.
Основними препаратами лікування ГЕР залишаються інгібітори протонної помпи (ІПП). Їх рекомендують і при ДГР. Ефективність прийому деяких ІПП при ДГР оцінювали в неконтрольованих або невеликих контрольованих дослідженнях зі змінними результатами [21]. Механізм їх дії при цій патології не зовсім зрозумілий. Вважається, що ЖК викликають пошкодження через свої детергентні властивості, однак при більш високих значеннях рівня рН вони преципітуються, а при більш низьких ще більше ушкоджують слизову оболонку шлунка. Застосування ІПП супроводжується вираженим підвищенням рівня рН і зменшенням шкідливого впливу ЖК на слизову оболонку шлунка.
Інший аспект «жовчі in excess» – хологенна діарея. Ця проблема менш відома практикуючим лікарям, тому розповімо про неї докладніше.
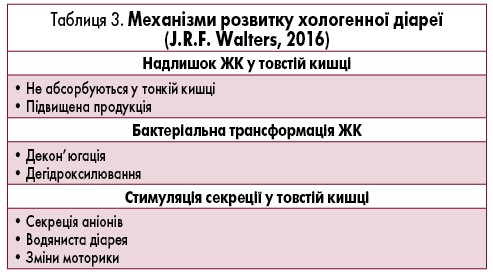 Хологенна діарея – секреторна діарея, що виникає внаслідок надлишкового надходження ЖК в ободову кишку через порушення їх зворотної реабсорбції у підвздошній кишці. Секреторний ефект ЖК у товстій кишці здійснюється через передавальний механізм – циклічний аденозинмонофосфат, під дією якого інгібується всмоктування й посилюється секреція води та електролітів у товстій кишці, що є причиною діареї [11, 12]. Виділяють 3 основних патофізіологічних механізми хологенної діареї (табл. 3).
Хологенна діарея – секреторна діарея, що виникає внаслідок надлишкового надходження ЖК в ободову кишку через порушення їх зворотної реабсорбції у підвздошній кишці. Секреторний ефект ЖК у товстій кишці здійснюється через передавальний механізм – циклічний аденозинмонофосфат, під дією якого інгібується всмоктування й посилюється секреція води та електролітів у товстій кишці, що є причиною діареї [11, 12]. Виділяють 3 основних патофізіологічних механізми хологенної діареї (табл. 3).
Важливо, що, в залежності від етіології й домінуючого варіанту патогенезу, описані 3 типи хологенної діареї (табл. 4).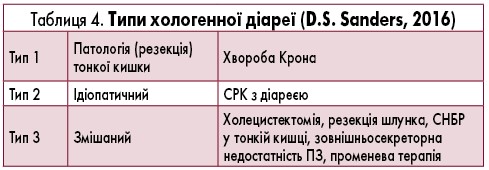
Тип 1 (вторинний) досліджений давно і зустрічається при резекції або запаленні клубової кишки (хвороби Крона та ін.). В умовах фізіологічної норми 95% ЖК реабсорбуються у клубовій кишці і транспортуються назад у печінку. При ураженні клубової кишки порушується всмоктування ЖК, і вони в надлишку надходять у товсту кишку, викликаючи хологенну діарею [12].
Тип 2 (ідіопатичний, або первинний) отримав свою назву через відсутність патогістологічних ознак ураження клубової кишки. Тривалий час вважався рідкісним. Однак останні дослідження вказують на те, що невелика кількість хворих із цим типом хологенної діареї була зумовлена складністю її диагностики. Результати останніх досліджень показують, що серед пацієнтів із СРК із діареєю більше 30% страждають на хологенну діарею, а її поширеність серед жителів Західної Європи сягає 1% [12]. Етіологія ідіопатичної хологенної діареї до теперішнього часу залишається незрозумілою. Розглядаються кілька її патофізіологічних механізмів. З’явилися дані, що ідіопатичний варіант мальабсорбції РК пов’язаний зі швидким транзитом кишкового вмісту. Деякі дослідники вважають причиною генетичні дефекти регуляції транспорту та синтезу ЖК або молекулярних механізмів, відповідальних за ці процеси [36].
Тип 3 (змішаний) включає в себе стани, при яких також можливе виникнення хологенної діареї: наприклад, перенесена холецистектомія, СНБР, панкреатит, мікроскопічний коліт, целіакія тощо.
Клінічна картина хологенної діареї характеризується частими водянистими випорожненнями, що супроводжуються відчуттям печіння в прямій кишці і задньому проході. Відсутність клінічних симптомів прогресування захворювання, незважаючи на його тривалість, нерідко призводить до помилкового діагнозу СРК. Характерною ознакою хологенної діареї є наявність ЖК у випорожненнях: вони зазвичай мають яскраво-жовтий або зелений колір. Іншою характерною ознакою цього типу діареї є біль у правій клубовій ділянці, часто з’являється при пальпації сліпої і висхідної кишки. Хологенна діарея має хронічний, але не прогресуючий перебіг [17]. У табл. 5 наведені диференційно-діагностичні ознаки хологенної діареї та діареї при СРК.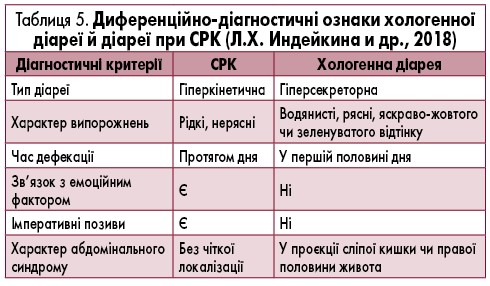
Діагностика мальабсорбції РК може проводитися за допомогою тесту SeHCAT, який заснований на використанні аналога кон’югованої ЖК (75Se-гомохолілтаурину), що проходить усі етапи ентерогепатичної циркуляції, втрати якого фіксують за допомогою γ-камери через 7 днів після перорального прийому цієї речовини. Збереження SeHCAT в організмі через 7 днів після перорального прийому менше 10-15% від вихідного вказує на наявність мальабсорбції РК. Однак з огляду на використання спеціального дорогого устаткування, цей метод не завжди є доступним (рис. 2) [12].
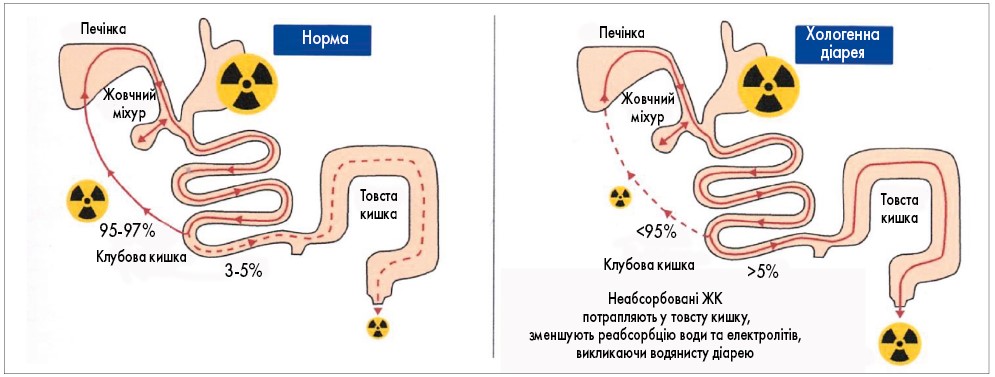 Рис. 2. Принцип тесту SeHCAT (O.P. Calvo, 2016)
Рис. 2. Принцип тесту SeHCAT (O.P. Calvo, 2016)
За допомогою рідинної хроматографії високої роздільної здатності можливе вимірювання в сироватці крові рівня попередника ЖК – 7α-гідрокси-4-холестену-3-1 (С4), підвищення якого також вказує на посилений синтез ЖК, характерний для хологенної діареї [26]. Рівень C4 значно зростає у пацієнтів із хологенною діареєю з чутливістю і специфічністю 90 та 79% відповідно. При цьому вміст C4 добре корелює з показником SeHCAT. З урахуванням простоти та економічності дослідження рівня C4 є більш привабливим як скринінговий тест для діагностики хологенної діареї [51].
Визначення концентрації FGF-19 у сироватці крові імуноферментним методом може також використовуватися як тест для діагностики мальабсорбції РК [40]. Раніше проведені дослідження показали, що медіанні рівні FGF-19 значно нижче в групі хворих з ідіопатичною хологенною діареєю, ніж у контрольній групі (120 нг/мл проти 231 нг/мл), а рівень C4 натщесерце значно вищий, ніж у контролі (51 нг/мл проти 18 нг/мл), що підтверджує дефіцит інгібування зворотного зв’язку гормоном FGF-19, внаслідок якого виникають перевироблення РК і хологенна діарея [49].
Для кількісного визначення ЖК у калі застосовується спектрофотометричний ферментний метод. У спиртовому екстракті зі зразків калу вагою 1-1,5 г ферментним методом визначають концентрацію ЖК із подальшим розрахунком їх добової екскреції з урахуванням кількості калових мас на добу. За даними Л.М. Крумс та співавт., у здорових осіб втрата ЖК із фекаліями становить 100-200 мг/добу. У хворих, які перенесли резекцію понад 100 см клубової кишки, середні втрати ЖК становлять 2250,7±685,3 мг/добу. У групі тих, хто переніс холецистектомію, середній вміст ЖК у калі також перевищував норму і становив у середньому 786,4±103,7 мг/добу [15].
Лікування хологенної діареї традиційно проводиться холестираміном, який є синтетичною аніонобмінною смолою, яка використовується для абсорбції ЖК у просвіті тонкої кишки. Однак препарат викликає запори, сорбує лікарські препарати, жиророзчинні вітаміни. Перспективними вважають колесевалам (секвестрант ЖК), обетіхолеву кислоту [11, 29].
Патогенетичне обґрунтування лікування синдрому «жовч in excess» препаратами вісмуту
Препарати вісмуту (вісмуту трикалію субцитрат, субсаліцилат, субнітрат, субкарбонат) використовуються в медицині з XVII століття для лікування різних захворювань органів ШКТ. Зараз відзначається своєрідний вісмутовий «ренесанс», пов’язаний з необхідністю покращення ефективності ерадикаційної терапії H. pylori). Інтерес до препаратів вісмуту також пов’язаний з їх цитопротективними властивостями, оскільки саме дефекти цитопротекції лежать в основі ряду захворювань ШКТ (наприклад, НПВП (нестероїдні протизапальні препарати)-індукованих гастро- та ентеропатій) [20].
Ефективність та безпечність сполук вісмуту доволі різні. Серед усіх солей вісмуту найбільш затребуваним є вісмуту трикалію субцитрат як найбільш ефективна і безпечна сполука. Саме трикалію субцитрат має найменші значення мінімальної переважної концентрації по відношенню до бактерії H. pylori, а також характеризується найбільшою клінічною ефективністю при лікуванні хелікобактеріозу [34].
Не так давно в Україні з’явився препарат Улькавіс®. У науково-дослідному центрі у м. Ново-Мєсто (Словенія) під керівництвом У. Худоклін було проведено порівняльний аналіз фізико-хімічних і структурних властивостей таблетованих форм препаратів, що містять вісмуту трикалію субцитрат: оригінального лікарського засобу Де-Нол® (Astellas) і дженерика Улькавіс® (КRКА). Під час дослідження аналізували і порівнювали зовнішній вигляд таблеток, їх міцність при роздавлюванні, структуру таблеток на зрізі, проводили сканувальну електронну мікроскопію, раманівське картування, визначали вивільнення аміаку з таблеток і розпадаємість препарату в статичних умовах. Автори констатували подібні структурні й фізико-хімічні властивості обох препаратів. Отримані дані свідчать про подібність характеристик процесів розпаду таблеток Улькавіс® і Де-Нол®, що дозволяє вважати подібними їх фармакокінетичні характеристики, а також припустити їх співставну терапевтичну еквівалентність. У той же час слід враховувати, що всі основні ерадикаційні схеми припускають кислотосупресію до рівня рН близько 5. Через це було б актуальним порівняти особливості розчинення таблеток Улькавіс® і Де-Нол® саме при цьому рівні рН [20].
У клінічному дослідженні, що проводилося з використанням вісмуту субцитрату (Улькавіс®) у складі ерадикаційної терапії, була продемонстрована висока ефективність і безпека цього лікарського засобу [23]. Фармацевтична еквівалентність, порівнянність структурних і фізико-хімічних властивостей, терапевтична ефективність препарату Улькавіс® (KRKA) є запорукою його терапевтичної еквівалентності до референтного лікарського засобу Де-Нол® (Astellas) [20].
Чому ж Улькавіс® доцільний при ДГЕР і хологенній діареї?
- На поверхні слизової вісмуту трикалію субцитрат утворює глікопротеїнвісмутові комплекси, що, по суті, є дифузійним бар’єром для соляної кислоти, який посилюється за рахунок додаткового підвищення в’язкості пристінкового слизу [20].
- Одночасно під впливом вісмуту відбувається перерозподіл продукції муцинів – рівень кислих муцинів, підвищений в ураженому епітелії, знижується при одночасному зростанні кількості нейтральних муцинів [20].
- Дослідження in vitro показали, що вісмуту властива антипепсинова активність [20].
- Феномен зв’язування ЖК вісмутом, що особливо важливо при жовчному рефлюксі та при хологенній діареї, був описаний після досліджень in vitro [45].
- Разом із дією описаних класичних фармакологічних ефектів вісмуту, що забезпечують захист і відновлення слизової, прискоренню репарації епітелію в зоні виразкового дефекту сприяє захист вісмутом епідермального фактора росту від гідролітичного руйнування [32].
- Окрім антибактеріальних властивостей, вісмут також має протизапальний ефект при проходженні через кишечник [28].
- Вісмут має певне значення у патогенетичному лікуванні гострої і хронічної діареї як антибактеріальний і антитоксичний агент [46].
- При включенні вісмуту трикалію субцитрату в схему потрійної антихелікобактерної терапії на 17,3% рідше спостерігається антибіотикасоційована діарея [19].
- Включення вісмуту трикалію субцитрату в схему лікування СИБР дозволяє домогтися більш ефективної деконтамінації (на 15,3%) і більш тривалої ремісії (на 9,5%) [19].
Наводимо клінічне спостереження пацієнтки з ПХЕС і синдромом «дуоденального демона» [7].
Клінічний випадок
18 грудня 2020 р. на консультацію до проф. Н.Б. Губергріц звернулася пацієнтка В., 39 р., домогосподарка. Скарги на відчуття нестачі повітря (з весни 2020 г.), біль в епігастрії, відчуття розпирання після їди, невпинна печія, гіркота в роті, відрижка, здуття живота, рідка дефекація до 3-4 разів на день (без слизу і крові, з помаранчевим відтінком).
У 2009 р. після перших пологів пацієнтці було проведено холецистектомію з приводу ЖКХ. До листопада 2020 р. почувалася задовільно. У 2015 р., після других пологів, з’явилася періодична печія, але пацієнтка до лікаря не зверталася, приймала антациди, альгінати. Погіршення відчула до кінця 2020 р.
При об’єктивному дослідженні патологічних ознак з боку органів грудної клітки не визначається. При пальпації черевної стінки болючість під мечовидним відростком. Печінка у краї реберної дуги. Селезінка не пальпується.
При езофагогастродуоденоскопії 22.12.2020 (рис. 3) виявлено наступне.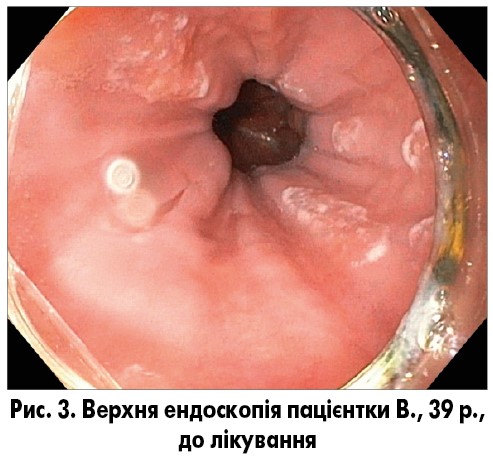
Стравохід вільно прохідний. Слизова стравоходу ерозована в нижній третині циркулярно протягом 2 см, вкрита фібрином. Палісадні судини не візуалізуються. Z-лінія на відстані 35 см від різців, вище рівня діафрагми і верхівок шлункових складок на 1 см. У стравоході сліди жовчі. Кардія не змикається. Кардіальна складка ІІ типу по Хіллу. Шлунок звичайної форми. Містить натщесерце до 50 мл жовчі. Розпрямляється при інсуфляції вільно. Складки шлунка звичайної форми. Перистальтика активна. Слизова оболонка шлунка вогнищево гіперемована. Воротар звичайної форми, змикається, прохідний для ендоскопа. Узято матеріал для оцінки стану слизової по OLGA/OLGIM, а також для виявлення Н. pylori. Цибулина ДПК звичайної форми, прохідна для ендоскопа, вільно розправляється повітрям. Слизова оболонка цибулини рожева. Ретробульбарний відділ ДПК не деформований, складки виражені. Слизова оболонка рожева. Фатерів сосок не змінений.
Висновок: рефлюкс-езофагіт D (LA), недостатність кардії, ДГР, рефлюкс-гастрит.
Патоморфологічний висновок: хронічний неатрофічний неактивний рефлюкс-гастрит (тип С), стадія 0 за системою OLGA, ступінь 0 за системою OLGIM.
На підставі клінічних даних, результатів ендоскопічного та гістологічного досліджень встановлений діагноз: постхолецистектомічний синдром, ДГР, рефлюкс-гастрит, рефлюкс-езофагіт стадії D, хологенна діарея.
Пацієнтці призначено лікування та надано рекомендації щодо дієти: вживати малошлакову м’яку їжу, що не подразнює шлунок, у теплому вигляді. Виключити продукти, що містять лактозу, багатоатомні спирти, жирні кислоти, сиру рослинну клітковину. Дозволені і рекомендовані: нежирні сорти м’яса, риби, яйця, каші, білий хліб, макаронні вироби, невелика кількість овочів і фруктів у кулінарній обробці.
Медикаментозна терапія: призначена Нольпаза по 40 мг вранці і ввечері за 30 хв до їди протягом 1 місяця, потім по 20 мг 2 р/день протягом 1 місяця. Вибір препарату зумовлений тим, що Нольпаза має багато переваг, а саме:
- біоеквівалентність оригінальному пантопразолу;
- pH-селективність;
- мінімальна вірогідність виникнення небажаних побічних ефектів;
- стабільна біодоступність;
- тривалість дії;
- незначний вплив на метаболізм інших лікувальних засобів;
- швидкість настання ефекту;
- зниження ризику рецидивів ГЕРХ;
- наявність двох форм випуску й різних дозувань;
- у разі наявності вираженого больового синдрому доцільно починати лікування з в/в введення з переходом на пероральний прийом 40 мг, а потім 20 мг;
- вигідне співвідношення ціна/ефективність;
- список В під час вагітності.
Пацієнтці також призначений Улькавіс® по 120 мг 3 р/день за 20-30 хв до їди та 1 таблетка на ніч протягом 2 місяців, Альфа Нормікс по 200 мг 4 р/день протягом 12 днів, Ітомед по 50 мг 3 р/день за 30 хв до їди протягом 8 тижнів. УДХК призначити не змогли через хологенну діарею. Незважаючи на це, при повторному візиті в березні 2021 р. пацієнтка В. відзначила значне поліпшення свого самопочуття: майже повна відсутність печії та гіркоти у роті, припинення епізодів нестачі повітря (ймовірно, ми справедливо вважали їх проявом ДГЕР), нормалізацію дефекації (ймовірно, мав місце СИБР, і лікування препаратами Альфа Нормікс та Улькавіс® сприяло ерадикації СИБР і нормалізації кишкової перистальтики). І, нарешті, отримана чітка позитивна динаміка при ендоскопії.
При езофагогастродуоденоскопіі 13.03.2021 огляд виконаний у звичайному (WL), вузькоспектральному (NBI) режимі, із застосуванням дистального ковпачка (рис. 4).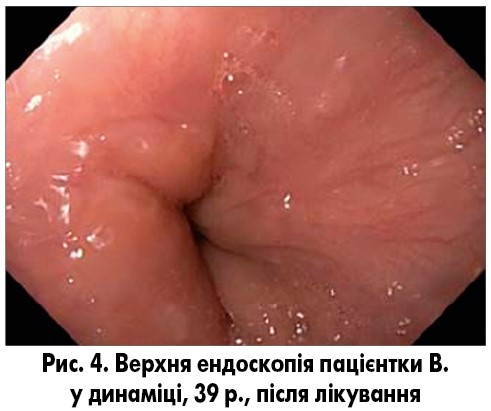
Стравохід вільно прохідний. Слизова стравоходу помірно гіперемована в нижній третині, з незначними рубцевими змінами над Z-лінією. В просвіті стравоходу жовч. Палісадні судини візуалізуються. Z-лінія на відстані 36 см від різців, вище рівня діафрагми і верхівок шлункових складок на 1 см. Кардія не змикається. Кардіальна складка ІV типу по Хіллу. Шлунок звичайної форми. Містить натщесерце до 50 мл жовчі. Розправляється при інсуфляції вільно. Складки шлунка звичайної форми. Перистальтика активна. Слизова оболонка шлунка вогнищево гіперемована. Воротар звичайної форми, змикається, прохідний для ендоскопа. Цибулина ДПК звичайної форми, прохідна для ендоскопа, вільно розправляється повітрям. Слизова оболонка цибулини рожева. Ретробульбарний відділ ДПК не деформований, складки виражені. Слизова оболонка рожева. Фатеров сосок не змінений.
Висновок: рефлюкс-езофагіт, недостатність кардії, еритематозна гастропатія, ДГР.
Пацієнтці рекомендований прийом препарату Нольпаза по 20 мг протягом 1 місяця, Улькавіс® по 1 таблетці 3 р/день протягом 1 місяця.
Список літератури знаходиться в редакції.
За підтримки компанії KRKA.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (61) 2021 р.




