15 листопада, 2021
Роль цинку та вітамінів С і D у щоденній підтримці імунітету для профілактики гострих респіраторних захворювань, у тому числі COVID-19
 Пандемія коронавірусної хвороби (COVID‑19) привернула увагу і лікарів, і пацієнтів до важливості основних нутрієнтів, особливо тих, які мають імуномодулювальні властивості та здатні підсилювати імунний захист у разі різних вірусних інфекцій (Calder P. C. et al., 2020; Infusino F. et al., 2020). Показано, що вірусні інфекції підвищують потребу в певних мікронутрієнтах, як-от вітаміни A, B, C та D, цинк і селен (Gombart A. F. et al., 2020; Jovic T. H. et al., 2020; Messina G. et al., 2020).
Пандемія коронавірусної хвороби (COVID‑19) привернула увагу і лікарів, і пацієнтів до важливості основних нутрієнтів, особливо тих, які мають імуномодулювальні властивості та здатні підсилювати імунний захист у разі різних вірусних інфекцій (Calder P. C. et al., 2020; Infusino F. et al., 2020). Показано, що вірусні інфекції підвищують потребу в певних мікронутрієнтах, як-от вітаміни A, B, C та D, цинк і селен (Gombart A. F. et al., 2020; Jovic T. H. et al., 2020; Messina G. et al., 2020).
Дієтичні добавки мікроелементів зі встановленою роллю в імунній функції можуть оптимізувати імунну відповідь організму, зменшуючи ризик розвитку інфекцій. У цьому контексті найпотужніша доказова база наявна для цинку та вітамінів C і D. Навіть незначний їх дефіцит може порушувати метаболізм і несприятливо впливати на імунну систему (Name J. J. et al., 2020).
Цинк
Цинк бере участь у розвитку й активації клітин-ефекторів і вродженого, і набутого імунітету (Maggini S. et al., 2010), а також сприяє підтримці цілісності епітеліальних бар’єрів – першої лінії захисту від проникнення патогенів (Maares M. et al., 2016; Shin K. et al., 2006). Модулюючи активність Т‑лімфоцитів, цинк може зменшувати вираженість цитокінового шторму, який спричиняє гострий респіраторний дистрес-синдром (ГРДС) або поліорганну недостатність за COVID‑19 (Coperchini F. et al., 2020; Rahman M. T. et al., 2020). Дефіцит цинку призводить до зниження активності природних кілерів і цитолітичних Т‑лімфоцитів, які беруть участь у руйнуванні вірусів, бактерій і пухлинних клітин (Prasad A. S., 2007).
Цинку також притаманна безпосередня противірусна активність: підвищений внутрішньоклітинний вміст цинку пригнічує реплікацію низки РНК‑вірусів (Suara R. O. et al., 2004; Wei Z. et al., 2012; Kaushik N. et al., 2018; Read S. A. et al., 2019). Інкубація культури клітин навіть за низької концентрації цинку пригнічувала реплікацію коронавірусу SARS-CoV за рахунок інгібування його РНК‑полімерази (te Velthuis A. J. et al., 2010). Крім того, цинк знижує активність ангіотензинперетворювального ферменту‑2 (АПФ‑2), який необхідний для проникнення SARS-CoV‑2 у клітини організму-господаря (Speth R. et al., 2014; McPherson S.W. et al., 2020).
Дефіцит цинку вражає близько третини населення світу – як у країнах, що розвиваються, так і в розвинутих країнах. Із дефіцитом цинку пов’язано близько 16% інфекцій нижніх дихальних шляхів, що може свідчити про потенційний зв’язок між цим станом і підвищеним ризиком розвитку COVID‑19 і тяжкого її перебігу (Wessels I. et al., 2020; WHO, 2002).
Епідеміологічні дані свідчать, що більшість смертей від COVID‑19 трапляються в осіб похилого віку з коморбідними станами (Dhama K. et al., 2020; Wang D. et al., 2020). У цього контингенту також спостерігається вища поширеність дефіциту цинку (Marreiro D. N. et al., 2002; Pisano M. et al., 2016), оскільки старіння супроводжується зниженням якості харчування, меншою ефективністю всмоктування нутрієнтів та інтенсивним впливом на їх обмін застосування медикаментів (Haase H. et al., 2009). Цікаво, що під час інфекційної хвороби організм може мобілізувати наявний цинк для пріоритетних функцій, передусім для роботи імунної системи, що призводить до зниження рівнів цинку та нестачі цього мікроелемента для менш важливих потреб, зокрема підтримки нормальних нюхових і смакових відчуттів, що типово для COVID‑19 (Name J. J. et al., 2020).
Не слід також нехтувати роллю цинку в складі білків міжклітинних з’єднань. В умовах дефіциту цинку цілісність цих з’єднань порушується, внаслідок чого полегшується надходження патогенів, і навпаки: добавки цинку покращують стан міжклітинних з’єднань (Sturniolo G. C. et al., 2002; Finamore A. et al., 2008; Wang X. et al., 2013).
Нестача цинку асоціюється зі збільшенням частоти респіраторних інфекцій, натомість призначення добавок цього мікроелемента – зі зменшенням поширеності пневмонії в дітей на 41% (Lassi Z. S. et al., 2016). Клінічні дослідження також показали, що добавки цинку можуть до 54% знижувати тяжкість і тривалість різноманітних симптомів застуди (гарячки, кашлю, болю в горлі та м’язах, закладеності носа) (Hemila H. et al., 2015, 2016; Prasad A. S. et al., 2000).
Вітамін С
Вітамін С є водорозчинною речовиною з антиоксидантними властивостями, що відіграє ключову роль у роботі імунної системи за рахунок зміцнення епітеліального бар’єра й участі у функціях клітин вродженого та набутого імунітету (Jovic T. H. et al., 2020; Carr A. C. et al., 2017).
Вміст вітаміну С в організмі людини може варіювати залежно від стану довкілля, в тому числі забруднення повітря, наявності гострих і хронічних захворювань (Carr A. C. et al., 2017). Особи похилого віку нерідко мають дефіцит вітаміну С через фонові захворювання та природне зниження вмісту вітаміну С з віком. Низький вміст вітаміну С (≤17 мкмоль/л) у цій популяції асоціюється зі смертністю від усіх причин, включаючи кардіоваскулярні (Fletcher A. E. et al., 2003). Показано, що в пацієнтів похилого віку, які лікувалися в стаціонарі з приводу гострих респіраторних інфекцій, на тлі призначення 200 мг вітаміну С на добу спостерігалося зменшення індексів тяжкості хвороби порівняно з групою плацебо (Hunt C. et al., 1984). У дослідженні C. Arvinte та співавт. (2020) низький рівень вітаміну С виступав асоційованим із віком чинником ризику смерті від COVID‑19.
Метааналіз 44 досліджень, у яких вітамін С призначався в дозах від 200 мг/добу, виявив зменшення тривалості застуди в дорослих і дітей. Автори пов’язують це з роллю цього вітаміну у функціонуванні імунної системи та його антигістамінними властивостями (Hemila H. et al., 2013).
Призначення вітаміну С зменшувало сумарну оцінку тяжкості респіраторних симптомів y пацієнтів із пневмонією (Hunt C. et al., 1994) та супроводжувалося сприятливими наслідками (зменшення інтенсивності запалення й ураження органів, зниження вірулентності патогенів, оптимізація імунного захисту) при ГРДС (Hoang B. X. et al., 2020).
В умовах ГРДС рідина та білки потрапляють в альвеоли, спричиняючи набряк легень. Причиною цього процесу є ушкодження щільних з’єднань ендотелію легень і, відповідно, підвищена проникність останнього для рідин, нейтрофілів та еритроцитів (Matthay M. A. et al., 2019). В експериментальному дослідженні на мишах із сепсисом і гострою легеневою дисфункцією інфузія вітаміну С у дозі 200 мг/кг сприяла усуненню рідини з легень, покращенню структури та функції альвеолярного епітеліального бар’єра та зменшенню прозапальної відповіді (Fisher B. J. et al., 2012).
Застосування вітаміну С як ад’юванту в терапії ГРДС зменшує частоту несприятливих наслідків сепсису. Метааналіз 18 контрольованих клінічних досліджень виявив, що пероральне чи внутрішньовенне застосування вітаміну С зменшувало тривалість перебування у відділенні інтенсивної терапії на 7,8-8,6% і тривалість штучної вентиляції легень на 18,2% (Hemila H. et al., 2019). Профілактика вітаміном С дає змогу зменшити рівень інтерлейкіну‑6 – одного з основних ефекторів цитокінового шторму (Bohm F. et al., 2007).
Вітамін D
Незважаючи на традиційну назву, вітамін D насправді є гормоном, оскільки, по-перше, переважно виробляється ендогенно та, по-друге, бере участь у регуляції роботи понад 200 генів різних клітин (Catarino A. M. et al., 2016; Peters B. S., Martini L. A., 2014).
Окрім впливу на гомеостаз кальцію та підтримки стану здоров’я кісток, вітамін D відіграє важливу роль у функціонуванні імунної системи. Те, що цей вітамін виступає потужним модулятором імунної системи, підтверджують такі факти: 1) рецептори до вітаміну D присутні в усіх імунних клітинах; 2) цей вітамін асоціюється з виробленням Т‑лімфоцитів і диференціацією В‑лімфоцитів; 3) вітамін D оптимізує протизапальні функції, впливаючи на рівень інтерлейкіну‑19; 4) вітамін D запускає процеси дозрівання та диференціації моноцитів і макрофагів; 5) цей вітамін бере участь у виробленні цитокінів і хемокінів; 6) вітамін D індукує секрецію лізосомальних ферментів кислої фосфатази та пероксиду водню (Vanherwegen A. S. et al., 2017; Xu Y. et al., 2020; Teymoori-Rad M. et al., 2019).
Рецептори вітаміну D, окрім імунних клітин, наявні й на епітеліальних клітинах легень. При їх активації зростає експресія противірусних пептидів – дефензинів і кателіцидинів. Вважається, що порушена противірусна відповідь за COVID‑19 і дефіциту вітаміну D опосередкована зниженням вмісту LL37 – протимікробного пептиду, що утворюється з кателіцидину (Crane-Godreau M.A. et al., 2020; Munshi R. et al., 2020).
Вітамін D також може пригнічувати надмірну запальну відповідь за рахунок пригнічення прозапальних цитокінів – фактора некрозу пухлини-α й інтерлейкіну‑6, що беруть участь у спричиненому тяжким перебігом COVID‑19 ГРДС (Xu Y. et al., 2020; Munshi R. et al., 2020). Дані понад 5 тис. пацієнтів із COVID‑19 свідчать про зв’язок між дефіцитом вітаміну D та тяжкістю цитокінового шторму (Daneshkhah A. et al., 2020). Метааналіз 25 рандомізованих контрольованих досліджень виявив, що добавки вітаміну D асоціюються з нижчим на 12% ризиком розвитку гострих респіраторних захворювань (Martineau A. R. et al., 2017).
Окрім ролі в клітинному й гуморальному імунітеті, вітамін D, як і цинк та вітамін C, бере участь у формуванні та підтримці епітеліального й ендотеліального бар’єрів, у тому числі в легеневій тканині. В експерименті на мишах із нокаутом гена вітаміну D було показано, що відсутність впливів цього вітаміну спричиняє розвиток запалення легень і порушення їхньої функції, що можна пояснити підвищенням проникності легеневого бар’єра (Chen H. et al., 2018). Відповідно до норм Ендокринного товариства, рівні 25(OH)D нижче 20 нг/мл свідчать про дефіцит вітаміну D, а рівні в межах 21-29 нг/мл – про його недостатність (Holick M. F. et al., 2011). Обидва ці стани погіршують роботу імунної системи й асоціюються з підвищеною схильністю до вірусних і бактерійних інфекцій (Pludowski P. et al., 2013; Vanherwegen A. S. et al., 2017). Зв’язок між дефіцитом вітаміну D та схильністю до розвитку COVID‑19, а також до тяжкого її перебігу було продемонстровано в численних дослідженнях та їхніх метааналізах. Зокрема, метааналіз 7 ретроспективних досліджень виявив, що достовірно нижчі рівні вітаміну D асоціювалися з гіршим прогнозом, аніж нормальний вміст цього вітаміну. Було також зафіксовано достовірну відмінність у рівні вітаміну D між пацієнтами, які вижили та померли від COVID‑19. Автори метааналізу дійшли висновку, що дефіцит вітаміну D є незалежним предиктором тяжкого перебігу COVID‑19, а профілактичне чи лікувальне його застосування в групах ризику може допомогти запобігти несприятливим наслідкам (Munshi R. et al., 2020).
Механізмом зв’язку вітаміну D та COVID‑19 може бути не лише модулювання імунної системи, а й здатність вітаміну D впливати на експресію рецепторів АПФ‑2 (Malek Mahdavi A., 2020).
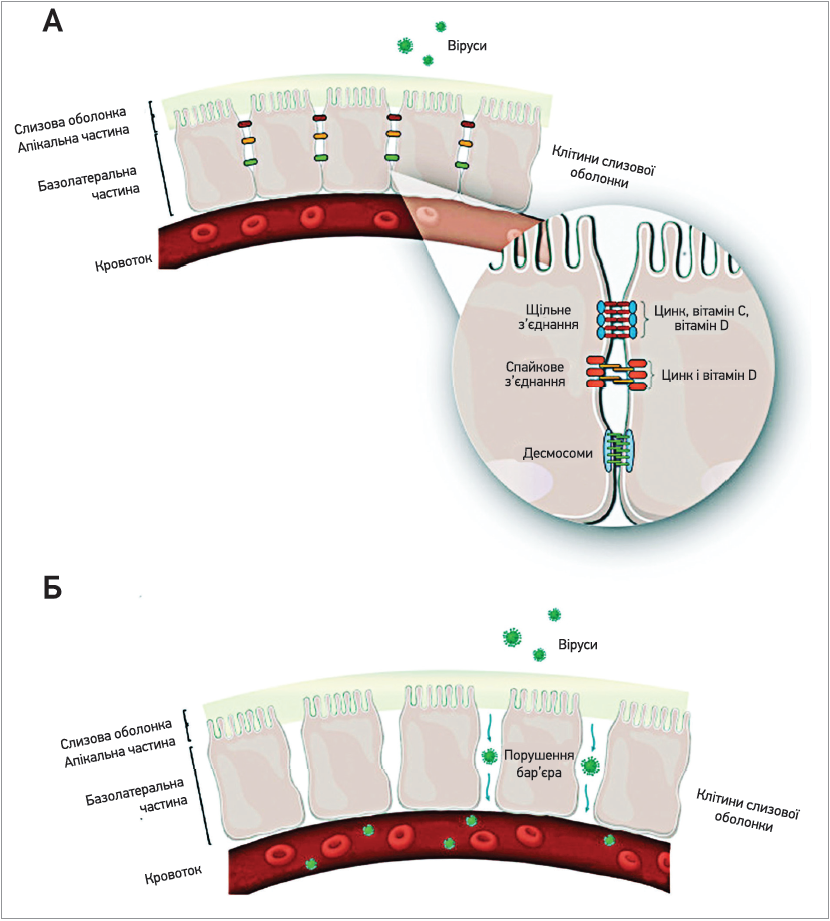
Краплі, що містять SARS-CoV‑2, потрапляють в організм людини при контакті зі слизовими оболонками ротової порожнини, дихальної та травної систем, кон’юнктивою. Саме тому цілісність бар’єрів, особливо епітеліальних, є дуже важливою для зменшення ризику інфікування. Епітеліальні клітини з’єднані щільними міжклітинними контактами, які запобігають проникненню патогенів і токсинів (рис., А) (Alberts B., 2017)
При порушенні цілісності з’єднувальних комплексів організм втрачає цей бар’єр і стає вразливим до дії пошкоджувальних агентів, зокрема вірусів, та їх проникнення в кровоплин (рис., Б) (Zhang Y. G. et al., 2013; Miyoshi Y. et al., 2016; Alberts B., 2017). Цинк і вітаміни C та D діють синергетично, забезпечуючи цілісність і функціонування білків з’єднувальних комплексів. І навпаки, на тлі їх дефіциту міцність щільних з’єднань різко знижується. Зокрема, при зменшенні внутрішньоклітинного рівня цинку знижуються рівні оклюдину та клаудину‑3 (представника родини білків, які контролюють розмір і заряд молекул, що проникають крізь парацелюлярний простір), натомість добавки цього мікроелемента відновлюють гомеостаз бар’єрних систем (Miyoshi Y. et al., 2016). За дефіциту цинку також відзначається дестабілізація цитоскелета клітин, що супроводжується підвищеною проникністю епітеліального бар’єра та нейтрофільною інфільтрацією парацелюлярного простору (Finamore A. et al., 2008). Вітамін С також впливає на експресію білків щільних з’єднань і підтримує бар’єрну функцію альвеол, що супроводжується нормалізацією балансу оклюдинів та інших білків (Fisher B. J. et al., 2012). Добавки аскорбінової кислоти зменшують набряк легень за рахунок стабілізації легеневого бар’єра, збереження парацелюлярної проникності для іонів і малих молекул, профілактики перебудови цитоскелета епітеліальних клітин та їхнього антиоксидантного захисту (Berger M. M., Oudemans-van Straaten H. M., 2015; Rao R., 2009). Вітамін D і його рецептори також беруть участь у експресії та функціонуванні оклюдинів і клаудину (Jovic T. H. et al., 2020; Zhang Y. G. et al., 2013). Показана дозо- та часозалежність експресії оклюдину‑2 та -12 від вітаміну D (Fujita H. et al., 2008). Обробка клітинних ліній вітаміном D забезпечувала зниження проникності клітинних мембран і відновлення морфології клітинного шару (Palmer H. G. et al., 2001).
Рис. (A) З’єднувальний комплекс епітеліальних клітин.
Збільшене зображення демонструє ці структури в парацелюлярному просторі та вплив цинку й вітамінів С і D. (Б) Дисфункція з’єднувального комплексу та її наслідки
Отже, деякі вітаміни та мінерали відіграють ключові ролі в імунній відповіді організму людини, в тому числі на COVID‑19. Добавки цих мікронутрієнтів можуть бути важливим заходом покращення стану імунної системи та профілактики розвитку тяжкої симптоматики. До них належать, зокрема, цинк і вітаміни C та D, які демонструють синергетичні ефекти на різних стадіях захисних реакцій організму-господаря, як-от підтримка цілісності біологічних бар’єрів і функціонування клітин вродженого та набутого імунітету. Літературні дані свідчать, що добавки цинку, вітамінів C та D здатні зменшувати тяжкість респіраторних інфекцій, тому в контексті пандемії COVID‑19 такі добавки можна розглядати як доступний, безпечний і недорогий засіб профілактики хвороби та боротьби з нею.
Шипучі таблетки ПАМП («Фармак», Україна) містять 10 мг цинку, 2000 МО вітаміну D та 1000 мг вітаміну С в 1 таблетці. Призначенням ПАМП є щоденна підтримка імунітету. З цією метою варто приймати по 1 таблетці 1 р/добу, розчинивши її у 250 мл води. Тривалість прийому визначає лікар. Вагомою перевагою ПАМП є ретельно підібрані дози компонентів. Зокрема, рекомендоване денне надходження вітаміну D становить 600-800 МО/добу, проте, за рекомендаціями Ендокринного товариства, для підтримки сироваткового рівня 25(OH)D понад 30 нг/мл дорослим необхідно приймати щонайменше 1500-2000 МО/добу (Holick M. F. et al., 2011). ПАМП також повністю (для жінок) або майже повністю покриває добову потребу в цинку, яка для жінок становить 8 мг, а для чоловіків – 11 мг (National Institutes of Health, 2021). Вміст вітаміну С у ПАМП значно перевищує добову потребу (90 мг для дорослих чоловіків і 75 мг для дорослих жінок) (National Institutes of Health, 2021), але не перевищує верхню межу допустимого надходження – 2000 мг (Zeratsky K., 2020). При COVID‑19 вивчалися саме високі дози вітаміну С, які дають змогу й задовільнити нормальні метаболічні потреби організму, й використати надлишок на боротьбу з інфекцією.
Медична газета «Здоров’я України 21 сторіччя» № 19 (512), 2021 р.