24 серпня, 2022
Гостра кровотеча при набутій гемофілії А: шунтуючі препарати або рекомбінантний свинячий фактор VIIІ
Незважаючи на розвиток сучасної медицини, багато лікарів продовжують вважати гемофілію спадковою патологією. Однак сьогодні у клінічній практиці, окрім спадкової форми, зустрічається набута гемофілія – досить рідкісний загрозливий для життя та часто фатальний розлад згортання крові, причиною якого є утворення аутоантитіл до власного фактора згортання крові, найчастіше до VIII (FVIII) – набута гемофілія А (НГА). При цьому саме рідкісність поширення й установка на спадковий характер НГА є ключовими факторами, які впливають на несвоєчасну діагностику та невідповідне лікування хворих, що, в свою чергу, пов’язано з високою смертністю у цій групі.
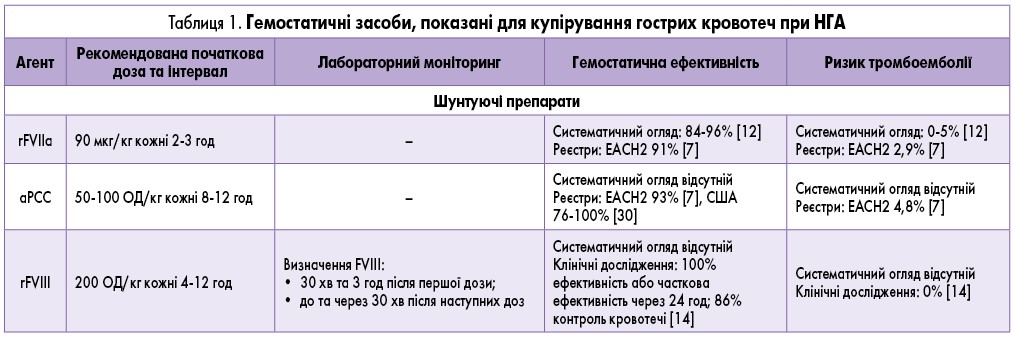
При розвитку інгібіторів до FVIII гострі кровотечі можна купірувати за допомогою препаратів із шунтуючим механізмом дії, які представлені рекомбінантним фактором VIIa (rFVIIa) та антиінгібіторним коагуляційним комплексом (aPCC), а також рекомбінантного свинячого FVIII (rFVIII). Результати попередніх досліджень, які порівнювали ефективність цих агентів, наразі недоступні, а непрямі докази свідчать про подібну ефективність усіх трьох препаратів. Відповідно, сьогодні рекомендації щодо вибору лікування НГА залежать від: (i) наявності препарату, (ii) профілю безпеки, (iii) вимог моніторингу, (iv) вартості та (v) особистого досвіду.
У 2021 р. були оприлюднені результати дослідження Andreas Tiede з кафедри гематології, гемостазу, онкології та трансплантації стовбурових клітин Ганноверської медичної школи (Department of Hematology, Hemostasis, Oncology and Stem Cell Transplantation, HannoverMedical School, Hannover, Germany) у журналі Hamostaseologie, в якому дослідник мав на меті визначити найбільш ефективний підхід до лікування гострих кровотеч при НГА.
Вступ
Пацієнти з НГА часто звертаються до відділень невідкладної медичної допомоги з симптомами гострої кровотечі [1]. У пацієнтів із явно вираженою кровотечею, ізольованим подовженням активованого часткового протромбінового часу (АЧТЧ) і низькою активністю FVIII необхідно одразу запідозрити НГА, щоб виправдати гемостатичне лікування у випадку значної кровотечі. Перед початком гемостатичного лікування, за можливості, також важливо провести визначення наявності інгібітору за допомогою специфічного аналізу крові – так званого тесту Бетесда, який виражається в одиницях Бетесда (БО/мл) або титрі Бетесда, а також виключити диференційні діагнози (наприклад, хворобу Віллебранда [2] або вовчаковий антикоагулянт) за допомогою відповідних тестувань [3, 4].
Хоча сьогоднішній розвиток медицини дозволяє чітко діагностувати НГА [5], ключовою причиною несвоєчасного виявлення цього захворювання є недостатня обізнаність лікарів щодо такої проблеми. Згідно з даними Європейського реєстру набутої гемофілії (EACH2), діагностична затримка НГА більше ніж на тиждень присутня у 35% пацієнтів, а середній час до початку гемостатичного лікування у пацієнтів цієї групи становить 20 днів [6]. Затримка в діагностиці та лікуванні може призвести до прогресування захворювання, що ще більше ускладнить гемостатичну терапію та підвищить вірогідність невдачі лікування. Відповідно до EACH2, єдиним параметром, який суттєво відрізнявся між пацієнтами, які відповідали на терапію, і тими, хто не мав відповіді, була затримка часу до початку лікування (медіана 1 проти 4 днів) [7].
У цьому дослідженні оцінюється оптимальне використання гемостатичних препаратів, показаних для купірування гострих кровотеч у пацієнтів із НГА. Ліки, які оцінюються в цьому дослідженні, представлені в таблиці 1. Включення шунтуючих препаратів (rFVIIa та aPCC) і рекомбінантного свинячого FVIII базується на статусі ліцензування цих препаратів в ЄС у міжнародних рекомендаціях щодо лікування НГА [1].
Механізм дії
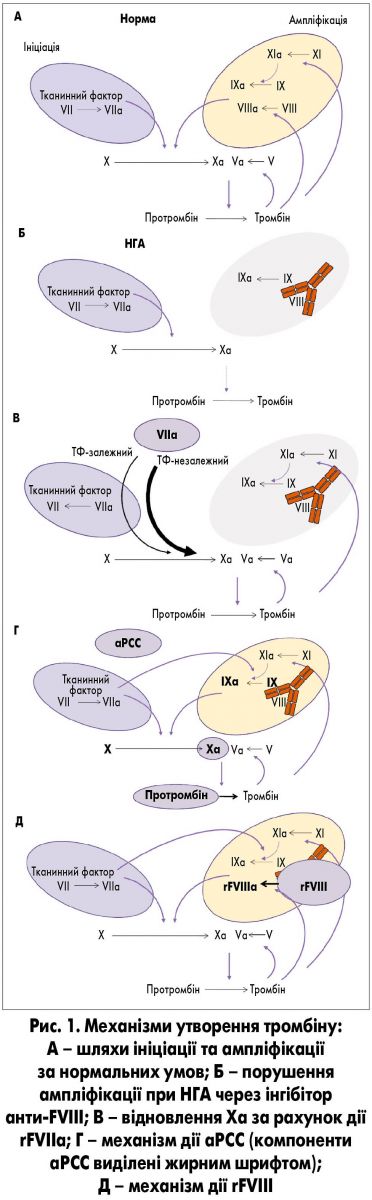 Сучасна модель гемостазу – клітинна, або клітинно-асоційована, включає 3 послідовні фази: ініціації, ампліфікації та пропагації. Перший етап ініціації за нормальних умов включає декілька послідовних фаз: утворення комплексу TF-VIIa-Ca2+, активація IX і X факторів та утворення тромбіну (рис. 1). У цій фазі також присутні механізми, спрямовані на обмеження утворення тромбіну, що включають специфічний інгібітор шляху тканинного фактора. Тромбін відіграє важливу роль у другій фазі ампліфікації, яка включає активацію V, XI фактора і FVIII, що в подальшому (на третій фазі пропагації) призводить до активації Х фактора (Ха). При цьому активований FVIII є лімітуючим фактором, і його інгібітори спричиняють серйозне порушення утворення Ха та тромбіну.
Сучасна модель гемостазу – клітинна, або клітинно-асоційована, включає 3 послідовні фази: ініціації, ампліфікації та пропагації. Перший етап ініціації за нормальних умов включає декілька послідовних фаз: утворення комплексу TF-VIIa-Ca2+, активація IX і X факторів та утворення тромбіну (рис. 1). У цій фазі також присутні механізми, спрямовані на обмеження утворення тромбіну, що включають специфічний інгібітор шляху тканинного фактора. Тромбін відіграє важливу роль у другій фазі ампліфікації, яка включає активацію V, XI фактора і FVIII, що в подальшому (на третій фазі пропагації) призводить до активації Х фактора (Ха). При цьому активований FVIII є лімітуючим фактором, і його інгібітори спричиняють серйозне порушення утворення Ха та тромбіну.
rFVIIa може відновити продукцію Xa і, як наслідок, утворення тромбіну за відсутності FVIII. Наразі існує значна кількість доказів того, що цей процес відбувається незалежно від тканинного фактора (ТФ) через взаємодію rFVIIa з поверхнями фосфоліпідів і різними рецепторами на судинних клітинах [8], що забезпечує відновлення тромбіну.
aPCC містить протромбін, фактор Xa та інші білки протромбінового комплексу, що забезпечує утворення тромбіну та підтримку гемостазу у пацієнтів із НГА. Наразі тривають дебати щодо ризику розвитку тромбоемболічних ускладнень на тлі застосування шунтуючих препаратів, оскільки вони містять активовані фактори згортання, а не профактори.
rFVIII замінює FVIII у системі згортання крові, що забезпечує нормальний гемостаз. Хоча rFVIII є неактивованим кофактором, дозозалежний ризик розвитку тромбоемболії не може бути виключений, враховуючи переконливі докази того, що FVIII є основним фактором ризику розвитку тромбозу в загальній популяції [10, 11].
Ефективність
Аналіз літератури виявив, що для rFVIIa доступний систематичний огляд літератури, в якому зібрано інформацію про >1000 випадків кровотечі у 671 пацієнта [12]. Також доступний огляд, який містить дані стосовно ефективності rFVIIa в хірургії [13]. Для aPCC реєстр EACH2 надає найбільш надійну інформацію [7]. Його ефективність порівнювали з rFVIIa за допомогою відповідних зразків за шкалою схильності (n=57 на групу) і виявили 93% гемостатичну ефективність для обох [7].
Дані стосовно ефективності rFVIII доступні у дослідженні, яке включало 29 пацієнтів [14], а також у кількох звітах та серіях [15-18]. У випадках гострої кровотечі, зареєстрованих у 28 пацієнтів, які підлягали оцінці, 100% продемонстрували ефективну або частково ефективну гемостатичну відповідь через 24 год. Чіткого контролю кровотечі було досягнуто у 24 із 28 пацієнтів (86%).
Безпека
У вищезазначеному систематичному огляді стосовно ефективності rFVIIa було визначено, що тромбоемболічні ускладнення були зареєстровані в 0-5% випадків [12]. Частота летальних випадків внаслідок тромбоемболічних ускладнень у пацієнтів оцінювалася в японському дослідженні (2 смерті серед 132 пацієнтів, які отримували FVIIa) та дослідженні GTH (3 смерті серед 61 пацієнта, які отримували FVIIa). Тромбоемболічна безпека застосування rFVIIa також оцінювалася в дослідженні E.J. Neufeld та співавт. (2015; [19]), результати якого визначили загалом 54 тромбоемболічні події у 50 пацієнтів, у тому числі 21 артеріальну, 12 венозних і 21 змішаного характеру. Летальні випадки зареєстровані у 19 з 50 пацієнтів.
Безпека застосування aPCC у пацієнтів із гемофілією оцінювалася у дослідженні L.M. Aledort та співавт. (2008; [20]). Порівнюючи кількість тромбоемболічних подій, включаючи деякі випадки дисемінованого внутрішньосудинного згортання, із загальною кількістю інфузій, автор робить висновок, що aPCC має сприятливий профіль безпеки. У реєстрі EACH2 кількість пацієнтів із тромбоемболічними ускладненнями становила 3 із 63, які отримували aPCC (4,8%), 5 із 174 – rFVIIa (2,9%) та 0 із 70 (0%) – людський FVIII або десмопресин [7].
При застосуванні rFVIII наразі не повідомлялося про тромбоемболічні випадки [14-18].
Таким чином, сучасні дані свідчать про однакову гемостатичну ефективність для всіх трьох препаратів. Ризик розвитку тромбоемболічних ускладнень наявний при застосуванні шунтуючих препаратів, але, відповідно до результатів досліджень, він є низьким, враховуючи похилий вік і профіль ризику пацієнтів із НГА. Тромбоемболічну безпеку застосування rFVIII поки неможливо оцінити.
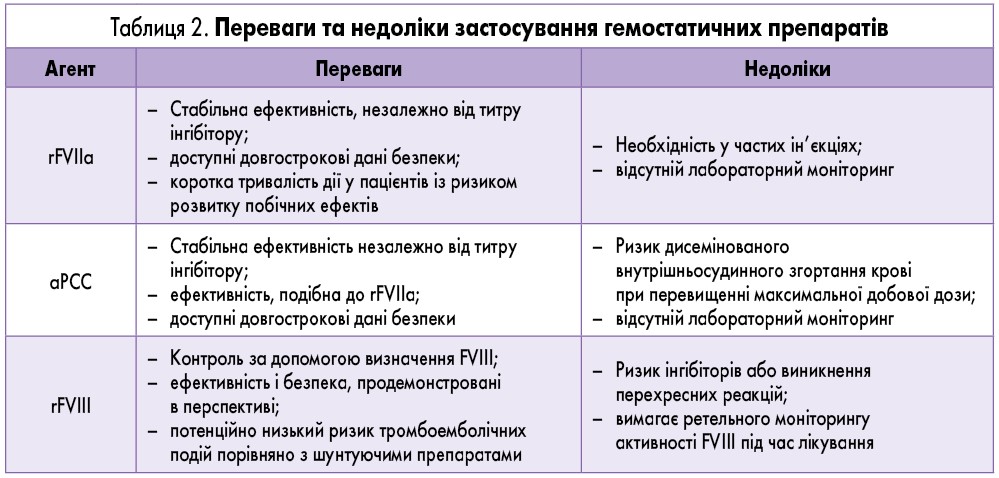
Додаткові переваги та недоліки застосування шунтуючих препаратів та rFVIII наведені в таблиці 2.
Пацієнти з НГА – це зазвичай особи похилого віку, які мають супутні захворювання, що асоційовано з певними ризиками при застосуванні гемостатичної терапії. Проте, враховуючи, що загальна частота тромбоемболічних подій на тлі застосування шунтуючих препаратів становила 0-5%, відмова від гемостатичного лікування невиправдана у пацієнтів цієї групи.
НГА є рідкісним захворюванням, що пов’язано з недостатньою обізнаністю медичного персоналу та через це призначенням невідповідного лікування. Експерти рекомендують при визначенні стратегії лікування НГА враховувати загальноприйняті критерії, які включають локальну доступність препарату, можливість моніторингу стану хворого та вартість лікування. Приклади менеджменту пацієнтів із НГА наведені на рисунку 2.
 Рис. 2. Алгоритм вибору гемостатичного препарату при НГА
Рис. 2. Алгоритм вибору гемостатичного препарату при НГА
Висновки
Результати цього дослідження продемонстрували, що і шунтуючі препарати, і rFVIII є ефективними методами лікування гострих кровотеч у пацієнтів із НГА. Враховуючи, що всі препарати мають приблизно однакову ефективність, лікування слід розпочинати з препарату, який безпосередньо доступний у лікувальному закладі. При застосуванні rFVIII важливо виявляти антисвинячі інгібітори за допомогою модифікованого тесту Бетезда.
Реферативний огляд статті A. Tiede, P. Collins, P. Knoebl et al. Critical Bleeding in Acquired Hemophilia A: Bypassing Agents or Recombinant Porcine Factor VIII? Hamostaseologie. 2021 Aug; 41 (4): 240-245. doi: 10.1055/a-1171-0522.
Підготувала Анна Хиць
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 3 (76) 2022 р.