26 вересня, 2023
Диференційна діагностика хронічної діареї
Алгоритм диференціації синдрому подразненого кишечнику з діареєю від інших органічних шлунково-кишкових захворювань з особливим акцентом на екзокринну недостатність підшлункової залози
Хронічна діарея (ХД), яку визначають як діарею, що триває >4 тиж, уражає до 5% населення світу незалежно від віку, статі, раси та соціально-економічного статусу. Діарея погіршує якість життя, порушує щоденну активність, а також суттєво збільшує використання ресурсів системи охорони здоров’я.
Диференційний діагноз ХД включає інфекції (бактерійні, паразитарні, вірусні), ендокринопатії (гіпертиреоз, цукровий діабет, ЦД), мальдигестії та мальабсорбції (целіакія, непереносимість лактози, екзокринна недостатність підшлункової залози, ЕНПЗ), порушення функціонування осі «мозок – кишечник» (синдром подразненого кишечнику, СПК), запальні хвороби (хвороба Крона, виразковий коліт), вплив проносних препаратів і вживання токсичних речовин, у т. ч. алкоголю.
Цей огляд охоплює стратегії диференційної діагностики діарейних захворювань з акцентом на діарейний варіант СПК (СПК-Д) та ЕНПЗ.
Синдром подразненого кишечнику
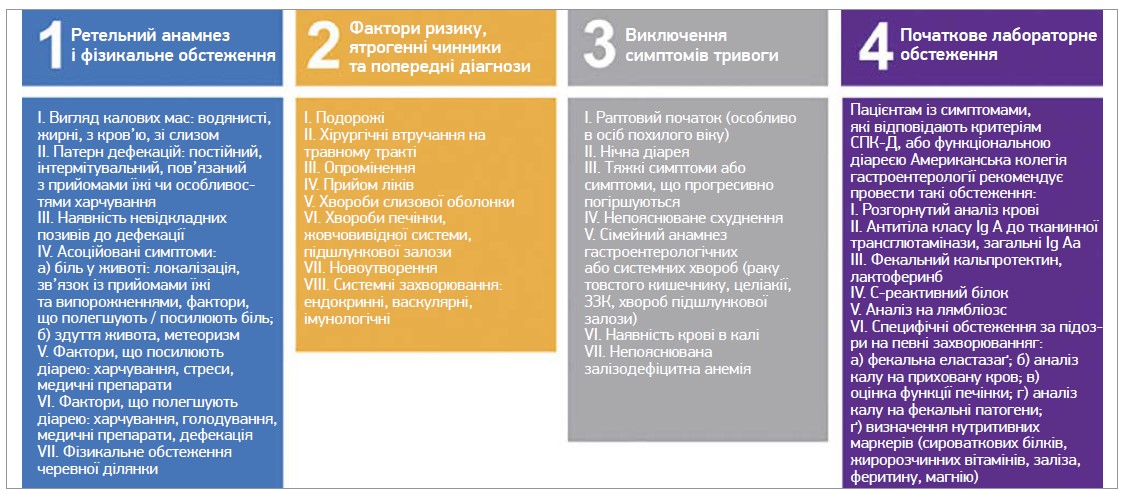
СПК є найпоширенішою причиною діареї у розвинених країнах. Найчастіше СПК зустрічається в жінок віком 20-40 років. Відповідно до IV Римських критеріїв, СПК діагностують за наявності абдомінального болю щонайменше 1 день/тиж, асоційованого зі змінами консистенції калових мас, частотою дефекації, погіршенням якості життя. Симптоми мають бути наявними впродовж попередніх 3 міс і розпочатися >6 міс до встановлення діагнозу. Поширеними симптомами СПК-Д, які не входять до діагностичних критеріїв, є здуття та відчуття розтягнення живота, невідкладні позиви до дефекації, відчуття неповного відходження калових мас, наявність слизу в калі. Важливо з’ясувати наявність у пацієнта симптомів тривоги: поява симптоматики у віці >50 років, непояснюване схуднення, рецидивувальні кровотечі та/або анемії, сімейний анамнез запальних захворювань кишечнику (ЗЗК), целіакія, колоректальний рак (рис. 1).
Рис. 1. Послідовний алгоритм диференційної діагностики ХД
Примітки: IgA – імуноглобуліни класу А; a - свідчить про целіакію; б - свідчить про СПК-Д (якщо проведення аналізу на кальпротектин неможливе, визначають лактоферин; якщо обидва аналізи недоступні – С-реактивний білок); c – в певних популяціях; г - відповідно до підозр лікаря-клініциста або для диференційного діагнозу; ґ - аналіз для оцінки функції печінки за підозри ЕНПЗ.
Діагноз СПК зазвичай установлюється на основі клінічної картини, оскільки точні біомаркери цієї хвороби відсутні. На основі домінувального патерну дефекації виокремлюють 4 варіанти СПК: СПК-Д, СПК із закрепом, СПК із чергуванням діареї та закрепу, некласифікований СПК. СПК-Д є найпоширенішим варіантом, на частку якого припадає до 40% усіх випадків СПК. У випадку СПК-Д кал пацієнта належить до 6-7 типів (рідкий, кашоподібний, водянистий) за Брістольською шкалою у >25% дефекацій та до 1-2 типів (твердий, грудкуватий, у формі кульок) – у <25% дефекацій. Слід зауважити, що текстуру калу необхідно оцінювати в ті дні, коли спостерігається біль у животі. Характеристики калових мас можуть допомогти в диференційній діагностиці (табл.).
|
Таблиця. Диференційна діагностика ХД на основі характеристик калових мас |
||
|
Водянисті |
Жирні |
Запальні |
|
Осмотичні діареї:
Секреторні діареї:
Функціональні діареї:
|
Мальабсорбція або мальдигестія:
|
ЗЗК:
|
Екзокринна недостатність підшлункової залози
Хоча ЕНПЗ зазвичай асоціюється із хворобами підшлункової залози, цей стан можуть спричиняти й екстрапанкреатичні хвороби. ЕНПЗ розвивається в ≈80% дітей із муковісцидозом протягом перших 2 років життя, а також у 10-30% пацієнтів із помірно тяжким і у 85% хворих із тяжким хронічним панкреатитом. Окрім того, ЕНПЗ супроводжує 72% випадків раку підшлункової залози.
Причинами зниження секреції панкреатичних ферментів і бікарбонатів в осіб із захворюваннями підшлункової залози є погіршення функції паренхіми органа та/або обструкція головної панкреатичної протоки. Зниження кількості ферментів у просвіті кишечнику спричиняє неможливість нормального перетравлювання їжі. Основна клінічна ознака ЕНПЗ – неадекватне травлення жирів.
Частота виникнення симптомів у пацієнтів з ЕНПЗ є дуже варіабельною та залежить від харчових звичок і дотримання дієти. В клінічних дослідженнях за участю хворих із підтвердженою ЕНПЗ поширеність клінічно вираженої стеатореї становила 23-70% в осіб із хронічним панкреатитом, 46% – у випадку раку підшлункової залози та 15% – у пацієнтів із муковісцидозом. Під час установлення діагнозу важливо ретельно зібрати харчовий анамнез, оскільки дієтологічні особливості здатні виражено впливати на симптоматику. Так, низький уміст жирів у раціоні може утруднювати виявлення ЕНПЗ, оскільки в такому випадку симптоми можуть бути відсутніми.
В осіб з ЕНПЗ виявляють типові ознаки синдрому мальабсорбції (діарея, відчуття розтягнення живота, спазматичні абдомінальні болі, здуття живота, схуднення) та нутритивних дефіцитів (дефіцит жиророзчинних вітамінів, мікронутрієнтів, білків). Клінічна картина ЕНПЗ залежить від причини такого стану, виразності дефіциту ферментів, умісту жирів у раціоні, але зазвичай пацієнти повідомляють про жирний кашоподібний кал із неприємним запахом, здуття живота та схуднення.
В довгостроковій перспективі наслідками ЕНПЗ можуть бути саркопенія, остеопороз, переломи при незначних травмах, метаболічне захворювання кісток, підвищення ризику розвитку інфекцій та серцево-судинні захворювання.
ЕНПЗ слід виключити в пацієнтів із ХД за наявності таких характеристик: анамнез хвороб підшлункової залози (гострий, рецидивувальний або хронічний панкреатит; муковісцидоз; рак підшлункової залози; гострий некротизувальний панкретит; ЦД), фактори ризику хвороб підшлункової залози (зловживання алкоголем та/або куріння), сімейний анамнез хвороб підшлункової залози (переважно хронічного панкреатиту чи раку), перенесених операцій у ділянці підшлункової залози або шлунка. Пацієнтів без анамнезу хвороб підшлункової залози слід обстежувати щодо ЕНПЗ лише у випадку значущої клінічної підозри.
Встановлення діагнозу ЕНПЗ, яке нерідко є складним через відсутність точних тестів, надзвичайно важливе для уникнення ускладнень. Зазвичай діагностика потребує наявності певних симптомів, нутритивних маркерів і відповідних результатів неінвазивних тестів для визначення функції підшлункової залози, як-от коефіцієнт абсорбції жирів (КАЖ), фекальна еластаза‑1 (ФЕ‑1). Хоча для оцінки панкреатичної функції існують й інші обстеження, вони є або інвазивними (наприклад, ендоскопічна оцінка функції підшлункової залози), або недоступними в щоденній клінічній практиці (наприклад, дихальні тести з міченим вуглецем). Прямий секретин-холецистокініновий тест – найчутливіший аналіз для виявлення зменшення стимульованої панкреатичної секреції, однак він є інвазивним, дороговартісним, складним у виконанні та часозатратним, тому не використовується в клінічній практиці. Ендоскопічне визначення функції підшлункової залози було запропоновано як альтернативу секретин-холецистокініновому тесту, але в нього також є певні обмеження. Обидва обстеження застосовуються для функціональної діагностики хронічного панкреатиту в пацієнтів із незрозумілими результатами візуалізаційних обстежень, але вони не підходять для діагностики ЕНПЗ.
Золотим стандартом для діагностики ЕНПЗ є КАЖ, але цей тест вимагає від пацієнта дотримання спеціального раціону, який містить 100 г жирів на добу протягом 5 днів, а також збирання всіх калових мас за 3-5-й дні. Оскільки ця процедура складна у виконанні та неприємна для пацієнта, вона рідко використовується в клінічній практиці. Концентрація в калі еластази (панкреатоспецифічного ферменту) відображає кількість ферменту, який секретується підшлунковою залозою. Вміст ФЕ‑1 у калі можна виміряти за допомогою імуноферментного аналізу невеликого зразка калових мас. Цей аналіз є простим і широкодоступним, тому найчастіше використовується для оцінки функції підшлункової залози.
В пацієнтів із ХД і високою імовірністю ЕНПЗ (наприклад, із раком головки підшлункової залози, тяжким хронічним кальцифікувальним панкреатитом, анамнезом хірургічного втручання на підшлунковій залозі – панкреатодуоденектомія, гастректомія) цінність функціональних обстежень обмежена; для встановлення діагнозу ЕНПЗ вони не обов’язкові. В хворих із ХД та низькою імовірністю ЕНПЗ (наприклад, в осіб без анамнезу панкреатичних хвороб чи операцій на підшлунковій залозі, без факторів ризику панкреатичних хвороб і без схуднення чи нутритивних дефіцитів) нормальний рівень ФЕ‑1 дозволяє виключити ЕНПЗ, а низький – підтвердити. Однак нерідко зустрічаються хибнопозитивні результати, які утруднюють діагностику.
ЕНПЗ – органічний розлад, який може імітувати СПК. ЕНПЗ, встановлена за низькою концентрацією ФЕ‑1, наявна в 5-6% пацієнтів, які відповідають Римським критеріям для СПК-Д, і в 4,6% хворих із непояснюваним болем у животі та/або діареєю, та/або СПК-Д. Однак слід зауважити, що низький рівень ФЕ‑1 не дозволяє однозначно виключити СПК-Д.
Диференційна діагностика ХД
Для успішного лікування ключове значення має раннє та точне встановлення діагнозу. В пацієнта із ХД може бути наявний спектр симптомів, які свідчать про один із таких патологічних станів, як СПК-Д, ЕНПЗ, целіакія, синдром надмірного бактерійного росту в тонкому кишечнику, ЗЗК, інфекційні хвороби (наприклад, лямбліоз). Усі ці стани можуть зумовити діарею, біль у животі, здуття та метеоризм, тому для встановлення точного діагнозу в пацієнтів із ХД автори рекомендують чотирикроковий діагностичний процес.
Крок 1. Ретельний збір анамнезу та фізикальне обстеження
Діагностику варто розпочинати з ретельного збору анамнезу, а також проведення фізикального обстеження. Пацієнтів, які звертаються до лікаря з ХД, що триває ≥4 тиж, слід детально розпитати про симптоми та попередній анамнез діареї. Хоча клінічне визначення діареї передбачає наявність рідких або водянистих калових мас і випорожнень ≥3 рази/24 год, пацієнти нерідко використовують для позначення інші слова та поняття. Це підкреслює важливість максимально деталізованого анамнезу.
Для встановлення діагнозу ключове значення має визначення характеру калових мас, оскільки пацієнти із функціональним закрепом також можуть скаржитися на діарею через часті позиви до дефекації, але під час подальшого розпитування пацієнта можна виявити такі симптоми, як посилене натужування, відчуття неповного спорожнення кишечнику, відчуття обструкції та проходження твердого калу.
Насамперед рекомендовано з’ясувати тип діареї. Водянистий характер калових мас може свідчити про СПК, целіакію, ендокринні захворювання чи зловживання проносними засобами, жирний – про мальабсорбцію/мальдигестію, а запальний – про інфекції або ЗЗК. Однак ці критерії не надають можливості дійти остаточного висновку.
Надалі потрібно виявити патерн діареї: чи є вона безперервною, рецидивувальною або пов’язаною із прийомами їжі (останнє може допомогти розрізнити секреторну та осмотичну діарею). Варто поставити запитання про час початку діареї, провокувальні фактори, об’єм калових мас і наявність у них домішок (кров, слиз, жир), а також з’ясувати, чи наявна діарея вночі, чи спостерігають невідкладні позиви до дефекації або нетримання калу. Паралельно слід розпитати хворого про інші шлунково-кишкові симптоми та скарги з боку інших систем, а також потенційні обтяжувальні фактори (дотримання дієти, стрес, прийом ліків).
Крок 2. Виявлення факторів ризику, ятрогенних чинників і попередніх діагнозів
Для виключення зовнішніх факторів ХД необхідно встановити, чи не подорожував пацієнт нещодавно до регіонів із високою поширеністю діарейних патогенів, як-от лямблії; чи не підлягав гастроінтестинальним хірургічним втручанням (видаленню жовчного міхура, ілеоцекальній резекції, шунтуванню шлунка за Roux-en-Y); чи не отримував променеву терапію і чи не приймає препаратів, здатних провокувати діарею.
Підвищеним ризиком розвитку діареї можуть супроводжуватися хвороби печінки та панкреатобіліарної системи, новоутворення і системні захворювання (ендокринні, судинні чи імунологічні).
Крок 3. Виключення симптомів тривоги
Деякі клінічні ознаки можуть свідчити про серйозніші захворювання, зокрема раптовий початок у пацієнтів похилого віку, нічна діарея, тяжкі симптоми або їх погіршення, непояснюване схуднення, сімейний анамнез шлунково-кишкових чи системних захворювань, наявність крові в калі або непояснюваний залізодефіцит.
Крок 4. Початкове лабораторне обстеження
Діагностична стратегія має ґрунтуватися на даних анамнезу та фізикального обстеження. Якщо наявні симптоми тривоги, слід насамперед виключити найімовірніші причини. Наприклад, в осіб із ХД із жирними каловими масами, асоційованою із прийомом їжі, в поєднанні зі схудненням і дефіцитом жиророзчинних вітамінів насамперед слід виключити ЕНПЗ. Для цього найчастіше використовується визначення ФЕ‑1, рівень якої <200 мкг/г фекалій свідчить про нестачу ФЕ‑1 і відображає низьку ферментну функцію підшлункової залози, корелюючи із виробленням інших панкреатичних ферментів (ліпази, амілази та трипсину). Однак пацієнтам, які звертаються до лікаря із симптомами, схожими на функціональну діарею або СПК-Д, і не мають симптомів тривоги, в останніх рекомендаціях Американської гастроентерологічної асоціації та Американської колегії гастроентерології надано пораду провести скринінг на целіакію (антитіла до тканинної трансглютамінази класу Ig A, загальні антитіла класу IgA), ЗЗК (фекальний кальпротектин або лактоферин чи С‑реактивний білок), лямбліоз (у певних популяціях). Американська гастроентерологічна асоціація також пропонує обстежити цих осіб щодо діареї, спричиненої неадекватною концентрацією жовчних кислот у просвіті кишечнику (за допомогою визначення вмісту жовчних кислот у фекаліях за 48-годинний період або сироваткового фактора росту фібробластів‑19).
Алгоритм диференційної діагностики ХД: фокус на СПК-Д та ЕНПЗ
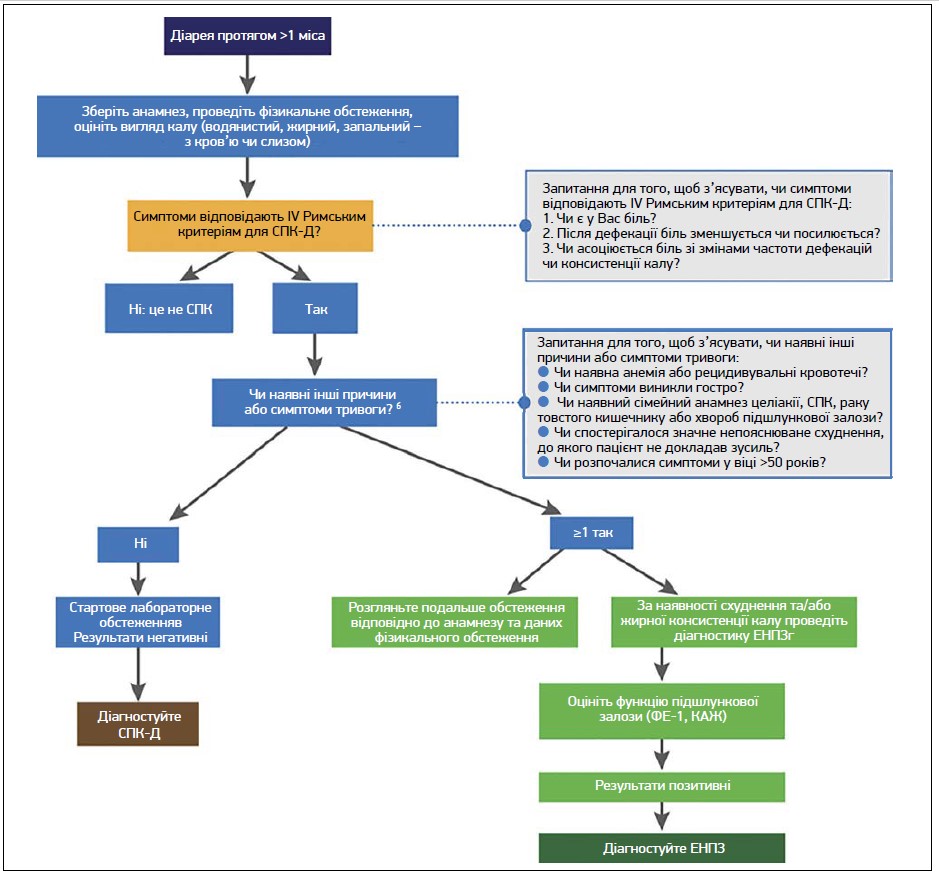
Авторами було запропоновано алгоритм диференціації СПК-Д та ЕНПз від інших діарейних синдромів (рис. 2).
Рис. 2. Загальна стратегія диференційного діагнозу для пацієнтів із ХД: ЕНПЗ або СПК-Д?
Примітки: a – клінічний діагноз СПК вимагає наявності діареї протягом >2 міс; б – якщо наявний ≥1 симптом тривоги, може знадобитися подальше обстеження; в – розгорнутий аналіз крові, С‑реактивний білок, фекальний кальпротектин або лактоферин, антитіла до тканинної трансглутамінази та загальні IgA; г – зазвичай за наявності хвороб підшлункової залози, хірургічних втручань на шлунку чи підшлунковій залозі, факторів ризику хвороб підшлункової залози (зловживання алкоголем, куріння).
Застосування цього алгоритму дозволяє мінімізувати кількість обстежень, зменшити витрати на охорону здоров’я за рахунок уникнення непотрібних аналізів, а також може допомогти у вчасному встановленні діагнозу та призначенні відповідного лікування. Алгоритм допомагає швидко та точно встановити діагноз СПК-Д; розпочинається із 3 запитань, що відповідають IV Римським критеріям: 1) чи є у Вас біль? 2) після дефекації біль зменшується або посилюється? 3) чи асоціюється біль зі змінами частоти дефекацій або консистенції калу? Якщо відповіді на ці 3 запитання є позитивними, а зазначені в алгоритмі симптоми тривоги відсутні, можна з точністю ≈97% діагностувати СПК-Д. Якщо наявні симптоми тривоги та виникає підозра на ЕНПЗ, слід визначити нутритивні маркери і рівень ФЕ‑1, а за відхилення цих показників від норми – провести візуалізаційне дослідження підшлункової залози. Якщо при останньому змін не виявляють, результат тесту на ФЕ‑1, найімовірніше, є хибним; ЕНПЗ необхідно виключити, натомість необхідно розпочати пошук іншої причини ХД.
Обговорення
Діарея є поширеним, але складним розладом, який провокують численні етіологічні та патогенетичні чинники. Розрізнення різноманітних видів ХД може становити вагому проблему, особливо у випадку співпадіння симптомів. Проблематичність диференційної діагностики доводить статистика щодо СПК-Д: у США залишаються недіагностованими до 75% випадків, які відповідають діагностичним критеріям цієї хвороби. Це викликає занепокоєння, оскільки СПК – найпоширеніша причина діареї; її можна досить точно діагностувати за допомогою декількох простих запитань та мінімальних обстежень.
Одним зі станів, які найчастіше плутають із СПК-Д, є ЕНПЗ. І навпаки, особам з ЕНПЗ нерідко встановлюють діагноз СПК-Д, тому автори цього огляду запропонували алгоритм, що допоможе диференціювати ці два захворювання. Цей алгоритм передбачає застосування нещодавно опублікованих рекомендацій Американської колегії гастроентерології та Американської гастроентерологічної асоціації. Застосування запропонованого простого алгоритму здатне допомогти практикуючим лікарям у своєчасному встановленні діагнозу, а також зменшити кількість зайвих обстежень, запобігаючи в такий спосіб відтермінуванню належного лікування і сприяючи покращенню якості життя пацієнта.
Від редакції
Хронічна діарея – дуже поширений розлад, що зустрічається у 3-6% популяції. Однією з важливих причин діареї є ЕНПЗ, частота якої в окремих підгрупах пацієнтів, як-от у хворих на хронічний панкреатит або муковісцидоз, досягає 90%. Наявність ЕНПЗ є абсолютним показанням до замісної терапії панкреатичними ферментами. Завдяки дуже високій безпеці ці препарати також можуть застосовуватися як емпірична терапія в пацієнтів із ХД.
Одним із найпопулярніших серед лікарів і пацієнтів України ферментних препаратів є Мезим® («Берлін-Хемі АГ», Німеччина). Мезим® успішно застосовується в лікуванні ЕНПЗ, яка супроводжується порушеннями травлення. Для лікарів особливо зручним є те, що Мезим® представлений у широкій лінійці доз і форм: Мезим® форте 10000 Од та Мезим® форте 20000 Од (кишковорозчинні таблетки), а також Мезим® капсули 10000 Од та Мезим® капсули 25000 Од (тверді капсули з кишковорозчинними таблетками). Це дозволяє підібрати оптимальний режим замісної ферментної терапії для кожного пацієнта.
Дозу Мезиму обирають на основі ступеня недостатності ферментної функції підшлункової залози, а тривалість застосування визначається лікарем індивідуально для кожного окремого випадку. У разі ЕНПЗ лікування Мезимом дає можливість досягти нормальної маси тіла та підтримувати її, нормалізувати частоту дефекацій і консистенцію калу, усунути стеаторею й абдомінальний біль. Усі форми Мезиму виготовлені із свинячого панкреатину, що відповідає сучасним рекомендаціям і є найбільш фізіологічним. Ефективність і безпека Мезиму широко вивчені у вітчизняних та зарубіжних клінічних дослідженнях, а багатий досвід успішного використання цього препарату зробив назву «Мезим» практично синонімом слова «фермент».
Стаття друкується в скороченні.
Список літератури знаходиться в редакції.
Darren B, Domínguez-Muñoz J.E. Differential Diagnosis of Chronic Diarrhea: An Algorithm to Distinguish Irritable Bowel Syndrome With Diarrhea
From Other Organic Gastrointestinal Diseases, With Special Focus on Exocrine Pancreatic Insufficiency. Journal of Clinical Gastroenterology 57 (7):
p. 663-670, August 2023.
Переклала з англ. Лариса Стрільчук